Что такое пробиотики и как они влияют на микрофлору кишечника. Какие виды пробиотиков существуют. Когда назначают пробиотики. Как выбрать эффективный пробиотик.
Что такое пробиотики и как они работают
Пробиотики — это живые микроорганизмы, которые при употреблении в достаточных количествах оказывают положительное влияние на здоровье человека. Основная цель пробиотиков — восстановление и поддержание нормальной микрофлоры кишечника.
Кишечная микрофлора играет важнейшую роль в организме человека:
- Участвует в процессах пищеварения и усвоения питательных веществ
- Синтезирует витамины группы B и витамин K
- Поддерживает иммунитет
- Защищает от патогенных микроорганизмов
- Регулирует обмен веществ
При нарушении баланса микрофлоры возникает дисбактериоз, который может привести к различным проблемам со здоровьем. Пробиотики помогают восстановить нормальный состав микрофлоры и улучшить работу кишечника.
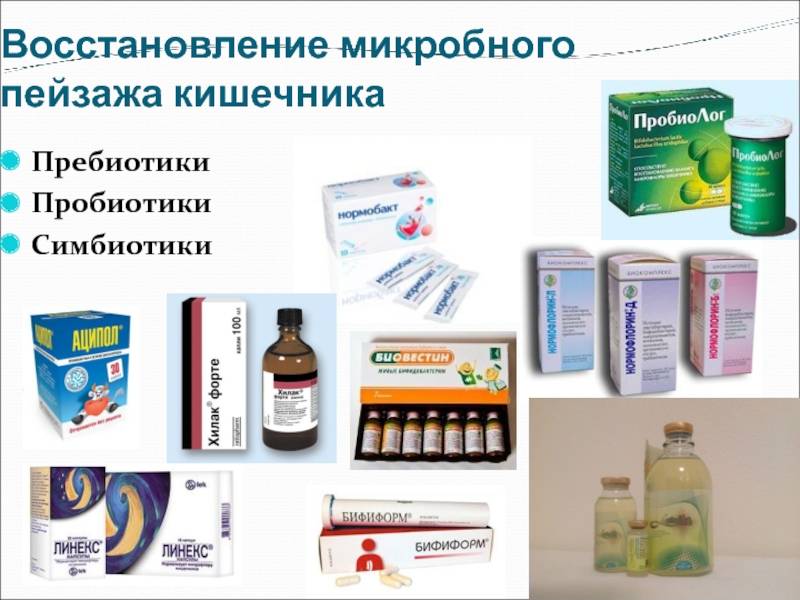
Основные виды пробиотиков
Существует несколько основных видов пробиотических микроорганизмов:

Лактобактерии (Lactobacillus)
Это самая многочисленная группа пробиотиков. Основные представители:
- L. acidophilus
- L. plantarum
- L. rhamnosus
- L. casei
- L. bulgaricus
Лактобактерии вырабатывают молочную кислоту, подавляющую рост патогенных микробов. Также они участвуют в синтезе витаминов и ферментов.
Бифидобактерии (Bifidobacterium)
Основные представители:
- B. bifidum
- B. longum
- B. infantis
- B. breve
Бифидобактерии поддерживают иммунитет, участвуют в синтезе витаминов группы B, защищают от патогенных микробов.
Сахаромицеты (Saccharomyces)
Наиболее известный представитель — Saccharomyces boulardii. Эти дрожжевые грибки помогают восстановить микрофлору после антибиотиков, уменьшают диарею.
В каких случаях назначают пробиотики
Основные показания для приема пробиотиков:
- Антибиотик-ассоциированная диарея
- Острые кишечные инфекции
- Синдром раздраженного кишечника
- Воспалительные заболевания кишечника (язвенный колит, болезнь Крона)
- Дисбактериоз кишечника
- Пищевая аллергия
- Атопический дерматит
- Профилактика респираторных инфекций
Также пробиотики могут назначаться для профилактики нарушений микрофлоры при стрессе, неправильном питании, смене климата и т.д.
Как выбрать эффективный пробиотик
При выборе пробиотика следует обратить внимание на следующие факторы:
Состав
Эффективный пробиотик должен содержать несколько штаммов бактерий в достаточной концентрации (не менее 1 млрд КОЕ/г). Наиболее изученные штаммы: L. rhamnosus GG, L. acidophilus LA-5, B. lactis BB-12.
Форма выпуска
Капсулы с кишечнорастворимой оболочкой защищают бактерии от желудочного сока. Также эффективны саше и флаконы с лиофилизированными бактериями.
Условия хранения
Многие пробиотики требуют хранения в холодильнике. Есть формы, стабильные при комнатной температуре.
Дополнительные компоненты
Пребиотики (инулин, фруктоолигосахариды) усиливают действие пробиотиков. Витамины и минералы улучшают общее состояние ЖКТ.
Эффективность пробиотиков
Эффективность пробиотиков подтверждена многочисленными исследованиями. Основные доказанные эффекты:
- Уменьшение длительности и выраженности диареи
- Профилактика антибиотик-ассоциированной диареи
- Облегчение симптомов синдрома раздраженного кишечника
- Поддержание ремиссии при язвенном колите
- Уменьшение частоты респираторных инфекций у детей
Однако эффективность зависит от конкретных штаммов и дозировок. Не все пробиотики одинаково полезны при разных состояниях.

Безопасность пробиотиков
В целом пробиотики безопасны для большинства людей. Возможные побочные эффекты обычно ограничиваются легкими нарушениями пищеварения в начале приема. Однако в некоторых случаях требуется осторожность:
- Иммунодефицитные состояния
- Тяжелые хронические заболевания
- Недоношенные дети
- Беременность и кормление грудью
Перед применением пробиотиков лучше проконсультироваться с врачом, особенно при наличии хронических заболеваний.
Пробиотики и антибиотики
Пробиотики часто назначают вместе с антибиотиками для профилактики дисбактериоза. Однако важно соблюдать правильный режим приема:
- Принимать пробиотики не ранее чем через 2-3 часа после антибиотика
- Выбирать устойчивые к антибиотикам штаммы (например, S. boulardii)
- Продолжать прием пробиотиков 1-2 недели после окончания курса антибиотиков
При правильном применении пробиотики помогают снизить риск антибиотик-ассоциированной диареи и быстрее восстановить нормальную микрофлору.
Пробиотики в продуктах питания
Некоторые продукты естественным образом содержат пробиотические бактерии:

- Йогурт
- Кефир
- Квашеная капуста
- Соленые огурцы
- Квас
- Комбуча
Однако концентрация бактерий в этих продуктах обычно ниже, чем в аптечных пробиотиках. Кроме того, не все штаммы способны выжить в кислой среде желудка.
Тем не менее, регулярное употребление кисломолочных продуктов помогает поддерживать здоровую микрофлору кишечника.
Пребиотики и синбиотики
Пребиотики — это неперевариваемые пищевые волокна, которые стимулируют рост полезных бактерий в кишечнике. Основные виды пребиотиков:
- Инулин
- Фруктоолигосахариды
- Галактоолигосахариды
Синбиотики — это комбинации пробиотиков и пребиотиков. Такое сочетание усиливает положительные эффекты обоих компонентов.
Пребиотики содержатся в некоторых продуктах питания:
- Лук
- Чеснок
- Артишок
- Банан
- Цикорий
Включение этих продуктов в рацион помогает поддерживать здоровье кишечной микрофлоры.
Будущее пробиотиков
Исследования в области пробиотиков продолжаются. Основные направления:
- Разработка новых штаммов с заданными свойствами
- Изучение влияния пробиотиков на различные заболевания
- Создание персонализированных пробиотиков
- Использование пробиотиков для доставки лекарств
Возможно, в будущем пробиотики станут важным компонентом персонализированной медицины, позволяющим корректировать состав микрофлоры для профилактики и лечения различных заболеваний.

Заключение
Пробиотики — это эффективный и безопасный способ поддержания здоровья кишечника и всего организма. Они помогают восстановить нормальную микрофлору, укрепить иммунитет и улучшить пищеварение. Однако важно правильно выбирать пробиотики и применять их по назначению врача.
Регулярное употребление кисломолочных продуктов и пребиотиков в сочетании с аптечными пробиотиками позволяет достичь максимального эффекта в поддержании здоровой микрофлоры кишечника.
Флориоза — для микрофлоры кишечника польза! Итальянский пробиотик, обогащенный инулином и витаминами
свойства компонентов
СОВРЕМЕННЫЙ
ИТАЛЬЯНСКИЙ
ПРЕ- и ПРОБИОТИК
Для физиологичного восстановления микрофлоры
Область применения
Источник пробиотических бифидо- и лактобактерий и инулина
Дополнительный источник витаминов группы В
Для восстановления кишечной микрофлоры и укрепления естественных защитных сил организма
В качестве средства профилактики кишечных расстройств
подробнее
Преимущества
1 /
Банановый вкус
- 1/ Банановый вкус 1
- 2/ Содержит 3*109 пробиотических бактерий
- 3/ Содержит 800 мг инулина в одном саше 1
-
4/
Содержит витамины B
- 5/ Произведен по инновационным технологиям
-
1/ Банановый вкус 1
-
2/Содержит 3*109 пробиотических бактерий
-
3/ Содержит 800 мг инулина в одном саше 1
4/ Содержит витамины
B1, B2, B6, B12-
5/ Произведен по инновационным технологиям
Способ применения
- Принимать содержимое 1 пакета-саше в день во время еды
- Содержимое пакета-саше необходимо рассасывать в полости рта до полного растворения
- Продолжительность приема — 10-20 дней
- При необходимости прием можно повторить
- Не требует запивания водой
Угроза дисбактериоза?
ПРИЕМ 1 РАЗ В ДЕНЬ
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
помощь из аптеки. Препараты для нормальной работы кишечника БАК-СЕТ.. Мульти-пробиотик БАК-СЕТ
По частоте встречаемости заболевания органов пищеварительной системы занимают второе место после болезней сердца и сосудов. Причин тому множество:
- неправильное питание — злоупотребление фастфудом, сладостями, газированными напитками и алкоголем,
- низкая двигательная активность,
- неблагоприятная экологическая обстановка,
- длительный или бесконтрольный прием антибактериальных препаратов.
При воздействии нескольких факторов риск сбоев в работе органов ЖКТ возрастает. Решить проблему помогут правильное питание и аптечные препараты для нормализации работы кишечника.
Сбалансированный рацион вместо лекарств
Самый простой и безопасный способ заставить кишечник работать — придерживаться сбалансированного рациона питания. Помните: правильно питаться нужно регулярно, а не только до первых признаков улучшения пищеварения. Вот главные секреты успеха:
Помните: правильно питаться нужно регулярно, а не только до первых признаков улучшения пищеварения. Вот главные секреты успеха:
- дробное питание — принимать пищу нужно 5-6 раз в день небольшими порциями;
- тщательное пережевывание пищи — не торопитесь и ешьте медленно;
- достаточное потребление клетчатки — ее много в овощах и фруктах;
- соблюдение питьевого режима — для взрослого человека норма составляет 1,5-2 л жидкости в день.
На работу кишечника негативно влияют магазинные соусы, большинство кондитерских изделий, дрожжевая выпечка, газированные и алкогольные напитки, жирное мясо и рыба, соленья, копчености, острые приправы. По возможности эти продукты следует исключить из рациона или хотя бы уменьшить их количество.
Напротив, благотворное воздействие на пищеварительный тракт оказывают нежирные сорта мяса и рыбы, растительное масло, свежие фрукты и овощи, кисломолочная продукция. При их регулярном употреблении восстановить нормальную работу кишечника проще.
При их регулярном употреблении восстановить нормальную работу кишечника проще.
Пробиотики — помощники из аптеки
Если восстановить правильную работу ЖКТ самостоятельно не получается, на помощь придут аптечные препараты для нормализации работы кишечника. Благотворное воздействие оказывают мульти-пробиотики последнего поколения БАК-СЕТ беби и БАК-СЕТ форте. Они отвечают главным критериям качества, обладают сбалансированным составом и имеют клинически подтвержденную эффективность.
Пробиотические бактерии, входящие в состав комплексов, обладают хорошей выживаемостью в кислой среде и способствуют росту популяции полезной микрофлоры. Удобную упаковку легко взять с собой куда угодно. Хранить препараты из линейки БАК-СЕТ можно при комнатной температуре.
Правильное питание и препараты для нормализации работы кишечника помогут восстановить оптимальный баланс микрофлоры. Перед приемом комплексов БАК-СЕТ проконсультируйтесь со специалистом.
Пробиотики для кишечника: когда нужны и чем полезны?
От состава микрофлоры в кишечнике зависит качество пищеварения и всасывания питательных веществ. Изменение баланса бактерий неизбежно сказывается на самочувствии. Восполнить дефицит полезных микроорганизмов помогают пробиотики.
Нарушения пищеварения
Полезные бактерии для кишечника: что поможет восстановить микрофлору?
Бактерии — неотъемлемая часть человеческого организма. Какую роль они играют в нашей жизни? Чем грозит дисбаланс кишечной микрофлоры?
Нарушения пищеварения
Все статьи по теме
Предыдущая статья Следующая статья
Регенерация пищеварительного тракта — ScienceDaily
Кишечник человека кишит миллиардами полезных бактерий. Терапия с использованием антибиотиков часто уничтожает большинство из них. Исследовательская группа, в которую входили ученые из MDC, исследовала, восстановится ли впоследствии кишечная флора и каким образом. Результаты были опубликованы в научном журнале Nature Microbiology .
Результаты были опубликованы в научном журнале Nature Microbiology .
В пищеварительном тракте человека обитает целый мир крошечных организмов. В кишечнике примерно столько же бактерий, сколько людей живет на Земле. Эти микроорганизмы почти всегда служат благополучию своего хозяина. Они помогают переваривать пищу, вырабатывают витамины и тренируют иммунную систему. Кроме того, само их присутствие помогает остановить распространение патогенов.
Но кишечный микрокосм, также известный как микробиом, чувствителен к нарушениям. «При выходе из равновесия есть риск инфекции, избыточного веса и диабета, а также воспалительных и неврологических заболеваний», — говорит доктор София Форслунд, которая в мае этого года перешла из Европейской лаборатории молекулярной биологии (EMBL). в Гейдельберге в Центр молекулярной медицины Макса Дельбрюка (MDC) в Берлине для изучения сложных взаимодействий между людьми и микробиомами.
Антибиотики оставляют неизгладимые следы в кишечнике
В исследовании, недавно опубликованном в журнале Nature Microbiology , Форслунд вместе с коллегами из Дании, Германии и Китая исследовал, как терапия антибиотиками широкого спектра действия влияет на взаимодействие кишечных бактерий. «Мы смогли показать, что микробиом почти полностью восстановился через шесть месяцев после приема препарата», — говорит шведский исследователь. Но только «почти»: «Некоторые чувствительные виды бактерий полностью исчезли», — говорит Форслунд.
«Мы смогли показать, что микробиом почти полностью восстановился через шесть месяцев после приема препарата», — говорит шведский исследователь. Но только «почти»: «Некоторые чувствительные виды бактерий полностью исчезли», — говорит Форслунд.
В ходе четырехдневного исследования группа под руководством исследователей MDC и двух ученых из Копенгагенского университета вводила коктейль из трех антибиотиков (меропенем, гентамицин и ванкомицин) двенадцати здоровым молодым людям, согласившимся участвовать. Эти препараты в основном используются, когда более распространенные антибиотики больше не действуют из-за того, что бактерии уже стали к ним устойчивыми.
Некоторые виды бактерий выжили после введения лекарств
Затем исследователи изучали микробиомы своих субъектов в течение шести месяцев. С помощью секвенирования ДНК — метода, используемого для определения структуры генетического материала — они определили, какие виды бактерий присутствуют в кишечнике мужчин и какие гены присутствуют в бактериях. Команда также уделила особое внимание генам устойчивости, с помощью которых микробы защищаются от лекарств. «Наше исследование, вероятно, является первым, в котором исследуется влияние антибиотиков на активность бактериальных генов», — говорит Форслунд.
Команда также уделила особое внимание генам устойчивости, с помощью которых микробы защищаются от лекарств. «Наше исследование, вероятно, является первым, в котором исследуется влияние антибиотиков на активность бактериальных генов», — говорит Форслунд.
Впервые было показано, что кишечник не стал полностью стерильным, несмотря на введение трех сильнодействующих антибиотиков, сообщает исследователь. Среди оставшихся бактерий команда даже обнаружила несколько ранее неизвестных видов, которые еще не были охарактеризованы. Другие микробы уменьшились и превратились в споры — форму жизни, в которой бактерии могут сохраняться в течение многих лет в опасных условиях, не теряя своих первоначальных свойств.
Первоначально появлялось все больше болезнетворных микроорганизмов
Последующее заселение кишечника происходило постепенно. «Похоже на то, когда лес медленно восстанавливается после пожара», — говорит Форслунд. Однако, по словам исследователя, изначально чаще появлялись бактерии с болезнетворными свойствами, такие как Enterococcus faecalis и Fusobacterium nucleatum. В то же время команда смогла выявить многие факторы вирулентности в микроорганизмах — структуры и метаболиты, более вредные для человека. «Это наблюдение объясняет, почему большинство антибиотиков вызывают желудочно-кишечные расстройства», — говорит Форслунд.
В то же время команда смогла выявить многие факторы вирулентности в микроорганизмах — структуры и метаболиты, более вредные для человека. «Это наблюдение объясняет, почему большинство антибиотиков вызывают желудочно-кишечные расстройства», — говорит Форслунд.
Однако со временем кишечная флора снова нормализовалась. Плохие микробы все чаще замещались хорошими бактериями, такими как бифидобактерии, продуцирующие молочную кислоту, которые играют важную роль в защите от патогенов. Через шесть месяцев микробиом испытуемых был почти таким же, как и раньше. Однако многие из более ранних разновидностей бактерий отсутствовали. «Как и ожидалось, количество генов устойчивости у бактерий также увеличилось», — сообщает Форслунд. Удивительно, но это не тот случай, когда виды бактерий, которые появляются быстрее всего после введения антибиотиков, также имеют наибольшее количество генов устойчивости. «Этот генетический материал, скорее всего, будет играть долгосрочную роль в репопуляции кишечника», — говорит исследователь.
Легочный микробиом также будет изучен дополнительно
«Учитывая кажущуюся необратимую потерю отдельных видов и увеличение числа генов резистентности, исследование еще раз показывает, насколько важно применять антибиотики с осторожностью», — подчеркивает Форслунд. добавив: «Необходимо также дополнительно изучить, как повысить в будущем показатели успеха в защите чувствительного микробиома от повреждений, вызванных антибиотиками».
Ученый планирует внести свой вклад в это исследование. Например, MDC в настоящее время проводит обсервационное исследование, в ходе которого Форслунд хочет выяснить, как долгосрочное лечение антибиотиками влияет на биоразнообразие кишечника, и увеличивает ли большее истощение видов риск ожирения и метаболических заболеваний. Она также хотела бы исследовать, как часто кишечные бактерии обмениваются своими генами устойчивости во время приема антибиотиков. Исследование влияния этих препаратов на микробиом легких уже находится на стадии планирования.
Нормализация слоев кишечной слизи хозяина требует длительной микробной колонизации.
- DOI:10.1016/j.chom.2015.10.007
- Идентификатор корпуса: 766147
@article{Johansson2015NormalizationOH,
title={Нормализация слоев кишечной слизи хозяина требует длительной микробной колонизации.},
автор = {Малин Э. В. Йоханссон, Хедвиг Э. Якобссон, Джессика Холм н-Ларссон, Андре Шютте, Анна Эрмунд и Ана Мара Родр { \'i}guez-Pi{\~n}eiro и Liisa Arike и Catharina Wising и Frida Svensson и Fredrik B{\"a}cked и Gunnar C. Hansson},
journal={Хост клетки \& микроб},
год = {2015},
объем={18 5},
страницы={
582-92
}
} - M. Johansson, H. Jakobsson, G. Hansson
- Опубликовано 11 ноября 2015 г. слизистый слой управляет кишечной микробиотой
Текущие знания о взаимодействии между кишечными бактериями и кишечным слизистым слоем в норме и при заболеваниях пересматриваются, чтобы внести свой вклад в разработку новых вариантов лечения заболеваний, связанных с дисфункцией слизистого слоя, таких как язвенный колит.
Взаимодействие муцина и микробиоты во время постнатального созревания кишечной экосистемы: клинические последствия
Поддержка совместимого со здоровьем созревания муцина и микробиоты в раннем возрасте имеет первостепенное значение для долгосрочного здоровья и служит важной возможностью для клинического вмешательства.
Динамика муцинов при физиологических и патологических состояниях
Рассмотрены новые данные, описывающие различные функциональные возможности и профили экспрессии подтипов GC в кишечных криптах, включая внутренние и внешние факторы, которые модулируют различные аспекты слизистого слоя, а также вклад измененной слизи. барьер для возникновения ВЗК.
Экспериментальные модели для изучения взаимодействия кишечных микробов и слизи в норме и при патологии.
Представлены структура и функция кишечной слизи и муцинов, их взаимодействие с кишечными бактериями (включая комменсальные, пробиотические и патогенные микроорганизмы) и их роль в модулировании здоровья и болезненных состояний.

Взаимодействие кишечных бактерий с компонентами кишечной слизи
- J. Sicard, G. Le Bihan, Philippe Vogeleer, M. Jacques, J. Harel
Биология, наука об окружающей среде
Фронт. Клетка. Заразить. микробиол.
- 2017
В этом обзоре рассматривается, как комменсальные представители микробиоты и патогенные бактерии используют слизь в своих интересах для стимулирования своего роста, образования биопленок и колонизации кишечника, и как компоненты, полученные из слизи, действуют как питательные вещества и химические сигналы для адаптации и патогенез бактерий.
Структура и переработка слизи толстой кишки
- E. Nyström
Химия
- 2018
Слой слизи, покрывающий эпителий толстой кишки, создает важнейшую первую линию защиты от бактерий, обитающих в кишечнике. Несколько линий доказательств указывают на то, что функциональный слизистый слой необходим…
Взаимодействие микробов и слизи в патогенезе колоректального рака
- O.
 Coleman, D. Haller
Coleman, D. Haller Биология
Рак
19048- 200550068 Современное понимание взаимодействия между кишечной микробиотой и слизью у здоровых людей и пациентов с колоректальным раком пересматривается, и глубокое знание сложных механизмов микробно-слизистых взаимодействий может способствовать разработке новых стратегий лечения колоректального рака.
Взаимосвязь между микробиотой кишечника, ассоциированной со слизистой оболочкой, и заболеваниями человека
Слой слизи, покрывающий желудочно-кишечный тракт (ЖКТ), играет решающую роль в поддержании гомеостаза кишечника. В толстой кишке внутренний слой слизи обеспечивает безопасное содержание комменсальных микробов…
Воздействие кишечных бактериальных инфекций на эпителиальный барьер и за его пределы
Изучая путь кишечных инфекций от первоначального установления до системных последствий, а также то, как хозяин может успешно восстанавливать повреждения, этот обзор связывает воедино эти сложные взаимодействия с предоставить целостный обзор воздействия кишечных инфекций на эпителиальный барьер и за его пределы.
Повышенное потребление кишечного микробного муцина способствует уничтожению паразитического червя
- Mathis Wolter, Erica T. Grant, M. Desai
Биология, медицина
bioRxiv
- 2022
Клинически значимая, иммунная и паразитарная оси является важным предварительным знанием в лечении паразитарных инфекций.
ПОКАЗАНЫ 1–10 ИЗ 42 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантности Наиболее влиятельные документыНедавность
Состав кишечной микробиоты формирует слизистый барьер толстой кишки
- H. Jakobsson, A. M. Rodríguez-Piñeiro, M. Johansson
Биология, наука об окружающей среде
Отчеты EMBO
- 2015
имеют последствия для здоровья и болезней и подчеркивают, что генетически идентичные животные, содержащиеся в одном и том же учреждении, могут иметь довольно разные микробиоты и барьерные структуры.
Значение и регуляция слизистого барьера толстой кишки в мышиной модели колита.
Продемонстрирована корреляция между снижением слизистого барьера и усилением клинических симптомов в начале колита, а также продемонстрирована способность бактерий регулировать толщину слизи толстой кишки.
Бактерии проникают через непроницаемый в норме слой слизистой оболочки толстой кишки как у мышиных моделей колита, так и у пациентов с язвенным колитом0055 2013
Слизь толстой кишки на животных моделях, у которых спонтанно развивается колит, и у пациентов с активным ЯК позволяет бактериям проникать и достигать эпителия, и это предполагает новую модель патофизиологии ЯК.
Антибактериальный лектин RegIIIγ способствует пространственному разделению микробиоты и организма-хозяина в кишечнике0051
Показано, что RegIIIγ, секретируемый антибактериальный лектин, необходим для поддержания зоны размером ~50 микрометров, которая физически отделяет микробиоту от эпителиальной поверхности тонкого кишечника.

Слизистая система желудочно-кишечного тракта в норме и при патологии
Желудок и толстая кишка имеют два слоя слизи; внутренний слой прикреплен, а внешний слой менее плотный и неприкрепленный, а внутренний слой слизи может быть проницаем для бактерий с помощью нескольких других механизмов, включая аберрации в иммунной системе.
The gut microbiota elicits a profound metabolic reorientation in the mouse jejunal mucosa during conventionalisation
- S. El Aidy, C. Merrifield, M. Kleerebezem
Medicine, Biology
Gut
- 2012
This study объясняет динамическую реакцию тощей кишки на микробиоту и поддерживает важную роль тощей кишки в метаболическом контроле, включая глюкозный и энергетический гомеостаз.
Метод ex vivo для изучения образования, свойств и толщины слизи в биоптатах толстой кишки человека и эксплантатах тонкой и толстой кишки мыши
- J.
 Gustafsson, Anna Ermund, M. Johansson, A. Schütte, G. Hansson, H. Sjövall
Gustafsson, Anna Ermund, M. Johansson, A. Schütte, G. Hansson, H. Sjövall Биология
- 2012
Этот метод ex vivo для анализа слизи толстой кишки человека и мыши тонкая и толстая кишка сохраняет ключевые свойства системы слизи in vivo и позволяет проводить исследования высокодинамичной системы слизи в хорошо контролируемых условиях.
Метод ex vivo для изучения образования, свойств и толщины слизи в биоптатах толстой кишки человека и эксплантатах тонкого и толстого кишечника мыши.
Этот ex vivo метод анализа свойств слизи в толстой кишке человека и тонкой и толстой кишке мыши сохраняет ключевые свойства системы слизи in vivo и позволяет проводить исследования высокодинамичной системы слизи в хорошо контролируемых условиях.
Индуцированное микроорганизмами расщепление меприна β в муцине MUC2 и функциональный канал CFTR необходимы для высвобождения заякоренной тонкой кишечной слизи прикрепляется к эпителию.

