Какие продукты можно и нельзя есть при панкреатите. Как составить правильное меню на неделю при обострении и в период ремиссии. Полезные рецепты блюд для диеты при панкреатите.
Особенности диеты при панкреатите
Панкреатит — это воспаление поджелудочной железы, которое требует особого подхода к питанию. Правильная диета играет ключевую роль в лечении и профилактике обострений этого заболевания.
Основные принципы диеты при панкреатите:
- Дробное питание небольшими порциями 5-6 раз в день
- Исключение жирной, жареной, острой и копченой пищи
- Ограничение соли до 5-6 г в сутки
- Отказ от алкоголя
- Употребление достаточного количества жидкости (1,5-2 л в день)
- Щадящая термическая обработка продуктов (варка, запекание, приготовление на пару)
Какие продукты можно есть при панкреатите?
При панкреатите рекомендуется употреблять следующие продукты:
- Нежирные сорта мяса и рыбы
- Обезжиренные молочные продукты
- Яйца (в ограниченном количестве)
- Крупы (рис, овсянка, гречка)
- Овощи и фрукты (кроме острых и кислых)
- Хлеб из муки грубого помола
- Растительные масла в небольшом количестве
Какие продукты нельзя есть при панкреатите?
При панкреатите следует исключить из рациона:

- Жирные сорта мяса и рыбы
- Копчености, колбасы, консервы
- Жареные и острые блюда
- Алкоголь
- Газированные напитки
- Сдобу и кондитерские изделия
- Грибы
- Бобовые
- Квашеную капусту и маринады
Меню на неделю при панкреатите
Правильно составленное меню поможет соблюдать диету при панкреатите. Вот примерный вариант меню на неделю:
Понедельник
- Завтрак: овсяная каша на воде, яблоко
- 2-й завтрак: нежирный йогурт
- Обед: суп-пюре из кабачков, отварная куриная грудка
- Полдник: запеченное яблоко
- Ужин: паровые рыбные котлеты с рисом
Вторник
- Завтрак: омлет из белков, тост из цельнозернового хлеба
- 2-й завтрак: банан
- Обед: вегетарианский борщ, отварная говядина
- Полдник: творог обезжиренный
- Ужин: запеченные овощи, отварная индейка
Среда
- Завтрак: гречневая каша на воде, груша
- 2-й завтрак: отвар шиповника
- Обед: овощной суп, паровая рыба
- Полдник: печеное яблоко
- Ужин: овощное рагу, отварное куриное филе
Четверг
- Завтрак: рисовая каша на воде, персик
- 2-й завтрак: нежирный кефир
- Обед: картофельный суп-пюре, отварная телятина
- Полдник: запеченная тыква
- Ужин: овощной омлет, отварная рыба
Пятница
- Завтрак: манная каша на воде, банан
- 2-й завтрак: яблоко
- Обед: рыбный суп, паровые куриные котлеты
- Полдник: творожная запеканка
- Ужин: тушеные кабачки, отварная говядина
Суббота
- Завтрак: овсяная каша на воде, груша
- 2-й завтрак: нежирный йогурт
- Обед: овощной суп-пюре, отварная индейка
- Полдник: запеченное яблоко
- Ужин: паровые рыбные тефтели с рисом
Воскресенье
- Завтрак: рисовая каша на воде, персик
- 2-й завтрак: отвар шиповника
- Обед: куриный суп с вермишелью, отварная рыба
- Полдник: печеная груша
- Ужин: овощное пюре, паровая куриная грудка
Рецепты блюд при панкреатите
Вот несколько полезных рецептов блюд, которые можно приготовить при панкреатите:

Суп-пюре из кабачков
Ингредиенты:
- Кабачки — 2 шт.
- Картофель — 1 шт.
- Морковь — 1 шт.
- Лук — 1 шт.
- Вода — 1 л
- Соль по вкусу
Приготовление:
- Овощи очистить и нарезать кубиками
- Залить водой и варить до готовности
- Измельчить блендером до однородной консистенции
- При подаче можно добавить немного нежирной сметаны
Паровые рыбные котлеты
Ингредиенты:
- Филе нежирной рыбы — 300 г
- Белый хлеб — 50 г
- Молоко — 50 мл
- Яичный белок — 1 шт.
- Соль по вкусу
Приготовление:
- Рыбу пропустить через мясорубку
- Хлеб замочить в молоке и отжать
- Смешать рыбный фарш, хлеб и белок
- Сформировать котлеты и готовить на пару 15-20 минут
Запеканка из нежирного творога
Ингредиенты:
- Творог обезжиренный — 400 г
- Яйцо — 1 шт.
- Манная крупа — 2 ст. л.
- Сахар — 2 ст. л.
- Ванилин
Приготовление:
- Творог протереть через сито
- Добавить яйцо, манку, сахар и ванилин
- Тщательно перемешать
- Выложить в форму и запекать в духовке 30-40 минут при 180°C
Особенности питания при обострении панкреатита
В период обострения панкреатита диета должна быть максимально щадящей. Первые дни обострения показано голодание или прием только жидкой пищи. Затем постепенно вводятся протертые каши и супы-пюре. Расширение рациона происходит медленно, под контролем врача.

Что можно есть в острый период панкреатита?
- Протертые каши на воде
- Овощные и фруктовые пюре
- Кисели
- Нежирные бульоны
- Отвар шиповника
Чего нельзя есть при обострении панкреатита?
- Любую твердую пищу
- Продукты, содержащие клетчатку
- Жирные, жареные, острые блюда
- Свежие фрукты и овощи
- Молочные продукты
- Сладости и выпечку
Питание при хроническом панкреатите
При хроническом панкреатите в период ремиссии диета может быть менее строгой, чем при обострении. Однако основные принципы правильного питания необходимо соблюдать постоянно.
Что можно есть при хроническом панкреатите?
- Нежирные сорта мяса и рыбы
- Обезжиренные молочные продукты
- Яйца (2-3 штуки в неделю)
- Овощи и фрукты в отварном и запеченном виде
- Хлеб вчерашней выпечки
- Сухофрукты
Чего нельзя есть при хроническом панкреатите?
- Жирные, жареные, копченые продукты
- Острые приправы и соусы
- Алкоголь
- Газированные напитки
- Кофе
- Шоколад
- Свежую выпечку
Влияние различных продуктов на поджелудочную железу
Некоторые продукты оказывают благоприятное воздействие на поджелудочную железу, в то время как другие могут спровоцировать обострение панкреатита.

Какие продукты полезны для поджелудочной железы?
- Овсянка
- Нежирная рыба
- Оливковое масло
- Куркума
- Шпинат
- Черника
- Чеснок
Какие продукты вредны для поджелудочной железы?
- Красное мясо
- Жареные продукты
- Алкоголь
- Газированные напитки
- Сахар и сладости
- Кофеин
- Трансжиры
Заключение
Правильное питание играет ключевую роль в лечении и профилактике панкреатита. Соблюдение диеты помогает снизить нагрузку на поджелудочную железу, уменьшить воспаление и предотвратить обострения заболевания. Важно помнить, что диета при панкреатите должна быть индивидуальной и составляться с учетом рекомендаций врача.
В диабетическом меню: рыба данио как модель развития и функции поджелудочной железы
1. Shapiro AM, Lakey JR, Ryan EA, Korbutt GS, Toth E, et al. Трансплантация островковых клеток у семи пациентов с сахарным диабетом 1 типа с использованием иммуносупрессивного режима без глюкокортикоидов. N Engl J Med. 2000; 343: 230–238. [PubMed] [Google Scholar]
2. Shapiro AM, Ricordi C, Hering BJ, Auchincloss H, Lindblad R, et al. Международные испытания Эдмонтонского протокола трансплантации островковых клеток. N Engl J Med. 2006; 355:1318–1330. [PubMed] [Академия Google]
3. Jorgensen MC, Ahnfelt-Ronne J, Hald J, Madsen OD, Serup P, et al. Иллюстрированный обзор раннего развития поджелудочной железы у мышей. Endocr Rev. 2007; 28:685–705. [PubMed] [Google Scholar]
4. Warga RM, Nusslein-Volhard C. Происхождение и развитие энтодермы рыбок данио. Разработка. 1999; 126: 827–838. [PubMed] [Google Scholar]
5. Фалькмер С. Сравнительная морфология панкреатических островков у животных. В: Volk BW, Arquilla ER, редакторы. Диабетическая поджелудочная железа. 2-е изд. Нью-Йорк: Plenum Medical Book Company; 1985. стр. 17–52. [Google Scholar]
В: Volk BW, Arquilla ER, редакторы. Диабетическая поджелудочная железа. 2-е изд. Нью-Йорк: Plenum Medical Book Company; 1985. стр. 17–52. [Google Scholar]
6. Argenton F, Zecchin E, Bortolussi M. Раннее появление клеток, экспрессирующих гормоны поджелудочной железы, у эмбрионов рыбок данио. Мех Дев. 1999; 87: 217–221. [PubMed] [Google Scholar]
7. Biemar F, Argenton F, Schmidtke R, Epperlein S, Peers B, et al. Развитие поджелудочной железы у рыбок данио: раннее рассеянное появление клеток, экспрессирующих эндокринные гормоны, и их конвергенция с образованием окончательного островка. Дев биол. 2001; 230:189–203. [PubMed] [Академия Google]
8. Chen S, Li C, Yuan G, Xie F. Анатомические и гистологические наблюдения поджелудочной железы взрослых рыбок данио. Поджелудочная железа. 2007; 34: 120–125. [PubMed] [Google Scholar]
9. Пишарат Х., Ри Дж. М., Суонсон М. А., Лич С. Д., Парсонс М. Дж. Направленная абляция бета-клеток в поджелудочной железе эмбрионов рыбок данио с использованием нитроредуктазы E. coli. Мех Дев. 2007; 124: 218–229. [Бесплатная статья PMC] [PubMed] [Google Scholar]
coli. Мех Дев. 2007; 124: 218–229. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Эдлунд Х. Органогенез поджелудочной железы — механизмы развития и последствия для терапии. Нат Рев Жене. 2002; 3: 524–532. [PubMed] [Академия Google]
11. Филд Х.А., Обер Э.А., Розер Т., Штайнер Д.Ю. Формирование пищеварительной системы у рыбок данио. I. Морфогенез печени. Дев биол. 2003; 253: 279–290. [PubMed] [Google Scholar]
12. Pezeron G, Mourrain P, Courty S, Ghislain J, Becker TS, et al. Живой анализ формирования энтодермального слоя идентифицирует случайное блуждание как новое гаструляционное движение. Карр Биол. 2008; 18: 276–281. [PubMed] [Google Scholar]
13. Александр Дж., Штейнир Д.Ю. Молекулярный путь, ведущий к образованию энтодермы у рыбок данио. Карр Биол. 1999;9:1147–1157. [PubMed] [Google Scholar]
14. Stainier DY. Взгляд на молекулярные внутренности формирования энтодермы. Гены Дев. 2002; 16: 893–907. [PubMed] [Google Scholar]
15. Grapin-Botton A, Constam D. Эволюция механизмов и молекулярный контроль образования энтодермы. Мех Дев. 2007; 124: 253–278. [PubMed] [Google Scholar]
Grapin-Botton A, Constam D. Эволюция механизмов и молекулярный контроль образования энтодермы. Мех Дев. 2007; 124: 253–278. [PubMed] [Google Scholar]
16. Dickmeis T, Mourrain P, Saint-Etienne L, Fischer N, Aanstad P, et al. Важнейший компонент пути формирования энтодермы, CASANOVA, кодируется новым родственным sox геном. Гены Дев. 2001; 15: 1487–149.2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Kikuchi Y, Agathon A, Alexander J, Thisse C, Waldron S, et al. casanova кодирует новый родственный Sox белок, необходимый и достаточный для раннего образования энтодермы у рыбок данио. Гены Дев. 2001; 15: 1493–1505. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Wallace KN, Pack M. Уникальные и консервативные аспекты развития кишечника у рыбок данио. Дев биол. 2003; 255:12–29. [PubMed] [Google Scholar]
19. Glover JC, Renaud JS, Rijli FM. Ретиноевая кислота и формирование паттерна заднего мозга. Дж Нейробиол. 2006; 66: 705–725. [PubMed] [Академия Google]
20. Begemann G, Schilling TF, Rauch GJ, Geisler R, Ingham PW. Мутация у рыбок данио neckless обнаруживает потребность в raldh3 в мезодермальных сигналах, которые паттернируют задний мозг. Разработка. 2001; 128:3081–3094. [PubMed] [Google Scholar]
Begemann G, Schilling TF, Rauch GJ, Geisler R, Ingham PW. Мутация у рыбок данио neckless обнаруживает потребность в raldh3 в мезодермальных сигналах, которые паттернируют задний мозг. Разработка. 2001; 128:3081–3094. [PubMed] [Google Scholar]
21. Grandel H, Lun K, Rauch GJ, Rhinn M, Piotrowski T, et al. Передача сигналов ретиноевой кислотой у эмбрионов рыбок данио необходима на стадиях пре-сегментации, чтобы сформировать передне-заднюю ось ЦНС и индуцировать зачаток грудного плавника. Разработка. 2002;129: 2851–2865. [PubMed] [Google Scholar]
22. Стаффорд Д., Принц В.Е. Передача сигналов ретиноевой кислотой необходима для критической ранней стадии развития поджелудочной железы рыбок данио. Карр Биол. 2002; 12:1215–1220. [PubMed] [Google Scholar]
23. Stafford D, Hornbruch A, Mueller PR, Prince VE. Законсервированная роль передачи сигналов ретиноидов в развитии поджелудочной железы позвоночных. Дев Гены Эвол. 2004; 214:432–441. [PubMed] [Google Scholar]
24. Chen Y, Pan FC, Brandes N, Afelik S, Solter M, et al. Передача сигналов ретиноевой кислотой необходима для развития поджелудочной железы и способствует эндокринной дифференцировке за счет экзокринной клеточной дифференцировки у Xenopus. Дев биол. 2004; 271:144–160. [PubMed] [Академия Google]
Chen Y, Pan FC, Brandes N, Afelik S, Solter M, et al. Передача сигналов ретиноевой кислотой необходима для развития поджелудочной железы и способствует эндокринной дифференцировке за счет экзокринной клеточной дифференцировки у Xenopus. Дев биол. 2004; 271:144–160. [PubMed] [Академия Google]
25. Молотков А., Молоткова Н., Дустер Г. Ретиноевая кислота, продуцируемая Raldh3 в мезодерме, необходима для развития дорсальной энтодермальной поджелудочной железы мыши. Дев Дин. 2005; 232:950–957. [PubMed] [Google Scholar]
26. Martin M, Gallego-Llamas J, Ribes V, Kedinger M, Niederreither K, et al. Агенезия дорсальной поджелудочной железы у мышей с дефицитом ретиноевой кислоты Raldh3. Дев биол. 2005; 284:399–411. [PubMed] [Google Scholar]
27. D’Amour KA, Bang AG, Eliazer S, Kelly OG, Agulnick AD, et al. Производство эндокринных клеток, экспрессирующих гормоны поджелудочной железы, из эмбриональных стволовых клеток человека. Нац биотехнолог. 2006;24:1392–1401. [PubMed] [Google Scholar]
28. Jiang W, Shi Y, Zhao D, Chen S, Yong J, et al. Получение in vitro функциональных клеток, продуцирующих инсулин, из эмбриональных стволовых клеток человека. Сотовый рез. 2007; 17: 333–344. [PubMed] [Google Scholar]
Jiang W, Shi Y, Zhao D, Chen S, Yong J, et al. Получение in vitro функциональных клеток, продуцирующих инсулин, из эмбриональных стволовых клеток человека. Сотовый рез. 2007; 17: 333–344. [PubMed] [Google Scholar]
29. Shim JH, Kim SE, Woo DH, Kim SK, Oh CH и др. Направленная дифференцировка эмбриональных стволовых клеток человека в направлении судьбы клеток поджелудочной железы. Диабетология. 2007; 50:1228–1238. [PubMed] [Google Scholar]
30. Sakaguchi T, Kuroiwa A, Takeda H. Новый ген sox, 226D7, действует ниже передачи сигналов Nodal, специфицируя предшественников энтодермы у рыбок данио. Мех Дев. 2001; 107: 25–38. [PubMed] [Академия Google]
31. Stafford D, White RJ, Kinkel MD, Linville A, Schilling TF, et al. Ретиноиды сигнализируют непосредственно к энтодерме рыбок данио, чтобы специфицировать инсулин-экспрессирующие β-клетки. Разработка. 2006; 133:949–956. [PubMed] [Google Scholar]
32. Waxman JS, Yelon D. Сравнение паттернов экспрессии недавно идентифицированных рецепторов ретиноевой кислоты и ретиноида X у рыбок данио. Дев Дин. 2007; 236: 587–595. [PubMed] [Google Scholar]
Дев Дин. 2007; 236: 587–595. [PubMed] [Google Scholar]
33. Kinkel MD, Eames SC, Alonzo MR, Prince VE. Cdx4 необходим в энтодерме для локализации поджелудочной железы и ограничения количества бета-клеток. Разработка. 2008;135:919–929. [PubMed] [Google Scholar]
34. Уэллс Дж.М., Мелтон Д.А. Ранняя энтодерма мыши сформирована растворимыми факторами из соседних зародышевых листков. Разработка. 2000; 127:1563–1572. [PubMed] [Google Scholar]
35. Dessimoz J, Opoka R, Kordich JJ, Grapin-Botton A, Wells JM. Передача сигналов FGF необходима для установления доменов кишечной трубки вдоль передне-задней оси in vivo. Мех Дев. 2006; 123:42–55. [PubMed] [Google Scholar]
36. Grapin-Botton A, Majithia AR, Melton DA. Ключевые события формирования поджелудочной железы запускаются в энтодерме кишечника эктопической экспрессией регуляторных генов поджелудочной железы. Гены Дев. 2001; 15: 444–454. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Haremaki T, Tanaka Y, Hongo I, Yuge M, Okamoto H. Интеграция множественных путей передачи сигналов на элементах ответа Fgf хвостового гомолога Xenopus Xcad3. Разработка. 2003; 130:4907–4917. [PubMed] [Google Scholar]
Интеграция множественных путей передачи сигналов на элементах ответа Fgf хвостового гомолога Xenopus Xcad3. Разработка. 2003; 130:4907–4917. [PubMed] [Google Scholar]
38. Хеброк М., Ким С.К., Мелтон Д.А. Репрессия хорды энтодермального Sonic hedgehog позволяет развиваться поджелудочной железе. Гены Дев. 1998; 12:1705–1713. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Manfroid I, Delporte F, Baudhuin A, Motte P, Neumann CJ, Voz ML, Martial JA, Peers B. Реципрокные эндодермально-мезодермальные взаимодействия, опосредованные fgf24 и fgf10 регулируют развитие поджелудочной железы. Разработка. 2007; 134:4011–4021. [PubMed] [Академия Google]
40. Dong PD, Munson CA, Norton W, Crosnier C, Pan X, et al. Fgf10 регулирует формирование паттерна и дифференцировку системы гепатопанкреатических протоков. Нат Жене. 2007; 39: 397–402. [PubMed] [Google Scholar]
41. Apelqvist A, Ahlgren U, Edlund H. Sonic hedgehog управляет дифференцировкой специализированной мезодермы в кишечнике и поджелудочной железе. Карр Биол. 1997; 7: 801–804. [PubMed] [Google Scholar]
Карр Биол. 1997; 7: 801–804. [PubMed] [Google Scholar]
42. Hebrok M. Передача сигналов Hedgehog в развитии поджелудочной железы. Мех Дев. 2003; 120:45–57. [PubMed] [Академия Google]
43. Рой С., Цяо Т., Вольф С., Ингам П.В. Сигнальный путь Hedgehog важен для спецификации поджелудочной железы у эмбрионов рыбок данио. Карр Биол. 2001; 11: 1358–1363. [PubMed] [Google Scholar]
44. diIorio PJ, Moss JB, Sbrogna JL, Karlstrom RO, Moss LG. Sonic hedgehog требуется на ранней стадии развития островков поджелудочной железы. Дев биол. 2002; 244:75–84. [PubMed] [Google Scholar]
45. Chung WS, Stainier DY. Внутриэнтодермальные взаимодействия необходимы для индукции бета-клеток поджелудочной железы. Ячейка Дев. 2008; 14: 582–59.3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Tiso N, Filippi A, Pauls S, Bortolussi M, Argenton F. Передача сигналов BMP регулирует формирование переднезаднего энтодермального паттерна у рыбок данио. Мех Дев. 2002; 118: 29–37. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
47. Кумар М., Джордан Н., Мелтон Д., Грейпин-Боттон А. Сигналы от мезодермы боковой пластинки направляют энтодерму в сторону поджелудочной железы. Дев биол. 2003; 259:109–122. [PubMed] [Google Scholar]
48. Kim SK, Hebrok M, Li E, Oh SP, Schrewe H, et al. Паттерн рецептора активина в органогенезе передней кишки. Гены Дев. 2000; 14:1866–1871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Spagnoli FM, Brivanlou AH. Мишень Gata5, TGIF2, определяет область поджелудочной железы путем модуляции сигналов BMP в энтодерме. Разработка. 2008; 135:451–461. [PubMed] [Google Scholar]
50. Field HA, Dong PD, Beis D, Stainier DY. Формирование пищеварительной системы у рыбок данио. II. Морфогенез поджелудочной железы. Дев биол. 2003; 261:197–208. [PubMed] [Google Scholar]
51. Horne-Badovinac S, Lin D, Waldron S, Schwarz M, Mbamalu G, et al. Позиционное клонирование сердца и души показывает множественные роли PKC лямбда в органогенезе рыбок данио.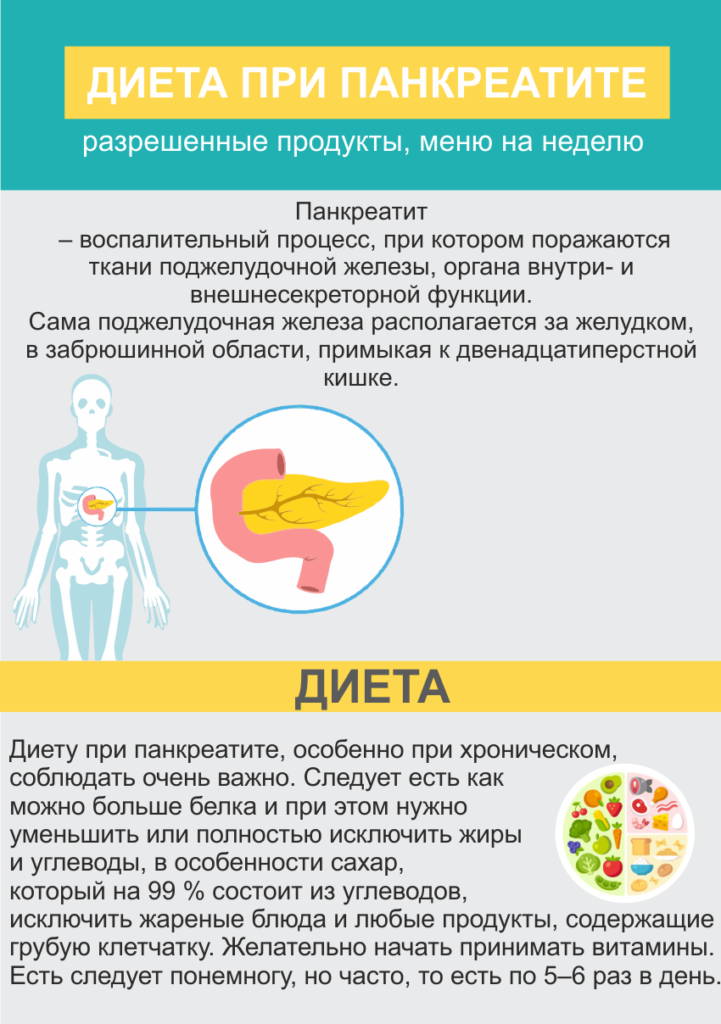 Карр Биол. 2001;11:1492–1502. [PubMed] [Google Scholar]
Карр Биол. 2001;11:1492–1502. [PubMed] [Google Scholar]
52. Уорд А.Б., Варга Р.М., Принц В.Е. Происхождение эндокринной и экзокринной поджелудочной железы у рыбок данио. Дев Дин. 2007; 236:1558–1569. [PubMed] [Google Scholar]
53. Matsui T, Raya A, Kawakami Y, Callol-Massot C, Capdevila J, et al. Неканоническая передача сигналов Wnt регулирует срединную конвергенцию зачатков органов во время развития рыбок данио. Гены Дев. 2005; 19: 164–175. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Kim HJ, Schleiffarth JR, Jessurun J, Sumanas S, Petryk A, et al. Передача сигналов Wnt5 в развитии поджелудочной железы позвоночных. БМС Биол. 2005; 3:23. 23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Zecchin E, Filippi A, Biemar F, Tiso N, Pauls S, et al. Отдельные дельта- и зубчатые гены контролируют последовательное отделение типов клеток поджелудочной железы от пулов предшественников у рыбок данио. Дев биол. 2007; 301:192–204. [PubMed] [Google Scholar]
56. Gradwohl G, Dierich A, LeMeur M, Guillemot F. Нейрогенин3 необходим для развития четырех линий эндокринных клеток поджелудочной железы. Proc Natl Acad Sci U S A. 2000; 97:1607–1611. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Gradwohl G, Dierich A, LeMeur M, Guillemot F. Нейрогенин3 необходим для развития четырех линий эндокринных клеток поджелудочной железы. Proc Natl Acad Sci U S A. 2000; 97:1607–1611. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Kawaguchi Y, Cooper B, Gannon M, Ray M, MacDonald RJ, et al. Роль регулятора транскрипции Ptf1a в превращении кишечных предшественников в панкреатические. Нат Жене. 2002; 32: 128–134. [PubMed] [Google Scholar]
58. Zecchin E, Mavropoulos A, Devos N, Filippi A, Tiso N, et al. Эволюционно законсервированная роль ptf1a в спецификации экзокринной судьбы поджелудочной железы. Дев биол. 2004; 268:174–184. [PubMed] [Google Scholar]
59. Lin JW, Biankin AV, Horb ME, Ghosh B, Prasad NB, et al. Дифференциальная потребность в ptf1a в эндокринных и экзокринных линиях развивающейся поджелудочной железы рыбок данио. Дев биол. 2004; 270:474–486. [PubMed] [Академия Google]
60. Донг П.Д., Провост Э., Лич С.Д., Стейнер Д.Ю. Градированные уровни Ptf1a по-разному регулируют эндокринную и экзокринную судьбу в развивающейся поджелудочной железе. Гены Дев. 2008; 22:1445–1450. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гены Дев. 2008; 22:1445–1450. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Leach SD. Эпителиальная дифференцировка при развитии и неоплазии поджелудочной железы: новые ниши для нестина и Notch. Дж. Клин Гастроэнтерол. 2005;39:S78–S82. [PubMed] [Google Scholar]
62. Apelqvist A, Li H, Sommer L, Beatus P, Anderson DJ, et al. Передача сигналов Notch контролирует дифференцировку клеток поджелудочной железы. Природа. 1999;400:877–881. [PubMed] [Google Scholar]
63. Hald J, Hjorth JP, German MS, Madsen OD, Serup P, Jensen J. Активированный Notch2 предотвращает дифференцировку ацинарных клеток поджелудочной железы и ослабляет развитие эндокринной системы. Дев биол. 2003; 260:426–437. [PubMed] [Google Scholar]
64. Murtaugh LC, Stanger BZ, Kwan KM, Melton DA. Передача сигналов Notch контролирует несколько стадий дифференцировки поджелудочной железы. Proc Natl Acad Sci U S A. 2003;100:14920–14925. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Esni F, Ghosh B, Biankin AV, Lin JW, Albert MA, et al. Notch ингибирует функцию Ptf1 и дифференцировку ацинарных клеток в развивающихся поджелудочных железах мышей и рыбок данио. Разработка. 2004; 131:4213–4224. [PubMed] [Google Scholar]
Esni F, Ghosh B, Biankin AV, Lin JW, Albert MA, et al. Notch ингибирует функцию Ptf1 и дифференцировку ацинарных клеток в развивающихся поджелудочных железах мышей и рыбок данио. Разработка. 2004; 131:4213–4224. [PubMed] [Google Scholar]
66. Lai EC. Передача сигналов Notch: контроль клеточной коммуникации и судьбы клеток. Разработка. 2004; 131:965–973. [PubMed] [Google Scholar]
67. Wan H, Korzh S, Li Z, Mudumana SP, Korzh V, et al. Анализы развития поджелудочной железы путем создания gfp трансгенных рыбок данио с использованием экзокринного промотора гена эластазы A, специфичного для поджелудочной железы. Разрешение ячейки опыта. 2006; 312:1526–1539.. [PubMed] [Google Scholar]
68. Curado S, Anderson RM, Jungblut B, Mumm J, Schroeter E, et al. Условная целенаправленная абляция клеток у рыбок данио: новый инструмент для изучения регенерации. Дев Дин. 2007; 236:1025–1035. [PubMed] [Google Scholar]
69. Скромный I, князь В.Е. Текущие перспективы обратной генетики рыбок данио: движение вперед. Дев Дин. 2008; 237: 861–882. [PubMed] [Google Scholar]
Дев Дин. 2008; 237: 861–882. [PubMed] [Google Scholar]
70. Kim HJ, Sumanas S, Palencia-Desai S, Dong Y, Chen JN, et al. Генетический анализ раннего формирования эндокринной поджелудочной железы у рыбок данио. Мол Эндокринол. 2006;20:194–203. [PubMed] [Google Scholar]
71. Йи Н.С., Лорент К., Пак М. Развитие экзокринной поджелудочной железы у рыбок данио. Дев биол. 2005; 284:84–101. [PubMed] [Google Scholar]
72. Ober EA, Verkade H, Field HA, Stainier DY. Мезодермальная передача сигналов Wnt2b позитивно регулирует спецификацию печени. Природа. 2006; 442: 688–691. [PubMed] [Google Scholar]
73. Serafimidis I, Rakatzi I, Episkopou V, Gouti M, Gavalas A. Новые эффекторы направленной и Ngn3-опосредованной дифференцировки эмбриональных стволовых клеток мыши в эндокринные предшественники поджелудочной железы. Стволовые клетки. 2008; 26:3–16. [PubMed] [Академия Google]
74. Kroon E, Martinson LA, Kadoya K, Bang AG, Kelly OG, et al. Панкреатическая энтодерма, полученная из эмбриональных стволовых клеток человека, генерирует инсулин-секретирующие клетки, чувствительные к глюкозе, in vivo. Нац биотехнолог. 2008; 26: 443–452. [PubMed] [Google Scholar]
Нац биотехнолог. 2008; 26: 443–452. [PubMed] [Google Scholar]
75. Эло Б., Виллано К.М., Говорко Д., Уайт Л.А. Личинки рыбок данио как модель метаболизма глюкозы: экспрессия фосфоенолпируваткарбоксикиназы в качестве маркера воздействия антидиабетических соединений. Дж Мол Эндокринол. 2007; 38: 433–440. [PubMed] [Академия Google]
76. Глисон М., Коннотон В., Арнесон Л.С. Индукция гипергликемии у рыбок данио рерио (Danio rerio) приводит к морфологическим изменениям сетчатки. Акта Диабетол. 2007; 44: 157–163. [PubMed] [Google Scholar]
77. Мерфи Р.Д., Зон Л.И. Скрининг малых молекул у рыбок данио. Методы. 2006; 39: 255–261. [PubMed] [Google Scholar]
78. Mavropoulos A, Devos N, Biemar F, Zecchin E, Argenton F, et al. sox4b является ключевым игроком в дифференцировке альфа-клеток поджелудочной железы у рыбок данио. Дев биол. 2005; 285: 211–223. [PubMed] [Академия Google]
79. Вендик Б., Майер Э., Мейер Д. Гены mnx у рыбок данио в формировании эндокринной и экзокринной поджелудочной железы. Дев биол. 2004; 268: 372–383. [PubMed] [Google Scholar]
Дев биол. 2004; 268: 372–383. [PubMed] [Google Scholar]
80. Milewski WM, Duguay SJ, Chan SJ, Steiner DF. Сохранение структуры, функции и экспрессии PDX-1 у рыбок данио. Эндокринология. 1998; 139:1440–1449. [PubMed] [Google Scholar]
81. Pauls S, Zecchin E, Tiso N, Bortolussi M, Argenton F. Функция и регуляция рыбок данио nkx2.2a во время развития островка и протоков поджелудочной железы. Дев биол. 2007; 304: 875–89.0. [PubMed] [Google Scholar]
82. Иноуэ А., Такахаши М., Хатта К., Хотта Ю., Окамото Х. Регуляция экспрессии мРНК островка-1 во время дифференцировки нейронов у эмбрионов рыбок данио. Дев Дин. 1994; 199:1–11. [PubMed] [Google Scholar]
83. Краусс С., Маден М., Холдер Н., Уилсон С.В. Рыбка данио pax[b] участвует в формировании границы между средним и задним мозгом. Природа. 1992; 360:87–89. [PubMed] [Google Scholar]
84. Nornes S, Clarkson M, Mikkola I, Pedersen M, Bardsley A, et al. Рыбки данио содержат два гена pax6, участвующих в развитии глаз. Мех Дев. 1998;77:185–196. [PubMed] [Google Scholar]
Мех Дев. 1998;77:185–196. [PubMed] [Google Scholar]
85. Korzh V, Sleptsova I, Liao J, He J, Gong Z. Экспрессия генов bHLH рыбок данио ngn1 и nrd определяет различные стадии дифференцировки нейронов. Дев Дин. 1998; 213:92–104. [PubMed] [Google Scholar]
86. Devos N, Deflorian G, Biemar F, Bortolussi M, Martial JA, et al. Дифференциальная экспрессия двух генов соматостатина во время эмбрионального развития рыбок данио. Мех Дев. 2002; 115: 133–137. [PubMed] [Google Scholar]
87. Delporte F. 2008, личное сообщение. [Академия Google]
88. Папасани М.Р., Робисон Б.Д., Харди Р.В., Хилл Р.А. Экспрессия двух инсулинов на раннем этапе развития у рыбок данио (Danio rerio) Physiol Genomics. 2006; 27:79–85. [PubMed] [Google Scholar]
89. Sun Z, Hopkins N. vhnf1, MODY5 и семейный ген, ассоциированный с GCKD, регулирует региональную спецификацию кишечника рыбок данио, пронефроса и заднего мозга. Гены Дев. 2001;15:3217–3229. [PMC free article] [PubMed] [Google Scholar]
90. Yee NS, Yusuff S, Pack M. Морфант pdx1 рыбок данио демонстрирует дефекты в развитии поджелудочной железы и хиральности органов пищеварения и потенциально идентифицирует мультипотентную клетку-предшественник поджелудочной железы. Бытие. 2001; 30: 137–140. [PubMed] [Академия Google]
Yee NS, Yusuff S, Pack M. Морфант pdx1 рыбок данио демонстрирует дефекты в развитии поджелудочной железы и хиральности органов пищеварения и потенциально идентифицирует мультипотентную клетку-предшественник поджелудочной железы. Бытие. 2001; 30: 137–140. [PubMed] [Академия Google]
91. Wilson ME, Yang KY, Kalousova A, Lau J, Kosaka Y, et al. Транскрипционный фактор HMG Box Sox4 способствует развитию эндокринной поджелудочной железы. Диабет. 2005; 54:3402–3409. [PubMed] [Google Scholar]
92. Харрисон К.А., Талер Дж., Пфафф С.Л., Гу Х., Керл Дж.Х. Агенезия дорсальной доли поджелудочной железы и аномальные островки Лангерганса у мышей с дефицитом Hlxb9. Нат Жене. 1999; 23:71–75. [PubMed] [Google Scholar]
93. Li H, Arber S, Jessell TM, Edlund H. Селективный агенез дорсальной части поджелудочной железы у мышей, лишенных гомеобоксного гена Hlxb9.. Нат Жене. 1999; 23:67–70. [PubMed] [Google Scholar]
94. Stoffers DA, Ferrer J, Clarke WL, Habener JF. Сахарный диабет II типа с ранним началом (MODY4), связанный с IPF1. Нат Жене. 1997; 17: 138–139. [PubMed] [Google Scholar]
Нат Жене. 1997; 17: 138–139. [PubMed] [Google Scholar]
95. Sussel L, Kalamaras J, Hartigan-O’Connor DJ, Meneses JJ, Pedersen RA, et al. Мыши, лишенные гомеодоменового транскрипционного фактора Nkx2.2, страдают диабетом из-за задержки дифференцировки бета-клеток поджелудочной железы. Разработка. 1998;125:2213–2221. [PubMed] [Академия Google]
96. Ahlgren U, Pfaff SL, Jessell TM, Edlund T, Edlund H. Независимая потребность в ISL1 при формировании мезенхимы поджелудочной железы и островковых клеток. Природа. 1997; 385: 257–260. [PubMed] [Google Scholar]
97. Sander M, Neubuser A, Kalamaras J, Ee HC, Martin GR, et al. Генетический анализ показывает, что PAX6 необходим для нормальной транскрипции генов гормонов поджелудочной железы и развития островков. Гены Дев. 1997; 11:1662–1673. [PubMed] [Google Scholar]
98. Фаянс С.С., Белл Г.И., Полонский К.С. Молекулярные механизмы и клиническая патофизиология диабета зрелого возраста у молодых. N Engl J Med. 2001;345:971–980. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
99. Sladek R, Rocheleau G, Rung J, Dina C, Shen L, et al. Полногеномное ассоциативное исследование выявляет новые локусы риска диабета 2 типа. Природа. 2007; 445: 881–885. [PubMed] [Google Scholar]
100. Haqq AM, Farooqi IS, O’Rahilly S, Stadler DD, Rosenfeld RG, et al. Уровни грелина в сыворотке обратно пропорциональны индексу массы тела, возрасту и концентрации инсулина у здоровых детей и заметно повышены при синдроме Прадера-Вилли. J Clin Endocrinol Metab. 2003; 88: 174–178. [PubMed] [Академия Google]
101. Lindner TH, Njolstad PR, Horikawa Y, Bostad L, Bell GI, et al. Новый синдром сахарного диабета, почечной дисфункции и порока развития половых органов, связанный с частичной делецией домена псевдо-POU ядерного фактора-1бета гепатоцитов. Хум Мол Жене. 1999; 8:2001–2008. [PubMed] [Google Scholar]
102. Sellick GS, Barker KT, Stolte-Dijkstra I, Fleischmann C, Coleman RJ, et al. Мутации в PTF1A вызывают агенезию поджелудочной железы и мозжечка. Нат Жене. 2004; 36: 1301–1305. [PubMed] [Академия Google]
Нат Жене. 2004; 36: 1301–1305. [PubMed] [Академия Google]
103. Trede NS, Medenbach J, Damianov A, Hung LH, Weber GJ, et al. Сеть корегулируемых компонентов сплайсосомы, обнаруженная у мутантов рыбок данио в факторе рециркуляции p110. Proc Natl Acad Sci U S A. 2007;104:6608–6613. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Chen JN, Haffter P, Odenthal J, Vogelsang E, Brand M, et al. Мутации, поражающие сердечно-сосудистую систему и другие внутренние органы у рыбок данио. Разработка. 1996; 123: 293–302. 293–302. [PubMed] [Академия Google]
105. Popperl H, Rikhof H, Chang H, Haffter P, Kimmel CB, et al. lazarus представляет собой новый ген pbx, который глобально опосредует функцию гена hox у рыбок данио. Мол Ячейка. 2000; 6: 255–267. [PubMed] [Google Scholar]
106. diIorio P, Alexa K, Choe SK, Etheridge L, Sagerstrom CG. Гомеодоменовые белки TALE-семейства регулируют экспрессию sonic hedgehog в энтодерме и формируют паттерн передней энтодермы. Дев биол. 2007; 304: 221–231. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2007; 304: 221–231. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. Hegde A, Qiu NC, Qiu X, Ho SH, Tay KQ, et al. Полногеномный анализ экспрессии аллелей мозговой бомбы рыбок данио с дефектами поджелудочной железы разной степени тяжести идентифицирует предполагаемые гены, чувствительные к Notch. ПЛОС ОДИН. 2008;3:e1479. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Mayer AN, Fishman MC. Nil per os кодирует консервативный белок мотива распознавания РНК, необходимый для морфогенеза и цитодифференцировки органов пищеварения у рыбок данио. Разработка. 2003; 130:3917–3928. [PubMed] [Google Scholar]
109. Pack M, Solnica-Krezel L, Malicki J, Neuhauss SC, Schier AF, et al. Мутации, влияющие на развитие органов пищеварения рыбок данио. Разработка. 1996; 123:321–328. 321–328. [PubMed] [Академия Google]
110. Кинкель МД. Неопубликованное наблюдение 2008 г. [Google Scholar]
111. Huang H, Vogel SS, Liu N, Melton DA, Lin S. Анализ развития поджелудочной железы у живых трансгенных эмбрионов рыбок данио. Мол Селл Эндокринол. 2001; 177: 117–124. [PubMed] [Google Scholar]
Мол Селл Эндокринол. 2001; 177: 117–124. [PubMed] [Google Scholar]
112. Ng AN, de Jong-Curtain TA, Mawdsley DJ, White SJ, Shin J, et al. Формирование пищеварительной системы у рыбок данио: III. Морфогенез кишечного эпителия. Дев биол. 2005; 286:114–135. [PubMed] [Академия Google]
113. Godinho L, Mumm JS, Williams PR, Schroeter EH, Koerber A, et al. Нацеливание нейритов амакриновых клеток на соответствующие синаптические пластинки в развивающейся сетчатке рыбок данио. Разработка. 2005; 132: 5069–5079. [PubMed] [Google Scholar]
114. Сакагути Т., Кикути Ю., Куроива А., Такеда Х., Стайнер Д.Ю. Синцитиальный слой желтка регулирует миграцию миокарда, влияя на сборку внеклеточного матрикса у рыбок данио. Разработка. 2006; 133:4063–4072. [PubMed] [Академия Google]
115. Chocron S, Verhoeven MC, Rentzsch F, Hammerschmidt M, Bakkers J. Bmp4 рыбок данио регулирует лево-правую асимметрию в двух разных временных точках развития. Дев биол. 2007; 305: 577–588. [PubMed] [Google Scholar]
116. Уоллес К.Н., Ахтер С., Смит Э.М., Лорент К., Пак М. Рост и дифференцировка кишечника у рыбок данио. Мех Дев. 2005; 122:157–173. [PubMed] [Google Scholar]
Уоллес К.Н., Ахтер С., Смит Э.М., Лорент К., Пак М. Рост и дифференцировка кишечника у рыбок данио. Мех Дев. 2005; 122:157–173. [PubMed] [Google Scholar]
Панкреатит у собак — липаза, специфичная для поджелудочной железы
Что такое панкреатит?
Панкреатит — заболевание, вызванное воспалением поджелудочной железы. Поджелудочная железа представляет собой небольшой мясистый орган между желудком и тонкой кишкой. Поджелудочная железа выполняет множество функций, связанных с пищеварением и регулированием уровня сахара в крови.
Собаки с тяжелым, внезапным панкреатитом часто очень больны и проявляют признаки рвоты, вялости, потери аппетита, болей в животе и лихорадки. У собак с менее тяжелыми формами панкреатита могут проявляться только легкие признаки болезни, а у некоторых собак могут наблюдаться незначительные постоянные проблемы с повторяющимися эпизодами болезни.
Можно ли использовать обычные тесты для диагностики панкреатита?
Обычные анализы крови, включая общий анализ крови и биохимический профиль (см. раздаточные материалы: «Полный анализ крови» и «Биохимия сыворотки»), как правило, выявляют аномалии, указывающие на панкреатит. Однако изменения не являются уникальными для болезни и не дают окончательного диагноза.
раздаточные материалы: «Полный анализ крови» и «Биохимия сыворотки»), как правило, выявляют аномалии, указывающие на панкреатит. Однако изменения не являются уникальными для болезни и не дают окончательного диагноза.
В прошлом диагноз панкреатита основывался на обнаружении высоких уровней двух ферментов, называемых сывороточной амилазой и сывороточной липазой. Хотя высокие значения этих ферментов могут быть обнаружены у собак с панкреатитом, тесты не оказались надежными и больше не считаются тестами выбора для диагностики панкреатита у собак.
Что такое липаза, специфичная для поджелудочной железы? Чем она отличается от липазы сыворотки?
Специфическая для поджелудочной железы липаза – это форма липазы, продуцируемая только поджелудочной железой. Он очень специфичен для поджелудочной железы, и его показатели в крови увеличиваются только при воспалении поджелудочной железы. Для сравнения, сывороточная липаза может поступать из тканей, отличных от поджелудочной железы, а высокие значения в крови могут возникать при состояниях, отличных от панкреатита.
«…показатели крови увеличиваются только при воспалении поджелудочной железы.»
Как измеряется липаза, специфичная для поджелудочной железы? Какой образец требуется?
Специфическую липазу поджелудочной железы измеряют с помощью теста под названием Иммунореактивность липазы поджелудочной железы собак, известного просто как cPLI. Для теста требуется только небольшой образец крови. Предпочтителен образец натощак, но это не обязательно для точности теста.
Должен ли образец быть отправлен в диагностическую лабораторию?
Вариант теста cPLI можно использовать в клинике (SNAP cPL© от IDEXX). Этот экспресс-тест «на стороне питомца» занимает всего несколько минут и может указать, может ли панкреатит быть причиной болезни питомца. В идеале образец также следует отправить в лабораторию, чтобы получить фактическое значение cPLI. Это поможет подтвердить диагноз панкреатита и обеспечит отправную точку или исходный уровень, который можно использовать для наблюдения за прогрессом питомца после начала лечения.
Насколько надежен cPLI?
Исследования показали, что cPLI имеет высокую степень точности в диагностике панкреатита у собак. Согласно этим исследованиям, примерно у 85% собак с панкреатитом будут высокие значения cPLI. Если cPLI высокий, существует 96% уверенность в том, что у пациента панкреатит, а не другое заболевание, вызывающее аналогичные симптомы. В настоящее время cPLI считается лучшим анализом крови для диагностики панкреатита у собак.
«Если cPLI высокий, с вероятностью 96 % у пациента панкреатит…»
Можно ли использовать cPLI для мониторинга клинического панкреатита?
Да. Липаза, специфичная для поджелудочной железы, очень быстро выводится из крови, что означает, что cPLI можно использовать для мониторинга изменений в поджелудочной железе в ответ на лечение. Быстро снижающееся значение cPLI вместе с улучшением состояния собаки свидетельствует о хорошем ответе на лечение. Клинический тест не так универсален для мониторинга панкреатита, и образцы должны быть отправлены в лабораторию.
