Какие препараты улучшают метаболизм головного мозга. Как действуют ноотропы и нейропротекторы. В каких случаях назначают метаболические средства для мозга. Какие побочные эффекты могут вызывать эти препараты.
Основные группы метаболических препаратов для мозга
Метаболические препараты для мозга представляют собой обширную группу лекарственных средств, которые улучшают обменные процессы в нервной ткани и способствуют нормализации функций головного мозга. К ним относятся:
- Ноотропы (пирацетам, фенотропил, ноопепт и др.)
- Нейропротекторы (цитиколин, церебролизин, кортексин и др.)
- Антиоксиданты (мексидол, эмоксипин и др.)
- Вазоактивные препараты (винпоцетин, нимодипин и др.)
- Аминокислоты и их производные (глицин, ГАМК, фенибут и др.)
Механизм действия метаболических препаратов
Как работают метаболические препараты для мозга? Их основные механизмы действия включают:
- Улучшение энергетического обмена нейронов
- Активизация синтеза нейромедиаторов
- Защита нервных клеток от повреждений
- Стимуляция нейропластичности
За счет этих эффектов метаболические средства способствуют улучшению когнитивных функций, памяти, внимания, повышают устойчивость мозга к неблагоприятным воздействиям.

Наиболее распространенные метаболические препараты
Глицин
Глицин является простейшей аминокислотой, которая выполняет функцию нейромедиатора в центральной нервной системе. Какие эффекты оказывает глицин?
- Улучшает метаболизм в тканях мозга
- Снижает психоэмоциональное напряжение
- Повышает умственную работоспособность
- Нормализует сон
Глицин выпускается в форме подъязычных таблеток по 100 мг. Стандартная дозировка составляет 100-300 мг 2-3 раза в день.
Пирацетам
Пирацетам — эталонный ноотропный препарат, который улучшает когнитивные функции и память. Каковы основные эффекты пирацетама?
- Усиливает синтез АТФ в нейронах
- Улучшает межполушарное взаимодействие
- Стимулирует обмен нейромедиаторов
- Повышает пластичность нервной ткани
Пирацетам назначают в дозе 800-2400 мг в сутки в 2-3 приема. Курс лечения обычно составляет 2-3 месяца.
Цитиколин
Цитиколин (цераксон) — нейропротектор с широким спектром действия. Какие эффекты оказывает цитиколин?
- Восстанавливает целостность мембран нейронов
- Улучшает энергетический обмен в нервных клетках
- Усиливает синтез ацетилхолина
- Активизирует процессы нейропластичности
Цитиколин назначают внутрь по 500-2000 мг в сутки или внутривенно капельно по 500-1000 мг в день. Курс лечения составляет 3-4 недели.

Показания к применению метаболических препаратов
В каких случаях назначают метаболические препараты для мозга? Основные показания включают:
- Острые нарушения мозгового кровообращения
- Хроническая ишемия головного мозга
- Когнитивные нарушения различного генеза
- Астенические состояния
- Депрессивные расстройства
- Возрастные нарушения памяти
Метаболические средства применяются как в острый период заболеваний, так и для длительной поддерживающей терапии при хронических состояниях.
Особенности применения у разных групп пациентов
Применение у пожилых людей
Как назначать метаболические препараты пожилым пациентам? Необходимо учитывать следующие особенности:
- Начинать с минимальных доз
- Учитывать наличие сопутствующих заболеваний
- Контролировать возможные лекарственные взаимодействия
- Проводить более длительные курсы лечения
Пожилым пациентам часто назначают комбинации препаратов с разным механизмом действия для достижения максимального эффекта.
Применение у детей
Какие особенности применения метаболических препаратов у детей? Следует соблюдать следующие правила:
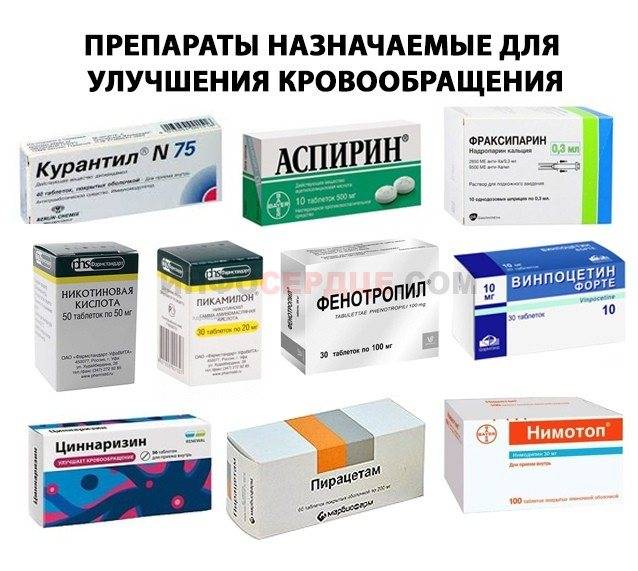
- Назначать только по строгим показаниям
- Использовать возрастные дозировки
- Отдавать предпочтение препаратам с минимумом побочных эффектов
- Контролировать переносимость лечения
Детям чаще назначают препараты на основе аминокислот (глицин, ГАМК) и витаминов группы В.
Сравнение эффективности различных препаратов
Какие метаболические препараты наиболее эффективны? Сравнительные исследования показывают:
- При острых нарушениях мозгового кровообращения — цитиколин, церебролизин
- При хронической ишемии мозга — винпоцетин, пирацетам, мексидол
- При когнитивных нарушениях — пирацетам, ноопепт, цитиколин
- При астенических состояниях — глицин, фенибут, пантогам
Однако эффективность во многом зависит от индивидуальных особенностей пациента и характера патологии. Часто оптимальный результат достигается при комбинировании препаратов.
Побочные эффекты и противопоказания
Какие побочные эффекты могут вызывать метаболические препараты для мозга? Наиболее частыми являются:
- Головная боль
- Головокружение
- Тошнота
- Нарушения сна
- Аллергические реакции
Большинство метаболических средств противопоказаны при индивидуальной непереносимости, тяжелых нарушениях функции печени и почек, беременности и лактации.

Перспективные направления в разработке метаболических препаратов
Какие новые подходы разрабатываются в создании метаболических средств для мозга? Основные направления включают:
- Синтез новых молекул с мультимодальным действием
- Разработка препаратов на основе эндогенных нейропептидов
- Создание нанопрепаратов для адресной доставки в мозг
- Использование методов генной и клеточной терапии
Эти подходы позволят повысить эффективность и безопасность метаболической терапии заболеваний нервной системы.
| Болюсы Хуато | Пилюли: банки 80 г в компл. с мерн. ложкой рег. №: П N011562/01 от 29.04.11 | QIXING Pharmaceutical (Китай) | ||
| Гитагамп® | Капс. | НПК ЭХО (Россия) контакты: | ||
| Глицин | Таб. защечные и подъязычные 100 мг: 25, 50, 100 или 150 шт. рег. №: ЛП-005369
от 26.02.19 №: ЛП-005369
от 26.02.19 | |||
| Глицин | Таб. подъязычные 100 мг: 10, 20 или 50 шт. | ВЕРТЕКС (Россия) | ||
| Глицин | Таб. | БИОТИКИ МНПК (Россия) | ||
| Глицин | Таб. подъязычные 100 мг: 50 шт. рег. №: ЛС-001851 от 27.12.11 Дата перерегистрации: 20.10.20 | ОЗОН (Россия) | ||
| Глицин Реневал | Таб. | ОБНОВЛЕНИЕ ПФК (Россия) | ||
| Глицин Форте | Таб. защечные 250 мг: 10, 20, 30, 50, 60, 90 или 100 шт. рег. №: ЛСР-002849/09 от 09.04.09 | КАНОНФАРМА ПРОДАКШН (Россия) | ||
| Глицин форте | Таб. | АТОЛЛ (Россия) Произведено: ОЗОН (Россия) | ||
| Глицин Форте | Таб. Таб. подъязычные 250 мг: 10, 20, 30, 50, 90 или 100 шт. рег. №: ЛП-002286 от 28.10.13 Дата перерегистрации: 17.11.20 | FARMAPLANT FABRIKATION CHEMISHER PRODUCTE (Германия) Произведено: ОЗОН (Россия) или БИОХИМИК (Россия) | ||
| Глицин-Канон | Таб. | КАНОНФАРМА ПРОДАКШН (Россия) | ||
| Глицин-МХФП | Таб. подъязычные 100 мг: 50 шт. рег. №: Р N003742/01 от 02.10.09 Дата перерегистрации: 11.10.11 | МОСХИМФАРМПРЕПАРАТЫ им. | ||
| Глицин+Мелатонин Эвалар | Таб. подъязычные 100 мг+3 мг: 20, 25, 40, 50, 60, 75, 80 или 100 шт. рег. №: ЛП-007897 от 18.02.22 | ЭВАЛАР (Россия) | ||
| Глутаминовая кислота | Таб. | МАРБИОФАРМ (Россия) | ||
| Глютаминовая кислота | Таб., кишечнорастворимые, покр. пленочной оболочкой, 250 мг: 10, 20, 30, 40, 50 или 60 шт. рег. №: Р N003127/01 от 24.11.08 Дата перерегистрации: 09. 06.20 06.20 | ТАТХИМФАРМПРЕПАРАТЫ (Россия) | ||
| Натрия оксибат | Р-р д/в/в и в/м введения 200 мг/1 мл: амп. 5 мл 5 или 10 шт. рег. №: ЛСР-003201/07 от 15.10.07 Дата перерегистрации: 02.02.18 | МОСКОВСКИЙ ЭНДОКРИННЫЙ ЗАВОД (Россия) | ||
| Тиоцетам | Таб. | АРТ-ФАРМ (Россия) Произведено: ОЗОН (Россия) | ||
| Тиоцетам® | Р-р д/в/в и в/м введения 25 мг+100 мг/мл: амп. | АРТ-ФАРМ (Россия) Произведено: ОЗОН (Россия) | ||
| Флатоцин солофарм | Р-р д/в/в введения: амп. | ГРОТЕКС (Россия) контакты: | ||
| Цитофлавин® | Р-р д/в/в введения: амп. | ПОЛИСАН НТФФ (Россия) контакты: | ||
| Цитофлавин® | Таб. | ПОЛИСАН НТФФ (Россия) контакты: | ||
| Глицин Озон | Таб. | ОЗОН (Россия) | ||
| Глицин-Био | Таб. подъязычные 100 мг: 50 шт. рег. №: ЛС-001851 от 27.12.11 Дата перерегистрации: 14.01.13 | ОЗОН (Россия) | ||
| Глицин-Био Фармаплант® | Таб. | ОЗОН (Россия) | ||
| Тиоцетам | Р-р д/в/в и в/м введения 25 мг+100 мг/мл: амп. 5 мл или 10 мл 10 шт. рег. №: ЛП-001618 от 02.04.12 Дата перерегистрации: 23.09.20 | АРТ-ФАРМ (Россия) Произведено: ГАЛИЧФАРМ (Украина) | ||
| Церебронорм | Таб. | ТОМСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА (Россия) | ||
Метаболическая терапия в неврологии: новые подходы | Танашян М.М., Бархатов Д.Ю.
Неуклонный рост числа больных с сосудистыми заболеваниями головного мозга ставит как одну из важнейших задач ангионеврологии предотвращение прогрессирования этих заболеваний и улучшение качества жизни пациентов. Наряду с высокой смертностью социально значимыми являются и последствия сосудистых заболеваний головного мозга – развитие повторных нарушений мозгового кровообращения (НМК), сосудистой деменции, а также нередко состояние стойкой инвалидности с потерей трудоспособности.
В патогенезе как острых, так и хронических форм цереброваскулярной патологии важную роль играет дефицит кислорода, который приводит к ограничению аэробного образования энергии вследствие нарушения энергосинтезирующей функции дыхательной цепи митохондрий. В результате происходят накопление активных форм кислорода, истощение запасов эндогенных антиоксидантов и активация перекисного окисления липидов клеточных мембран (ПОЛ), что может приводить к гибели клеток мозга [6,20]. Ранее было показано, что активация ПОЛ наблюдается не только при острых НМК, но и при хронических цереброваскулярных заболеваниях (ХЦВЗ): дисциркуляторной энцефалопатии (ДЭ) и последствиях НМК, так как мозг больных при этих состояниях находится в условиях хронической гипоксии вследствие развития гипертонической или атеросклеротической ангиопатии. В связи с этим становится очевидной целесообразность использования в комплексной терапии хронических сосудистых заболеваний мозга препаратов, способных защищать мозг от гипоксии и тем самым тормозить ПОЛ [1,5].
Оптимальная тактика лечения ишемического инсульта заключается в проведении тромболитический терапии в первые 3–4,5 ч после возникновения первых признаков инсульта. Однако в связи со сложностями доставки больного в указанное время, наличием множества противопоказаний к такому виду лечения, не всегда адекватным оснащением неврологических учреждений она проводится не более чем у 1–3% от общего числа больных с ишемическим инсультом [7]. Из других методов, применяемых в остром периоде ишемического инсульта, следует отметить: гиперволемическую гемодилюцию с целью увеличения церебральной перфузии, антикоагулянтную и антиагрегантную терапию, поддержание АД на оптимальных цифрах, борьбу с осложнениями острого периода инсульта. Последнее время с целью нейропротекции стала широко применяться антиоксидантная терапия [4,12,15]. Терапия больных с ХЦВЗ включает неспецифическое профилактическое лечение с учетом факторов риска, имеющее целью предотвратить или значительно замедлить прогрессирование заболевания и включающее:
• нормализацию АД, углеводного и липидного обмена при их нарушении;
• борьбу с курением, ожирением и гиподинамией;
• ограничение употребления алкоголя, соли, животных жиров;
• при стенозирующем атеросклерозе магистральных артерий головы – оперативную коррекцию.
В связи с той большой ролью, которую играет оксидантный стресс в гибели мозгового вещества, больным с цереброваскулярными заболеваниями показаны курсы антиоксидантной терапии [17,19]. Эффективность антиоксидантной терапии при острых и хронических цереброваскулярных заболеваниях подчеркивается большим количеством исследователей [18,23].
Ведущими российскими научными учреждениями (ИБХФ им. Н.М. Эмануэля РАН, НИИ фармакологии РАМН и ВНЦ БАВ) был разработан 3–окси–6–метил–2– этилпиридина сукцинат. Являясь многофункциональным препаратом, он действует, как антиоксидант, а с другой стороны, благодаря наличию в его формуле янтарной кислоты проявляет антигипоксические свойства, улучшая энергетический обмен в клетке. Являясь структурным аналогом витамина В6, имеет в своей фармакологической формуле метаболит цикла трикарбоновых кислот – сукцинат, обеспечивающий гораздо более мощные антиоксидантные и антигипоксические свойства, нежели другие антиоксидантные препараты, оказывающие позитивное влияние на основные звенья патогенеза заболеваний, связанных с процессами свободно–радикального окисления и кислородозависимыми патологическими состояниями. Кроме того, его химическая формула и механизм действия объясняют его чрезвычайно малые побочные эффекты, хорошую переносимость и минимум противопоказаний [4,8]. На фармацевтическом рынке препарат представлен российской компанией «Сотекс» под названием «Нейрокс». Также он обладает антиатерогенным, ноотропным, ГАМК–протективным действиями. Доказана целесообразность использования препарата в комплексной терапии инсульта и других заболеваний нервной системы, при которых имеют место повышение скорости перекисного окисления липидов, гипоксия, нарушения мозгового метаболизма. Благодаря многофакторному механизму действия фармакологические эффекты препарата реализуются на трех уровнях – нейрональном, сосудистом и метаболическом. При этом он:
Кроме того, его химическая формула и механизм действия объясняют его чрезвычайно малые побочные эффекты, хорошую переносимость и минимум противопоказаний [4,8]. На фармацевтическом рынке препарат представлен российской компанией «Сотекс» под названием «Нейрокс». Также он обладает антиатерогенным, ноотропным, ГАМК–протективным действиями. Доказана целесообразность использования препарата в комплексной терапии инсульта и других заболеваний нервной системы, при которых имеют место повышение скорости перекисного окисления липидов, гипоксия, нарушения мозгового метаболизма. Благодаря многофакторному механизму действия фармакологические эффекты препарата реализуются на трех уровнях – нейрональном, сосудистом и метаболическом. При этом он:
• активно реагирует с перекисными радикалами белков и липидов;
• оказывает модулирующее действие на некоторые мембрансвязанные ферменты (фосфодиэстеразу, аденилатциклазу), ионные каналы;
• обладает гиполипидемическим действием, снижает уровень перекисной модификации липопротеидов, уменьшает вязкость липидного слоя клеточных мембран;
• блокирует синтез некоторых простагландинов, тромбоксана и лейкотриенов;
• оптимизирует энергосинтезирующие функции митохондрий в условиях гипоксии, улучшает синаптическую передачу;
• оптимизирует реологические свойства крови, подавляет агрегацию тромбоцитов.
Таким образом, Нейрокс улучшает энергетический обмен клетки, активирует энергосинтезирующие функции митохондрий, влияет на содержание биогенных аминов и улучшает синаптическую передачу. За счет наличия в его составе молекулы сукцината препарат оказывает влияние на работу дыхательной цепи, повышая ее эффективность; ингибирует свободнорадикальное окисление липидов мембран, связывая их перекисные радикалы; повышает активность антиоксидантных ферментов, ответственных за образование и расходование активных форм кислорода (в частности, супероксиддисмутазы).
Антистрессорное действие препарата выражается в нормализации постстрессового поведения, соматовегетативных показателей, восстановлении циклов сон–бодрствование, а также нарушенных процессов обучения и памяти, в снижении дистрофических, морфологических изменений, возникающих после стресса в различных структурах мозга. Нейрокс обладает геропротекторным действием; оказывает отчетливое корригирующее влияние на нарушенные при старении процессы обучения и памяти, улучшая процесс фиксации, сохранения и воспроизведения информации; способствует восстановлению эмоционального и вегетативного статуса; уменьшает проявления неврологического дефицита; снижает в мозге и крови уровни маркеров старения – липофусцина, малонового альдегида, холестерина. Механизм геропротективного действия препарата связан с его антиоксидантными свойствами, способностью ингибировать процессы перекисного окисления липидов, с прямым мембранотропным эффектом, способностью восстанавливать ультраструктурные изменения гранулярной эндоплазматической сети и митохондрий, модулировать работу рецепторов. Ноотропные его свойства выражаются в способности улучшать процессы обучения и памяти, противодействовать угасанию привитых навыков и рефлексов. Препарат модулирует рецепторные комплексы мембран мозга, в частности, бензодиазепиновые, ГАМКергические, ацетилхолиновые рецепторы. Он обладает антиатерогенным действием: снижает гиперлипидемию, препятствует активации перекисного окисления липидов, повышает активность антиоксидантной системы, тормозит локальные сосудистые механизмы атерогенеза, уменьшает риск развития патологических изменений в сосудистой стенке. Нейрокс снижает содержание атерогенных липопротеидов и триглицеридов, повышает уровень липопротеидов высокой плотности в сыворотке крови.
Механизм геропротективного действия препарата связан с его антиоксидантными свойствами, способностью ингибировать процессы перекисного окисления липидов, с прямым мембранотропным эффектом, способностью восстанавливать ультраструктурные изменения гранулярной эндоплазматической сети и митохондрий, модулировать работу рецепторов. Ноотропные его свойства выражаются в способности улучшать процессы обучения и памяти, противодействовать угасанию привитых навыков и рефлексов. Препарат модулирует рецепторные комплексы мембран мозга, в частности, бензодиазепиновые, ГАМКергические, ацетилхолиновые рецепторы. Он обладает антиатерогенным действием: снижает гиперлипидемию, препятствует активации перекисного окисления липидов, повышает активность антиоксидантной системы, тормозит локальные сосудистые механизмы атерогенеза, уменьшает риск развития патологических изменений в сосудистой стенке. Нейрокс снижает содержание атерогенных липопротеидов и триглицеридов, повышает уровень липопротеидов высокой плотности в сыворотке крови. Кроме того, он подавляет агрегацию тромбоцитов и стабилизирует биологические мембраны (в частности, мембраны эритроцитов и тромбоцитов), ингибирует синтез тромбоксана А, лейкотриенов и усиливает синтез простациклина. Нейрокс способен оказывать выраженное потенцирующее действие на эффекты нейропсихотропных препаратов. Под его влиянием усиливается действие транквилизирующих, нейролептических, снотворных, противосудорожных и аналгезирующих средств, что позволяет снизить их дозы и таким образом уменьшить побочные эффекты.
Кроме того, он подавляет агрегацию тромбоцитов и стабилизирует биологические мембраны (в частности, мембраны эритроцитов и тромбоцитов), ингибирует синтез тромбоксана А, лейкотриенов и усиливает синтез простациклина. Нейрокс способен оказывать выраженное потенцирующее действие на эффекты нейропсихотропных препаратов. Под его влиянием усиливается действие транквилизирующих, нейролептических, снотворных, противосудорожных и аналгезирующих средств, что позволяет снизить их дозы и таким образом уменьшить побочные эффекты.
Нейрокс оказался высокоэффективным при острых нарушениях мозгового кровообращения, дисциркуляторной энцефалопатии, вегетососудистой дистонии, атеросклеротических нарушениях функций мозга и при других состояниях, сопровождающихся гипоксией тканей. Показано как профилактическое, так и лечебное действие препарата при данных заболеваниях [13]. Так, его курсовое применение в дозе 300–400 мг/сут. парентерально у больных ХЦВЗ на фоне артериальной гипертензии и атеросклероза оказывало выраженное положительное влияние. При ХЦВЗ в фазе декомпенсации Нейрокс следует назначать внутривенно струйно или капельно в дозе 100 мг 2–3 раза в сут. на протяжении 14 дней. Затем – внутримышечно по 100 мг/сут. в последующие 2 нед. Для проведения профилактических курсов лечения при ХЦВЗ препарат вводят внутримышечно в дозе 100 мг 2 раза в сут. на протяжении 10–14 дней. Переносимость препарата хорошая, что позволяет рекомендовать Нейрокс в базовую терапию больных ХЦВЗ.
При ХЦВЗ в фазе декомпенсации Нейрокс следует назначать внутривенно струйно или капельно в дозе 100 мг 2–3 раза в сут. на протяжении 14 дней. Затем – внутримышечно по 100 мг/сут. в последующие 2 нед. Для проведения профилактических курсов лечения при ХЦВЗ препарат вводят внутримышечно в дозе 100 мг 2 раза в сут. на протяжении 10–14 дней. Переносимость препарата хорошая, что позволяет рекомендовать Нейрокс в базовую терапию больных ХЦВЗ.
Эффективность препарата Нейрокс была неоднократно доказана в различных клинических исследованиях. Так, в 2010 г. на базе ЦКБ Управления делами президента РФ было проведено исследование действия препарата Нейрокс у 44 пациентов с острыми нарушениями мозгового кровообращения [3]. На фоне терапии отмечалась положительная динамика в восстановлении сознания, регресса очаговых неврологических симптомов. В наблюдении не было зарегистрировано нежелательных явлений и аллергических реакций, напрямую связанных с используемым препаратом или режимом дозирования.
Полученные результаты исследования свидетельствуют о клинической эффективности, хорошей переносимости терапии Нейроксом у больных с легким и среднетяжелым ишемическим инсультом.
В открытое сравнительное контролируемое исследование на базе НИИ терапии СО РАМН [15] были включены 60 пациентов обоего пола с подтвержденным диагнозом «дисциркуляторная энцефалопатия 1–2 ст.». Терапия препаратом Нейрокс проводилась в течение 15 дней. Выявлено положительное влияние Нейрокса на окислительный потенциал липопротеинов низкой плотности (ЛПНП), а именно – уменьшение предрасположенности к окислительным процессам ЛПНП in vivo под влиянием препарата. Выявлен дополнительный эффект препарата основной группы (Нейрокс) на антиоксидантный потенциал ЛПНП, а именно – повышение содержания в ЛПНП липофильных антиоксидантов a–токоферола и b–каротина, что более положительно характеризует Нейрокс в отношении антиоксидантных свойств. Отмечен более выраженный противоастенический эффект по 4 субшкалам: общей астении, сниженной активности, сниженной мотивации и психической астении. Выявлено положительное влияние препарата на уровень тревожности. Детальный анализ по субшкалам тревоги выявил положительную динамику в подгруппе «выраженная тревога» (p<0,05) на фоне лечения препаратом Нейрокс, а также на вегетативную симптоматику. Выявлено положительное влияние препарата на когнитивную симптоматику нейродинамического типа. Следует особо подчеркнуть, что по ряду исследовавшихся параметров Нейрокс превосходит препараты сходной химической структуры.
Выявлено положительное влияние препарата на уровень тревожности. Детальный анализ по субшкалам тревоги выявил положительную динамику в подгруппе «выраженная тревога» (p<0,05) на фоне лечения препаратом Нейрокс, а также на вегетативную симптоматику. Выявлено положительное влияние препарата на когнитивную симптоматику нейродинамического типа. Следует особо подчеркнуть, что по ряду исследовавшихся параметров Нейрокс превосходит препараты сходной химической структуры.
Авторы другого исследования отметили хорошую переносимость этилметилгидроксипиридина сукцината, его полную совместимость с другими назначавшимися лекарственными средствами в лечении цереброваскулярных заболеваний [13]. Оказалось, что максимальный эффект наблюдался при одновременном проведении немедикаментозного лечения и нейрореабилитационных мероприятий. Полученные результаты позволили авторам констатировать, что максимально раннее начало лечения (желательно – в первые часы от момента развития инсульта) обеспечивает его достоверно более высокую эффективность. Полученные результаты подтверждают целесообразность применения этилметилгидроксипиридина сукцината (Нейрокс) у больных с различными клиническими проявлениями сосудистого поражения головного мозга. Необходимо максимально раннее начало введения препарата, назначение повторных курсов его введения одновременно с назначением антиагрегантов, при строгом контроле артериального давления и устранении других имеющихся факторов сердечно–сосудистого риска.
Полученные результаты подтверждают целесообразность применения этилметилгидроксипиридина сукцината (Нейрокс) у больных с различными клиническими проявлениями сосудистого поражения головного мозга. Необходимо максимально раннее начало введения препарата, назначение повторных курсов его введения одновременно с назначением антиагрегантов, при строгом контроле артериального давления и устранении других имеющихся факторов сердечно–сосудистого риска.
В Научном центре неврологии РАМН также было проведено изучение влияния этилметилгидроксипиридина сукцината на основные субъективные и объективные проявления ХЦВЗ, а также влияние препарата на психоэмоциональное состояние пациентов по шкалам депрессии и астенизации у больных с ХЦВЗ. Под воздействием препарата отмечено улучшение состояния пациентов и уменьшение выраженности наиболее часто встречающихся клинических проявлений данной патологии – астенического синдрома, вегетативных и вестибулярно–мозжечковых нарушений. Показано достоверное улучшение когнитивных функций по результатам когнитивных вызванных потенциалов Р300. Препарат не влияет на основные параметры сердечной деятельности (артериальное давление и частота пульса) и не мешает достижению оптимального гипотензивного эффекта на фоне адекватно подобранной гипотензивной терапии.
Препарат не влияет на основные параметры сердечной деятельности (артериальное давление и частота пульса) и не мешает достижению оптимального гипотензивного эффекта на фоне адекватно подобранной гипотензивной терапии.
Ряд работ посвящен применению препарата Нейрокс и при других формах церебральной дисфункции: хронических эпилептогеннных очагах, синдроме хронической усталости и т.д. [2,4,7,9,11]. Подчеркивается достоверное многофакторное положительное действие препарата (при отсутствии противопоказаний).
Таким образом, на основании многочисленных исследовательских работ показано, что препарат Нейрокс обладает широким спектром фармакологического действия, позволяющим с успехом применять его при всех формах ишемических цереброваскулярных заболеваний.
Литература
1. Антипенко Е.А.,Густов А.В. Антиоксидантная терапия при дисциркуляторной энцефалопатии. Журн неврол и психиат. 2010; 110: 7 :53–55.
2. Арцимович Н.Г., Галушина Т.С. Синдром хронической усталости. М.: Научный мир, 2001.
М.: Научный мир, 2001.
3. Бадалян О.Л., Савенков А.А., Таишева К.Х., Тертышник О.Ю. Возможности применения Нейрокса в комплексном лечении хронической ишемии мозга. РМЖ, 2010, № 8.
4. Батышева Т.Т., Артемова И.Ю., и др. Хроническая ишемия мозга: механизмы развития и современное комплексное лечение // Справочник практического врача. Т. 3. М., 2004 С. 18–23
5. Биленко М.В. Теоретические и экспериментальные обоснования применения антиоксидантной терапии для профилактики острых ишемических повреждений в органах. В кн: Биоантиокислители в регуляции метаболизма в норме и патологии. М.– 1982.– С. 195–213.
6. Болдырев А.А. Окислительный стресс и мозг. Соросовский образовательный журнал, 2001, № 7, С. 21–27.
7. Гусев Е.И., Скворцова В.И., Ишемия головного мозга. М.: Медицина, 2001
8. Гусев Е.И., Скворцова В.И., Платонова И.А. Терапия ишемического инсульта. Consilium medicum (спецвыпуск «Неврология») 2003; 18–25
9. Дамулин И. В., Захаров В.В. Диагностика и лечение нарушений памяти и других высших мозговых функций у пожилых/ Под ред. Н.Н.Яхно. – М.: Универсум Паблишинг, 1997.
В., Захаров В.В. Диагностика и лечение нарушений памяти и других высших мозговых функций у пожилых/ Под ред. Н.Н.Яхно. – М.: Универсум Паблишинг, 1997.
10. С.Н.Дума, Ю.И.Рагино Роль антиоксидантов в коррекции психовегетативных, астенических и когнитивных нарушений. Журнал «Трудный пациент» / Архив / № 4–2011 /
11. Дюмаев К.М., Воронина Т.А., Смирнов Л.Д. Антиоксиданты в профилактике и терапии патологий ЦНС. М., 1995.
12. Камчатнов П.Р., Михайлова Н.А., Жданова С.В. Коррекция свободнорадикального окисления у больных с расстройствами мозгового кровообращения. Трудный пациент. 2010; 8: 6–7: 26–30.
13. Камчатнов П.Р. Применение препарата Нейрокс™ у больных с расстройствами мозгового кровообращения. Справочник поликлинического врача, 2010, N 9.–С.54–57.
14. Никифоров А.С., Коновалов А.Н., Гусев Е.И. // Клиническая неврология. Медицина, 2002.
15. М.В.ПУТИЛИНА Комплексная терапия последствий ишемии мозга. Журнал «Медицинский совет» №9–10 (2010)
16. Смирнова И.Н., Суслина З.А., Танашян М.М. и др. Антиоксидантное и нейротрофическое действие цитофлавина при хронических цереброваскулярных заболеваниях // Вестник Санкт–Петербургской Гос. мед. академии им. И.И. Мечникова. – 2002. – № 3, С. 110– 114.
Смирнова И.Н., Суслина З.А., Танашян М.М. и др. Антиоксидантное и нейротрофическое действие цитофлавина при хронических цереброваскулярных заболеваниях // Вестник Санкт–Петербургской Гос. мед. академии им. И.И. Мечникова. – 2002. – № 3, С. 110– 114.
17. Смирнова И.Н., Федорова Т.Н., Танашян М.М. соавт. Клиническая эффективность и антиоксидантная активность Мексидола при хронических цереброваскулярных заболеваниях //
18. Суслина З.А., Федорова Т.Н., Максимова М.Ю. и др. Антиоксидантная терапия при ишемическом инсульте // Журн. неврол. и психиатрии им. С.С.Корсакова. – 2000. – № 10. – С. 34–38.
19. Суслина З.А., Федорова Т.Н., Максимова М.Ю., Ким Е.К. Антиоксидантное действие милдроната и L–карнитина при лечении больных с сосудистыми заболеваниями головного мозга // Экспер. и клин. фармакол. – 2003.– № 3. – С. 32 – 35.
20. Фёдорова Т.Н. Окислительный стресс и защита головного мозга от ишемических повреждений). Дис. … докт. биол. наук. М., 2004.
21. Шмырев В. И., Крыжановский С. М. Опыт применения отечественного препарата церетон у больных в остром периоде ишемического инсульта // Журн. Неврол и психиатр. 2008; 12: 46–49.
Шмырев В. И., Крыжановский С. М. Опыт применения отечественного препарата церетон у больных в остром периоде ишемического инсульта // Журн. Неврол и психиатр. 2008; 12: 46–49.
22. Clemens J.A. Cerebral ischemia gene activation,neuronal injury, and the protective role of antioxidants. Free Radic Biol Med. 2000; 28: 10: 1526–1531.
23. Kontos H.Oxygen Radical in Cerebral ischemia: The2001Willis ture. Stroke. 2001; 32: 2712–2716.
Препарат, воздействующий на метаболизм мозга, улучшает когнитивные функции
ТОРОНТО — Новое средство, предназначенное для регуляции метаболизма глюкозы в головном мозге, значительно влияет на когнитивные функции у пациентов с болезнью Альцгеймера (БА) легкой и средней степени тяжести, свидетельствуют результаты небольшого исследования второй фазы.
Исследование показало, что более чем у половины пациентов, принимавших препарат (называемый T3D-959), наблюдалось улучшение по крайней мере на 1 балл по когнитивной субшкале шкалы оценки болезни Альцгеймера (ADAS-cog).
«Это меняет правила игры», — сказал Джон Дидсбери, доктор философии, основатель и генеральный директор T3D Therapeutics, компании, разрабатывающей лекарство. «Это совершенно новый метаболический подход к лечению болезни Альцгеймера».
Изменения ADS-cog, наблюдаемые с новым агентом, «значительнее, чем у всего, что вы увидите здесь, на всей этой научной конференции», — сказал доктор Дидсбери. Он обсудил свое исследование с Medscape Medical News во время Международной конференции Ассоциации Альцгеймера (AAIC).
Однако другие эксперты более осторожны, говоря, что еще слишком рано радоваться небольшому открытому исследованию.
Голодный мозг
AD вызывается «голоданием» мозга, которое приводит к воспалению и отложению бляшек и клубков, говорит доктор Дидсбери, чей опыт включает исследования диабета. По его словам, новое пероральное средство является сенсибилизатором инсулина, поэтому оно «резко улучшает метаболизм глюкозы в головном мозге».
Препарат помогает включить основные сигнальные пути, жизненно важные для памяти, включая канонический сигнальный путь wnt, сигнальный путь инсулина и сигнальный путь инсулиноподобного фактора роста-1, объяснил он.
Джеймс Хендрикс, доктор философии, директор по глобальным научным инициативам, медицинским и научным связям, Ассоциация Альцгеймера, говорит, что эта цель немного отличается от цели пиоглитазона, лекарства от диабета, испытываемого в 3-й фазе исследования, получившего название ЗАВТРА.
Текущее многоцентровое, двойное слепое, рандомизированное, плацебо-контролируемое исследование TOMORROW частично разработано для оценки эффективности низких доз пиоглитазона в качестве средства для отсрочки появления легких когнитивных нарушений у когнитивно нормальных людей с высоким генетическим риском развития болезни Альцгеймера. .
T3D-959 и пиоглитазон нацелены на сходные пути, но «немного различаются с точки зрения селективности и, возможно, отличаются фармакологическими свойствами, поэтому это похожий подход» к попыткам повлиять на метаболизм мозга, но не совсем то же самое, сказал доктор. Хендрикс.
Хендрикс.
Текущее исследовательское исследование T3D-959 включало 36 пациентов, средний возраст 73 года, с легкой или умеренной формой болезни Альцгеймера (оценка Mini-Mental State Examination от 14 до 36) в трех центрах в США.
Пациенты принимали препарат в форме капсул по 3 мг, 10 мг, 30 мг или 9 мг.0 мг 1 раз в сутки в течение 14 дней.
В соответствии с «расплывчатым» определением респондента (улучшение по крайней мере на 1 балл по шкале ADAS-cog) у 17 из 32 пациентов наступило улучшение в среднем на 4,4 балла за 2 недели.
При более строгом определении ответчика (улучшение на 2 балла или больше) у 14 пациентов улучшилось примерно на 4,78 балла.
А при еще более строгом определении ответчика (улучшение на 3 балла и более) ответила почти треть пациентов (10 из 32 пациентов, или 31%) с улучшением почти на 6 баллов (5,74).
«Это огромное улучшение», — прокомментировал доктор Дидсбери.
Не было никакой разницы в реакции между пациентами с легким или умеренным заболеванием.
Эффекты также кажутся долговечными; По словам доктора Дидсбери, у всех пациентов при всех дозах средний показатель ADAS-cog улучшился еще на 0,22 балла после того, как пациенты не принимали препарат в течение 1 недели.
У 10 пациентов, у которых к концу лечения препарат улучшился на 3 балла и более, было дополнительное улучшение на 0,29пунктов после того как снадобье на 1 неделю, он сказал.
Анализ нейровизуализации с помощью фтордезоксиглюкозо-позитронно-эмиссионной томографии также показал, что препарат улучшает метаболизм глюкозы в областях мозга, вовлеченных в БА, включая островок, поясную извилину, скорлупу и нижнюю кору головного мозга.
«Низкий метаболизм сахара является отличительной чертой этого заболевания и является лучшим предиктором будущего снижения когнитивных функций, чем скопление бляшек или тау-насыщение», — говорит доктор Дидсбери.
По его словам, ни у одного из участников исследования не было побочных эффектов.
Препарат также может влиять на метаболизм вне головного мозга. «В частности, он может контролировать липидный гомеостаз и энергетический гомеостаз, регулируя окисление жирных кислот, рассеивание энергии и митохондриальное дыхание», — сказал доктор Дидсбери.
«В частности, он может контролировать липидный гомеостаз и энергетический гомеостаз, регулируя окисление жирных кислот, рассеивание энергии и митохондриальное дыхание», — сказал доктор Дидсбери.
Доктор Дидсбери сказал, что ему неизвестно ни о какой другой компании, разрабатывающей аналогичный агент.
Против Зерна
«Мы маленькие мышки, которые рычали,» сказал он. «Мы идем против течения, бросая вызов общепринятой научной идее о том, что БА вызывают бляшки или клубки. Для нас это проявления болезни, а не ее причина».
Поскольку метаболические аномалии головного мозга являются «восходящей движущей силой» болезни Альцгеймера, это помогает объяснить, почему так много пациентов имеют амилоидные бляшки, но не заболевают этой болезнью, сказал доктор Дидсбери.
По его мнению, эти новые результаты более впечатляющие, чем те, которые были показаны для других препаратов, обсуждавшихся на встрече, включая ингибиторы BACE 1 (фермент, расщепляющий белок-предшественник β-сайта амилоида 1), сказал он. Некоторые плакаты на встрече AAIC в этом году освещали ранние результаты для агентов, которые ингибируют BACE 1, необходимые для производства нейротоксического β-амилоидного пептида, который, как считается, играет решающую роль в AD.
Некоторые плакаты на встрече AAIC в этом году освещали ранние результаты для агентов, которые ингибируют BACE 1, необходимые для производства нейротоксического β-амилоидного пептида, который, как считается, играет решающую роль в AD.
Доктор Дидсбери и его коллеги не изучали влияние своего нового препарата на уровень амилоида или тау. «Лакмусовой бумажкой для нас является то, как это действует на пациента, и это работает».
Четыре из первоначальных пациентов теперь включены в 26-недельное открытое расширенное исследование. После прекращения приема препарата в течение 2–4 месяцев они снова принимали препарат для дополнительного исследования.
После завершения еще одного испытания фазы 2 компания надеется начать испытание фазы 3, сказал доктор Дидсбери.
Необходимы более длительные и масштабные испытания этого препарата, подчеркнул д-р Хендрикс. Хотя первоначальные результаты «выглядят многообещающими» и «потенциально захватывающими», сказал д-р Хендрикс, «мы должны умерить это волнение, зная, что это небольшое и раннее исследование, и что это открытое исследование, поэтому нет группы плацебо для сравнения. .»
.»
Концепция того, что болезнь Альцгеймера является своего рода диабетом мозга, исследуется в другом месте. В дополнение к испытанию TOMORROW исследователи исследуют интраназальный инсулин в надежде, что он попадет в мозг и повлияет на метаболизм и познание; введенный инсулин не пересекает гематоэнцефалический барьер, добавил он.
«Нам придется подождать, чтобы узнать, какой подход лучше всего подходит», — сказал доктор Хендрикс.
Исследование финансировалось T3D Therapeutics. Доктор Дидсбери является основателем и генеральным директором компании. Доктор Хендрикс не раскрыл никаких соответствующих финансовых отношений.
Международная конференция Ассоциации Альцгеймера (AAIC) 2016. Резюме 390. Представлено 27 июля 2016 г.
Несмотря на последние достижения, лечение заболеваний головного мозга и неврологических расстройств, таких как синдромы Паркинсона и Альцгеймера, рассеянный склероз, рак головного мозга, психические расстройства, многие формы эпилепсии, хроническая боль и мигрень, остается серьезной проблемой. Растет потребность в разработке эффективных ЦНС-активных препаратов, способных достигать нужных областей мозга. Это оказалось проблематичным, поскольку мозг очень эффективно защищен от экзогенных веществ, включая многие потенциально полезные препараты, действующие на ЦНС. Этот вопрос подробно обсуждался на исследовательском семинаре EU-COST, на котором был подготовлен программный документ для ЕС (Kapitulnik et al., 2010).
Растет потребность в разработке эффективных ЦНС-активных препаратов, способных достигать нужных областей мозга. Это оказалось проблематичным, поскольку мозг очень эффективно защищен от экзогенных веществ, включая многие потенциально полезные препараты, действующие на ЦНС. Этот вопрос подробно обсуждался на исследовательском семинаре EU-COST, на котором был подготовлен программный документ для ЕС (Kapitulnik et al., 2010).
Доступ к тканям головного мозга и последующее воздействие лекарств или других химических веществ зависят от их способности преодолевать гематоэнцефалический барьер (BBB; Pelkonen et al., 2008; Kapitulnik et al., 2009). ГЭБ представляет собой физический и функциональный барьер, который предотвращает проникновение многих лекарств и химических веществ в клетки головного мозга независимо от их молекулярного размера. ГЭБ контролирует доступ к мозгу основных питательных веществ, витаминов и ионов, а также некоторых белков и пептидов и удаляет продукты метаболизма в мозге, например метаболиты нейромедиаторов. Он также препятствует поступлению в мозг потенциально вредных веществ (например, билирубина, эндогенно образующегося нейротоксического катаболита гема, а также экзогенных токсинов).
Он также препятствует поступлению в мозг потенциально вредных веществ (например, билирубина, эндогенно образующегося нейротоксического катаболита гема, а также экзогенных токсинов).
ГЭБ состоит из эндотелиальных клеток мелких кровеносных сосудов. Тот факт, что эндотелиальные клетки капилляров головного мозга сильно отличаются от таковых на периферии, придает ГЭБ его дискриминационные характеристики. Эндотелиальные клетки головного мозга характеризуются плотными контактами, отсутствием межклеточных щелей и фенестраций, незначительной пиноцитарной активностью и высоким электрическим сопротивлением. Эти клетки имеют непрерывную базальную мембрану и окружены перицитами и концевыми ножками астроцитов, которые являются частью ГЭБ и контролируют его проницаемость (обзор Abbott et al., 2010).
Белки, участвующие в транспорте лекарств (переносчики лекарств, DT) и метаболизме (ферменты метаболизма лекарств, DME), описаны во многих органах (печень, легкие, почки, кишечник, мозг, кожа, кровеносные сосуды и др. ). Эти белки играют важную роль, регулируя как перемещение между органами, так и элиминацию лекарств и чужеродных соединений (ксенобиотиков), а также синтез и деградацию/элиминацию эндогенных соединений (эндобиотиков), таких как гормоны и простаноиды. В некоторых случаях их действие полезно (детоксикация как ксенобиотиков, так и эндобиотиков), но они могут также проявлять вредные эффекты, как в случае некоторых DT, которые не позволяют лекарствам проникать в мозг, или DME, которые активируют ксенобиотики (например, лекарства). и химические канцерогены) с образованием токсичных метаболитов (подробные обзоры см. Dutheil et al., 2010; Miller, 2010). Было показано, что некоторые гены, регулирующие экспрессию DT и DME, являются полиморфными, что приводит к синтезу белков с нарушенной или повышенной активностью (Ieiri et al., 2009).; Cascorbi and Haenisch, 2010 г.; Франке и др., 2010; Йоханссон и Ингельман-Сандберг, 2011). Таким образом, эти полиморфизмы могут сильно влиять на уровни лекарств и химических токсинов в крови.
). Эти белки играют важную роль, регулируя как перемещение между органами, так и элиминацию лекарств и чужеродных соединений (ксенобиотиков), а также синтез и деградацию/элиминацию эндогенных соединений (эндобиотиков), таких как гормоны и простаноиды. В некоторых случаях их действие полезно (детоксикация как ксенобиотиков, так и эндобиотиков), но они могут также проявлять вредные эффекты, как в случае некоторых DT, которые не позволяют лекарствам проникать в мозг, или DME, которые активируют ксенобиотики (например, лекарства). и химические канцерогены) с образованием токсичных метаболитов (подробные обзоры см. Dutheil et al., 2010; Miller, 2010). Было показано, что некоторые гены, регулирующие экспрессию DT и DME, являются полиморфными, что приводит к синтезу белков с нарушенной или повышенной активностью (Ieiri et al., 2009).; Cascorbi and Haenisch, 2010 г.; Франке и др., 2010; Йоханссон и Ингельман-Сандберг, 2011). Таким образом, эти полиморфизмы могут сильно влиять на уровни лекарств и химических токсинов в крови.
Транспортеры наркотиков и DME также присутствуют в BBB. Используя подходы транскриптомики и протеомики, присутствие этих белков было продемонстрировано в изолированных микрососудах головного мозга и биоптатах коры головного мозга (Shawahna et al., 2011). DT и DME контролируют доступ к мозгу и локальную концентрацию как эндобиотиков, так и ксенобиотиков. Транспортные белки обеспечивают прохождение тех веществ, которые необходимы ЦНС, таких как глюкоза, незаменимые аминокислоты и предшественники нейротрансмиттеров. Существуют также транспортеры и метаболические ферменты, которые действуют в противоположном направлении, тем самым предотвращая доступ к мозгу некоторых жирорастворимых лекарств и потенциально токсичных веществ, включая метаболиты, которые в противном случае могли бы диффундировать в мозг и вызывать повреждения. К сожалению, это означает, что ГЭБ также может предотвращать попадание в мозг эффективных лекарств. Это также может препятствовать побочным эффектам этих и других препаратов. Количество этих препаратов больше, чем когда-то предполагалось.
Количество этих препаратов больше, чем когда-то предполагалось.
Более того, функция DT в ГЭБ также нарушается во время заболевания (Zlokovic, 2008; Engelhardt and Sorokin, 2009), что приводит к усиленному воздействию нейротоксичных соединений на ЦНС и уменьшению дренажа белков ЦНС, таких как амилоид белков, тем самым способствуя нейродегенерации. Сегодня мы все еще очень мало знаем о том, как воспалительные компоненты системных заболеваний или заболеваний ЦНС влияют на транспорт лекарств в мозг и как пептиды и белки проходят через ГЭБ.
Значение активных переносчиков и местного метаболизма в ГЭБ в возникновении вредного воздействия лекарств и химических веществ окружающей среды остается в значительной степени неизвестным. Известно, что транспортеры и ферменты работают вместе (например, в кишечнике и печени; Benet, 2009), но неизвестно, как они координируются в ГЭБ или насколько важны ферменты по сравнению с транспортерами в ГЭБ. . Таким образом, крайне важно охарактеризовать экспрессию, активность и физиологическую и патологическую регуляцию этих белков в ГЭБ и прилегающих областях мозга, как в in vivo и в модельных системах.
Методы, используемые в настоящее время для изучения транспорта и метаболизма лекарств и токсинов в ГЭБ и прилегающих областях мозга, включают набор зондов для измерения экспрессии генов транспортеров и ферментов в соответствующих модельных системах in vitro и in vivo , батарея субстратных зондов для различных транспортеров и ферментов, метаболизирующих ксенобиотики, для изучения в модельных системах, иммунохимические методы для изучения локализации и архитектуры транспортеров и ферментов в структурах мозга, а также методы визуализации для исследования процессов, зависящих от времени и места. транспорта и метаболизма. Базовая характеристика всех разрабатываемых модельных систем с помощью указанных выше методов является необходимой предпосылкой для широкого применения моделей для других видов исследований. Кроме того, разработка новых моделей и методов также имеет первостепенное значение.
Будущие задачи
1. Несмотря на то, что за последнее десятилетие были накоплены важные знания о DT в интерфейсах кровь-мозг и кровь-ЦСЖ, они все еще очень ограничены. Однако становится ясно, что набор DT, выраженных в этих интерфейсах, несколько отличается от такового в периферических органах, что делает необходимым тщательную идентификацию DT в вышеупомянутых интерфейсах, а также понимание их регуляции и функции.
Однако становится ясно, что набор DT, выраженных в этих интерфейсах, несколько отличается от такового в периферических органах, что делает необходимым тщательную идентификацию DT в вышеупомянутых интерфейсах, а также понимание их регуляции и функции.
2. Имеющиеся знания о DME в этих интерфейсах довольно ограничены, и поэтому необходимо дальнейшее изучение ферментов, экспрессируемых в этих тканях.
3. Учитывая известное взаимодействие между DT и DME в печени и кишечнике, важно определить, работают ли эти белки в тандеме в ЦНС или конкурируют за свои субстраты.
Результаты исследований взаимодействий между ферментами и транспортерами, лекарствами и эндогенными соединениями, а также роли полиморфизмов ферментов и транспортеров в определении доступа к мозгу и концентрации активных центров лекарств будут способствовать терапевтическому воздействию существующих и вновь разрабатываемых препаратов ЦНС, а также для профилактики токсического действия ксенобиотиков.
Ссылки
Abbott, N.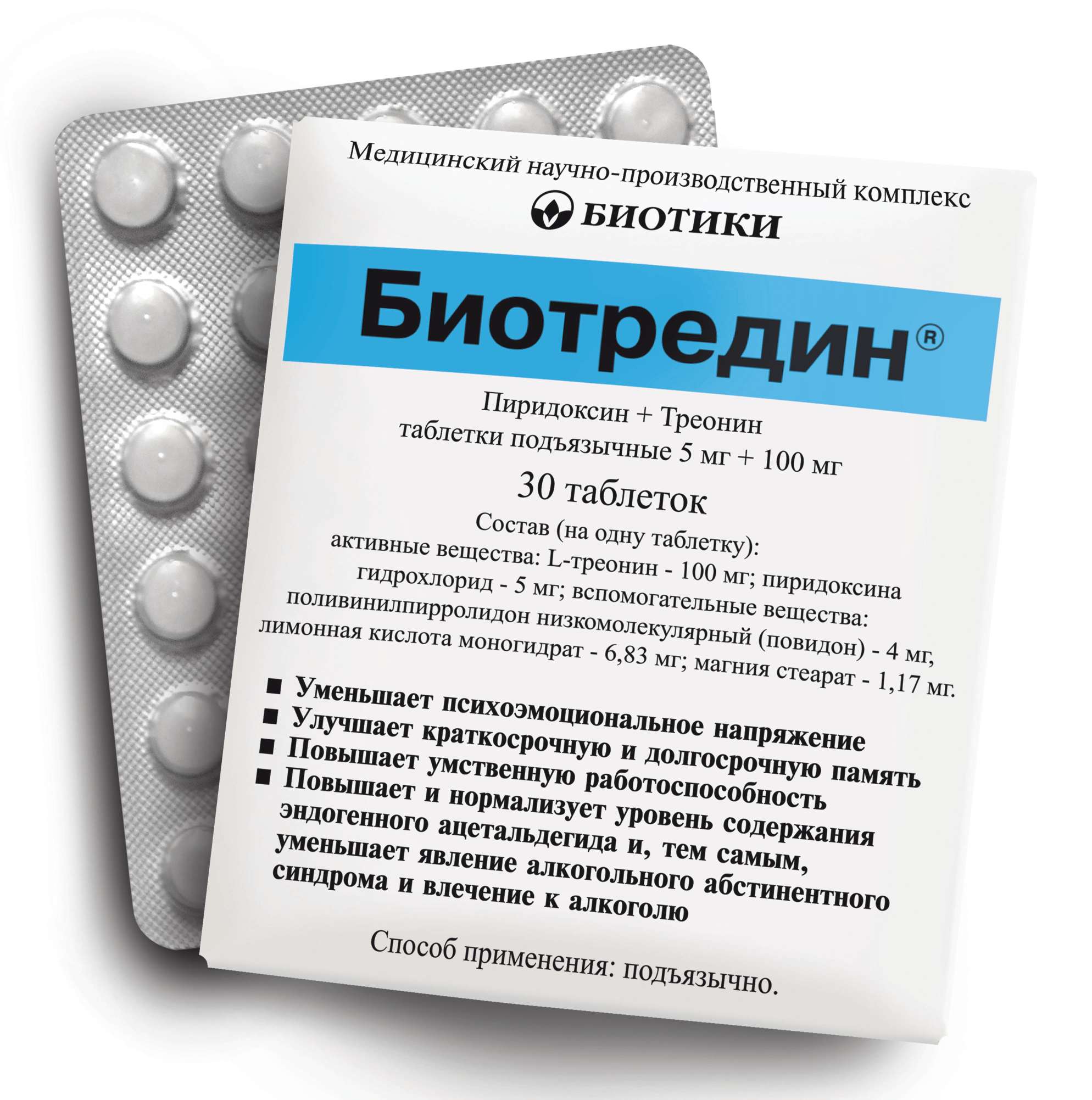 J., Patabendige, A.A.K., Dolman, D.E.M., Yusof, S.R., and Begley, D.J. (2010). Структура и функция гематоэнцефалического барьера. Нейробиол. Дис. 37, 13–25.
J., Patabendige, A.A.K., Dolman, D.E.M., Yusof, S.R., and Begley, D.J. (2010). Структура и функция гематоэнцефалического барьера. Нейробиол. Дис. 37, 13–25.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Benet, LZ (2009). Альянс переносчика лекарств и метаболизма: раскрытие и определение взаимодействия. Мол. Фармакол. 6, 1631–1643.
Полный текст CrossRef
Cascorbi, I., and Haenisch, S. (2010). Фармакогенетика АТФ-связывающих кассетных переносчиков и клиническое значение. Методы Мол. биол. 596, 95–121.
Опубликован Аннотация | Pubmed Full Text
Dutheil, F., Jacob, A., Dauchy, S., Beaune, P., Scherrmann, J.-M., Decleves, X., and Loriot, M.-A. (2010). Транспортеры ABC и цитохромы P450 в центральной нервной системе человека: влияние на фармакокинетику головного мозга и вклад в нейродегенеративные расстройства. Экспертное заключение. Препарат Метаб. Токсикол. 6, 1161–1174.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Энгельхардт Б. и Сорокин Л. (2009). Гематоэнцефалический и гематоэнцефалический барьеры: функция и дисфункция. Семин. Иммунопатол. 31, 497–511.
и Сорокин Л. (2009). Гематоэнцефалический и гематоэнцефалический барьеры: функция и дисфункция. Семин. Иммунопатол. 31, 497–511.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Франке, Р. М., Гарднер, Э. Р., и Спарребум, А. (2010). Фармакогенетика транспортеров лекарств. Курс. Фармакол. Дизайн 16, 220–230.
Полный текст CrossRef
Иеири И., Хигучи С. и Сугияма Ю. (2009 г.). Генетические полиморфизмы переносчиков захвата (OATP1B1, 1B3) и оттока (MRP2, BCRP): значение индивидуальных различий в фармакокинетике и фармакодинамике статинов и других клинически значимых препаратов. Экспертное заключение. Препарат Метаб. Токсикол. 5, 703–729.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Йоханссон, И., и Ингельман-Сандберг, М. (2011). Генетический полиморфизм и токсикология – с акцентом на цитохром Р450. Токсикол. науч. 120, 1–13.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Капитульник Дж. , Хаммарлунд-Уденаес М., Гундерт-Реми У., Костелиду К., Крайтон Р., Заркович Н. и Бубис А. Р. (2010). Исследовательский семинар COST: фармакология и токсикология гематоэнцефалического барьера: современное состояние, потребности в будущих исследованиях и ожидаемая польза для ЕС. Перед. Нейроски .
, Хаммарлунд-Уденаес М., Гундерт-Реми У., Костелиду К., Крайтон Р., Заркович Н. и Бубис А. Р. (2010). Исследовательский семинар COST: фармакология и токсикология гематоэнцефалического барьера: современное состояние, потребности в будущих исследованиях и ожидаемая польза для ЕС. Перед. Нейроски .
CrossRef Full Text
Капитульник Дж., Пелконен О., Гундерт-Реми У., Даль С.Г. и Бубис А.Р. (2009 г.). Воздействие фармацевтических препаратов и других активных химических веществ на биологические мишени: механизмы, взаимодействия и интеграция в модели PB-PK/PD. Экспертное заключение. тер. Цели 13, 867–887.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Миллер, Д. С. (2010). Регуляция Р-гликопротеина и других переносчиков лекарств ABC через гематоэнцефалический барьер. Trends Pharmacol. науч. 31, 246–254.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Пелконен О.

 : 50 шт.
: 50 шт. подъязычные 100 мг: 50 или 100 шт.
подъязычные 100 мг: 50 или 100 шт. защечные и подъязычные 100 мг: 20, 28, 30, 50, 56, 60, 100 или 105 шт.
защечные и подъязычные 100 мг: 20, 28, 30, 50, 56, 60, 100 или 105 шт. защечные и подъязычные 250 мг: 10, 20, 30, 50, 60, 90, 100, 150, 270 или 300 шт.
защечные и подъязычные 250 мг: 10, 20, 30, 50, 60, 90, 100, 150, 270 или 300 шт. подъязычные 250 мг: 10, 20, 25, 30, 50, 75, 90, 100, 125, 225 или 250 шт.
подъязычные 250 мг: 10, 20, 25, 30, 50, 75, 90, 100, 125, 225 или 250 шт. защечные 1000 мг: 5,10 или 20 шт.
защечные 1000 мг: 5,10 или 20 шт. Н.А.Семашко
(Россия)
Н.А.Семашко
(Россия) , покрытые оболочкой, 250 мг: 60 шт.
, покрытые оболочкой, 250 мг: 60 шт. , покр. пленочной оболочкой, 50 мг+200 мг: 60, 90, 100 или 120 шт.
, покр. пленочной оболочкой, 50 мг+200 мг: 60, 90, 100 или 120 шт. 5 мл или 10 мл 10 шт.
5 мл или 10 мл 10 шт. 10 мл 5 или 10 шт.
10 мл 5 или 10 шт. , покр. кишечнорастворимой оболочкой: 50 или 100 шт.
, покр. кишечнорастворимой оболочкой: 50 или 100 шт. подъязычные 50 мг: 10 или 50 шт.
подъязычные 50 мг: 10 или 50 шт. подъязычные 100 мг: 50 шт.
подъязычные 100 мг: 50 шт. , покр. кишечнорастворимой обол.: 10, 20, 60, 100 или 200 шт.
, покр. кишечнорастворимой обол.: 10, 20, 60, 100 или 200 шт.