Как антибиотики влияют на микрофлору кишечника. Какие пробиотики эффективны для восстановления микробиома после антибиотикотерапии. Механизмы действия пробиотических штаммов на кишечную микробиоту.
Кишечный микробиом и его роль в организме человека
Кишечная микрофлора в настоящее время рассматривается как самостоятельный многоклеточный орган, играющий важную роль в обеспечении гомеостаза организма человека. Общая численность микроорганизмов, обитающих в различных отделах человеческого организма, составляет 1015 (100 трлн), что на 2 порядка больше, чем количество клеток собственно организма человека.
Основные факты о кишечном микробиоме:
- Вес микрофлоры составляет 5–6% веса организма
- На питание микрофлоры расходуется около 20% питательных веществ, поступающих в кишечник
- Микробиота представлена более чем 40 000 бактериальных штаммов из 1800 родов
- Микробиом содержит до 10 млн генов, отличающихся от генов человека
Кишечная микрофлора состоит из двух взаимосвязанных популяций: полостной и пристеночной (мукозной) микрофлоры. Основные функции кишечного микробиома:

- Участие в пищеварении и метаболизме
- Синтез витаминов группы В, К и других биологически активных веществ
- Поддержание иммунитета
- Защита от патогенных микроорганизмов
- Регуляция моторики кишечника
- Детоксикация
Влияние антибиотиков на кишечную микрофлору
Применение антибиотиков может существенно нарушать баланс кишечной микробиоты. Основные эффекты антибиотиков на микрофлору кишечника:
- Снижение общего количества бактерий
- Уменьшение видового разнообразия микрофлоры
- Подавление роста полезных бактерий (лактобактерий, бифидобактерий)
- Увеличение числа условно-патогенных микроорганизмов
- Нарушение соотношения анаэробных и аэробных бактерий
Наиболее выраженное негативное влияние на микрофлору оказывают антибиотики широкого спектра действия, особенно при длительном применении. К антибиотикам высокого риска развития дисбиоза относятся:
- Пенициллины (ампициллин, амоксициллин)
- Цефалоспорины (особенно 3 поколения)
- Клиндамицин
- Фторхинолоны
Антибиотик-ассоциированная диарея
Одним из серьезных осложнений антибиотикотерапии является антибиотик-ассоциированная диарея (ААД). Это состояние характеризуется развитием диареи на фоне или после приема антибиотиков. Основные факты об ААД:

- Частота возникновения — 5-30% пациентов, получающих антибиотики
- Наиболее частый возбудитель — Clostridium difficile (15-25% случаев)
- Симптомы: водянистая диарея, боли в животе, лихорадка
- Может развиваться в течение 2 месяцев после окончания приема антибиотиков
- В тяжелых случаях приводит к псевдомембранозному колиту
Пробиотики для восстановления микрофлоры после антибиотиков
Применение пробиотиков является эффективным методом профилактики и коррекции нарушений микрофлоры, вызванных антибиотиками. Основные эффекты пробиотиков:
- Восстановление нормального состава кишечной микрофлоры
- Подавление роста патогенных бактерий
- Стимуляция иммунитета
- Улучшение барьерной функции кишечника
- Нормализация моторики кишечника
Наиболее эффективные пробиотические штаммы
По данным многочисленных исследований, следующие пробиотические штаммы показали высокую эффективность в профилактике и лечении антибиотик-ассоциированной диареи:
- Saccharomyces boulardii
- Lactobacillus rhamnosus GG
- Lactobacillus acidophilus
- Bifidobacterium longum
- Lactobacillus plantarum
- Lactobacillus reuteri
Механизмы действия пробиотических штаммов
Различные пробиотические штаммы обладают разными механизмами действия:
Saccharomyces boulardii:
- Секреция протеазы, расщепляющей токсины C. difficile
- Стимуляция выработки секреторного IgA
- Антисекреторное действие
- Трофическое действие на слизистую кишечника
Lactobacillus rhamnosus GG:
- Продукция бактериоцинов
- Стимуляция выработки муцина
- Усиление барьерной функции кишечника
- Иммуномодулирующее действие
Bifidobacterium longum:
- Продукция короткоцепочечных жирных кислот
- Снижение pH в кишечнике
- Конкуренция с патогенами за питательные вещества
- Стимуляция роста полезной микрофлоры
Рекомендации по применению пробиотиков
Для максимальной эффективности пробиотиков при антибиотикотерапии следует соблюдать следующие правила:
- Начинать прием пробиотиков с первого дня антибиотикотерапии
- Принимать пробиотики между приемами антибиотиков (интервал 2-3 часа)
- Продолжать прием пробиотиков в течение 1-2 недель после окончания курса антибиотиков
- Использовать пробиотики, содержащие несколько штаммов
- Выбирать пробиотики с доказанной клинической эффективностью
- Соблюдать рекомендованную дозировку (не менее 5-10 млрд КОЕ в сутки)
Перспективные направления в области пробиотиков
Современные исследования в области пробиотиков направлены на создание более эффективных препаратов для коррекции микробиома. Основные тенденции:
- Разработка метабиотиков — препаратов на основе метаболитов пробиотических бактерий
- Создание синбиотиков — комбинации пробиотиков и пребиотиков
- Использование генно-модифицированных пробиотических штаммов
- Применение бактериофагов для селективного воздействия на патогенную микрофлору
- Персонализированный подбор пробиотиков на основе анализа микробиома пациента
Роль диеты в восстановлении микрофлоры
Помимо пробиотиков, важную роль в восстановлении нормального состава микрофлоры после антибиотиков играет диета. Рекомендации по питанию:
- Увеличить потребление пребиотиков (пищевых волокон)
- Включить в рацион ферментированные продукты (йогурт, кефир, квашеная капуста)
- Ограничить употребление сахара и рафинированных углеводов
- Употреблять достаточное количество овощей и фруктов
- Включить в рацион продукты, богатые полифенолами (ягоды, зеленый чай)
Заключение
Антибиотики оказывают существенное негативное влияние на кишечную микрофлору, что может приводить к различным нарушениям здоровья. Применение пробиотиков является эффективным методом профилактики и коррекции дисбиоза, вызванного антибиотиками. Наиболее изученными и эффективными пробиотическими штаммами являются Saccharomyces boulardii, Lactobacillus rhamnosus GG, Lactobacillus acidophilus и Bifidobacterium longum. Для максимальной эффективности пробиотики следует принимать с первого дня антибиотикотерапии и продолжать в течение 1-2 недель после ее окончания. Важную роль в восстановлении микрофлоры играет также правильное питание с включением пребиотиков и ферментированных продуктов.

Дальнейшие исследования в области пробиотиков направлены на создание более эффективных препаратов и персонализированный подход к коррекции микробиома. Это открывает новые перспективы в профилактике и лечении различных заболеваний, связанных с нарушением микрофлоры кишечника.
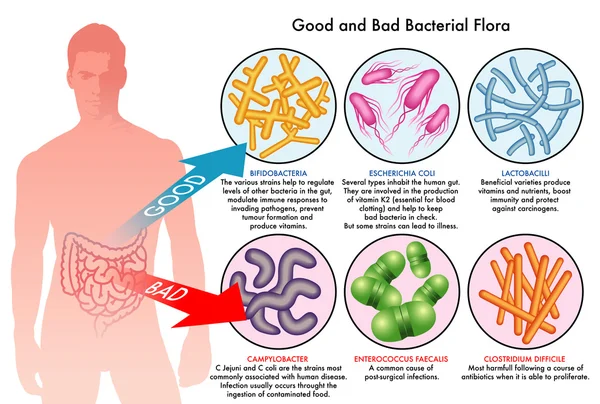
Антибиотики и Пробиотики
- Кишечный микробиом и макроорганизм
- Что происходит с кишечной микрофлорой в эру антибиотиков? Антибиотик-ассоциированная диарея
- Пути нормализации кишечной микрофлоры: пробиотические препараты
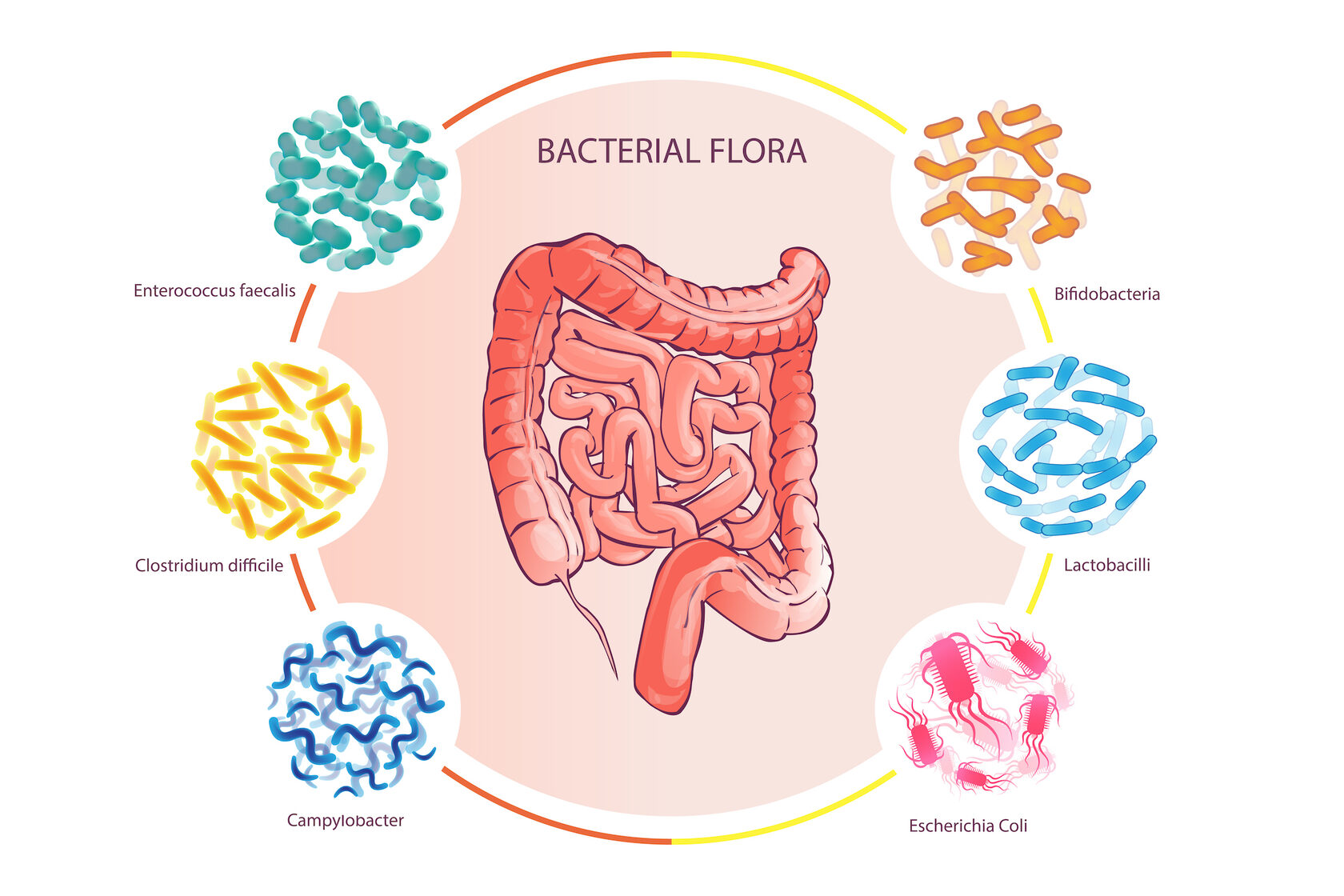
Кишечный микробиом и макроорганизм
Кто в доме хозяин? Доминируют микроорганизмы
10% — клетки макроорганизма
90% — микроорганизмы (бактерии простейшие, вирусы)
Более 60 % микрофлоры заселяет ЖКТ
Кишечная микрофлора (микробиота, кишечный микробиом) – отдельный орган, ответственный за метаболические процессы в организме
Содержание микроорганизмов в различных отделах ЖКТ (на 1 мл (г) содержимого)
Микрофлора тонкой кишки
Микрофлора толстой кишки
Симбионтная микрофлора кишечника
Различия состава микрофлоры тонкой и толстой кишки
Переваривание и всасывание
Различия микрофлоры по характеру метаболизма
Короткоцепочечные жирные кислоты
- Вырабатываются микрофлорой в процессе гидролиза углеводов.

- Обеспечивают до 20% ежедневной энергетической потребности организма, в т.ч., трофику эпителия.
- Стимулируют деление эпителиальных клеток и регулируют их созревание (масляная, пропионовая).
- Создают кислую среду в кишечнике и обеспечивают антимикробное действие (молочная, уксусная, пропионовая).
- Регулируют обмен ионов и липидов (молочная, пропионовая).
Антибиотик (C.difficile)-ассоциированная диарея
Определение: Токсины, продуцирующие C.difficile в ЖКТ, вызывают диарею и в тяжелых случаях – псевдомембранозный колит, обычно после приема антибиотиков. Характерна диарея , в ряде случаев кровавая; возможны всплески и острый живот.
Диагноз — обнаружение токсина C.difficile в кале.
Лечение — оральный прием метронидазола или ванкомицина
Эпидемиология, патогенез (I)
C.difficile – наиболее частая причина антибиотик-ассоциированного колита
C. difficile – индуцируемая диарея:
difficile – индуцируемая диарея:
- Причина 8% от всех госпитализированных больных
- Причина 20-30% всех случае госпитальной (нозокомиальной) диареи
- Асимптоматические носители инфекции C.difficile (15-70% новорожденных, 3-8% здоровых взрослых лиц)
Что происходит с кишечной микрофлорой в эру антибиотиков?
Эпидемиология, патогенез (II)
Антибиотик-индуцированное изменение флоры ЖКТ
Антибиотики наибольшего риска
- Пенициллины (ампициллин, амоксициллин)
- Цефалоспорины ( в особенности 3 поколения)
- Клиндамицин
C.difficile продуцирует цитотоксин и энтеротоксин
- Главная мишень – толстая кишка
- Секреция жидкости
- Псевдомембраны (дискретные желто-белые наложения)
- Токсический мегаколон (редко!)
Клиника
Начало заболевания в среднем через 5-10 дней после начала приема антибиотиков (разброс: от 1-го дня до 2 месяцев от начала)
Диарея: между мягкой и полуоформленной до частой и водянистой
Ложные позывы
Боль в животе
Осложнения
- Сепсис
- Острый живот
- Реактивный артрит (синдром Рейтера)
Диагноз, лечение
Диагноз:
- Диарея, возникающая в период двух месяцев от начала приема антибиотиков или в первые 72 часа после госпитализации
- Обнаружение токсина в кале
Лечение
- Метронидазол: 250мг 4 р или 500мг 3 р –10 дней при отсутствии эффекта или рецидива
- Повторить метронидазол в течение 21 дня или
- Ванкомицин:125-500 мг 4 раза – 10 дней
Особенности современной инфекции C. difficile
difficile
Заболевание наиболее часто регистрируется у амбулаторных пациентов
Наиболее серьезные исходы – при внутрибольничных вспышках
Дополнительно к штаммам, продуцирующим токсины А и В, все чаще выделяют штаммы, продуцирующие бинарный токсин: актин-специфическую АДФ-рибозилтрансферазу
Повышается резистентность к метронидазолу
Длительное (более 6 мес) применение ингибиторов протонной помпы –фактор риска развития C.difficile-ассоциированного колита
C.difficile представляет угрозу для сотрудников медицинских учреждений
Пути нормализации кишечной микрофлоры: пробиотические препараты
Пробиотики
- Пробиотики – заселение кишечника промышленными пробиотическими штаммами
- Lactobacillus
- Bifidumbacterium
- Escherihia coli
- Bacillus
- Saccharomyces boulardii
Микробы основной популяции: Lactobacillus
Общие характеристики:
- главные обитатели тонкой кишки,
- факультативные анаэробы, Грам+,
- выделено 56 видов,
- сахаролитические («молочнокислые»),
- выраженный антагонизм по отношению к условно патогенной флоре,
- выраженная иммуногенность,
- высокая способность к синтезу витаминов группы В, К, F, РР,
- трофика эпителия.

Микробы основной популяции: Lactobacillus
Лечебные культуры :
- L. acidophilus
- L. Plantarum
- L. rhamnosus
- L. сasei
- L. Paraсasei
- L. bulgaricus
- L. reuteri
- L. rhamnosus GG
- L. Salivarius
- L. Fermentum
Микробы основной популяции: Bifidumbacterium
Общие характеристики:
- главные обитатели толстой кишки,
- анаэробы, Грам +,
- выделено 30 видов,
- сахаролитические («молочнокислые»),
- выраженный антагонизм по отношению к условно патогенной флоре,
- выраженная иммуногенность,
- высокая способность к синтезу витаминов группы В, К, F, РР, аминокислот,
- трофика эпителия.
Микробы основной популяции: Bifidumbacterium
Лечебные культуры:
- B. breve
- B.
 longum
longum - B. infantis
- B. lactis
- B. bifidum
- B. adolescentis
Микробы, не обитающие в кишечнике человека: Saccharomyces boulardii
- Общие характеристики:
- дрожжевые грибки, не способные колонизировать ж.-к.т.,
- генетическая устойчивость к антибиотикам,
- разрушают энтеротоксины (в частности, Clostridium difficile) и блокируют рецепторы к ним,
- антисекреторное действие,
- выраженное иммуностимулирующее действие.
- Новый препарат на основе S. boulardii (Saccharomyces cerevisiae Hansen CBS 5296): Флорасан А
Пробиотики (I)
Saccharomyces boulardii – 1г/сутки:
- Предотвращает антибиотик-ассоциированную диарею у пациентов, находящихся на искусственном питании через катетер
- Механизм: секреция протеазы, гидролизирующей экзотоксины А и В, выделяемые C.
 difficile
difficile
LGG
- Значительное снижение диареи среди 202 госпитализированных взрослых пациентов
S. boulardii +E.faecium или E.faecium SF68:
Эффективные агенты в профилактике антибиотик-ассоциированной диареи
Пробиотики (II)
E.faecium –1*109 КОЕ/сутки:
- Снижает частоту диареи с 27% до 9%
B.longum — 1*109 КОЕ/сутки:
- Предупреждает эритромицин-ассоциированные нарушения ЖКТ
Сравнительная оценка LGG, Saccharomyces boulardii, L.acidophilus, B.lactis:
- Все пробиотики оказались эффективнее плацебо
ФЛОРАСАН А
«А» : восстановление после Антибиотикотерапии
Источник пробиотических микроорганизмов:
1. Лизат Saccharomyces cerevisiae 0,5 гр.
2. Bifidobacterium longum, не менее 1х109 КОЕ
3. Bifidobacterium bifidum не менее 1х109 КОЕ
Bifidobacterium bifidum не менее 1х109 КОЕ
4. Lactobacillus rhamnosus не менее 1х109 КОЕ
*Восстановление нарушенных функций желудочно-кишечных тракта и нормализации микрофлоры кишечника у лиц, имеющих острые расстройства стула, при лечении антибактериальными средствами
Флорасан А
1. Профилактика расстройств пищеварения и нарушения микрофлоры в мочеполовой системе:
ПРИМЕНЯТЬ с 1-ого дня курса антибиотиков Дозировка: Взрослым и детям>12 лет по 1 капсуле 2 раза в день
2. Лечение при возникновении диареи и/или вульвовагинита, уретрита и др. на фоне приёма антибактериальных препаратов:
Дозировка: по 1 капсуле 3-4 раза в день, длительность приёма 5-7 дней, затем по 1 капсуле х 2 р/д
Заключение
- Огромная сложность взаимодействий внутри кишечного микробиома, отношений между микробиомом и макроорганизмом
- При антибиотикотерапии нарушается состав микрофлоры
- Перспективно включение в схемы антибиотикотерапии индивидуальных пробиотических препаратов Флорасан А
Новые аспекты в лечении вагинальных дисбиозов » Медвестник
Микрофлора кишечника в настоящее время рассматривается как самостоятельный дополнительный многоклеточный орган, играющий важную роль в обеспечении гомеостаза организма человека. Общая численность микроорганизмов, обитающих в различных отделах человеческого организма, составляет 1015 (100 трлн), что на 2 порядка больше, чем количество клеток собственно организма человека. Вес микрофлоры составляет 5–6% веса организма. На питание микрофлоры расходуется около 20% питательных веществ, поступающих в кишечник, и 10% вырабатываемой организмом энергии. Связанная с человеком микробиота представлена более чем 40 000 бактериальных штаммов из 1800 родов, которые содержат до 10 млн отличающихся от человека генов.
Общая численность микроорганизмов, обитающих в различных отделах человеческого организма, составляет 1015 (100 трлн), что на 2 порядка больше, чем количество клеток собственно организма человека. Вес микрофлоры составляет 5–6% веса организма. На питание микрофлоры расходуется около 20% питательных веществ, поступающих в кишечник, и 10% вырабатываемой организмом энергии. Связанная с человеком микробиота представлена более чем 40 000 бактериальных штаммов из 1800 родов, которые содержат до 10 млн отличающихся от человека генов.
Кишечная микрофлора состоит из двух взаимосвязанных популяций: полостной и пристеночной (мукозной) микрофлоры.
Основная функция пробиотических препаратов в гинекологии заключается в поддержании базового компонента нормобиоты, а не в колонизации влагалища случайной или транзиторной микрофлорой, приоритетное место продолжают занимать пробиотики на основе живых клеток молочно-кислых бактерий родов Lactobacillus и Bifidobacterium, ключевая роль которых в функциональной активности физиологического биоценоза влагалища и в регуляции его состава убедительно доказана.
В состав ряда пробиотиков входят грамположительные анаэробные бактерии рода Bifidobacterium spp., которые хотя и не являются резидентной флорой во влагалищном биотопе, но высеваются примерно у каждой 10-й здоровой женщины.
Бифидобактерии обладают антагонистической активностью против широкого спектра патогенных и условно-патогенных бактерий, синтезируют витамины группы В (B1, B2 и др.) и витамин К. Бифидобактерии являются одними из основных представителей микрофлоры ЖКТ: совершая в составе пероральных форм пробиотиков пассаж по кишечнику, могут колонизировать влагалище.
Lactobacillus acidophilus, которая встречается в пищеварительном тракте и вагине человека и некоторых других млекопитающих, является одним из видов гомоферментативных бактерий рода Lactobacillus, которые производят только молочную кислоту, в связи с чем и получила свое родовое название от лат. lacto- — «молоко» и bacillus — «палочка» и видовое название от acidum — «кислота» и «philus» — «любить». Эта бактерия выживает в более кислых средах, чем другие виды (pH 4–5 и меньше) и оптимально растет при температурах около 30 градусов Цельсия.
Основу ряда пробиотических препаратов составляют штаммы, полученные в результате промышленного культивирования штаммов лактобацилл, выделенных из урогенитальной зоны здоровых женщин (L.rhamnosus GR-1, L.rhamnosus 35, L.reuteri RC-14).
Штамм L.rhamnosus GR–1 выделен из дистальных отделов уретры, штамм L.reuteri RC–14 – из влагалища здоровых женщин. Оба штамма обладают выраженными адгезивными эффектами в отношении вагинальных эпителиоцитов, продуцируют перекись водорода и бактериоциноподобные вещества как при местном применении, так и при пероральном приеме. Согласно данным доклинических и клинических исследований, способны подавлять размножение и и адгезию условно патогенных и патогенных микроорганизмов урогенитального тракта, как E.coli, Enterococcus faecalis, Klebsiella pneumoniae, Staphilococcus epidermidis, Gardnerella vaginalis, Streptococcus B, Candida albicans, и др. (2).
Оба штамма адгезируют к уроэпителиальным клеткам и ингибируют рост и адгезию уропатогенов, GR-1 устойчив к спермициду ноноксинолу-9, а RC-14 продуцирует перекись водорода.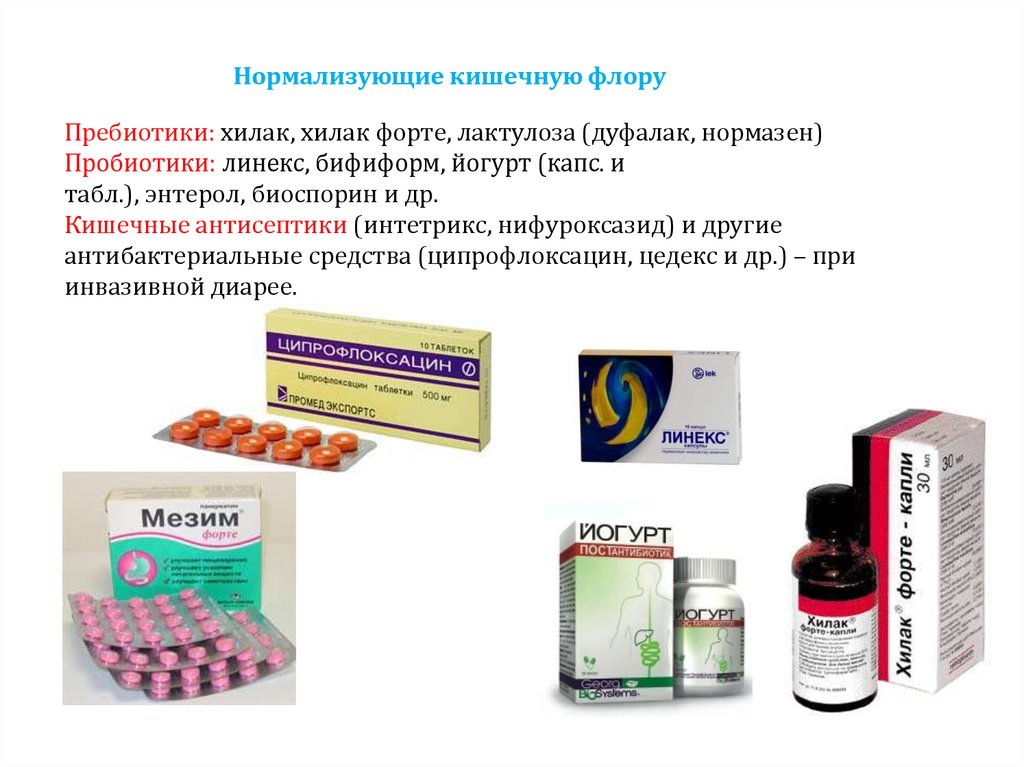 Штамм GR-1 более пригоден для применения при инфекциях влагалища, чем L. rhamnosus GG, так как после инстилляции значительно дольше сохраняется во влагалище и способен его колонизировать.
Штамм GR-1 более пригоден для применения при инфекциях влагалища, чем L. rhamnosus GG, так как после инстилляции значительно дольше сохраняется во влагалище и способен его колонизировать.
В состав лекарственного препарата эти штаммы входят в равной пропорции. Доказано, что оба штамма обладают высокими адгезивными свойствами, то есть они способны к активной фиксации на клетках вагинального эпителия и успешному размножению.
Так как штаммы L.rhamnosus GR–1 и L.reuteri RC–14 сохраняют жизнеспособность после прохождения через ЖКТ, они обладают высокой колонизационной способностью как в ЖКТ, так и во влагалище, являются представителями нормофлоры влагалища. Препараты, содержащие данные штаммы, являются препаратами выбора для нормализации вагинальной микрофлоры среди пробиотиков для перорального приема.
В настоящее время результаты исследований ученых позволяют рассматривать бактериальную транслокацию из желудочно-кишечного тракта в качестве естественного защитного механизма: микроорганизмы, вегетирующие только в толстой кишке, при определенных ситуациях могут появиться в тонком кишечнике, что приводит к развитию физиологического дисбиоза с последующим проникновением микроорганизмов в кровь через участки физиологической десквамации и межклеточные щели слизистой оболочки желудка и верхних отделов тонкого кишечника. (3,4)
(3,4)
В физиологических условиях бактериальная транслокация включает в себя Sampling (активный захват микроорганизмов) с участием фагоцитирующих клеток и опсонических гуморальных факторов (комплемент, антитела и др.). Взаимодействие микробиоты с лимфоидной тканью, в том числе с Пейеровыми фолликулами, во многом зависит от способности М-клеток к фагоцитозу (1,2).
Для преодоления кишечного барьера и активизации механизма транслокации титр колонизационного пула микроорганизмов должен достигать 109 КОЕ (1,2).
Бактериальная транслокация на сегодняшний день представляет собой важный фактор связи между кишечником матери, молочными железами, грудным вскармливанием и осуществлением передачи комменсальных кишечных микроорганизмов новорожденному.
Большинство бифидобактерий, колонизирующих кишечник новорожденных, представлены материнскими штаммами бифидобактерий, присутствующих в грудном молоке. Преобладающими видами бифидобактерий являются B. longum (77% случаев), B. bifidum (26%), B. catenulatum (15%) и B. breve.
bifidum (26%), B. catenulatum (15%) и B. breve.
В исследовании Cianci A. с соавт. (9) проведено изучение эффективности применения L. rhamnosus/reuteri, вводимых перорально по 2 таблетки в сутки в течение 15 дней в лечении и профилактике бактериального вагиноза, профилактике рецидивов. Согласно полученным результатам, 92% пациенток имели полную реколонизацию лактобактерий, что, по мнению авторов, имеет значение в профилактике рецидивов, поскольку происходит восстановление вагинальной экосистемы.
Результаты исследования подтверждают, что пробиотические штаммы L. rhamnosus GR-1 и L. reuteri RC-14 способны подавлять рост C. albicans и в ряде случаев оказывать фунгицидное действие на грибок (18).
Несмотря на то что наиболее распространенным возбудителем кандидоза остается C.albicans, за последние 15–20 лет отмечено значительное увеличение числа инфекций, вызываемых C.tropicalis, C.parapsilosis, C.glabrata и C.krusei. В исследовании Chew S. Y. с соавт. (19) обнаружена выраженная антагонистическая активность пробиотических штаммов L. rhamnosus GR-1 и L. reuteri RC-14 в отношении всех протестированных штаммов C. glabrata. Лактобациллы проявляли противогрибковые эффекты, в т.ч. связанные с их способностью к агрегации. В присутствии штаммов L. rhamnosus GR-1 и L. reuteri RC-14 зафиксировано прекращение роста и гибель клеток C. glabrata.
Y. с соавт. (19) обнаружена выраженная антагонистическая активность пробиотических штаммов L. rhamnosus GR-1 и L. reuteri RC-14 в отношении всех протестированных штаммов C. glabrata. Лактобациллы проявляли противогрибковые эффекты, в т.ч. связанные с их способностью к агрегации. В присутствии штаммов L. rhamnosus GR-1 и L. reuteri RC-14 зафиксировано прекращение роста и гибель клеток C. glabrata.
Эффективность данной комбинации в восстановлении вагинального биоценоза при пероральном применении изучена в многоцентровом двойном слепом рандомизируемом плацебо-контролируемом исследовании, в которое были включены женщины с лабораторно подтвержденным вагинальным дисбиозом (бактериальный вагиноз, кандидозный вульвовагинит, микст-инфекция) или трихомонадным вагинитом. Пациентки основной группы перорально принимали капсулы с L. rhamnosus GR-1 и L. reuteri RC-14, пациентки контрольной группы получали плацебо. Длительность приема препарата/плацебо 6 нед. При трихомонадном вагините назначили метронидазол в дозе 2 г per os однократно. Контрольное обследование (окраска вагинальных мазков по Граму) проводили через 6 и 12 нед. Восстановление вагинальной микробиоты через 6 недель подтвердилось у 40 пациенток исследования (26,9%) в группе плацебо и у 243 (61,5%) – в группе с пробиотиками (p
При трихомонадном вагините назначили метронидазол в дозе 2 г per os однократно. Контрольное обследование (окраска вагинальных мазков по Граму) проводили через 6 и 12 нед. Восстановление вагинальной микробиоты через 6 недель подтвердилось у 40 пациенток исследования (26,9%) в группе плацебо и у 243 (61,5%) – в группе с пробиотиками (p
Многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование проведено для определения возможности применения перорального пробиотического препарата, содержащего три штамма лактобацилл, вместе со стандартным лечением метронидазолом, а также антибиотиками (при неэффективности метронидазола) для снижения частоты рецидивов бактериального вагиноза (БВ) и аэробного вагинита (АВ). Пациенты частных гинекологических клиник Польши с рецидивирующими БВ/АВ и наличием симптомов были рандомизированы в 2 группы : 1-я группа –назначение метронидазола 500 мг 2 р/д 7 дней (клиндамицина) и перорального пробиотика (10 дней prOVag) ; 2-я группа – назначение метронидазола (клиндамицина) и плацебо. Лечение поводилось в перименструальный период с 18–22 дня менструального цикла.
Лечение поводилось в перименструальный период с 18–22 дня менструального цикла.
Первичные точки эффективности – клинические или микробиологические рецидивы БВ/АВ и безопасность пробиотиков. Вторичные точки эффективности – вагинальный рН, оценка критерия Ньюджента и количество лактобацилл в вагинальной микробиоте. Исследование показало, что применение перорального пробиотического препарата приводит к повышению количества лактобацилл во влагалище, что ассоциировалось у пациенток со снижением рН влагалищной среды, поддержанием критерия Ньюджента и подавлянием роста патогенов. Данное исследование продемонстрировало, что пероральные пробиотики удлиняют ремиссию у пациентов с рецидивирующим БВ/АВ, а также улучшают клинические и микробиологические показатели.
У пациенток, резистентных к метронидазолу, на фоне применения клиндамицина (перорально и местно) в комбинации с пероральным пробиотиком отмечено также нарастание колонизации влагалища лактобациллами, несмотря на то, что штаммы лактобацилл, используемые в prOVag, чувствительны к клиндамицину in vitro.
Заключение
В настоящее время результаты исследований ученых позволяют рассматривать бактериальную транслокацию из желудочно-кишечного тракта в качестве естественного защитного механизма. Экспериментальное подтверждение этого процесса получено с применением гнотобиологических моделей взаимодействия макроорганизма хозяина с микробиотой, которые продемонстрировали проникновение микроорганизмов через кишечный барьер, что сопровождалось транзиторной бактериемией.
Вагинальные дисбиозы достаточно часто сочетаются с дисбиозом пищеварительного тракта. В данной ситуации пероральный прием пробиотиков при влагалищном дисбиозе имеет свои плюсы за счет параллельной коррекции состава кишечного биоценоза (10, 11, 12). Желудочно-кишечный тракт представляет собой важнейший элемент иммунной системы, дисбаланс в котором создает условия для развития иммунодефицитных состояний, являющихся фоном для развития хронических воспалительных заболеваний половых органов и их рецидивов. Анатомическая близость двух биотопов способствует проникновению микроорганизмов из кишечника во влагалище. Как правило, у 6 из 10 женщин, имеющих нарушение вагинальной микробиоты, обнаруживается также дисбиоз кишечника, а у 71 % женщин, страдающих бактериальным вагинозом, выявляется дисбиоз желудочно-кишечного тракта, т.е. эти два биотопа взаимосвязаны, и следует предположить единый дисбиотический процесс в организме с доминирующим проявлением в том или ином биотопе. Целесообразной является реализация концепции комплексного подхода, сочетающего своевременную коррекцию микроэкологических нарушений одновременно в двух биотопах, профилактику дисбиозов кишечника и влагалища.
Как правило, у 6 из 10 женщин, имеющих нарушение вагинальной микробиоты, обнаруживается также дисбиоз кишечника, а у 71 % женщин, страдающих бактериальным вагинозом, выявляется дисбиоз желудочно-кишечного тракта, т.е. эти два биотопа взаимосвязаны, и следует предположить единый дисбиотический процесс в организме с доминирующим проявлением в том или ином биотопе. Целесообразной является реализация концепции комплексного подхода, сочетающего своевременную коррекцию микроэкологических нарушений одновременно в двух биотопах, профилактику дисбиозов кишечника и влагалища.
Так как штаммы L.rhamnosus GR–1 и L.reuteri RC–14 сохраняют жизнеспособность после прохождения через ЖКТ, они обладают высокой колонизационной способностью как в ЖКТ, так и во влагалище, являются представителями нормофлоры влагалища. Препараты, содержащие данные штаммы, являются препаратами выбора для нормализации вагинальной микрофлоры среди пробиотиков для перорального приема. Примером такого продукта являются капсулы Вагилак, которые имеют удобную пероральную форму приема и могут применяться у женщин и девочек с 10 лет.
VGC-17.07.2020
Список литературы:1. Г.И. Подопригора1, 2, Л.И. Кафарская1, Н.А. Байнов1, А.Н. Шкопоров1Бактериальная транслокация из кишечника: микробиологические, иммунологические и патофизиологические аспекты. Вестник РАМН, 2015, 70(6)
2. Назаренко Л.Г., Соловьева Н.П. Применение орального пробиотика как альтернативная клиническая стратегия профилактики акушерских и перинатальных инфекций //Здоровье женщины. – 2013 — № 6 (82). – С.91-96
3. Owens W.E., Berg R.D. Bacterial translocation from gastrointestinal tracts thymectomized micе.—Current Microbiology, 1982; 7(iss.3): 169-134.
4. И.Ю. Чичерин, И.П. Погорельский, И.А. Лундовских, И.В. Дармов, К.Е. Гаврилов, А.С. Горшков, А.И. Маньшин. Транслокация кишечной микробиоты. Журнал Международной медицины Оториноларингология / Аллергология / Иммунология / Инфекционные заболевания / 2016 / № 2(19), стр 87-99
5. Г.И. Подопригора1, 2, Л. И. Кафарская1, Н.А. Байнов1, А.Н. Шкопоров1Бактериальная транслокация из кишечника: микробиологические, иммунологические и патофизиологические аспекты. Вестник РАМН, 2015, 70(6)
И. Кафарская1, Н.А. Байнов1, А.Н. Шкопоров1Бактериальная транслокация из кишечника: микробиологические, иммунологические и патофизиологические аспекты. Вестник РАМН, 2015, 70(6)
6. Hase K, Kawano K, Nochi T, Pontes GS, Fukuda S, Ebisawa M, et al. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 2009;462(7270):226–230 doi: 10.1038/nature08529.
7. Ohno H, Hase K. Glycoprotein 2 (GP2): grabbing the FimH bacteria into M cells for mucosal immunity. Gut Microbes. 2010;1(6):407-410 doi: 10.4161/gmic.1.6.14078.
8. Gronlund MM, Gueimonde M, Laitinen K, Kociubinski G, Gronroos T, Salminen S, et al. Maternal breast-milk and intestinal bifidobacteria guide the compositional development of thе Bifidobacterium microbiota in infants at risk of allergic disease. Clin Exp Allergy. 2007;37(12):1764–1772. doi: 10.1111/j.1365-2222.2007.02849.x.
9. Cianci A., Giordano R., Delia A., et al. Efficacy of Lactobacillus Rhamnosus GR-1 and of Lactobacillus Reuteri RC-14 in the treatment and prevention of vaginoses and bacterial vaginitis relapses. Minerva Ginecol. 2008;60(5):369–76.]
Efficacy of Lactobacillus Rhamnosus GR-1 and of Lactobacillus Reuteri RC-14 in the treatment and prevention of vaginoses and bacterial vaginitis relapses. Minerva Ginecol. 2008;60(5):369–76.]
10. Köhler G.A., Assefa S., Reid G. Probiotic interference of Lactobacillus rhamnosus GR-1 and Lactobacillus reuteri RC-14 with the opportunistic fungal pathogen Candida albicans. Infect Dis Obstet Gynecol. 2012:636474. Doi: 10.1155/2012/63647(46)4
11. Тихомиров А.Л., Сарсания С.И. Комплаентность при терапии влагалищных дисбиозов. Медицинский совет. 2019;12:146-152. DOI: https://doi.org/10.21518/2079-701X-2019-12-146-152.
12. Кира Е.Ф. Бактериальный вагиноз. — М.:ООО «Медицинское информационное агенство», 2012 -472 с
13. Biagi E., Candela M., Fairwether–Taight S., Franceschi C., Brigidi P. Ageing of human metaorganism: the microbial counterpart //Age. — 2012 — Vol. 34 — P.247–267.
14. Потапов В.А. Пробиотики в гинекологии. Очередная мода или осознанная необходимость (аналитический обзор / В. Потапов // З турботою про жінку. — 2015. — N 1. — С. 10-15
Очередная мода или осознанная необходимость (аналитический обзор / В. Потапов // З турботою про жінку. — 2015. — N 1. — С. 10-15
15. Попкова С.М. и др. Микроэкологические сочетания вагинального и кишечного биотопов у женщин с воспалительными заболеваниями нижнего этажа полового тракта и девочек-подростков с дисфункцией яичников БЮЛЛЕТЕНЬ СО РАМН, ТОМ 33, № 4, 2013 стр.77-84
16. Irkitova A.N., Kagan Ya.R., Sergeeva I.Ya. Svoystva, ekologicheskie aspekty i prakticheskoe znachenie atsidofil’noy palochki. 1.Opisanie i mestoobitanie // Aktual’nye problemy tekhniki i tekhnologii pererabotki moloka. – Sib. NII syrodeliya. – Vyp.8. – 2011.– S. 207–212. (in Russian)
17. Mezzasalma V., Manfrini E., Ferri E., Boccarusso M., Di Gennaro P., Schiano I., Michelotti A., Labra M. Orally administered multispecies probiotic formulations to prevent uro-genital infections: a randomized placebo-controlled pilot study. Arch Gynecol Obstet. 2017;295(1):163-172.
18. Cianci A., Giordano R., Delia A., et al. Efficacy of Lactobacillus Rhamnosus GR-1 and of Lactobacillus Reuteri RC-14 in the treatment and prevention of vaginoses and bacterial vaginitis relapses. Minerva Ginecol. 2008;60(5):369–76.]
19. Chew S.Y., Cheah Y.K., Seow H.F., et al. Probiotic Lactobacillus rhamnosus GR-1 and Lactobacillus reuteri RC-14 exhibit strong antifungal effects against vulvovaginal candidiasis-causing Candida glabrata isolates. J Appl Microbiol. 2015;118(5):1180–90. Doi: 10.1111/ jam.12772.
Про+ Синбиотик | Кио-Дофилус | Пробиотик
- Семейство торговых марок
- |
- Кио-Дофилус®
- |
- Про+ Синбиотик
Баланс и поддержка кишечника*
| Теперь доступно! |
Доступные размеры
50 штук, 25 порционных упаковок
20 миллиардов
Без глютена
Без ГМО
Без сои
Без молочных продуктов
Без искусственных красителей
Без искусственных ароматизаторов
Без охлаждения
Пробиотики Kyo-Dophilus созданы для поддержания здоровья пищеварительной и иммунной систем. * Наши пробиотики обеспечивают эффективность, качество и продлевают жизнеспособность живых клеток без охлаждения.
* Наши пробиотики обеспечивают эффективность, качество и продлевают жизнеспособность живых клеток без охлаждения.
Дружественное трио®
Дружественное трио® является основой наших составов. Friendly Trio® представляет собой клинически изученную запатентованную смесь человеческого штамма Lactobacillus gasseri KS-13, Bifidobacterium bifidum 9.0047 G9-1 и Bifidobacterium longum
- L. gasseri поддерживает функцию желудочно-кишечного тракта и иммунитет.*
- B. bifidum может регулировать здоровую микрофлору кишечника и повышать иммунитет за счет уменьшения воспаления.*
- Известно, что B. longum нормализует перистальтику кишечника*
РЕКОМЕНДУЕМОЕ ПРИМЕНЕНИЕ:
Принимайте по две жевательные таблетки Kyo-Dophilus Pro+ Synbiotic один раз в день, чтобы сбалансировать желудочно-кишечный тракт и улучшить пищеварение для общего самочувствия.*
Упаковка продукта, которую вы получаете, может содержать дополнительную информацию или может отличаться от того, что показано на нашем веб-сайте. Пожалуйста, ознакомьтесь с информацией, прилагаемой к вашему продукту, не полагайтесь исключительно на информацию, показанную на этой странице.
Пожалуйста, ознакомьтесь с информацией, прилагаемой к вашему продукту, не полагайтесь исключительно на информацию, показанную на этой странице.
*Эти утверждения не были оценены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Этот продукт не предназначен для диагностики, лечения, лечения или предотвращения каких-либо заболеваний.
Заметили значительно более спокойный желудок и лучшее пищеварение
Camille
Я действительно ощутил преимущества этого продукта. Моему организму потребовалось несколько дней, чтобы приспособиться (а значит, он работал), и я заметил, что желудок стал намного спокойнее, и…
Я действительно ощутил преимущества этого продукта. Моему телу потребовалось несколько дней, чтобы приспособиться (что означало, что оно работает), и я заметил, что желудок и пищеварение стали намного спокойнее. Его легко принимать каждый день и он приятный на вкус.
Camille
Отлично подходит для тех, кто ненавидит глотать таблетки
B. Abode
Abode
Единственное, что мешает мне соблюдать ежедневный прием пробиотиков, — это принять таблетку. Ребята, я ненавижу принимать таблетки. В какой-то момент я подумал…
Единственное, что мешает мне соблюдать ежедневный прием пробиотиков, — это принять таблетку. Ребята, я ненавижу принимать таблетки. Я думал, что в какой-то момент в своей взрослой жизни я преодолею это, и хотя я приближаюсь к 35 годам, чувство, которое я ненавижу, когда принимаю таблетки, никогда не исчезало. Поэтому я могу оценить такие продукты, которые легко принимать, например, Kyo-Dophilus Pro+ Synbiotic! Это жевательный!
B. Abode
Помощь моему 13-летнему ребенку при СРК
Кристи
Моя дочь принимает этот продукт для лечения СРК, и он невероятно помогает и избавляет меня от душевной боли от расстроенного 13-летнего ребенка. Жизнь уже улучшается…
Моя дочь принимает этот продукт для лечения СРК, и он невероятно помогает и спасает меня от душевной боли от расстроенного 13-летнего ребенка. Ее жизнь уже улучшается
Ее жизнь уже улучшается
Кристи
Помогает с моей пищевой непереносимостью!
апрель
Мне нечасто удается найти добавки, которые работают с моей пищевой непереносимостью. Мне нравится, что Kyo-Dolphilus находится в удобных для переноски отдельных пакетиках, не содержит глютена и…
Нечасто я могу найти добавки, которые работают с моей пищевой непереносимостью. Мне нравится, что Kyo-Dolphilus находится в удобных для переноски отдельных пакетах, не содержит глютена и его можно жевать. Я много борюсь со здоровьем кишечника и помогаю всему двигаться так, как должно в моем теле. Эти таблетки помогают моему телу бороться со вздутием живота и дискомфортом в животе. Спасибо за продукт, который помогает мне в повседневной жизни.
Апрель
Q
Что означает число «КОЕ»?
Большинство добавок измеряется в миллиграммах. Пробиотики, с другой стороны, измеряются в КОЕ (колониеобразующие единицы). Это относится к количеству жизнеспособных живых бактерий, способных делиться и образовывать колонии. Количество КОЕ обычно указывается в миллиардах.
Количество КОЕ обычно указывается в миллиардах.
Q
Нужно ли хранить пробиотики Kyo-Dophilus в холодильнике?
Благодаря уникальным запатентованным методам обработки, используемым при производстве пробиотиков Kyo-Dophilus®, бактерии стабильны при комнатной температуре и поэтому не требуют охлаждения. Выбранные Kyo-Dophilus штаммы бактерий находятся в состоянии покоя и не становятся активными до тех пор, пока не попадут во влажную среду, например, при употреблении вместе с едой или жидкостью. Kyo-Dophilus гарантирует, что «на момент истечения срока годности (или потребления)» вы получаете количество бактерий (КОЕ), указанное на этикетке.
Q
Где производятся ваши продукты Kyo-Dophilus?
Наша готовая продукция производится в Калифорнии, США, на нашем современном заводе, сертифицированном GMP.
Q
Каков источник ваших пробиотиков Kyo-Dophilus?
Три основных штамма, используемых во всех наших продуктах Kyo-Dophilus (The Friendly Trio®): L. gasseri KS-13, B. bifidum G9-1 и B. longum MM-2, получены из человеческого источника из одноразовый, запатентованный и неинвазивный метод. Другие штаммы Kyo-Dophilus Multi 9продукты Kyo-Dophilus Max производятся из человеческого, молочного или ферментированного зерна. (Благодаря методу обработки они не содержат молочных или зерновых аллергенов)
gasseri KS-13, B. bifidum G9-1 и B. longum MM-2, получены из человеческого источника из одноразовый, запатентованный и неинвазивный метод. Другие штаммы Kyo-Dophilus Multi 9продукты Kyo-Dophilus Max производятся из человеческого, молочного или ферментированного зерна. (Благодаря методу обработки они не содержат молочных или зерновых аллергенов)
Продукт | Исан Сэйчояку Охты
- Дом
- Продукт
- Исан Сэйчояку из Ohta
- Безрецептурный препарат типа 3
- Планшет
Показания
Жидкий стул, регуляция кишечника (регуляция стула), запоры, чувство распирания в животе
Упаковка
- 160 таблеток
- 370 таблеток
Особенности
Лекарство для регуляции работы кишечника, включающее комбинацию молочнокислых бактерий и растительных лекарственных средств, предназначенное для людей с чувствительным кишечником.
Молочнокислые бактерии делают кишечник устойчивым к стимуляции.
Три вида кишечных пробиотиков, состоящие из 2 видов молочнокислых бактерий (Bifidobacterium Longum и Lactobacillus Gasseri) и 1 вида Clostridium butyricum соответственно, работают в эффективном режиме, так что нарушенный кишечник становится хорошо сбалансированным, а условия кишечника улучшаются. быть устойчивым к стимуляции.
Функция кишечника нормализована, чтобы быть эффективным для чувствительного кишечника.
Два вида растительных лекарственных средств, контролирующих функцию кишечника (например, трава герани и кора мальлоты), нормализуют функцию кишечника. Жидкий стул и запоры облегчаются, состояние кишечника контролируется, а полезные бактерии остаются в форме.
Рекомендуется использовать лицам со следующими симптомами.

Лекарство для регуляции кишечника рекомендуется людям, желающим улучшить состояние слабого кишечника; человек с рыхлым кишечником, вызванным психическим напряжением, употреблением алкоголя и т.п.; и человека беспокоит вздутие кишечника.
Направления
Пожалуйста, принимайте после еды следующее количество.
| Возраст | Доза | Раз/день |
|---|---|---|
| Для взрослых (15 лет и старше) | 3 таблетки | 3 раза в день |
| 8-14 лет | 2 таблетки | |
| 5-7 лет | 1 таблетка | |
| До 5 лет | Не принимать | |
ПРИМЕЧАНИЕ к указаниям
*Срок годности: Посмотрите на обратную сторону продукта.
Ингредиенты
Суточная доза (9 таблеток)
| Категория | Ингредиенты | Количество | Функция |
|---|---|---|---|
| Кишечные пробиотики | Бифидобактерии Лонгум | 30 мг | Типичная пробиотическая полезная бактерия, работающая в основном в толстом кишечнике, подавляющая рост вредных бактерий и улучшающая состояние кишечника. |
| Лактобактерии Гассери | 30 мг | Молочнокислая бактерия, работающая в основном в тонком кишечнике и подавляющая рост вредных бактерий. | |
| Closridium Butyricum | 90 мг | Пробиотическая полезная бактерия, устойчивая к желудочной кислоте и способствующая росту бифидобактерий. | |
| Контроль функции кишечника Лекарственные травы | Экстракт травы герани (трава герани) | 102 мг (1020 мг) | Регуляция перистальтики толстого и тонкого кишечника; контроль нарушенной перистальтики кишечника, с улучшением жидкого стула и запоров. |
| Экстракт коры мальлотуса (кора мальлотуса) | 63 мг (504 мг) | Оздоровление слизистых оболочек желудка и кишечника. Кроме того, контролируются функции желудка и кишечника, устраняются жидкий стул и запоры. | |
| Желудочные травы | Порошок горечавки | 51 мг | Улучшает работу желудка и способствует пищеварению. |
| Дигестант | Биодиастазы 1000 | 60 мг | Комбинированный пищеварительный фермент для переваривания крахмала и белка. Запись опубликована в рубрике Разное. Добавьте в закладки постоянную ссылку. |

