Как антибиотики нарушают баланс микрофлоры кишечника. Какие симптомы указывают на дисбактериоз. Как пробиотики и пребиотики помогают восстановить микрофлору. Какие правила нужно соблюдать при приеме пробиотиков.
Влияние кишечной микрофлоры на здоровье человека
Кишечник играет важнейшую роль в здоровье человека, и это связано не только с пищеварением. Недавние исследования показали, что кишечник влияет на наше эмоциональное состояние и иммунитет:
- В кишечнике вырабатывается 90-95% серотонина — «гормона счастья»
- Нервная система кишечника содержит около 100 миллионов нейронов
- 70-80% иммунных клеток находятся в кишечнике
- Кишечник населяет около 100 триллионов микроорганизмов — кишечная микробиота
Микробиота кишечника контролирует работу иммунной системы и защищает организм от болезней. Поэтому так важно поддерживать здоровый баланс кишечной микрофлоры.
Как микрофлора кишечника защищает от инфекций
Кишечник имеет собственную иммунную систему, которая называется иммунитетом слизистых. Нормальная микрофлора кишечника играет ключевую роль в поддержании этой системы защиты:

- Обучает иммунную систему распознавать патогены
- Поддерживает боеготовность иммунитета
- Не дает размножаться болезнетворным бактериям
- Стимулирует выработку защитных веществ
Исследования показали, что у животных без микрофлоры иммунитет слизистых развит слабо. Это доказывает важность нормальной микрофлоры для иммунитета всего организма.
Негативное влияние антибиотиков на микрофлору
Многие люди при простудах и ОРВИ необоснованно принимают антибиотики. Это приносит больше вреда, чем пользы:
- Антибиотики бесполезны при вирусных инфекциях
- Они убивают полезные бактерии в кишечнике
- Нарушается баланс микрофлоры
- Организм становится более уязвимым к инфекциям
Антибиотики назначаются только врачом при бактериальных осложнениях. Самолечение антибиотиками недопустимо.
Правила приема антибиотиков
Если врач назначил антибиотики, следует соблюдать несколько важных правил:
- Проходить полный курс лечения, не нарушая дозировку
- Принимать только назначенный препарат, не меняя его самостоятельно
- Поддерживать кишечник пробиотиками для профилактики побочных эффектов
Нарушение этих правил может привести к развитию устойчивости бактерий к антибиотикам и усугубить проблемы с микрофлорой кишечника.

Дисбактериоз как последствие приема антибиотиков
Частым последствием приема антибиотиков является дисбактериоз — нарушение баланса кишечной микрофлоры. Его симптомы:
- Диарея
- Метеоризм
- Нарушения стула
- Запоры
- Повышение температуры
- Аллергические реакции
При дисбактериозе условно-патогенные микроорганизмы начинают преобладать над полезными бактериями. Это снижает защитные функции кишечника.
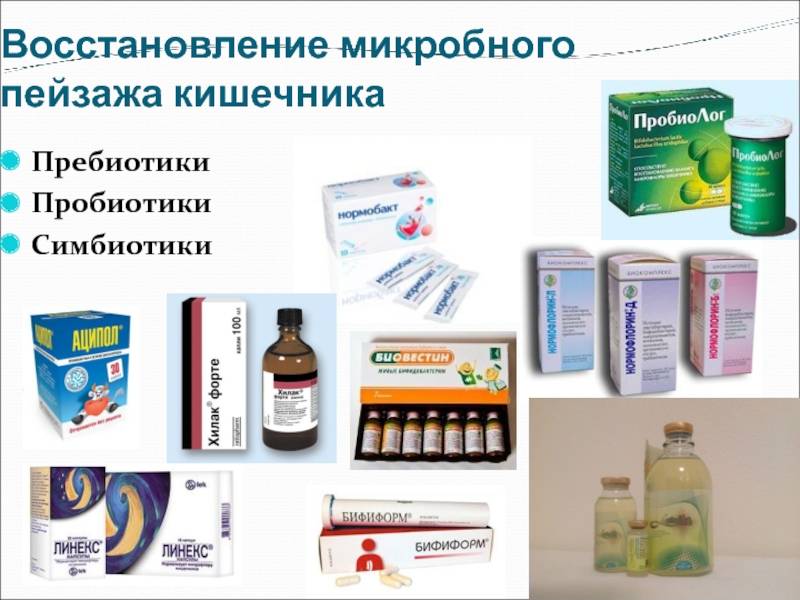
Как пробиотики и пребиотики помогают восстановить микрофлору
Для восстановления микрофлоры после антибиотиков обычно назначают пробиотики и пребиотики:
- Пробиотики — живые полезные бактерии (лактобактерии, бифидобактерии)
- Пребиотики — пищевые волокна, стимулирующие рост полезных бактерий
Пробиотики подавляют рост патогенных микробов и восстанавливают нормальный состав микрофлоры. Пребиотики служат питательной средой для роста полезных бактерий.
Правила приема пробиотиков
Чтобы пробиотики дали максимальный эффект, важно соблюдать несколько правил:
- Начинать прием одновременно с антибиотиками
- Принимать пробиотики через 3 часа после антибиотика
- Проходить курс не менее 2 недель
При соблюдении этих правил пробиотики помогут быстрее восстановить баланс микрофлоры и уменьшить побочные эффекты антибиотиков.

Новые разработки в области регуляции микробиома
Недавно FDA одобрило первый пероральный препарат для лечения микробиома — SER-109. Он представляет собой капсулы со спорами бактерий для борьбы с рецидивирующими инфекциями C. difficile:
- Препарат содержит специально подобранные штаммы бактерий
- Принимается перорально в течение 3 дней
- Эффективно предотвращает рецидивы инфекции
- Восстанавливает здоровый баланс микрофлоры
Это открывает перспективы для создания новых препаратов для регуляции микробиома при различных заболеваниях.
Влияние кишечных бактерий на метаболизм
- Подавляет способность печени окислять жирные кислоты
- Повышен у людей с ожирением и заболеваниями печени
- Снижает способность сжигать жир во время голодания
Это открытие позволяет лучше понять связь между кишечной микрофлорой, диетой и метаболизмом. В будущем это может помочь в разработке новых методов лечения ожирения через воздействие на микробиом.
Таблетка от всего Как избавить организм от вредного воздействия антибиотиков: Люди: Из жизни: Lenta.ru
Фото: Marat Safin / Diomedia
1От работы кишечника зависит здоровье
Прежде чем говорить об антибиотиках, расскажем, как работает кишечник.
В представлении большинства людей работа кишечника ограничивается пищеварением. Но, как недавно выяснили ученые, от этого органа также зависит наше эмоциональное состояние. Именно в нем вырабатывается 90-95 процентов «гормона счастья» — серотонина. А еще нервная система кишечника содержит около 100 миллионов нейронов, что позволяет ей быстро сообщать в мозг о чувстве голода или посылать сигнал тревоги после некачественной пищи.
Но что особенно важно, кишечник защищает организм от болезней. Наш организм населен огромным количеством микроорганизмов. Значительная их часть — около 100 триллионов — проживает в кишечнике. Их сообщество ученые называют микробиотой. Она среди прочего контролирует работу иммунитета, ведь 70-80 процентов иммунных клеток находятся как раз в кишечнике.
Как кишечный иммунитет и микрофлора борются с болезнями
Поверхность кишечника — потенциальные входные ворота для различных инфекций. Поэтому у кишечника развита система резистентности — устойчивости к инфекциям. Иммунитет кишечника также называют местным иммунитетом, или иммунитетом слизистых.
Нормальная микрофлора кишечника играет важную роль в поддержании баланса этой системы. Чтобы противостоять инфекциям эффективно, надо научиться распознавать их и бороться с ними. Именно нормальная микрофлора — «тренер» иммунной системы кишечника, который поддерживает ее боеспособность на случай, если в кишечник попадет опасный патогенный агрессор.
Как антибиотики влияют на микрофлору
Чтобы «помочь» иммунитету, многие люди при респираторных инфекциях пьют антибиотики.
Антибиотики были созданы для борьбы с бактериями: препараты разрушают их стенки, не давая размножаться и передвигаться по организму. А грипп и ОРВИ — хоть они и протекают по-разному — это вирусные инфекции. У вирусов нет клеточных стенок, которые мог бы взломать антибиотик. Он абсолютно бесполезен при простудных заболеваниях.
Зато в кишечнике препарат, наконец, находит поле для работы: там водится много полезных бактерий, которых антибиотик принимает за врагов. Поэтому превентивный удар антибиотиками на пятый день болезни (чтобы уберечься от осложнений) делает организм лишь более уязвимым.4
Когда на самом деле нужны антибиотики
1. Проходить курс лечения полностью, а еще не нарушать дозу и правила приема, иначе может возобновиться рост патогенов, и справиться с ними станет сложнее.

2. Пить только тот препарат, который назначен, а не менять его самовольно. В противном случае вы делаете вклад в развитие у бактерий резистентности (то есть устойчивости) к антибиотикам. А значит, в будущем может настать момент, когда микробы перестанут реагировать на лечение, что уже произошло в случае с некоторыми болезнями.
Что такое дисбактериоз кишечника
Диарея, метеоризм, нарушения стула, запоры и другие признаки — зачастую это симптомы дисбактериоза, который развивается после простуд и особенно на фоне приема антибиотиков. Это не болезнь, как раньше считалось, а состояние кишечной микробиоты, при котором условно-патогенные микроорганизмы одержали верх над полезными бактериями. В таком состоянии кишечник уже не может защищать организм от болезнетворных микробов, из-за чего, кроме проблем с пищеварением, может повыситься температура и даже возникнуть аллергические реакции на безобидные продукты.
Как кишечнику помогают пробиотики и пребиотики
Для восстановления микрофлоры после перенесенных вирусных и бактериальных инфекций обычно назначают пробиотики и пребиотики. Пробиотики — это живые бактерии и микроорганизмы, похожие на полезную микрофлору кишечника. Чаще всего это лактобактерии и бифидобактерии, которые способны подавить условно-патогенную микрофлору и не дать ей размножаться дальше. В общем, это лучшие друзья кишечника.
Пробиотики есть во всех кисломолочных продуктах. Но в препаратах они содержатся в высокой концентрации и тщательно отобраны по штаммам, поэтому их можно и нужно пить для профилактики, как и витамины.
Для поддержания баланса также важны пребиотики — клетчатка, способствующая росту полезной микрофлоры. Клетчаткой богаты отруби, зеленые листовые овощи, фрукты, ягоды, бобовые, миндальные орехи, какао, инжир.
Как правильно пить пробиотики
Пробиотики полезно пропить после каждой простуды, а при приеме антибиотиков это становится обязательным условием. Чтобы добиться максимального эффекта, стоит помнить три важных правила.
Чтобы добиться максимального эффекта, стоит помнить три важных правила.
1. Начинать курс пробиотиков и антибиотиков одновременно. Вопреки распространенному мнению, антибиотики не ослабляют действие пробиотиков. В первую очередь потому, что современные пробиотики крепко цепляются к стенкам кишечника. А еще кишечник нуждается в помощи сразу, а не тогда, когда баланс микрофлоры будет серьезно нарушен.
2. Принимать пробиотик через три часа после антибиотика. За это время повышается вероятность, что антибиотик не сможет повлиять на работу пробиотика.
В норме микрофлора восстанавливается в течение полугода. Прием пробиотиков может существенно ускорить этот процесс и успокоить недовольно ворчащий кишечник.
3. Проходить курс лечения не меньше двух недель. Чтобы микрофлора восстановилась, нужно время, за которое полезные бактерии размножатся.
В мире зарегистрировали первую таблетку из человеческих фекалий
Наука 6010
ПоделитьсяЭто свершилось! Ученые наконец-то научились делать не конфетку, а сразу таблетку из натуральных человеческих экскрементов. Первый препарат на основе отходов жизнедеятельности зарегистрирован Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Первая в мире пероральная терапия на основе фекальной микробиоты предназначена для лечения рецидивирующих инфекций бактерии Clostridioides difficile.
Препарат, в основе которого донорские человеческий фекалии, первый в истории фармакологии. Хотя сама по себе фекальная терапия известна в мире давно и вызывает немало споров. Пациенту с теми или иными проблемами ЖКТ пересаживается микробиота (содержимое кишечника) здорового человека по мере нормализации его собственной микробиоты. Впервые о таком методе лечения упоминается еще в IV веке: в Китае пациентам, которые мучились от тяжелой диареи, назначали «желтый суп». В наше время, как рассказал «МК» заведующий отделением эндоскопии УКБ №2 Первого Московского Государственного медицинского университета им И.М. Сеченова Павел Павлов, в медицинской литературе в 1958 году впервые описали успешное лечение псевдомембранозного (клостридиального) колита методом трансплантации фекальной микрофлоры (ТФМ): «Американская FDA разрешила ТФМ для лечения рецидивирующих или устойчивых к антибиотикам клостридиальных колитов в 2013 году, а в Европе это произошло в 2017 году. С тех пор началось победное шествие метода по планете».
С тех пор началось победное шествие метода по планете».
Теперь же все упрощено до таблетки, что не требует инвазивных вмешательств. Пока препарат предназначен только взрослым (с 18 лет), но, возможно, со временем получит одобрение и для педиатрической практики. Лечение одобрено лишь для инфекций, которые вызывает бактерия Clostridioides difficile, которые проходят в рецидивирующем режиме.
Чаще всего такие инфекции развиваются у пациентов, получающих антибиотикотерапию в стационарах. Считается, что прием антибиотиков нарушает баланс микрофлоры кишечника, что создает благоприятные условиях для размножения этой патогенной бактерии. Она выделяет токсины, что приводит к общей интоксикации организма и появлению таких симптомов, как боли в животе, диарея. Все это не проходит безобидно: у ряда пациентов такое инфицирование приводит к воспалительным заболеваниям кишечника (псевдомембранозному колиту), которое периодически вызывает рецидивы. Ну, а в некоторых случаях бактерия Clostridioides difficile становится даже причиной летального исхода. Ежегодно по этой причине умирает от 15 до 30 тысяч человек только в США.
Ежегодно по этой причине умирает от 15 до 30 тысяч человек только в США.
Кстати, в России всплеск заболеваемости псевдомембранозным колитом врачи фиксировали в первый год пандемии, когда пациентов с тяжелыми формами ковида буквально пичкали разными видами антибиотиков.
Одним из основных методов лечения Clostridioides difficileдо сих пор были… тоже антибиотики, правда, лишь определенной группы. Ибо к большинству известных антибиотиков она устойчива. Однако чаще всего инфицирование становится хроническим: через какое-то время после снятия симптомов болезнь рецидивирует. Пациенту вновь назначают антибиотики, что еще больше нарушает баланс кишечной микрофлоры. Новая капсула на основе донорских фекалий здорового человека, обещается, вызывать рецидивов псевдомембранозного колита не будет. Лекарство не только останавливает размножение клостридии, но и насыщает микробиом полезными микроорганизмами.
И хотя для изготовления таблетки микрофлора доноров тщательно проверяется, небольшой риск заражения патогенами остается. Как и передачи аллергенов (в случае, если донор съел какой-то продукт, на который есть аллергия у рецепиента). Эксперты называют такой способ лечения не самым приятным с эстетической точки зрения, зато дающим надежду людям с тяжелым заболеванием.
Как и передачи аллергенов (в случае, если донор съел какой-то продукт, на который есть аллергия у рецепиента). Эксперты называют такой способ лечения не самым приятным с эстетической точки зрения, зато дающим надежду людям с тяжелым заболеванием.
Как рассказывает в своей соцсети врач-фармаколог Юрий Киселев, микробиом — это совокупность микроорганизмов, более-менее постоянно обитающих в конкретной зоне нашего организма: «Микробиом не просто пассивно живет на нас как на лужайке, он выделяет огромное количество веществ как гигантская биофабрика. Если говорить о толстом кишечнике, то эти молекулы зачастую имеют малый размер, позволяющий им не только влиять на состояние слизистой кишечника, но и проникать вглубь и распространяться по организму с током крови, потенциально влияя на все органы и функции организма. По сути, эта биофабрика и есть самостоятельный орган!
Научные исследования последних 20-30 лет показали, что изменения в микробиоме толстого кишечника как-то связаны с десятками заболеваний: от аллергии и депрессии до язвенного колита и артрита. Более того, микробиом влияет и на принимаемые нами лекарства».
Более того, микробиом влияет и на принимаемые нами лекарства».
Эксперт подчеркивает, что пока в мире «никакие препараты пробиотиков (живые микроорганизмы) или пребиотиков («удобрения» для микробиома, типа инулина) не имеют убедительных доказательств. Однако в лечении хронической клостридиальной диареи — изнуряющего, тяжелого заболевания — достигнут успех за счет фекальной трансплантации содержимого толстого кишечника здорового человека в кишечник больного. Юрий Киселев рассказывает также об одном из последних исследований, когда в кишечную палочку пациента вставляют ген для производства чего-то полезного (даже лекарства), и возвращают обратно: «Так у нас получается собственное фармпроизводство в собственном кишечнике».
…В России новая фекальная капсула пока не зарегистрирована, а метода фекальной трансплантации нет даже в «Порядках оказания медицинской помощи» Минздрава РФ. Но он все же используется в научно-исследовательских учреждениях в качестве экспериментального лечения для самых трудных пациентов, кому уже не помогли длительные курсы антибиотиков. По словам доктора Павлова, в лечении рецидивирующих клостридиальных колитов метод демонстрирует высокую эффективность. Если в России появятся фекальные препараты, не требующие «танцев с бубнами» (то есть, специальных процедур по пересадке), жизнь наших пациентов существенно упростится.
По словам доктора Павлова, в лечении рецидивирующих клостридиальных колитов метод демонстрирует высокую эффективность. Если в России появятся фекальные препараты, не требующие «танцев с бубнами» (то есть, специальных процедур по пересадке), жизнь наших пациентов существенно упростится.
…Тем временем, исследователи полагают, что с помощью микробиома можно лечить более 50 специфических расстройств и заболеваний, включая сахарный диабет, воспалительные заболевания кишечника, атеросклероз, дерматит, астму и колоректальный рак. Различные исследования показывают, что медицинские решения, основанные на микробиоме, потенциально могут оказать положительное влияние на все аспекты здоровья человека и помочь вылечить людей по всему миру. Ученые вдохновлены безграничными возможностями, которые микробиом дает для прогнозирования, диагностики и лечения множества заболеваний.
Подписаться
Авторы:- org/Person»> Екатерина Пичугина
Министерство здравоохранения Владимир Павлов США Россия Китай
Что еще почитать
Что почитать:Ещё материалы
В регионах
ЧВК «Вагнер» наведались в евпаторийский клуб, где участник СВО не смог исполнить гимн РФ
67554
Крымфото: МК в Крыму
22 мая – день Николая Чудотворца, что строго запрещено в большой праздник
Фото 14262
ПсковК морю на псковскую зарплату: как в Сочи «тянут деньги» из туристов.
 Почём отдых в 2023 году
Почём отдых в 2023 годуФото 11019
ПсковСветлана Пикалёва
20 мая – старинный праздник Купальницы: что нельзя делать, чтобы не навлечь беду
Фото 4135
Псков«Появится молодая элита»: экс-депутат Владимиров предрёк изменения в Красноярском крае после ареста Егорова
2380
КрасноярскВладислав Пирогов
Парк Шереметьевых оказался порезанным на куски
2138
Московская областьЕвгения Григорьева
В регионах:Ещё материалы
FDA одобрило первую таблетку для микробиома
Пробиотики долгое время были главными ингредиентами молочных продуктов, напитков и добавок, обещая создать лучший бактериальный баланс в нашем кишечнике.
26 апреля Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) сделало шаг к формализации идеи корректировки популяций кишечных бактерий, когда оно одобрило первый пероральный препарат, предназначенный для лечения микробиома. Таблетка, названная SER-109, представляет собой коктейль из бактерий, который может предотвратить повторные инфекции бактерий C. difficile у людей, у которых были предыдущие эпизоды, и помочь им поддерживать здоровый уровень кишечных бактерий. Поддержание надлежащего баланса полезных бактерий может быть важным способом держать в страхе такие болезнетворные бактерии, как C. difficile .
FDA основывало свое решение на клинических испытаниях, которые производитель препарата, компания Seres Therapeutics, провела в сотрудничестве с Nestle Health Science с участием почти 200 человек с рецидивирующими инфекциями, вызванными C. diff . Эти инфекции легко распространяются в больницах и с трудом поддаются лечению, поскольку многие бактерии в настоящее время устойчивы к антибиотикам. По данным Центров по контролю и профилактике заболеваний США (CDC), примерно каждый шестой человек, перенесший 9Инфекция 0005 C. difficile повторится через две-восемь недель. Ежегодно в США происходит около 156 000 инфекций, вызывающих диарею, судороги, обезвоживание и лихорадку. Ежегодно от C. diff умирает от 15 000 до 16 000 человек.
По данным Центров по контролю и профилактике заболеваний США (CDC), примерно каждый шестой человек, перенесший 9Инфекция 0005 C. difficile повторится через две-восемь недель. Ежегодно в США происходит около 156 000 инфекций, вызывающих диарею, судороги, обезвоживание и лихорадку. Ежегодно от C. diff умирает от 15 000 до 16 000 человек.
В исследованиях, на которых основывалось одобрение, люди принимали по четыре капсулы SER-109 ежедневно перорально в течение трех дней, чтобы попытаться предотвратить рецидив инфекции. У 88% участников не было повторной инфекции через восемь недель после однократного курса лечения — период времени, в течение которого многие инфекции возвращаются — по сравнению с 60% тех, кто получал плацебо. Через полгода 79% тех, кто принимал SER-109, остались без повторных инфекций, в то время как только 53% получавших плацебо. Таблетки даются после того, как пациенты закончат курс антибиотиков, чтобы сначала убить как можно больше бактерий C. diff ; затем микробиотическая терапия помогает восстановить полезные бактерии.
diff ; затем микробиотическая терапия помогает восстановить полезные бактерии.
Еще от TIME
«Это потенциально может изменить способ лечения этого заболевания», — говорит Эрик Шафф, президент и главный исполнительный директор Seres.
До сих пор усилия по изменению микробиома для лечения конкретных заболеваний в основном включали фекальные трансплантаты. Исследования подтвердили идею о том, что пересадка фекалий от людей со здоровыми кишечными бактериями может посеять эти полезные бактерии в кишечнике людей с менее здоровым макияжем. Но фекальные трансплантаты, одобренные FDA в конце 2022 года для лечения C. diff — сложны в разработке и администрировании. Фекалии собирают у здоровых доноров и обрабатывают в ходе ряда этапов очистки и стерилизации, чтобы гарантировать, что от одного человека к другому передаются только желаемые популяции бактерий, а затем их вводят ректально. Однако у некоторых реципиентов инфекция развивается из-за недостаточно очищенных фекалий, и вопросы о балансе пользы и риска продолжают беспокоить этот подход.
Продукт Seres, исключающий ректальное введение, также изготавливается из пожертвованного фекального материала, который стерилизуется и обрабатывается, но в форме спор, чтобы содержать комбинацию бактерий, которые активируются только после того, как достигают кишечника. Рецепт, на совершенствование которого у компании ушло почти десять лет, включает бактерии из типа Firmicute, одной из доминирующих популяций кишечных бактерий человека. В настоящее время фекальный материал собирается у проверенных доноров в нескольких центрах Seres, и Шафф говорит, что требуется всего несколько десятков доноров, чтобы обеспечить то, что необходимо для потенциального лечения каждого случая 9 в США.0005 С. разн. .
Путь Сереса к одобрению не был гладким. После положительных первых результатов у пациентов в 2016 году второй этап испытаний компании, завершенный в 2021 году, разочаровал, показав, что большинству людей лечение не помогло. После корректировки дозы и способа тестирования пациентов на C. diff заключительная фаза тестирования на людях дала более обнадеживающие результаты. Эти результаты, которые подтверждают первоначальные данные раннего испытания, послужили основанием для одобрения FDA.
diff заключительная фаза тестирования на людях дала более обнадеживающие результаты. Эти результаты, которые подтверждают первоначальные данные раннего испытания, послужили основанием для одобрения FDA.
Одобрение открывает двери для нового класса средств для лечения микробиома, которые легко принимать и которые эффективны. Шафф говорит, что инфекции C. diff — это только начало; компания уже тестирует другую комбинацию бактерий, SER-155, которая, по-видимому, предотвращает смертельные инфекции у людей, перенесших трансплантацию органов. При правильном сочетании бактерий, способных подавлять популяции устойчивых к антибиотикам бактерий, у этих пациентов может быть больше шансов на борьбу с инфекциями и выживание их трансплантатов. «Если мы увидим тягу [с пациентами, перенесшими трансплантацию], то мы думаем, что есть возможности для лечения цирроза печени, раковой нейтропении и других состояний, при которых устойчивость к противомикробным препаратам является проблемой», — говорит Шафф.
Если данные о SER-109 и SER-155 по-прежнему будут показывать преимущества в регулировании микробиома кишечника, то к списку могут присоединиться и другие инфекции, например, инфекции мочевыводящих путей. «Это одобрение является переломным моментом для отрасли, — говорит Шафф. «У нас есть возможность лечить пациентов с инфекциями C. difficile , но это ни в коем случае не конец истории».
Свяжитесь с нами по телефону по адресу [email protected].
Ученые идентифицировали способствующий ожирению метаболит кишечных бактерий
Бактерии в нашем кишечнике настраивают наш метаболизм в зависимости от нашего рациона, и новое исследование показывает, как они это делают. Исследователи Эмори определили химическое вещество, способствующее ожирению, вырабатываемое кишечными бактериями. Химическое вещество, называемое дельта-валеробетаином, подавляет способность печени окислять жирные кислоты.
Результаты были недавно опубликованы в Nature Metabolism .
«Открытие дельта-валеробетаина дает потенциальный взгляд на то, как манипулировать нашими кишечными бактериями или нашим рационом для пользы для здоровья», — говорит соавтор Эндрю Нейш, доктор медицинских наук, профессор патологии и лабораторной медицины в Медицинской школе Университета Эмори. .
«Теперь у нас есть молекулярный механизм, который обеспечивает отправную точку для понимания нашего микробиома как связи между нашей диетой и составом нашего тела», — говорит Дин Джонс, доктор философии, профессор медицины в Медицинской школе Университета Эмори и соавтор. бумаги.
Бактериальный метаболит дельта-валеробетаин был идентифицирован путем сравнения печени мышей, содержащихся в обычных условиях, с печенью стерильных мышей, рожденных в стерильных условиях и изолированных в специальном учреждении. Дельта-валеробетаин присутствовал только у обычных мышей.
Кроме того, авторы показали, что люди, страдающие ожирением или имеющие заболевания печени, как правило, имеют более высокий уровень дельта-валеробетаина в крови. Люди с ИМТ> 30 имели уровни, которые были примерно на 40 процентов выше. Дельта-валеробетаин снижает способность печени сжигать жир во время голодания. Со временем повышенное накопление жира может способствовать ожирению.
Люди с ИМТ> 30 имели уровни, которые были примерно на 40 процентов выше. Дельта-валеробетаин снижает способность печени сжигать жир во время голодания. Со временем повышенное накопление жира может способствовать ожирению.
Определенные разновидности бактерий могут производить больше дельта-валеробетаина, чем другие, и вполне возможно, что человек, чей микробиом содержит больше этих бактерий, будет испытывать большее давление на свой метаболизм из-за подавления митохондриальной функции, — говорит Нейш.
«Есть ряд последствий, над которыми мы работаем, — говорит он.
Другой вопрос: какие факторы в рационе человека — время приема пищи или состав — способствуют более высокой выработке валеробетаина? У мышей дельта-валеробетаин способствует ожирению и накоплению жира в печени, когда мышей кормят диетой с высоким содержанием жиров и высоким содержанием сахара, типичной для людей в западных странах, но не стандартной мышиной диетой.
Дельта-валеробетаин производится из аминокислоты лизина с помощью известных микробных ферментов, поэтому диета с высоким содержанием лизина также может повышать уровень дельта-валеробетаина, говорит Нейш. Дельта-валеробетаин является предшественником ТМАО (N-оксид триметиламина), связь которого, как показали исследователи из Кливлендской клиники, с сердечно-сосудистыми заболеваниями. Авторы говорят, что необходимо дополнительно изучить влияние дельта-валеробетаина на риск сердечно-сосудистых заболеваний.
Дельта-валеробетаин является предшественником ТМАО (N-оксид триметиламина), связь которого, как показали исследователи из Кливлендской клиники, с сердечно-сосудистыми заболеваниями. Авторы говорят, что необходимо дополнительно изучить влияние дельта-валеробетаина на риск сердечно-сосудистых заболеваний.
Чувствительность нашего организма к дельта-валеробетаину, возможно, развилась как механизм, способствующий накоплению жира в условиях, когда это выгодно — когда пищи было мало, а доступ к ней был нерегулярным, — говорит Кен Лю, бывший аспирант факультета молекулярной и системной фармакологии. кто является первым автором статьи. (Лю получил докторскую степень.)
Когда Лю впервые обнаружил дельта-валеробетаин, это была относительно неизвестная молекула. С тех пор появилось несколько статей о его метаболическом значении.
«Нам нужно было выяснить его структуру и способы его синтеза, потому что мы не могли просто купить его у поставщика», — говорит он. «И мы понятия не имели, что он сделал. Мы подумали: это похоже на карнитин, поэтому он может взаимодействовать с карнитиновым челночным путем».
Мы подумали: это похоже на карнитин, поэтому он может взаимодействовать с карнитиновым челночным путем».
Карнитин, который иногда принимают в качестве пищевой добавки, действует как челнок, перенося жирные кислоты в митохондрии для использования в качестве топлива, а дельта-валеробетаин замедляет челнок. Следствием исследования команды является то, что кишечные бактерии могут влиять на то, получит ли кто-то, пытающийся похудеть, пользу от добавок карнитина.
«Этот тип информации потенциально может помочь кому-то разработать индивидуальную стратегию снижения веса», — говорит Лю. «Но есть много вещей, которые нам нужно лучше понять о том, как дельта-валеробетаин действует в контексте».
Свободных от микробов мышей помещали в ядро Emory Gnotobiotic Animal Core, а их метаболиты анализировали в интегрированном ядре метаболомики/липидомики Emory. Исследователи протестировали клинические образцы, полученные из Технического института прогнозирования здоровья Эмори-Джорджия и Центра изучения здоровья и благополучия, а также образцы из исследования трансплантации фекального микробиома.
