Каковы основные виды паразитарных заболеваний у детей. Как проявляются глистные инвазии у детей разного возраста. Какие методы диагностики паразитозов наиболее эффективны. Какие препараты используются для лечения глистных инвазий у детей. Как правильно проводить комплексную терапию паразитозов у детей.
Распространенность паразитарных заболеваний у детей
Паразитарные заболевания широко распространены среди детского населения. Наиболее частыми являются:
- Аскаридоз
- Энтеробиоз
- Лямблиоз
По данным статистики:
- В России ежегодно выявляется более 2 млн больных нематодозами
- Пораженность детей, посещающих детские учреждения, лямблиозом достигает 35%
- Доля детей в структуре заболеваемости энтеробиозом составляет 95%, аскаридозом — 65%
Высокая распространенность паразитозов у детей связана с несколькими факторами:
- Широкое распространение яиц и цист паразитов в окружающей среде
- Недостаточное развитие гигиенических навыков у детей младшего возраста
- Периоды снижения иммунной защиты в определенные возрастные периоды
- Высокая интенсивность обменных процессов в детском организме, что благоприятно для жизнедеятельности паразитов
Особенности паразитарных инвазий в разные возрастные периоды
Пики выявления паразитарных заболеваний у детей отмечаются в следующих возрастных группах:

- 2-3 года
- 4-7 лет
- 10-14 лет
Это связано с особенностями развития детского организма в эти периоды:
- Напряженность процессов адаптации
- Снижение резервов защиты
- Интенсивное влияние окружающей среды
- Повышение уровня обмена веществ для обеспечения роста
Факторы риска заражения меняются с возрастом ребенка:
- Для детей младшего возраста более значимы санитарно-гигиенические условия проживания
- Для подростков важнее социально-экономические и географические факторы (пребывание в лагере, поездки и т.д.)
Механизмы защиты организма от паразитов
Защита желудочно-кишечного тракта от паразитов включает специфические и неспецифические механизмы:
Неспецифическая защита:
- Зрелость ферментативных систем
- Кислотно-щелочной градиент в различных отделах ЖКТ
- Нормальная микрофлора кишечника
- Адекватная моторика ЖКТ
Специфическая защита:
- Эозинофилы крови
- Иммуноглобулин Е
Полноценный антипаразитарный иммунный ответ формируется у ребенка не ранее 4 лет. До этого возраста дети более восприимчивы к заражению паразитами.

Влияние паразитов на организм ребенка
Паразиты оказывают комплексное воздействие на детский организм:
Местное влияние:
- Контактное воспаление слизистой оболочки кишечника
- Стимуляция вегетативных реакций
- Нарушение процессов кишечного всасывания
- Нарушение моторики ЖКТ
- Нарушение микробиоценоза кишечника
Системное влияние:
- Использование питательных веществ в ущерб организму ребенка
- Индукция аллергических реакций
- Стимуляция аутоиммунных процессов
- Иммуносупрессивное действие
- Эндогенная интоксикация
Паразитарные инвазии часто сопровождаются:
- Аллергическим синдромом (у 71,3% детей с аскаридозом и энтеробиозом)
- Функциональными нарушениями ЖКТ (у 75,3% детей)
- Невротическими реакциями
- Нарушениями адаптации
Диагностика паразитозов у детей
Диагностика паразитарных заболеваний у детей представляет определенные сложности:
- Прямые методы обнаружения паразитов (анализ кала, соскоб) требуют многократного повторения из-за цикличности выделения яиц/цист
- Серологические методы (ИФА) обладают недостаточной специфичностью
- ПЦР-диагностика высокоспецифична, но дорога для массового применения
Важное значение имеет клинический осмотр ребенка и учет косвенных признаков паразитоза:
- Аллергический синдром
- Астенический синдром
- Полилимфаденопатия
- Нарушения кишечного всасывания
- Нарушения углеводного обмена
- Затяжное течение заболеваний ЖКТ
- Гепатоспленомегалия
Лабораторные признаки, указывающие на возможный паразитоз:
- Анемия
- Эозинофилия
- Базофилия
- Повышение уровня АСТ
При УЗИ органов брюшной полости у детей старше 3 лет косвенными признаками паразитоза могут быть:
- Гепатоспленомегалия
- Неравномерность паренхимы печени и селезенки
- Увеличение лимфоузлов в воротах селезенки
Лечение паразитарных заболеваний у детей
Лечение глистных инвазий у детей должно быть комплексным и включать:
- Применение специфических антигельминтных препаратов
- Коррекцию нарушенных функций ЖКТ
- Энтеросорбцию
- Витаминотерапию
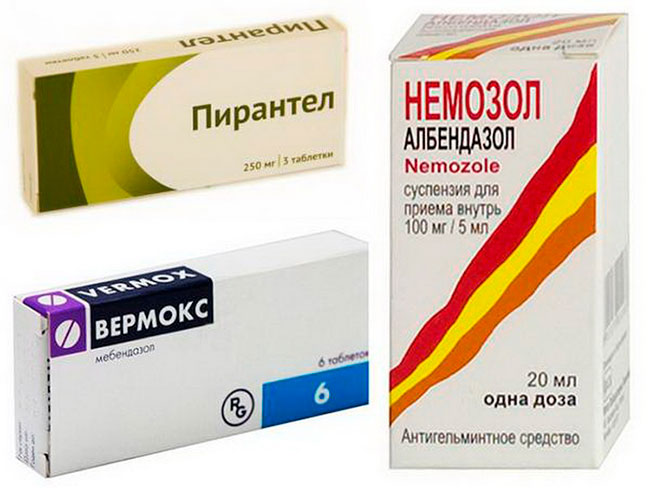
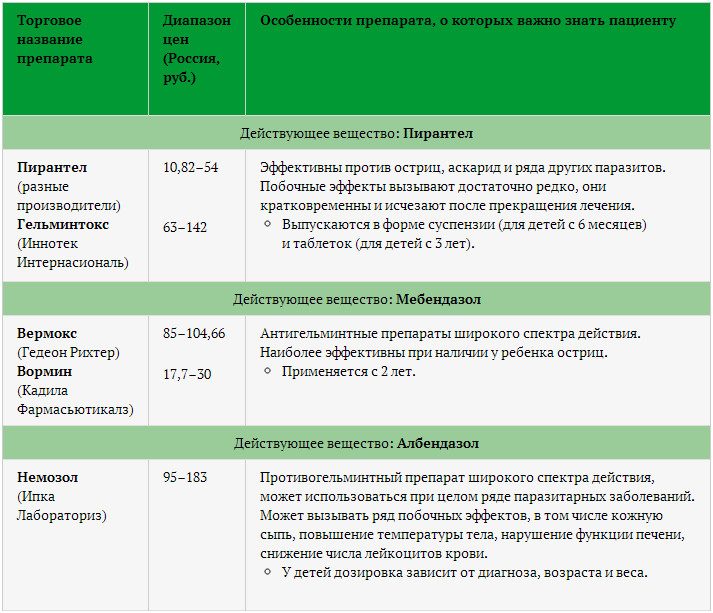
Препараты для лечения основных паразитозов у детей:
Аскаридоз:
- Вермокс (мебендазол) — с 2 лет, по 100 мг 2 раза в день 3 дня
- Пирантел — 10 мг/кг однократно
- Немозол (альбендазол) — с 2 лет, 400 мг однократно
Энтеробиоз:
- Вермокс — 100 мг однократно
- Пирантел — 10 мг/кг однократно
- Немозол — 400 мг однократно
Лямблиоз:
- Орнидазол — 25-30 мг/кг в 2 приема 5 дней
- Макмирор (нифурател) — 15 мг/кг 2 раза в день 7 дней
- Немозол — 15 мг/кг 1 раз в день 5-7 дней
Коррекция нарушенных функций ЖКТ:
- Ферментные препараты
- Пробиотики
- Желчегонные средства при лямблиозе
Энтеросорбция:
Применение энтеросорбентов помогает связать и вывести токсины, образующиеся при гибели паразитов.
Витаминотерапия:
Важным условием успешного лечения энтеробиоза является одновременное лечение всех членов семьи и строгое соблюдение гигиенического режима для предотвращения реинвазии.
Принципы комплексной терапии паразитозов у детей
В педиатрической клинике МОНИКИ разработаны следующие принципы лечения паразитарных заболеваний у детей:
- Применение специфических антипаразитарных препаратов с учетом вида возбудителя
- Коррекция нарушенных функций ЖКТ (ферментопатия, дисбиоз, моторные нарушения) курсами ферментных препаратов и пробиотиков
- Обязательное назначение энтеросорбентов
- Применение поливитаминных комплексов с микроэлементами
Данный комплексный подход позволяет:
- Эффективно элиминировать паразитов
- Предотвратить развитие функциональных нарушений ЖКТ
- Избежать формирования органической патологии
- Снизить риск реинвазии
Профилактика паразитарных заболеваний у детей
Основные меры профилактики глистных инвазий у детей включают:
- Соблюдение правил личной гигиены
- Мытье рук перед едой и после посещения туалета
- Тщательное мытье овощей и фруктов
- Термическая обработка мяса и рыбы
- Борьба с мухами и тараканами
- Регулярная уборка и проветривание помещений
- Профилактическая дегельминтизация домашних животных
- Санитарно-просветительская работа среди населения
Важное значение имеет своевременное выявление и лечение заразившихся детей, а также обследование контактных лиц для предотвращения распространения инвазии.
Заключение
Паразитарные заболевания остаются актуальной проблемой детского возраста. Своевременная диагностика и правильно проведенное комплексное лечение позволяют эффективно избавить ребенка от паразитов и предотвратить развитие осложнений. Необходимо повышать настороженность врачей в отношении паразитозов и проводить активную профилактическую работу среди населения.

Особенности терапии при паразитарных инвазиях у детей | #10/13
Паразитарное заболевание — развитие болезненных симптомов в результате жизнедеятельности гельминта или простейших в организме человека [1]. Основной фактор выживания и распространения паразитов — их необычайно высокая репродуктивная способность, а также постоянно совершенствующиеся механизмы приспособления к обитанию в теле человека. К сожалению, настороженность медицинских работников в отношении паразитарных заболеваний у населения в настоящее время чрезвычайно низка, а профилактика гельминтозов сведена к лечению выявленных инвазированных пациентов [12, 13]. Вместе с тем многие исследователи отмечают связь широкой распространенности паразитозов у детского населения с развитием функциональной патологии органов пищеварения на фоне нарушений регуляции и высокий риск формирования хронических заболеваний даже при условии естественной санации ребенка с течением времени.
Самые распространенные и изученные заболевания — аскаридоз, энтеробиоз (рис. 1) и лямблиоз — регистрируются повсеместно. В России ежегодно выявляется более 2 млн больных нематодозами. При оценке территориального распределения лямблиоза по России установлено, что самый высокий средний уровень показателей заболеваемости в течение многих лет отмечен в Санкт-Петербурге, причем пораженность детей, посещающих детские учреждения, составляет 35% [2].
1) и лямблиоз — регистрируются повсеместно. В России ежегодно выявляется более 2 млн больных нематодозами. При оценке территориального распределения лямблиоза по России установлено, что самый высокий средний уровень показателей заболеваемости в течение многих лет отмечен в Санкт-Петербурге, причем пораженность детей, посещающих детские учреждения, составляет 35% [2].
Каждый человек в течение жизни неоднократно переносит различные паразитарные заболевания [9]. В детском возрасте паразитозы встречаются чаще. У детей раннего возраста (до 5 лет) этому способствует широкая распространенность репродуктивного материала паразитов (цисты, яйца, личинки (рис. 2)) в окружающей среде и недостаточное развитие гигиенических навыков.
Имеют значение и периоды транзиторного ослабления иммунной защиты слизистых оболочек пищеварительного тракта. Пики выявленных паразитарных заболеваний у детей отмечаются в возрасте 2–3 года, в 4–7 лет, в 10–14 лет. В структуре заболеваемости доля детей младшего возраста и школьников достигает 95% среди всех зарегистрированных больных энтеробиозом и 65% — среди больных аскаридозом [1].
Для этих периодов жизни ребенка характерна напряженность процессов адаптации и уменьшение резервов защиты наряду с интенсивным влиянием окружающей среды. Сопоставление значимости критериев, определяющих особенности выделенных возрастных отрезков (массоростовые «скачки», критические периоды развития иммунной системы, пики первичной заболеваемости), позволяет в первую очередь выделить возрастающий в это время в организме ребенка уровень обмена веществ, направленный на обеспечение массо-ростового спурта. Это условие выгодно для паразитов, так как основная задача их жизнедеятельности — выработка огромного количества репродуктивного материала (яйца, цисты), что также в первую очередь требует очень высокой интенсивности обменных процессов. Например, при лямблиозе в 1 г фекалий больного человека выделяется до 12 млн цист [4, 8].
Значимость определенных факторов риска меняется в соответствии с возрастом ребенка. Доказано, что для детей младшего возраста более значимы санитарно-гигиенические условия проживания, а для подростков при сборе анамнеза необходимо уделить внимание социально-экономическим и географическим факторам (пребывание в лагере, туристическая поездка, наличие младшего брата или сестры) (рис. 3).
3).
Транзиторное снижение противоинфекционного иммунитета как фактор риска возникновения паразитоза у детей регистрируется также в период реконвалесценции после вирусных заболеваний, вызываемых вирусами герпетической группы (цитомегаловирус, вирус простого герпеса I и II, вирус Эпштейна–Барр), может возникать в результате ятрогении (применение иммуносупрессивной терапии при аллергических и аутоиммунных заболеваниях). В настоящее время значимая доля детей находится в состоянии дезадаптации, которое также сопровождается снижением иммунной защиты.
Иммунную защиту желудочно-кишечного тракта (ЖКТ) ребенка можно условно разделить на специфическую и неспецифическую. К неспецифической защите относят комплекс условий нормального пищеварения: зрелость ферментативных систем, обеспечение кислотно-щелочного градиента в различных отделах ЖКТ, деятельность нормальной микрофлоры, адекватную моторику.
В ряде случаев возможно нарушение неспецифической защиты. Например, зрелость ферментных систем зависит от биологического возраста ребенка, который не всегда совпадает с паспортным. Нередко этот так называемый феномен отсроченного ферментативного старта входит в фенотип ребенка с диффузной дисплазией соединительной ткани. Данный фенотип может включать также следующие определенные признаки: аномалии развития ушной раковины, «готическое» небо, эпикант, гипертелоризм, синдром гипермобильности суставов, малые аномалии развития сердца, желчного пузыря и пр. Существующая у такого ребенка функциональная недостаточность ферментных систем сочетается с изменением эластичности и прочности стенки ЖКТ, формируя предрасположенность к возникновению функциональных нарушений органов пищеварения. Проведенные исследования доказали, что у детей с количеством вышеуказанных малых аномалий развития более 5 в 78% случаев отмечаются паразитарные инвазии, тогда как в контрольной группе частота встречаемости паразитозов составила менее 45% [3, 6].
Нередко этот так называемый феномен отсроченного ферментативного старта входит в фенотип ребенка с диффузной дисплазией соединительной ткани. Данный фенотип может включать также следующие определенные признаки: аномалии развития ушной раковины, «готическое» небо, эпикант, гипертелоризм, синдром гипермобильности суставов, малые аномалии развития сердца, желчного пузыря и пр. Существующая у такого ребенка функциональная недостаточность ферментных систем сочетается с изменением эластичности и прочности стенки ЖКТ, формируя предрасположенность к возникновению функциональных нарушений органов пищеварения. Проведенные исследования доказали, что у детей с количеством вышеуказанных малых аномалий развития более 5 в 78% случаев отмечаются паразитарные инвазии, тогда как в контрольной группе частота встречаемости паразитозов составила менее 45% [3, 6].
Отдельно необходимо отметить, что для такого заболевания, как лямблиоз, предрасполагающим фактором инвазии является нерегулярное и недостаточное отделение желчи в кишечник при аномалиях развития желчного пузыря (перетяжки, перегибы). Лямблиоз, выявленный у пациентов педиатрического отделения МОНИКИ, в 100% случаев сопровождался дисфункцией билиарного тракта.
Лямблиоз, выявленный у пациентов педиатрического отделения МОНИКИ, в 100% случаев сопровождался дисфункцией билиарного тракта.
У детей в восстановительном периоде после острых кишечных инфекций, после массивной антибиотикотерапии, а также у пациентов с хронической патологией органов пищеварения сопутствующие нарушения ферментного обеспечения, нормофлоры и моторики кишечника также делают ЖКТ более уязвимым для паразитов (рис. 4).
Специфическая защита слизистой оболочки органов пищеварения зависит от возраста ребенка и его зрелости. Механизм специфической иммунной защиты является одной из наиболее древних систем организма, так как гельминтозы сопровождают человечество в течение многих тысячелетий. Этот механизм представлен прежде всего эозинофилами крови и иммуноглобулином Е.
Классический развернутый антипаразитарный ответ может быть сформирован у ребенка не ранее достижения им 4 лет и тесно связан с качеством и количеством IgE, созревающего к этому возрасту. При контакте организма с паразитом в первую очередь выделяются медиаторы воспаления: интерлейкин, лейкотриен С4, D4, простагландины, тромбоксаны. Увеличивается количество лимфоцитов, продуцирующих IgM и IgG. В клиническом анализе крови отмечается рост уровня эозинофилов и базофилов, связанный с увеличением содержания этих клеток в тканях инвазированного органа. Встречаясь с личинками паразита, тканевые базофилы выделяют гепарин и гистамин, которые в сочетании с лейкотриенами и другими медиаторами воспаления вызывают общие проявления: зуд, реактивный отек, гиперемию, а также могут спровоцировать общие проявления: бронхоспазм, проявления крапивницы или диарею. Аллергическое воспаление при паразитозах развивается по классическому пути и призвано создать условия, приводящие к гибели и/или элиминации паразита [5].
Увеличивается количество лимфоцитов, продуцирующих IgM и IgG. В клиническом анализе крови отмечается рост уровня эозинофилов и базофилов, связанный с увеличением содержания этих клеток в тканях инвазированного органа. Встречаясь с личинками паразита, тканевые базофилы выделяют гепарин и гистамин, которые в сочетании с лейкотриенами и другими медиаторами воспаления вызывают общие проявления: зуд, реактивный отек, гиперемию, а также могут спровоцировать общие проявления: бронхоспазм, проявления крапивницы или диарею. Аллергическое воспаление при паразитозах развивается по классическому пути и призвано создать условия, приводящие к гибели и/или элиминации паразита [5].
Вместе с тем эозинофилы обладают выраженным цитотоксическим потенциалом, превышающим возможности других клеток крови, что объясняет первостепенное значение эозинофилов в антипаразитарных реакциях и их повреждающую роль при аллергии. Основное действие эозинофилы оказывают в барьерных тканях. В очаге инвазии они дегранулируют, оказывая гельминтотоксическое и цитотоксическое действие. Белки эозинофильных гранул (большой основной протеин, эозинофильная пероксидаза, эозинофильный катионный протеин, эозинофил-производный нейротоксин) токсичны не только для паразита, но и для клеток организма ребенка. Еще одной из важных причин системных и органных поражений, сопутствующих паразитозам, является образование иммунных комплексов [9, 10].
Белки эозинофильных гранул (большой основной протеин, эозинофильная пероксидаза, эозинофильный катионный протеин, эозинофил-производный нейротоксин) токсичны не только для паразита, но и для клеток организма ребенка. Еще одной из важных причин системных и органных поражений, сопутствующих паразитозам, является образование иммунных комплексов [9, 10].
Действие паразитов на организм ребенка осуществляется с вовлечением многих систем. Практически все их виды могут вызывать сдвиг соотношения Th2/Th3 клеток в направлении, благоприятном для их выживания. Описаны случаи, когда продукты выделения паразита оказывали гормоноподобное действие на организм хозяина [5].
Местное влияние паразиты осуществляют, вызывая контактное воспаление слизистой оболочки и стимулируя вегетативные реакции. При этом нарушаются процессы кишечного всасывания, адекватная моторика ЖКТ и его микробиоценоз.
Системное влияние оказывается за счет использования паразитом энергетического и пластического потенциала пищи в ущерб организму ребенка, индукции аллергии и аутоиммунных процессов, целенаправленной иммуносупрессии и эндогенной интоксикации. Проведенными исследованиями показано, что аллергический синдром сопутствует аскаридозу и энтеробиозу в 71,3% случаев. Среди детей с атопическим дерматитом паразитозы выявляются у 69,1%, при этом лямблиоз из числа всех инвазий составляет 78,5% [4].
Проведенными исследованиями показано, что аллергический синдром сопутствует аскаридозу и энтеробиозу в 71,3% случаев. Среди детей с атопическим дерматитом паразитозы выявляются у 69,1%, при этом лямблиоз из числа всех инвазий составляет 78,5% [4].
Особенно узнаваемую клиническую картину формирует токсокароз (рис. 5). Клиническими маркерами этой инвазии являются лейкемоидная реакция эозинофилов (от 20% и выше эозинофилов в формуле крови), сопровождающая ярко и упорно протекающий аллергический синдром в виде атопического дерматита с выраженным зудом и резистентностью к традиционной терапии или тяжелую бронхиальную астму с частыми приступами.
В 75,3% случаев паразитозы сопровождаются разнообразными функциональными нарушениями со стороны ЖКТ. Рядом работ доказано, что паразитарная инвазия способна вызывать нарушения углеводного обмена, а также дисахаридазную недостаточность за счет снижения уровня лактазы [7, 9].
Паразитарные инвазии, как правило, сопровождаются невротическими реакциями различной степени выраженности, в частности, лямблии недаром называют «паразитами тоски и печали».
У большинства детей нарушения адаптации являются одним из важных звеньев патогенетического процесса при паразитозе. Следует отметить, что состояние дезадаптации затрагивает в первую очередь лимфоцитарное звено иммуногенеза, что не может не сказываться на созревании и дифференцировке специфического иммунитета.
Диагностика паразитозов
До настоящего времени ведется поиск простого, доступного и надежного метода диагностики паразитозов. Разработанные методики прямого визуального обнаружения требуют минимальной экспозиции диагностического материала, многократных повторных исследований. Известные способы диагностики глистных инвазий и протозоозов, такие как метод толстого мазка фекалий по Като, метод формалин-эфирного осаждения, перианальный соскоб, микроскопия пузырной и печеночной желчи, имеют ряд недостатков, связанных как с особенностями развития паразита, так и с состоянием макроорганизма и его реактивностью.
Вместе с тем затраченные усилия могут быть бесполезными, если исследование проводится в период паузы выработки цист или яиц. Например, неинформативность перианального соскоба при 1–2-кратном методе обследования обусловлена периодичностью яйцекладки самками остриц. Особенность выделения цист лямблиями получила название «феномен прерывистого цистовыделения», при котором фазы массивного выделения цист заменяются отрицательной фазой, которая может длиться от 2–3 суток до 2–3 недель. В этот период обнаружить лямблии в кале невозможно.
Например, неинформативность перианального соскоба при 1–2-кратном методе обследования обусловлена периодичностью яйцекладки самками остриц. Особенность выделения цист лямблиями получила название «феномен прерывистого цистовыделения», при котором фазы массивного выделения цист заменяются отрицательной фазой, которая может длиться от 2–3 суток до 2–3 недель. В этот период обнаружить лямблии в кале невозможно.
Непрямые методы исследования (определение специфических антител) обладают недостаточной специфичностью и достоверностью. Известно, например, что, проходя сложный цикл развития от яйца до взрослого состояния, гельминты меняют свой антигенный состав. Антитела в организме хозяина вырабатываются в основном в ответ на поступление экскретов и секретов гельминта, тогда как в иммунодиагностических реакциях используются соматические антитела. Возникающая неспецифическая сенсибилизация организма, общность некоторых антигенов трематод, простейших и человека создают высокий удельный вес ложноположительных серологических реакций в титрах ниже достоверно диагностических. Таким образом, исследование методом иммуноферментного анализа (ИФА) на гельминты является высокочувствительным, но низкоспецифичным методом. Определение паразитов методом полимеразной цепной реакции (ПЦР) является высокоспецифичным и высокочувствительным методом, но из-за дороговизны и сложности не может быть скрининговым, когда, например, нужно обследовать группу детей из детского учреждения.
Таким образом, исследование методом иммуноферментного анализа (ИФА) на гельминты является высокочувствительным, но низкоспецифичным методом. Определение паразитов методом полимеразной цепной реакции (ПЦР) является высокоспецифичным и высокочувствительным методом, но из-за дороговизны и сложности не может быть скрининговым, когда, например, нужно обследовать группу детей из детского учреждения.
Не теряет своей актуальности клинический осмотр ребенка и внимательный учет косвенных признаков паразитоза. Важно отметить возможность течения паразитоза при аллергическом и астеническом синдроме, полилимфаденопатии неясного генеза, при нарушениях кишечного всасывания, углеводного обмена, при затяжном и хроническом течении болезней пищеварительного тракта, гепатоспленомегалии неясного генеза. Течение паразитарной инвазии имеет клинические особенности: обычно признаки поражения минимизированы, заболевание носит стертый характер, обострения полиморфны и неярки. Особенностью обострений заболеваний данной группы является их цикличность с периодом в 11–15 дней.
Косвенными лабораторными признаками паразитоза могут быть анемия, базофилия, эозинофилия, увеличение уровня аспартатаминотранферазы (АСТ).
Кроме того, признаки возможной паразитарной инвазии следует учитывать при оценке результатов инструментального исследования. При ультразвуковом исследовании органов брюшной полости у ребенка старше 3 лет косвенными признаками паразитоза являются гепатоспленомегалия, неравномерность паренхимы печени и селезенки за счет мелких гиперэхогенных сигналов, увеличенные лимфатические узлы в воротах селезенки.
Паразитарная инвазия определяет внешний вид и жалобы ребенка. Обычно это эмоционально лабильный и тревожный ребенок с сухими бледными кожными покровами, с признаками нарушения регенерации кожи и слизистых оболочек, с полилимфаденопатией, аденоидными вегетациями II–III степени, «заедами» в углах рта, «географическим» языком, со сниженным или избирательным аппетитом, часто с неустойчивым стулом. Отмечаются и различные проявления аллергического синдрома в виде рецидивирующей крапивницы, упорного течения атопического дерматита либо бронхообструктивного синдрома.
Лечение гельминтозов
Лечение гельминтозов должно начинаться с применения специфических антигельминтных препаратов. Современный арсенал лекарственных средств, используемых для лечения кишечных паразитозов, включает значительное количество препаратов различных химических классов [11]. Они применяются как в клинической практике для лечения выявленных больных, так и с целью массовой профилактики.
Определяя препарат для специфической противопаразитарной терапии, следует понимать, что спектр действия этих препаратов не особенно широк. Практически все препараты этой группы применяются многие десятки лет и целесообразно предположить, что паразиты выработали системы приспособления и заболевание может быть резистентным к проводимой терапии. По данным Г. В. Кадочниковой (2004), эффективность такого традиционного препарата, как Декарис, в современных условиях не достигает 57%. Кроме того, эта группа противопаразитарных средств, к сожалению, имеет ряд побочных эффектов: тошноту, рвоту, абдоминальный синдром.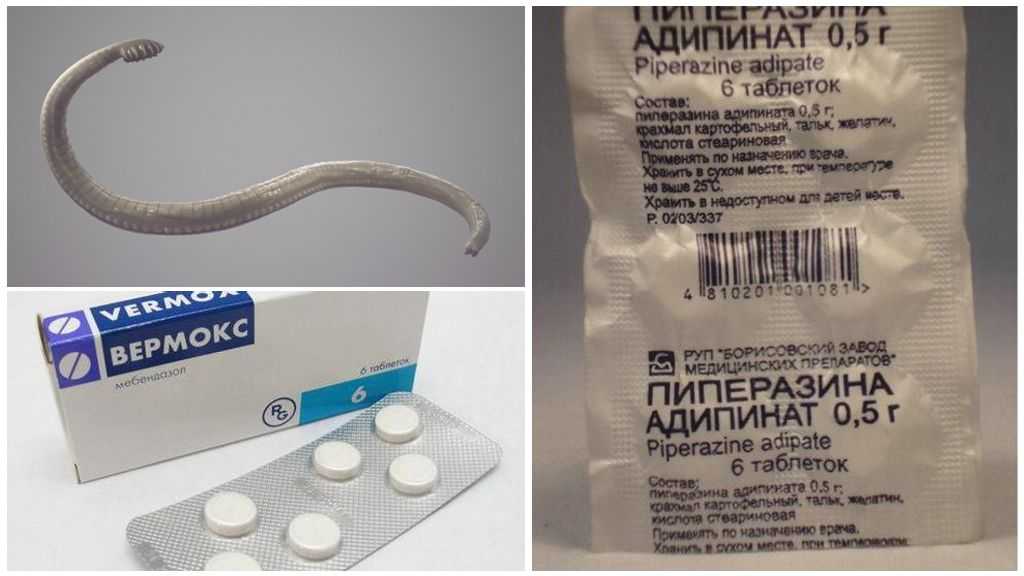
Таким образом, в современных условиях следует отдавать предпочтение более современным препаратам, которые, во-первых, являются универсальными для лечения как нематодозов, так и смешанных глистных инвазий и активны в отношении такого распространенного паразита, как лямблия. Во-вторых, использование одного противопаразитарного препарата, а не их комбинации, ощутимо снижает риск неприятных побочных эффектов. На сегодняшний день единственный представитель этой группы в нашей стране — альбендазол (Немозол).
Для лечения аскаридоза у детей старшего возраста или при рецидивировании заболевания в настоящее время под наблюдением врача может быть применен комбинированный прием антигельминтных средств (например, альбендазол в течение трех дней, затем — Вермокс в течение трех дней). Непременным условием успешной дегельминтизации больных энтеробиозом являются одновременное лечение всех членов семьи (коллектива) и строгое соблюдение гигиенического режима для исключения реинвазии. Следует отметить, что важное значение имеет ежедневная влажная уборка, так как были описаны казуистические случаи распространения репродуктивного материала остриц на частичках пыли на высоту до 1,5 метра.
Лечение лямблиоза предусматривает обязательную диету с ограничением потребления легкоусвояемых углеводов, увеличением доли белка в пище, употреблением «закисляющих» продуктов (отвары брусники, клюквы), использование желчегонных отваров и препаратов.
В педиатрической клинике МОНИКИ разработаны принципы терапии паразитозов, учитывающие особенности патогенеза инвазии и позволяющие качественно и надежно вылечить данную группу заболеваний. Благодаря применению разработанной схемы терапии удается эффективно предотвратить реинвазию и развитие функциональных нарушений органов пищеварения у детей.
Принципы терапии больных паразитозами
1. Прием антипаразитарных препаратов проводится с учетом вида возбудителя инвазии.
Препараты, применяемые в лечениии аскаридоза:
- Вермокс (мебендазол) (для детей с 2 лет) — по 100 мг 2 раза в сутки в течение 3 дней;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.

Препараты, применяемые в лечении энтеробиоза:
- Вермокс (мебендазол) (для детей с 2 лет) — 100 мг однократно;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении лямблиоза:
- орнидазол 25–30 мг/кг (если масса тела больше 35 кг — 1000 мг) в два приема в течение 5 дней, 1 день — 1/2 дозы, повторный курс через 7 дней;
- Макмирор (нифурател) — по 15 мг/кг 2 раза в сутки в течение 7 дней;
- Немозол (альбендазол) — по 15 мг/кг однократно в течение 5–7 дней.
2. Лечение паразитоза предусматривает измененные в результате жизнедеятельности паразитов свойства пищеварительного тракта ребенка (функциональные нарушения органов пищеварения, ферментопатия, изменение микробиоценоза) и их коррекцию курсами ферментных препаратов и синбиотиков (табл. 1).
3. Обязательное применение энтеросорбентов и комплекса поливитаминов с микроэлементами (табл. 2 и 3).
2 и 3).
Таким образом, разработанные в клинике педиатрии МОНИКИ принципы комплексной терапии паразитозов у детей предусматривают поэтапное восстановление функционального состояния ЖКТ, нарушенного в результате местного и системного влияния паразитов. Применение комплексной терапии позволяет предотвратить дальнейшее развитие функциональных нарушений с формированием органической патологии, а также избежать реинвазии.
Литература
- Авдюхина Т. И., Константинова Т. Н. и др. Энтеробиоз. Клиника, диагностика, лечение, эпидемиология, профилактика: Учеб. пособие для врачей. М., 2003. 56 с.
- Благова Н. Н. Некоторые факторы иммунитета у больных аскаридозом и энтеробиозом на фоне лечения албендазолом: Автореф. дис. … канд. мед. наук. СПб, 1997. 24 с.
- Гельминтозы человека / Под редакцией проф. В. И. Лучшева, д.м.н. В. В. Лебедева; пособие для врачей. Краснодар. Советская Кубань, 1998; 124.
- Ахметова Р.
 А., Туперцева Г. Т. и др. Диагностика, лечение и профилактика лямблиозной инвазии у детей с хроническими болезнями органов пищеварения: метод. рекомендации. Уфа: Изд-во БГМУ, 2008. 48 с.
А., Туперцева Г. Т. и др. Диагностика, лечение и профилактика лямблиозной инвазии у детей с хроническими болезнями органов пищеварения: метод. рекомендации. Уфа: Изд-во БГМУ, 2008. 48 с. - Изачик Ю. А., Изачик Н. А. Иммунология желудочно-кишечного тракта в норме и при патологических состояниях. В: Иммунология и иммунопатология детского возраста / Д. В. Стефани, Ю. Е. Вельтищев. М.: Медицина, 1996. С. 327–351.
- Кадочникова Г. В. Аскаридоз у детей, совершенствование диагностики и лечения. Автореф. канд. дисс. Пермь, 2004.
- Копанев Ю. А., Соколов А. Л. Дисбактериоз у детей. М.: ОАО «Издательство «Медицина», 2008. 128 с.
- Коровина Н. А., Захарова И. Н. и др. Диагностика и лечение лямблиоза у детей. Пособие для врачей. М., 2006. 52 с.
- Лысенко А. Я., Владимова М. Г., Кондрашин А. В., Майори Дж. Клиническая паразитология. Под общей ред. Лысенко А. Я. Руководство. Женева, ВОЗ: 2002.
 752 с.
752 с. - Маркин А. В. Вопросы профилактики важнейших гельминтозов в России // Журн. микробиол. 1995. № 1. С. 106–108.
- Озерецковская Н. Н., Зальнова Н. С., Тумольская Н. И. Клиника и лечение гельминтозов. Л., Медицина, 1985.
- Профилактика паразитарных болезней на территории Российской Федерации; Санитарные правила и нормы. М.: Информационно-издательский центр Минздрава России, 1997; 168.
- Эпидемиологический надзор за паразитарными болезнями. Методические указания. М., 2005. 82 с.
Л. И. Васечкина1, кандидат медицинских наук
Т. К. Тюрина, кандидат медицинских наук
Л. П. Пелепец, кандидат биологических наук
А. В. Акинфиев, кандидат медицинских наук
ГБУЗ МО МОНИКИ им. М. Ф. Владимирского, Москва
1 Контактная информация: rimmoniki@mail. ru
ru
Принципы и современные тенденции лечения эхинококкоза печени
Роль паразитов в структуре заболеваемости населения Российской Федерации в последние годы неуклонно возрастает. Все чаще эхинококкоз встречается в неэндемичных очагах, где врачи не знакомы или мало знакомы с основными принципами его диагностики и лечения, что нередко приводит к позднему выявлению заболевания и к досадным ошибкам в лечении. Эти факты заставляют уделять более пристальное внимание проблеме эхинококковой инвазии. Ведь помимо того, что страдают, как правило, молодые трудоспособные люди, а также дети, более чем 2/3 пациентов требуется хирургическое лечение. К сожалению, остается высокой частота рецидивов заболевания, что вызывает вполне понятную неудовлетворенность хирургов результатами лечения этой категории больных [2, 4, 8]. В этой работе мы ставили своей целью обсудить основные особенности развития эхинококка и соответственно течения заболевания, а также важные моменты хирургического и консервативного лечения инвазии.
Возбудителем эхинококкоза является цепень Echinococcus granulosus, который паразитирует на плотоядных животных. Эхинококкоз относится к тяжелым паразитарным заболеваниям и в своем развитии всегда проходит стадию формирования кист. Эхинококкоз человека и животных одинаков, и для полного развития паразита обязательно необходим промежуточный хозяин.
Промежуточные хозяева паразита — человек и сельскохозяйственные животные. Окончательные хозяева, например собаки, заражаются, поедая внутренности животных с эхинококковыми кистами. Содержащиеся в кисте зародышевые элементы (протосколексы и ацефалоцисты) прикрепляются к стенке тонкой кишки животного и вырастают во взрослые особи. Созревшие членики, содержащие 400—800 онкосфер, отрываются от брюшка протосколекса; инфицированные фекалии собак загрязняют траву, землю; яйца попадают в кишечник овец, свиней, верблюдов или человека, на шерсть собак. Человек может заразиться, гладя собаку, употребляя в пищу загрязненные овощи. Важно понимать, что роль мясных продуктов минимальна, так как и человек, и сельскохозяйственные животные являются промежуточными хозяевами, а термическая обработка мяса практически всегда приводит к гибели паразита. Возможность заражения через мясо играет роль только у лиц, занятых убоем скота, разделкой мяса и шкур [2, 4, 8].
Важно понимать, что роль мясных продуктов минимальна, так как и человек, и сельскохозяйственные животные являются промежуточными хозяевами, а термическая обработка мяса практически всегда приводит к гибели паразита. Возможность заражения через мясо играет роль только у лиц, занятых убоем скота, разделкой мяса и шкур [2, 4, 8].
Распространенное даже среди некоторых медицинских работников мнение о возможности заражения здорового человека от больного в корне неверно. В работе с заразившимися эхинококкозом и их окружением стоит обращать особое внимание на такого рода разъяснительные беседы, поскольку часто таких пациентов зачем-то изолируют. Однако, сталкиваясь со случаем заражения эхинококкозом одного из членов семьи, всегда имеет смысл обследовать и остальных. Это связано не с тем, что они заражают друг друга, а с тем, что члены одной семьи вместе могли употребить пищу, уже содержавшую яйца эхинококка.
После попадания яйца эхинококка (онкосферы) в организм промежуточного хозяина происходит следующее. Онкосферы покрыты оболочкой, которая растворяется под действием желудочного сока. Высвободившиеся паразиты пробуравливают слизистую оболочку кишечника и через систему воротной вены попадают в печень, где развиваются в зрелую кисту. Большинство паразитов задерживается в печеночных синусоидах, поэтому 70% эхинококковых кист формируются именно в печени. Отдельные яйца проходят через печень и, минуя сердце, задерживаются в легочном капиллярном русле, что приводит к образованию легочных кист (15—20%). Эхинококковое поражение сердца также возможно, но отмечается довольно редко — менее чем у 0,5% больных. Это связывают с высокой скоростью потока крови через орган. При попадании паразита в большой круг кровообращения образуются кисты (10—15%) в селезенке, головном и костном мозге и т. д. Как казуистические описаны наблюдения изолированного эхинококкоза подкожной клетчатки ног, связки матки, глаза, щитовидной и поджелудочной желез [1, 3, 7]. Таким образом, при подозрении на эхинококкоз в первую очередь целесообразно обследовать первый орган-мишень печень, а затем легкие.
Онкосферы покрыты оболочкой, которая растворяется под действием желудочного сока. Высвободившиеся паразиты пробуравливают слизистую оболочку кишечника и через систему воротной вены попадают в печень, где развиваются в зрелую кисту. Большинство паразитов задерживается в печеночных синусоидах, поэтому 70% эхинококковых кист формируются именно в печени. Отдельные яйца проходят через печень и, минуя сердце, задерживаются в легочном капиллярном русле, что приводит к образованию легочных кист (15—20%). Эхинококковое поражение сердца также возможно, но отмечается довольно редко — менее чем у 0,5% больных. Это связывают с высокой скоростью потока крови через орган. При попадании паразита в большой круг кровообращения образуются кисты (10—15%) в селезенке, головном и костном мозге и т. д. Как казуистические описаны наблюдения изолированного эхинококкоза подкожной клетчатки ног, связки матки, глаза, щитовидной и поджелудочной желез [1, 3, 7]. Таким образом, при подозрении на эхинококкоз в первую очередь целесообразно обследовать первый орган-мишень печень, а затем легкие.
Из зародыша эхинококка в течение нескольких месяцев развивается материнская киста, представляющая собой пузырь, заполненный жидкостью. Стенка эхинококковой кисты состоит из двух оболочек: наружной кутикулярной и внутренней герминативной (зародышевой). Кутикулярная и герминативная оболочки макроскопически представлены единой капсулой, поэтому чаще всего они фигурируют под единым понятием «хитиновая оболочка». Снаружи эхинококковая киста окружена плотной соединительнотканной фиброзной капсулой, образующейся из тканей органа в результате защитной реакции промежуточного хозяина против продуктов метаболизма паразита [3].
Диагностика эхинококкозаВ раннем периоде эхинококкоз протекает практически бессимптомно. В связи с этим больные зачастую обращаются за медицинской помощью, когда паразитарная киста достигает значительных размеров, сдавливая соседние органы, или в связи с прорывом кисты в плевральную полость или в бронхи и т. д.
д.
Решающее значение в диагностике ранних стадий, а также в качестве подтверждающего метода при наличии радиологических признаков эхинококкоза имеют иммунологические исследования — выявление в крови специфических антител к эхинококку с помощью реакции иммуноферментного анализа (ИФА). Высокое содержание специфических антител наблюдается у 95% больных с активным процессом: при локализации живых кист паразита в печени, брюшной полости и забрюшинном пространстве, а также при множественном и сочетанном поражении внутренних органов. Имеет смысл выполнять не качественный, а количественный анализ на эхинококкоз в связи с высокой частотой ложноположительных результатов при качественном анализе.
Эозинофилия встречается в 18—83% наблюдений; некоторые авторы отмечают характерное для больных эхинококкозом повышение количества лейкоцитов, общего белка плазмы крови. Количество лимфоцитов крови обычно снижено; уровень всех классов иммуноглобулинов крови чаще повышен. Оговоримся, что все эти изменения состава крови характерны для активных форм и даже полиорганного поражения паразитом. При 1—2 даже зрелых кистах картина периферической крови, как правило, существенных изменений не претерпевает.
При 1—2 даже зрелых кистах картина периферической крови, как правило, существенных изменений не претерпевает.
Ведущим методом лучевой диагностики эхинококкоза печени и прочих органов является ультразвуковое исследование (УЗИ). Метод общедоступен и позволяет диагностировать эхинококкоз в стадии, когда паразитарные кисты имеют еще небольшой размер, начиная с 1,5—2 см.
На сонограмме сама эхинококковая киста представляет собой гипоэхогенное (анэхогенное) образование с двойным контуром. Это и есть хитиновая оболочка, которая выглядит как гиперэхогенный внутренний слой кисты. Внутри нее нередко определяются множественные подвижные гиперэхогенные включения по типу осадка. Это зародышевые элементы эхинококка, так называемый «гидатидный песок». Фиброзная капсула выглядит как гиперэхогенный ободок и отделена от хитиновой оболочки гипоэхогенным слоем — «лимфатической щелью» (рис. 1). Рис. 1. Сонограмма эхинококковой кисты печени. Определяется анэхогенное образование с базальным усилением, гипоэхогенным ободком и четким двухконтурным строением стенки.
Ленточная гиперэхогенная структура в просвете кисты (отслоившаяся хитиновая оболочка), как и дополнительные кистозные включения (дочерние кисты), патогномоничны только для эхинококковых кист (рис. 2). Рис. 2. Сонограмма эхинококковой кисты с отслоившейся хитиновой оболочкой (ленточная гиперэхогенная структура, указана стрелками). Диагноз эхинококкоза правомочен уже при сочетании двух—трех из указанных признаков [3].
При размере кисты до 30—40 мм эти признаки слабо выражены, что чрезвычайно затрудняет дифференциальную диагностику, поэтому при небольших кистах, помимо ИФА крови на эхинококкоз, целесообразно выполнение магнитно-резонансной томографии (МРТ). Как правило, МРТ позволяет определить признаки, характерные для паразитарной кисты [9].
ЛечениеДля химиотерапии эхинококковой инвазии разработан препарат альбендазол. Однако в качестве единственного метода лечения альбендазол эффективен лишь на ранних стадиях заболевания, пока не сформировалась плотная фиброзная капсула с лимфатической щелью вокруг собственно паразитарной кисты [4]. Эти структуры надежно защищают эхинококк от системных воздействий. В связи с этим наиболее распространенным методом лечения большинства больных эхинококкозом является хирургическое вмешательство [3, 7].
Эти структуры надежно защищают эхинококк от системных воздействий. В связи с этим наиболее распространенным методом лечения большинства больных эхинококкозом является хирургическое вмешательство [3, 7].
Для хирургического лечения эхинококкоза разработано три типа вмешательств: традиционные открытые, лапароскопические и миниинвазивные чрескожные. По данным мировой статистики, в настоящее время миниинвазивные вмешательства применяют почти у трети больных эхинококкозом [5, 7, 8]. При этом хирурги более склонны к щадящим вмешательствам в странах, относящихся к эндемичным, где число больных существенно больше. В тех странах, где болезнь встречается спорадически, все еще доминирует чрезмерно радикальный подход с преобладанием тотальной перицистэктомии либо резекции печени.
Привлекательная, на первый взгляд, методика лапароскопического удаления эхинококковых кист себя не всегда оправдывает. Дело в том, что различные технические приспособления, препятствующие попаданию гидатидной жидкости в брюшную полость, по мере спадения полости уже не позволяют надежно исключить риск обсеменения. С этим связана высокая частота рецидивов после операции. В последние годы показания к лапароскопической операции при эхинококкозе печени были пересмотрены, и техническая доступность кисты уже не считается одним из основных показаний к ней. Лапароскопические вмешательства целесообразны при технической возможности удаления кисты без ее вскрытия, т. е. при возможности выполнения так называемой идеальной эхинококкэктомии. Такая ситуация складывается при краевом либо экстраорганном расположении кисты, что встречается крайне редко [7, 10].
С этим связана высокая частота рецидивов после операции. В последние годы показания к лапароскопической операции при эхинококкозе печени были пересмотрены, и техническая доступность кисты уже не считается одним из основных показаний к ней. Лапароскопические вмешательства целесообразны при технической возможности удаления кисты без ее вскрытия, т. е. при возможности выполнения так называемой идеальной эхинококкэктомии. Такая ситуация складывается при краевом либо экстраорганном расположении кисты, что встречается крайне редко [7, 10].
Чрескожная эхинококкэктомия на сегодняшний день является стандартом оперативного лечения больных эхинококкозом печени при кистах I—II типа по классификации Gharbi [6]. Методика сочетает в себе преимущества малотравматичного доступа и возможность эрадикации паразита [1, 5, 9]. По мере накопления опыта пересматриваются и противопоказания к чрескожным вмешательствам. Наш опыт свидетельствует, что традиционные противопоказания к чрескожной эхинококкэктомии, такие как расположение кисты поверхностно, подкапсульно, внепеченочно, близко к магистральным сосудам и протокам в ткани печени или вне ее, а также наличие небольшого количества дочерних кист внутри материнской, весьма относительны. Такие особенности несколько усложняют операцию, но при квалифицированном ее выполнении не влияют на результат [3, 5].
Такие особенности несколько усложняют операцию, но при квалифицированном ее выполнении не влияют на результат [3, 5].
Главным и по сути единственным противопоказанием к чрескожной эхинококкэктомии является выход зародышевых элементов за пределы фиброзной капсулы — так называемое экзогенное почкование. При таком варианте кисты нет возможности воздействовать гермицидом на отпочковавшийся фрагмент, и это почти всегда приводит к рецидиву болезни.
Методика чрескожной эхинококкэктомии из печениВ зарубежной практике методика чрескожной эхинококкэктомии фигурирует под аббревиатурой PAIR — puncture, aspiration, injection, and respiration (пункция, аспирация, инъекция и реаспирация). Как нетрудно догадаться, это перечисление основных этапов операции [5].
Чрескожное вмешательство при эхинококкозе требует весьма тщательного соблюдения методики выполнения операции. Основными требованиями являются использование при первичном вхождении в кисту иглы-катетера и чреспеченочный доступ проведения инструмента. При первичной пункции живой эхинококковой кисты абсолютно недопустимо применение методики Сельдингера, т. е. введение катетера по проводнику после удаления пункционной иглы. Поскольку гидатидная жидкость находится в кисте под большим давлением, излияние ее с обсеменением полости в процессе замены иглы на катетер неизбежно. По этой же причине необходим чреспеченочный доступ к кисте, какой бы заманчивой и безопасной не казалась траектория пункции вне органа. Ткань печени служит дополнительным барьером между кистой и свободной брюшной полостью.
При первичной пункции живой эхинококковой кисты абсолютно недопустимо применение методики Сельдингера, т. е. введение катетера по проводнику после удаления пункционной иглы. Поскольку гидатидная жидкость находится в кисте под большим давлением, излияние ее с обсеменением полости в процессе замены иглы на катетер неизбежно. По этой же причине необходим чреспеченочный доступ к кисте, какой бы заманчивой и безопасной не казалась траектория пункции вне органа. Ткань печени служит дополнительным барьером между кистой и свободной брюшной полостью.
Итак, после пункции кисты иглой-катетером под контролем УЗИ выполняют противопаразитарную обработку эффективным гермицидом. Гидатидную жидкость полностью удаляют и отправляют на паразитологическое исследование для дополнительной верификации диагноза. Оставшуюся полость в соответствующем объеме по катетеру заполняют гермицидом. Одним из наиболее эффективных интраоперационных гермицидов с доказанным противопаразитарным действием на Echinococcus granulosus in vitro и in vivo является 87% водный раствор глицерина с экспозицией не менее 7 мин. Именно этап удаления гидатидной жидкости и противопаразитарной обработки является наиболее ответственным во всей операции и требует скрупулезного соблюдения методики. Высок риск излияния жидкости в окружающее пространство с развитием в отдаленном периоде обсеменения и рецидива либо выраженной аллергической реакции у пациента во время операции вплоть до анафилаксии. В связи с этим целесообразна превентивная профилактика анафилактических реакций путем заблаговременного интраоперационного введения дозы кортикостероида. Экспозиция гермицида длительнее 7 мин не оправдана. Экспериментальные исследования на мышах подтвердили, что для полной гибели протосколексов экспозиции 87% водного раствора глицерина в течение 6—7 мин достаточно.
Именно этап удаления гидатидной жидкости и противопаразитарной обработки является наиболее ответственным во всей операции и требует скрупулезного соблюдения методики. Высок риск излияния жидкости в окружающее пространство с развитием в отдаленном периоде обсеменения и рецидива либо выраженной аллергической реакции у пациента во время операции вплоть до анафилаксии. В связи с этим целесообразна превентивная профилактика анафилактических реакций путем заблаговременного интраоперационного введения дозы кортикостероида. Экспозиция гермицида длительнее 7 мин не оправдана. Экспериментальные исследования на мышах подтвердили, что для полной гибели протосколексов экспозиции 87% водного раствора глицерина в течение 6—7 мин достаточно.
После полного удаления гермицида наступает этап собственно эхинококкэктомии, т. е. удаления всех элементов паразита с хитиновой оболочкой. После обработки глицерином, т. е. уничтожения живых протосколексов, уже возможна замена иглы-катетера на дренаж достаточного диаметра (не менее 16 Fr) по проводнику. Это позволяет при определенном опыте полностью удалить все элементы паразита и хитиновой оболочки в первые сутки после операции. Возможно ли оставление оболочки в уже обработанной гермицидом кисте? Возможно, но нецелесообразно, потому что почти всегда сохраняется остаточная полость, риск нагноения которой достоверно почти в 2 раза выше при оставленной оболочке. После удаления максимально возможного объема хитиновой оболочки дренаж из кисты можно извлекать и считать эхинококкэктомию завершенной.
Это позволяет при определенном опыте полностью удалить все элементы паразита и хитиновой оболочки в первые сутки после операции. Возможно ли оставление оболочки в уже обработанной гермицидом кисте? Возможно, но нецелесообразно, потому что почти всегда сохраняется остаточная полость, риск нагноения которой достоверно почти в 2 раза выше при оставленной оболочке. После удаления максимально возможного объема хитиновой оболочки дренаж из кисты можно извлекать и считать эхинококкэктомию завершенной.
После чрескожной эхинококкэктомии перед хирургом встает вопрос об остаточной полости после операции. Однозначного решения этой проблемы пока нет. Нами эмпирически установлено, что у детей практически всегда остаточная полость самостоятельно закрывается в течение первого года после операции. У взрослых сокращение объема полости происходит реже. При этом попытки повторных вмешательств с целью дополнительного склерозирования полости только усугубляют ситуацию.
Опыт показывает, что остаточная полость требует выжидательной тактики и динамического наблюдения. Чем больше сроки наблюдения, тем меньше число больных с остаточной полостью. В то же время чем чаще повторные вмешательства, тем ригиднее и устойчивее к воздействиям становятся стенки кисты. В принципе очевидно, что существование остаточной полости малых размеров, порядка 4—5 см, не оказывает существенного влияния ни на функцию печени, ни на организм в целом. Выработанного международного алгоритма в отношении остаточных полостей пока нет. На основании собственного опыта мы пришли к выводу, что при клинически значимой остаточной полости более эффективна ее микроволновая абляция, чем повторное чрескожное дренирование и склерозирование.
Чем больше сроки наблюдения, тем меньше число больных с остаточной полостью. В то же время чем чаще повторные вмешательства, тем ригиднее и устойчивее к воздействиям становятся стенки кисты. В принципе очевидно, что существование остаточной полости малых размеров, порядка 4—5 см, не оказывает существенного влияния ни на функцию печени, ни на организм в целом. Выработанного международного алгоритма в отношении остаточных полостей пока нет. На основании собственного опыта мы пришли к выводу, что при клинически значимой остаточной полости более эффективна ее микроволновая абляция, чем повторное чрескожное дренирование и склерозирование.
Стоит коснуться и традиционных открытых методов лечения эхинококкоза печени. С накоплением опыта сформировались четкие показания к выполнению лапаротомии при эхинококкозе. На сегодняшний день необходимость большой травматичной операции нередко обусловлена обсеменением брюшной полости в случае несоблюдения правил анти- и апаразитарности при предыдущем лапароскопическом или чрескожном вмешательстве [7, 9].
Общее стремление к минимизации травматичности операции коснулось и традиционного хирургического лечения при эхинококкозе печени. Доказано, что простая эхинококкэктомия, заключающаяся во вскрытии и противопаразитарной обработке кисты с последующим удалением оболочек и при необходимости капитонажем остаточной полости, дает столь же удовлетворительные отдаленные результаты в отношении рецидива заболевания, как и тотальная перицистэктомия или резекция печени, т. е. полное удаление кисты даже вместе с фиброзной капсулой [7].
Несмотря на усовершенствование методик вмешательства, соблюдение принципов анти- и апаразитарности выполнения хирургического вмешательства, внедрение различных химических и физических методов воздействия на паразита, использование совершенного инструментария, частота рецидивов заболевания остается высокой и достигает 5—33% [8, 10], поэтому огромное влияние на результаты лечения оказывает последующая химиотерапия, или противогельминтная терапия. Она необходима и для воздействия на отсевы эхинококка малых размеров, недоступные современным методам диагностики. Несколькими многоцентровыми исследованиями, в которых участвовала и наша клиника, доказано, что курс специфических противопаразитарных препаратов строго обязателен для предупреждения рецидива болезни даже после идеально выполненной операции [7—9].
Несколькими многоцентровыми исследованиями, в которых участвовала и наша клиника, доказано, что курс специфических противопаразитарных препаратов строго обязателен для предупреждения рецидива болезни даже после идеально выполненной операции [7—9].
Наиболее эффективными и общепринятыми препаратами, воздействующими на гидатидозный эхинококк, являются альбендазол и его аналоги [4, 9]. Досадно, что хирурги не очень охотно рекомендуют больным послеоперационное медикаментозное лечение. Преобладающая точка зрения о чрезвычайной токсичности препарата не соответствует действительности. Более того, химиотерапия оправдана и в качестве самостоятельного метода лечения при кистах размером до 3 см и менее, особенно при легочном эхинококкозе. Подчеркнем, однако, что при кисте большого размера показано обязательное оперативное лечение в том или ином объеме, поскольку применение в этом случае только альбендазола малоэффективно.
Таким образом, научные достижения последних лет кардинально изменили подходы к диагностике и выбору метода лечения больных эхинококкозом. Новые аспекты морфологии паразита показали, что результатом применения современных высокоинформативных инструментальных методов исследования является не просто констатация факта наличия кисты, но и указание в протоколе исследования ее характеристик, размера, характера содержимого, формы, описание формы дочерних кист, упоминание о наличии экзо- и эндогенно почкующихся кист, степени их проникновения в фиброзную капсулу. Наиболее эффективными в этом плане признаны УЗИ и МРТ. Выявление кистозных образований практически всегда требует проведения серологических реакций на эхинококкоз. Больные эхинококкозом независимо от размера и локализации кист не подлежат динамическому наблюдению и должны быть направлены в хирургический стационар, располагающий опытом лечения таких больных. Обязательным является комплексный подход, включающий применение послеоперационной противогельминтной терапии. Хирургическому лечению подлежат все больные с эхинококковыми кистами размером более 3 см. Выбор методики вмешательства определяется в зависимости от технической возможности стационара и характеристик самой кисты.
Новые аспекты морфологии паразита показали, что результатом применения современных высокоинформативных инструментальных методов исследования является не просто констатация факта наличия кисты, но и указание в протоколе исследования ее характеристик, размера, характера содержимого, формы, описание формы дочерних кист, упоминание о наличии экзо- и эндогенно почкующихся кист, степени их проникновения в фиброзную капсулу. Наиболее эффективными в этом плане признаны УЗИ и МРТ. Выявление кистозных образований практически всегда требует проведения серологических реакций на эхинококкоз. Больные эхинококкозом независимо от размера и локализации кист не подлежат динамическому наблюдению и должны быть направлены в хирургический стационар, располагающий опытом лечения таких больных. Обязательным является комплексный подход, включающий применение послеоперационной противогельминтной терапии. Хирургическому лечению подлежат все больные с эхинококковыми кистами размером более 3 см. Выбор методики вмешательства определяется в зависимости от технической возможности стационара и характеристик самой кисты.
Авторы заявляют об отсутствии конфликта интересов.
Антигельминтные средства Сестринский уход и управление
Антигельминтные средства — это препараты, используемые для лечения инфекций, вызванных чувствительными инвазивными червями.
Таблица распространенных лекарственных средств и непатентованных наименований
Ниже приведена таблица часто встречающихся антигельминтных средств, их непатентованных и торговых марок:
| Классификация | Общее название | Торговая марка |
|---|---|---|
| Антигельминтные средства | альбендазол | Альбенза |
| ивермектин | Стромектол | |
| мебендазол | Вермокс | |
| празиквантел | Бильтрицид | |
| пирантел | Антиминт, Пин-Рид |
Основные болезни: Глистные инфекции
- Это инфекции желудочно-кишечного тракта или других тканей, вызванные глистными инвазиями.
 Им страдает около 1 миллиарда человек, что делает его наиболее распространенным из всех заболеваний.
Им страдает около 1 миллиарда человек, что делает его наиболее распространенным из всех заболеваний. - Заражение очень распространено в тропических районах. Путешественники могут заразиться гельминтозом и принести его домой, где черви могут заразить других людей.
- Наиболее распространенными инфекционными гельминтами являются нематоды (круглые черви) и платигельминты (плоские черви), которые проникают в кишечник и ткани.
Терапевтическое действие
Желаемое и полезное действие антигельминтных средств:
- Они воздействуют на метаболические пути, присутствующие у инвазивного червя, но отсутствуют или значительно отличаются у человека-хозяина.
Показания
Антигельминтные средства показаны при следующих заболеваниях:
- Альбендазол для лечения активных поражений, вызванных свиным цепнем, и кистозной болезни печени, легких и брюшины, вызванной собачьим цепнем.
- Ивермектин используется для лечения остриц, стронгилоидоза, онхоцеркоза или речной слепоты.

- Мебендазол предназначен для лечения заболеваний, вызванных острицами, круглыми червями, власоглавами и анкилостомами.
- Празиквантел предназначен для лечения большого числа шистосом или трематод.
- Пирантел предназначен для лечения остриц и аскарид.
Вот некоторые важные аспекты, которые следует помнить при назначении антигельминтных средств для разных возрастных групп:
Дети
- Перед началом любой лекарственной терапии важно провести посев подозреваемого червя.
- Альбендазол, ивермектин и празиквантел более токсичны, поэтому их следует избегать у детей. Вместо этого обычно дается жевательный препарат мебендазола.
- Во время терапии у детей могут развиться серьезные желудочно-кишечные расстройства, поэтому внимание медсестры должно быть сосредоточено на состоянии питания и гидратации.
Взрослые
- Эту возрастную группу может оттолкнуть мысль о глистной инвазии, и они могут неохотно обсуждать необходимые изменения образа жизни и планы лечения.

- Беременные и кормящие женщины не должны использовать эти препараты, если преимущества явно не перевешивают риски. Потенциальные риски должны быть доведены до сведения пациентов.
Пожилые люди
- Пожилые пациенты более восприимчивы к побочным эффектам со стороны желудочно-кишечного тракта и ЦНС при терапии антигельминтными средствами, особенно с нарушениями функции печени и почек.
Фармакокинетика
Ниже приведены характерные взаимодействия антигельминтных средств с организмом с точки зрения всасывания, распределения, метаболизма и выведения:
Метаболизм: печень
Выведение: толстая кишка (кал)
Противопоказания и меры предосторожности
Противопоказания и меры предосторожности при использовании антигельминтных средств:
- Известная аллергия на препарат.
 Предотвращает реакции гиперчувствительности.
Предотвращает реакции гиперчувствительности. - Лактация. Лекарство может попасть в грудное молоко.
- Заболевания почек и печени. Вмешательство в метаболизм и выведение лекарств.
- Тяжелая диарея и недоедание. Может изменить действие препарата на кишечник и любых ранее существовавших гельминтов.
- Пирантел не считается безопасным для детей младше 2 лет.
Побочные эффекты
Использование антигельминтных средств может привести к следующим побочным эффектам:
- ЖКТ: дискомфорт в животе, диарея, боль
- ЦНС: головная боль, головокружение,
- Иммунологические: лихорадка, озноб, озноб, недомогание, сыпь, зуд, выпадение волос
- Альбендазол связан с тяжелой депрессией костного мозга и почечной недостаточностью.
Взаимодействия
Ниже приведены лекарственные взаимодействия при использовании антигельминтных средств:
- Дексаметазон, празиквантел, циметидин.
 Повышение токсического действия альбендазола
Повышение токсического действия альбендазола
Вопросы ухода за больными
Важные аспекты ухода за больными при назначении антигельминтных препаратов:
Оценка медсестер
Ниже приведены важные моменты, которые медсестра должна учитывать при проведении осмотра, сбора анамнеза и осмотра:
- Оценка упомянутых предостережений и противопоказаний (например, известные аллергии, гепаторенальная дисфункция, беременность и лактация и т. д.), чтобы предотвратить любые неблагоприятные осложнения.
- Провести тщательную физическую оценку (другие принимаемые лекарства, рефлексы и мышечную силу, цвет кожи, температуру, текстуру и т. д.), чтобы установить исходные данные до начала медикаментозной терапии, определить эффективность терапии и оценить возникновение любых побочных эффектов, связанных с с медикаментозной терапией.
- Оцените функцию печени пациента, включая функциональные тесты печени, чтобы определить целесообразность терапии и контролировать токсичность.

- Получите культуру кала на яйца и паразитов, чтобы определить инфицирующего червя и назначить соответствующее лечение.
- Обследуйте брюшную полость, чтобы оценить любые изменения по сравнению с исходным уровнем, связанные с инфекцией, выявить возможные побочные эффекты и следить за улучшением состояния.
Сестринский диагноз
Вот некоторые из сестринских диагнозов, которые можно сформулировать при использовании этих препаратов для терапии:
- Острая боль, связанная с желудочно-кишечным трактом, ЦНС и кожными эффектами препарата
- Несбалансированное питание: меньше, чем требуется организму, связанное с желудочно-кишечными эффектами препарата
Внедрение с обоснованием
Это жизненно важные сестринские вмешательства, проводимые у пациентов, принимающих антигельминтные препараты:
- Организовать соответствующие тесты на культуру и чувствительность перед началом терапии, чтобы обеспечить правильное лекарство для восприимчивых видов Plasmodium.

- Введите полный курс препарата, чтобы получить все положительные эффекты.
- Контролируйте функцию печени и проводите офтальмологическое обследование до и периодически во время лечения, чтобы обеспечить раннее выявление и быстрое вмешательство с прекращением приема препарата в случае появления признаков недостаточности или ухудшения зрения.
- Обеспечьте комфорт и меры безопасности при воздействии на ЦНС (например, боковые поручни и помощь при передвижении при наличии головокружения и слабости) для предотвращения травм пациента. Обеспечьте гигиену полости рта и свободный доступ к туалетным комнатам, если это необходимо, чтобы справиться с последствиями желудочно-кишечного тракта.
- Обучите клиента медикаментозной терапии, чтобы способствовать пониманию и соблюдению требований.
Оценка
Вот аспекты лечения, которые следует оценить для определения эффективности медикаментозной терапии:
- Мониторинг реакции пациента на терапию (разрешение глистной инвазии и улучшение признаков и симптомов).

- Мониторинг побочных эффектов (например, ориентация и воздействие, состояние питания, цвет кожи и поражения, функция печени, сообщения о дискомфорте и боли в животе и т. д.).
- Оцените понимание пациентом лекарственной терапии, попросив пациента назвать лекарство, его показания и побочные эффекты, на которые следует обратить внимание.
- Мониторинг приверженности пациента лекарственной терапии.
Пожалуйста, подождите, пока активность загружается. Если это действие не загружается, попробуйте обновить браузер. Также для этой страницы требуется javascript. Пожалуйста, посетите с помощью браузера с включенным javascript.
Если загрузка не удалась, нажмите здесь, чтобы повторить попытку
Выберите букву правильного ответа. Удачи!
Поздравляем! Вы завершили задание Антигельминтное средство .
Вы набрали %%SCORE%% из %%TOTAL%%.
Ваша эффективность была оценена как %%RATING%%
Ваши ответы выделены ниже.
Оптимизация эффективности антигельминтного лечения детей
Crompton DWT. Сколько человеческих гельминтозов в мире? Дж Параситол 1999; 85: 397–403
Статья пабмед КАС Google Scholar
Бентвич З., Калинкович А., Вейсман З. Иммунная активация является доминирующим фактором в патогенезе африканского СПИДа. Иммунол Сегодня 1995; 16: 187–91
Статья пабмед КАС Google Scholar
Borkow G, Bentwich Z. Искоренение гельминтозов может иметь важное значение для успешной вакцинации против ВИЧ и туберкулеза. Bull World Health Organ 2000; 78: 1368–9
PubMed КАС Google Scholar
Gopinath R, Ostrowski M, Justement ST, et al. Филяриозы повышают восприимчивость мононуклеарных клеток периферической крови к инфицированию вирусом иммунодефицита человека in vitro. Дж. Заразить Dis 2000; 182: 1804–8
Дж. Заразить Dis 2000; 182: 1804–8
Статья пабмед КАС Google Scholar
ван ден Биггелаар А., ван Ри Р., Родригес Л.С. и др. Снижение атопии у детей, инфицированных Schistosoma haematobium : роль индуцированного паразитами интерлейкина-10. Ланцет 2000; 356(9243): 1723–7
Артикул пабмед Google Scholar
Майкл Э., Банди Д.А., Холл А и др. Этот червивый мир: пятьдесят лет спустя: проблема борьбы с распространенными гельминтозами человека сегодня [постер]. Паразитол сегодня 1997; 13(11): Вставка
Google Scholar
Стивенсон Л.С., Латам М.С., Оттесен Э.А. Недоедание и паразитарные гельминтозы. Паразитология 2000; 121 Доп.: S23–38
Артикул пабмед Google Scholar
Всемирный банк. Доклад о мировом развитии: инвестиции в здоровье. Оксфорд: Издательство Оксфордского университета, 1993
Google Scholar
Чан М.С. Глобальное бремя кишечных нематодных инфекций: пятьдесят лет спустя. Паразитол сегодня 1997; 13: 438–43
Статья пабмед КАС Google Scholar
Банди Д.А., Чан М.С., Медли Г.Ф. и др. Кишечные нематодозные инфекции. В: Приоритеты здравоохранения и анализ бремени болезней: методы и приложения глобальных, национальных и субнациональных исследований. Бостон (Массачусетс): Издательство Гарвардского университета для ВОЗ и Всемирного банка. В прессе
Murray CJL, Lopez AD, редакторы. Глобальные сравнительные оценки в секторе здравоохранения, бремя болезней, расходы и пакеты вмешательств. Женева: Всемирная организация здравоохранения, 1994
Google Scholar
Montresor A, Gyorkos TW, Crompton DWT и др. Мониторинг программ борьбы с гельминтами: руководство по мониторингу воздействия программ борьбы, направленных на снижение заболеваемости, вызываемой передающимися через почву гельминтами и шистосомами, с особым упором на детей школьного возраста. Женева: Всемирная организация здравоохранения, 1999 г. WHO/CDS/CPC/SIP/99.3.
Google Scholar
O’Lorcain P, Holland CV. Значение для общественного здравоохранения Ascaris lumbricoides . Паразитология 2000; 121 Доп.: S51–72
Артикул пабмед Google Scholar
ACC/SCN. Четвертый доклад о положении в области питания в мире. Женева: ACC/SCN в сотрудничестве с IFPRI, январь 2000 г.,
Google Scholar
Стивенсон Л.С., Лэтэм М.С., Оттесен Э.А. Глобальное недоедание. Паразитология 2000; 121 Доп.: S5–22
Паразитология 2000; 121 Доп.: S5–22
Артикул пабмед Google Scholar
Скримшоу Н.С., Санджованни Дж.П. Синергизм питания, инфекции и иммунитета: обзор. Ам Дж. Клин Нутр, 1997; 66 Дополнение: 464–77S
Google Scholar
Montresor A, Crompton DWT, Hall A и др. Руководство по оценке передаваемых через почву гельминтозов и шистосомозов на уровне общин: руководство для руководителей программ борьбы. Женева: Всемирная организация здравоохранения, 1998. ВОЗ/CTD/SIP/98.1
Google Scholar
Всемирная организация здравоохранения. Отчет неофициальной консультации ВОЗ по мониторингу эффективности лекарств в борьбе с шистосомозом и кишечными нематодами. Женева: Всемирная организация здравоохранения, 1999 г. WHO/CDS/CPC SIP/99.1
Google Scholar
Оттесен Э.А., Исмаил М.М., Хортон Дж. Роль альбендазола в программах по ликвидации лимфатического филяриатоза. Паразитол Сегодня 1999; 15: 382–6
Статья пабмед КАС Google Scholar
Браун К.Р., Риччи Ф.М., Оттесен Э.А. Ивермектин: эффективность при лимфатическом филяриатозе. Паразитология 2000; 121 Дополнение: S133–46
Артикул пабмед Google Scholar
Horton J, Witt C, Ottesen EA, et al. Анализ безопасности разовой дозы, двух схем приема препаратов, применяемых в программах по ликвидации лимфатического филяриатоза. Паразитология 2000; 121 Доп.: S147–60
Артикул пабмед Google Scholar
Horton J. Альбендазол: обзор антигельминтной эффективности и безопасности у людей. Паразитология 2000; 121 Доп.: S113–32
Артикул пабмед Google Scholar
Оттесен Э.А., Дюк БОЛ, Карам М. и др. Стратегии и средства контроля/устранения лимфатического филяриатоза. Bull World Health Organ 1997; 75(6): 491–503
ПабМед КАС Google Scholar
Всемирная организация здравоохранения. Профилактика и борьба с кишечными паразитарными инфекциями. Женева: Всемирная организация здравоохранения, 1987 г. Серия технических отчетов №. 749.
Google Scholar
Всемирная организация здравоохранения. Отчет неофициальной консультации ВОЗ по анкилостомозу и анемии у девочек и женщин, Женева: Всемирная организация здравоохранения; 1994 5–7 дек. ВОЗ/CDS/IPI/95.1
Google Scholar
Chodakewitz J. Ивермектин и лимфатический филяриатоз: клиническое обновление. Паразитол сегодня 1995; 11: 233–5
Статья Google Scholar
Moulia-Pelat JP, Glaziou P, Weil GJ, et al. Комбинация ивермектин плюс диэтилкарбамазин, новое эффективное средство для борьбы с лимфатическим филяриатозом. Троп Мед Паразитол 1995; 46: 9–12
PubMed КАС Google Scholar
Оттесен Э.А., Рамачандран К.П. Инфекция и заболевание лимфатическим филяриатозом: стратегии борьбы. Паразитол сегодня 1995; 11: 129–31
Статья Google Scholar
Исмаил М.М., Джаякоди Р.Л., Вейл Г.Дж. и др. Эффективность однократных комбинаций альбендазола, ивермектина и диэтилкарбамазина для лечения филяриатоза банкрофта. Trans R Soc Trop Med Hyg 1998; 92: 94–7
Статья пабмед КАС Google Scholar
Beach MJ, Streit TG, Addiss DG, et al. Оценка комбинированного лечения кишечными гельминтами и Wuchereria bancrofti комбинированного лечения ивермектином и альбендазолом у гаитянских школьников. Am J Trop Med Hyg 1999; 60: 479–86
Am J Trop Med Hyg 1999; 60: 479–86
PubMed КАС Google Scholar
Исмаил М.М., Джаякоды Р.Л. Эффективность альбендазола и его комбинаций с ивермектином или диэтилкарбамазином (ДЭК) при лечении Инфекция Trichuris trichiura в Шри-Ланке. Энн Троп Мед Паразитол 1999; 93: 501–4
Артикул пабмед КАС Google Scholar
Савиоли Л., Ренганатан Э., Монтресор А. и др. Борьба с шистосомозом: глобальная картина. Паразитол сегодня 1997; 13(11): 444–8
Статья пабмед КАС Google Scholar
Сяо С.Х., Бут М., Таннер М. Профилактическое действие артеметера против Инфекции Schistosoma japonicum . Паразитол Сегодня 2000; 16(3): 122–6
Статья пабмед КАС Google Scholar
Стивенсон Л.С., Холланд К.В., Купер Э.С. Значение для общественного здравоохранения Trichuris trichiura . Паразитология 2000; 121 Доп.: S73–96
Артикул пабмед Google Scholar
Стивенсон Л.С., Латам М.С., Курц К.М. Лечение однократной дозой альбендазола улучшает рост кенийских школьников, больных анкилостомозом, 9Инфекции 0331 Trichuris trichiura и Ascaris lumbricoides . Am J Trop Med Hyg 1989; 41: 78–87
PubMed КАС Google Scholar
Stephenson LS, Latham MC, Kurz KM, et al. Однократное лечение кенийскими детьми метрифонатом или празиквантелом, II: влияние на рост в отношении S. haematobium и количества яиц анкилостомы. Am J Trop Med Hyg 1989; 41: 453–61
Google Scholar
Симеон Д.Т., Грэнтэм-Макгрегор С. М., Каллендар Дж.Е. и др. Лечение инфекции Trichuris trichiura улучшает рост, успеваемость и посещаемость школы у некоторых детей. Дж. Нутр, 1995 г.; 125: 1875–83
М., Каллендар Дж.Е. и др. Лечение инфекции Trichuris trichiura улучшает рост, успеваемость и посещаемость школы у некоторых детей. Дж. Нутр, 1995 г.; 125: 1875–83
PubMed КАС Google Scholar
Стивенсон Л.С., редактор. Шистосомоз и недоедание. Серия монографий Cornell International Nutrition. Итака (Нью-Йорк): Корнельский университет, 1986
Google Scholar
Stoltzfus RJ, Chwaya HM, Montresor A, et al. Малярия, анкилостомоз и недавняя лихорадка связаны с анемией и показателями статуса железа у занзибарских детей в возрасте от 0 до 5 лет, и эти отношения меняются с возрастом. Дж. Нутр 2000; 130: 1724–33
PubMed КАС Google Scholar
Гринберг Б.Л., Гилман Р.Х., Шапиро Х. и др. Однократная пиперазиновая терапия на Ascaris lumbricoides : неудачный метод стимуляции роста. Ам Дж. Клин Нутр, 1981; 34: 2508–16
Ам Дж. Клин Нутр, 1981; 34: 2508–16
PubMed КАС Google Scholar
Latham MC, Stephenson LS, Kurz KM. Лечение метрифонатом или празиквантелом улучшает физическую форму и аппетит кенийских школьников с Schistosoma haematobium и анкилостомозом. Am J Trop Med Hyg 1990; 43: 170–9
PubMed КАС Google Scholar
Квалсвиг Д.Д., Беккер П.Дж. Избирательное заражение активных и общительных детей шистосомозом. Энн Троп Мед Паразитол 1988; 82: 471–4
PubMed КАС Google Scholar
Махендра Радж С. Кишечный геогельминтоз и рост у детей младшего школьного возраста на северо-востоке полуострова Малайзия. J Trop Med Pub Health, Юго-Восточная Азия, 1998; 29: 112–7
КАС Google Scholar
Parraga IM, Assis AM, Prado MS, et al. Половые различия в росте детей школьного возраста, больных шистосомозом и геогельминтозом. Am J Trop Med Hyg 1996; 55: 150–6
PubMed КАС Google Scholar
Кромптон ДВТ. Значение анкилостомоза для общественного здравоохранения. Паразитология 2000; 121 Доп.: S39–50
Артикул пабмед Google Scholar
Stephenson LS, Holland CV. Влияние гельминтозов на питание человека. Лондон: Тейлор и Фрэнсис, 1987
Google Scholar
ACC/SCN. Второй доклад о положении в области питания в мире. Том. 1. Глобальные и региональные результаты. Женева: ACC/SCN, 1992
Google Scholar
Stephenson LS, Latham MC, Adams EJ, et al. Физическая подготовка, рост и аппетит кенийских школьников с анкилостомозом, 9 летИнфекции 0331 Trichuris trichiura и Ascaris lumbricoides улучшаются через четыре месяца после однократного приема альбендазола. Дж. Нутр, 1993 г.; 123: 1036–46
Дж. Нутр, 1993 г.; 123: 1036–46
PubMed КАС Google Scholar
Хаджу В., Стивенсон Л.С., Абади К. и др. Улучшение аппетита и роста у инфицированных гельминтами школьников через три и семь недель после однократного приема пирантела памоата. Паразитология 1996; 113: 497–504
Артикул пабмед Google Scholar
Стивенсон Л.С. Влияние шистосомоза на питание человека. Паразитология 1993; 107 Доп.: S107–23
Артикул пабмед Google Scholar
Stephenson LS, Latham MC, Adams EJ, et al. Прибавка в весе у кенийских школьников, инфицированных анкилостомами Trichuris trichiura и Ascaris lumbricoides , улучшилась после лечения альбендазолом один или два раза в год. Дж Нутр 1993; 123: 656–65
PubMed КАС Google Scholar
Stephenson LS, Latham MC, Kurz KM, et al. Взаимосвязь Schistosoma haematobium , анкилостомоза и малярийных инфекций и лечения метрифонатом с ростом кенийских школьников. Am J Trop Med Hyg 1985; 34: 1109–18
PubMed КАС Google Scholar
Поллитт Э. Недоедание и инфекции в классе. Париж: ЮНЕСКО, 19.90
Google Scholar
Коннолли К.Дж., Квалсвиг Д.Д. Инфекция, питание и когнитивные способности у детей. Паразитология 1993; 107 Дополнение: S187–200
Артикул пабмед Google Scholar
Ноукс С., Банди Д.А. Влияет ли заражение гельминтами на умственную деятельность и успеваемость? Паразитол сегодня 1994; 10: 14–8
Статья пабмед КАС Google Scholar
Уоткинс В.Е., Поллитт Э. «Глупость или глисты»: вредят ли кишечные глисты умственной деятельности? Психологический бык 1997; 121: 171–91
Статья пабмед КАС Google Scholar
Guyatt H. Влияют ли кишечные нематоды на продуктивность во взрослом возрасте? Паразитол Сегодня 2000; 16: 153–8
Статья пабмед КАС Google Scholar
Nokes C, Grantham-Mcgregor SM, Sawyer AW, et al. Умеренные и тяжелые инфекции Trichuris trichiura влияет на когнитивные функции ямайских школьников. Паразитология 1992; 104: 539–47
Статья пабмед Google Scholar
Роуз В. Шестой годовой отчет Международного совета здравоохранения Фонда Рокфеллера (1 января 1919 г. – 31 декабря). Нью-Йорк (Нью-Йорк): Фонд Рокфеллера, 1920
Google Scholar
