Каковы преимущества сульфата железа при лечении железодефицитной анемии. Как оценивается эффективность препаратов железа. Какие побочные эффекты могут возникать при приеме сульфата железа. Как снизить риск побочных эффектов при лечении препаратами железа.
Эффективность сульфата железа в лечении железодефицитной анемии
Сульфат железа остается одним из наиболее эффективных препаратов для лечения железодефицитной анемии (ЖДА). Многочисленные исследования подтверждают его высокую биодоступность и способность быстро повышать уровень гемоглобина.
Сравнительная эффективность различных препаратов железа
В сравнительных исследованиях сульфат железа демонстрирует более высокую эффективность по сравнению с другими пероральными препаратами железа:
- Средний суточный прирост гемоглобина при приеме сульфата железа составляет 1,4-1,8 г/л
- Для железо-полимальтозного комплекса этот показатель составляет 0,9 г/л
- Различия статистически значимы (p<0,05)
Эти данные свидетельствуют о более высокой биодоступности сульфата железа по сравнению с комплексными соединениями железа.
Прогностическое значение динамики гемоглобина
Важным показателем эффективности лечения является скорость прироста уровня гемоглобина в первые недели терапии. Метаанализ 5 клинических исследований показал:
- У 73% пациентов наблюдался прирост гемоглобина на 1 г/дл к 14 дню лечения сульфатом железа
- Этот показатель является предиктором эффективности дальнейшей терапии
- Чувствительность и специфичность «теста двухнедельного прироста гемоглобина» составили 90,1% и 79,3% соответственно
Таким образом, оценка динамики гемоглобина в первые 2 недели позволяет прогнозировать эффективность лечения и при необходимости своевременно корректировать терапию.
Безопасность применения сульфата железа
Побочные эффекты со стороны желудочно-кишечного тракта
Основные опасения при применении сульфата железа связаны с возможными побочными эффектами со стороны ЖКТ. Метаанализ плацебо-контролируемых исследований показал:
- Риск нарушений функции ЖКТ при приеме сульфата железа в 2,32 раза выше, чем при приеме плацебо
- Частота побочных эффектов не зависит от суточной дозы препарата в диапазоне 100-400 мг элементарного железа
При этом важно учитывать, что частота побочных эффектов значительно различается для разных лекарственных форм сульфата железа:

- Для препаратов с замедленным высвобождением железа частота нежелательных явлений составляет 3,7-4,1%
- Для обычных форм сульфата железа — 30,2-32,3%
Это подчеркивает важность правильного выбора лекарственной формы препарата.
Окислительный стресс при приеме препаратов железа
Долгое время существовало мнение о повышенном риске окислительного стресса при приеме сульфата железа по сравнению с трехвалентными комплексами. Однако клинические исследования не подтверждают эти опасения:
- Не выявлено значимых различий в динамике маркеров окислительного стресса при приеме разных препаратов железа
- При лечении сульфатом железа отмечено снижение уровня малонового диальдегида — одного из основных маркеров окислительного стресса
Эти данные свидетельствуют об отсутствии повышенного риска окислительного стресса при применении сульфата железа у пациентов с железодефицитной анемией.
Современные подходы к повышению безопасности терапии сульфатом железа
Оптимизация дозирования препаратов железа
Современные исследования позволяют пересмотреть традиционные схемы назначения препаратов железа. Выявлено, что:

- При частом приеме высоких доз железа повышается уровень гепсидина, что снижает абсорбцию железа
- Повышенный уровень гепсидина сохраняется около 48 часов после приема препарата
На основании этих данных предлагаются новые схемы дозирования:
- Снижение разовой и суточной дозы препарата
- Увеличение интервалов между приемами до 48-72 часов
Такой подход позволяет повысить эффективность терапии и снизить риск побочных эффектов.
Применение препаратов с замедленным высвобождением железа
Использование препаратов сульфата железа с замедленным высвобождением позволяет значительно повысить безопасность терапии:
- Частота нежелательных явлений со стороны ЖКТ снижается в 8-10 раз по сравнению с обычными формами
- Эффективность терапии сохраняется на высоком уровне
Применение таких препаратов признано клиническим стандартом лечения железодефицитной анемии.
Заключение
Сульфат железа остается оптимальным пероральным препаратом для лечения железодефицитной анемии, сочетающим высокую эффективность, хорошую переносимость и доступность. Современные подходы к дозированию и использование форм с замедленным высвобождением позволяют значительно повысить безопасность терапии. При этом эффективность лечения может быть спрогнозирована уже в первые недели на основании динамики уровня гемоглобина.

Сульфат железа в лечении железодефицитной анемии: позиции сохраняются
ДИ — доверительный интервал
ЖДА — железодефицитная анемия
ЖСК — железо в сыворотке крови
МДА — малоновый диальдегид
ОР — относительный риск
ОС — окислительный стресс
ОШ — отношение шансов
ПЖ — препараты железа
ПЭ — побочные эффекты
СЖ — сульфат железа
СОЖ — слизистая оболочка желудка
СРП — свободнорадикальные процессы
Применение соединений железа с лечебной целью уходит вглубь истории медицины, когда эти соединения еще не позиционировались как фармакологический класс под рубрикой «препараты железа» (ПЖ) и не имели четкого обоснования к назначению. Соединения железа стали прописывать больным с малокровием около 1660 г. с целью «укрепления сил», еще даже не подозревая, что железо входит в состав гемоглобина — переносчика кислорода. С этой целью применяли даже обычные железные опилки.
В настоящее время в клинической практике существуют 2 группы ПЖ, которые различаются в зависимости от валентности железо (двух- или трехвалентное), входящего в препарат. Степень абсорбции солей двухвалентного железа в несколько раз выше, чем солей трехвалентного железа, так как они пассивно диффундируют через белковые каналы, что обеспечивает более быстрый прирост уровня железа в сыворотке крови (ЖСК) и гемоглобина. Препараты, содержащие железо в трехвалентном состоянии, должны применяться более длительно, а в случае дефицита меди в организме могут оказаться неэффективными.
Клинический опыт использования ПЖ, результаты исследования их сравнительной эффективности и переносимости, данные метаанализов явились базой для создания национальных практических рекомендаций, а также рекомендации ВОЗ по ведению больных железодефицитной анемией (ЖДА) [1, 2]. Богатый арсенал пероральных ПЖ, выпускаемых различными фармацевтическими компаниями, ставит перед врачом проблему выбора оптимального ПЖ в конкретной клинической ситуации. При этом наряду с ориентировкой на свойства ПЖ (количество элементарного железо, наличие дополнительных веществ, улучшающих абсорбцию железо, валентность, лекарственная форма и др.) врач находится под постоянным прессингом публикаций об эффективности и безопасности различных П.Ж. Эти публикации не всегда отвечают требованиям доказательной медицины и порой не лишены некоторой тенденциозности. Основной мишенью «атак» среди пероральных ПЖ оказался сульфат железа (СЖ) — наиболее распространенная лекарственная форма ПЖ, назначаемая лицам с наличием ЖДА (дети, взрослые, пожилые, беременные).
— недостаточная биодоступность и эффективность,
— наличие ПЭ, возводимых в ранг токсического действия,
— окислительный стресс (ОС).
Сравнительная эффективность пероральных ПЖ. В настоящее время препаратами первого ряда для лечения ЖДА являются ПЖ для приема внутрь, среди которых основное место продолжает занимать СЖ [3]. Более 10 лет назад нами проведено исследование по сравнительной оценке эффективности препаратов СЖ (сорбифер дурулес, ферро- фольгамма) и препарата железо-полимальтозного комплекса феррум лек в виде жевательных таблеток [4]. У всех пациентов на фоне приема ПЖ получен благоприятный клинический эффект (значительное уменьшение или исчезновение признаков анемии и сидеропении) и повышение или нормализация уровня гемоглобина. Однако наиболее важными в данном исследовании оказались величина и темпы прироста уровня гемоглобина при применении указанных ПЖ.
Со 2-й недели лечения отмечено статистически значимое различие по увеличению уровня гемоглобина между группой больных, получавших сорбифер дурулес и феррум лек (2,2 г и 1,1 г/л соответственно; р<0,05), а на 3-й неделе — между группой, получавшей феррум лек и два других препарата СЖ (р<0,05). В среднем суточный прирост уровня гемоглобина в группах больных, леченных препаратами сорбифер дурулес, ферро-фольгамма и феррум лек, составил 1,8±0,6, 1,4±0,6 и 0,9±0,7 г/л соответственно. Различие по среднему показателю статистически значимо во всех 3 группах: сорбифер дурулес — ферро-фольгамма (р<0,005), сорбифер дурулес — феррум лек (р<0,001) и ферро-фольгамма — феррум лек (р<0,05). Более выраженная эффективность препаратов солей железа по сравнению с препаратами железосодержащих комплексов, по-видимому, обусловлена различной биодоступностью указанных ПЖ.
Таким образом, прирост уровня гемоглобина оказался наиболее выраженным у препарата сорбифер дурулес. Следует отметить, что эти данные фактически подтвердили наши прежние результаты по оценке величины и темпов прироста уровня гемоглобина на фоне лечения больных ЖДА препаратом сорбифер дурулес [5]. В более позднем исследовании при сравнении эффективности 5 различных препаратов СЖ в суточной дозе 70—200 мг элементарного железо величина и скорость прироста уровня гемоглобина были почти одинаковыми и составляли для группы больных, получавшей ферро-фольгамму и сорбифер дурулес, 2,5 и 2,2 г/л/сут соответственно [6], что практически соответствовало полученным нами результатам. По данным другого исследования по оценке эффективности препаратов СЖ, при лечении препаратом сорбифер дурулес женщин с онкогинекологической патологией и заболеваниями желудочно-кишечного тракта прирост уровня гемоглобина в течение 1-го месяца колебался от 10 до 50 г/л с медианой прироста 30 г/л, т. е. около 1 г/л/сут [7]. Более низкий показатель суточного прироста уровня гемоглобина в данном исследовании мог быть обусловлен гетерогенным контингентом пациентов (больные ЖДА и анемией хронических заболеваний), имевших различную феррокинетику и чувствительность к ПЖ.
Следует отметить, что эти данные фактически подтвердили наши прежние результаты по оценке величины и темпов прироста уровня гемоглобина на фоне лечения больных ЖДА препаратом сорбифер дурулес [5]. В более позднем исследовании при сравнении эффективности 5 различных препаратов СЖ в суточной дозе 70—200 мг элементарного железо величина и скорость прироста уровня гемоглобина были почти одинаковыми и составляли для группы больных, получавшей ферро-фольгамму и сорбифер дурулес, 2,5 и 2,2 г/л/сут соответственно [6], что практически соответствовало полученным нами результатам. По данным другого исследования по оценке эффективности препаратов СЖ, при лечении препаратом сорбифер дурулес женщин с онкогинекологической патологией и заболеваниями желудочно-кишечного тракта прирост уровня гемоглобина в течение 1-го месяца колебался от 10 до 50 г/л с медианой прироста 30 г/л, т. е. около 1 г/л/сут [7]. Более низкий показатель суточного прироста уровня гемоглобина в данном исследовании мог быть обусловлен гетерогенным контингентом пациентов (больные ЖДА и анемией хронических заболеваний), имевших различную феррокинетику и чувствительность к ПЖ.
О клиническом значении высокой биодоступности СЖ может свидетельствовать эффективность одного из препаратов СЖ — сорбифер дурулес при назначении его больным после бариатрических операций (билиопанкреатическое шунтирование) по поводу патологического ожирения. По данным длительного мониторинга (5 лет), у пациентов, не принимавших ПЖ, фиксировались достоверно более низкие уровни гемоглобина и железа в сыворотке крови (ЖСК), начиная с 4 и 3 лет после операции соответственно [8]. Примечательно, что подобные результаты достигались при приеме перорального ПЖ в условиях значительного уменьшения «кишечной площади» абсорбции железа, т. е. в ситуациях, являющихся, казалось бы, показанием к применению ПЖ парентерально. Однако высокая биодоступность препарата сорбифер дурулес позволяет в условиях значительного сокращения площади всасывания железа достигать абсорбции, адекватной для поддержания его гомеостаза у пациентов данной категории. Улучшению биодоступности препарата сорбифер дурулес может способствовать наличие в его составе аскорбиновой кислоты.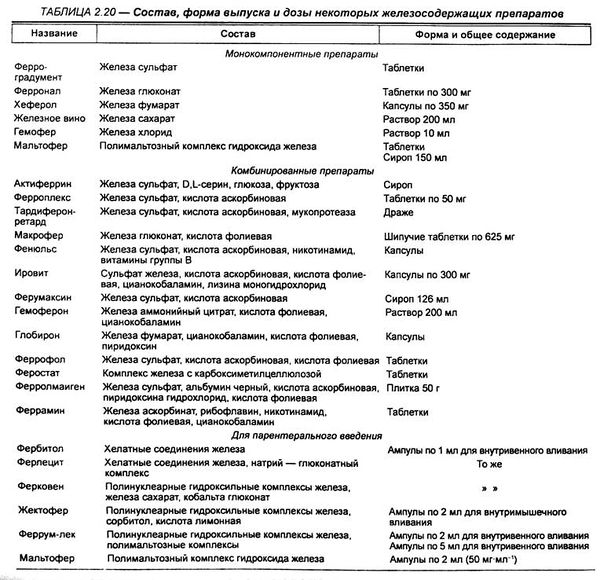
Выявленная закономерность прироста уровня гемоглобина, который регистрировался уже к концу 1-й недели, позволяла расценивать эту тенденцию как предиктор эффективности и ориентировку к продолжению лечения П.Ж. Значительно позже удалось подтвердить прогностическое значение темпов и величины прироста уровня гемоглобина для прогнозирования эффекта П.Ж. Получены важные результаты метаанализа 5 клинических рандомизированных исследований по оценке эффективности препаратов СЖ у больных ЖДА вследствие различных причин (меноррагии, послеродовой период, воспалительные заболевания кишечника и др.). В 73% случаев отмечался прирост к 14-му дню на 1 мг/дл уровня гемоглобина (1-я группа — ответившие на лечение), в то время как у 27% уровень гемоглобина к этому сроку повышался менее чем на 1 г/дл (2-я группа — не ответившие на лечение). В последующем больные 1-й группы продолжали получать длительную терапию пероральными ПЖ с эффектом, а пациентам 2-й группы назначались ПЖ внутривенно (железополимальтозные комплексы). Полученные результаты позволили авторам расценить величину прироста гемоглобина после двухнедельного лечения как предиктор эффективности лечения в дальнейшем, а в зависимости от динамики уровня гемоглобина принимать решение о дальнейшей тактике — продолжении приема пероральных ПЖ или назначение ПЖ внутривенно [9]. Специальные расчеты показали, что чувствительность и специфичность «теста двухнедельного прироста гемоглобина» составили 90,1 и 79,3%, а прогностическая ценность положительного и отрицательного результатов теста — 92,9 и 72,7% соответственно.
Полученные результаты позволили авторам расценить величину прироста гемоглобина после двухнедельного лечения как предиктор эффективности лечения в дальнейшем, а в зависимости от динамики уровня гемоглобина принимать решение о дальнейшей тактике — продолжении приема пероральных ПЖ или назначение ПЖ внутривенно [9]. Специальные расчеты показали, что чувствительность и специфичность «теста двухнедельного прироста гемоглобина» составили 90,1 и 79,3%, а прогностическая ценность положительного и отрицательного результатов теста — 92,9 и 72,7% соответственно.
ОС и ПЖ. Как известно, препараты солей железо содержат двухвалентное железо, которое после поступления в кровь превращается в трехвалентное для последующего его включения в молекулу гемоглобина. Превращение двухвалентного в трехвалентное железо благодаря потере одного электрона может сопровождаться образованием свободных радикалов и активацией свободнорадикальных процессов (СРП) — ОС, теоретически способным негативно влиять на физиологические процессы в различных органах и тканях. В то же время существует мнение, что препараты железосодержащих комплексов, в состав которых входит трехвалентное железо, лишены прооксидантного действия. Это различие между двумя группами железосодержащих препаратов постулируется как недостаток препаратов солей железа и преимущество железосодержащих комплексов. Между тем способность препаратов солей железа вызывать ОС показана лишь в эксперименте и в условиях in vitro. Реальность О.С. при лечении препаратами солей железа в клинических условиях оставалась недоказанной [10, 11].
В то же время существует мнение, что препараты железосодержащих комплексов, в состав которых входит трехвалентное железо, лишены прооксидантного действия. Это различие между двумя группами железосодержащих препаратов постулируется как недостаток препаратов солей железа и преимущество железосодержащих комплексов. Между тем способность препаратов солей железа вызывать ОС показана лишь в эксперименте и в условиях in vitro. Реальность О.С. при лечении препаратами солей железа в клинических условиях оставалась недоказанной [10, 11].
В проведенном нами исследовании активности СРП у больных ЖДА на фоне лечения препаратами солей железа (сорбифер дурулес, ферро-фольгамма) и железосодержащих комплексов (феррум лек) не удалось выявить различия по динамике показателей СРП (базальная и стимулированная хемолюминесценция, малоновый диальдегид — МДА) и антиперекисной активности плазмы в зависимости от принимаемого ПЖ [12]. Более того, при лечении препаратом сорбифер дурулес отмечалось статистически значимое снижение уровня МДА в плазме по сравнению с исходным уровнем, причем выявлена положительная корреляция между уровнями МДА и ЖСК. Полученные результаты свидетельствуют, что вопреки существующему мнению на фоне лечения СЖ не только не развивается ОС, но происходит снижение активности СРП. Возможно, это является результатом уменьшения выраженности анемии на фоне лечения препаратом сорбифер дурулес, а также наличием в его составе аскорбиновой кислоты, обладающей антиоксидантными свойствами. В более поздних работах получены неоднозначные результаты в отношении развития ОС при лечении препаратами солей железа. Так, при изучении влияния СЖ и железополимальтозного комплекса на процессы перекисного окисления у беременных с ЖДА наблюдалось снижение уровня МДА — основного показателя активности перекисного окисления и увеличение общей антиперекисной активности плазмы. Указанные изменения были выражены в одинаковой степени при применении препаратов двух- и трехвалентного железа [13]. В другом исследовании выявлены увеличение показателей перекисного окисления липидов [14] и снижение антиоксидантной активности у женщин с ЖДА, получавших С.
Полученные результаты свидетельствуют, что вопреки существующему мнению на фоне лечения СЖ не только не развивается ОС, но происходит снижение активности СРП. Возможно, это является результатом уменьшения выраженности анемии на фоне лечения препаратом сорбифер дурулес, а также наличием в его составе аскорбиновой кислоты, обладающей антиоксидантными свойствами. В более поздних работах получены неоднозначные результаты в отношении развития ОС при лечении препаратами солей железа. Так, при изучении влияния СЖ и железополимальтозного комплекса на процессы перекисного окисления у беременных с ЖДА наблюдалось снижение уровня МДА — основного показателя активности перекисного окисления и увеличение общей антиперекисной активности плазмы. Указанные изменения были выражены в одинаковой степени при применении препаратов двух- и трехвалентного железа [13]. В другом исследовании выявлены увеличение показателей перекисного окисления липидов [14] и снижение антиоксидантной активности у женщин с ЖДА, получавших С. Ж. Во всяком случае, клиническое значение такого «лабораторного феномена», как изменения показателей СРП на фоне применения СЖ, остается неясным и нуждается в дальнейшем изучении.
Ж. Во всяком случае, клиническое значение такого «лабораторного феномена», как изменения показателей СРП на фоне применения СЖ, остается неясным и нуждается в дальнейшем изучении.
Переносимость СЖ. Результаты метаанализа плацебо-контролируемых исследований по оценке переносимости пероральных и парентеральных ПЖ с включением 6831 больного [15] показали, что ПЭ в виде нарушения функций ЖКТ при лечении пероральными препаратами СЖ возникали чаще, чем на фоне плацебо (относительный риск — ОР 2,32 при 95% доверительном интервале — ДИ от 1,74 до 3,08) и ПЖ для внутривенного введения (ОР 3,05 при 95% ДИ от 2,07 до 4,48). Частота и выраженность ПЭ в группах больных с воспалительными заболеваниями кишечника и у беременных была одинаковой. Связи между ПЭ и суточной дозой ПЖ в диапазоне 100 —400 мг элементарного железо не отмечено. В ряде публикаций особое внимание обращено на ПЭ при применении СЖ и игнорируется очевидный клинический эффект, величина и темпы прироста уровней гемоглобина, доступность и экономические преимущества СЖ. В отсутствие исследований высокого методологического уровня по безопасности СЖ для убедительности приводятся единичные сообщения о токсических эффектах СЖ (поражение пищевода, желудка, кишечника и др.) [16] у пациентов различного возраста, без анализа конкретной ситуации, сопутствующей патологии, приема других лекарственных препаратов и т. д. Более того, в попытках убедить в токсичности СЖ в указанной работе приводится даже ссылка на случай отравления ребенка, принявшего 30 (!) таблеток данного препарата [17]. Нелепость данного случая в качестве иллюстрации токсичности лекарственных препаратов СЖ очевидна, поскольку в подобных ситуациях в отсутствие контроля родителей любой фармакологический препарат может быть дискредитирован. В качестве дополнительного аргумента против СЖ приводятся результаты экспериментального исследования по оценке влияния двух- и трехвалентных ПЖ на функцию печени и почек у крыс [18]. Результаты, подкрепленные фотографиями с отложением железа в органах, свидетельствуют, по мнению авторов, о токсическом влиянии препаратов двухвалентного железа по сравнению с трехвалентным.
В отсутствие исследований высокого методологического уровня по безопасности СЖ для убедительности приводятся единичные сообщения о токсических эффектах СЖ (поражение пищевода, желудка, кишечника и др.) [16] у пациентов различного возраста, без анализа конкретной ситуации, сопутствующей патологии, приема других лекарственных препаратов и т. д. Более того, в попытках убедить в токсичности СЖ в указанной работе приводится даже ссылка на случай отравления ребенка, принявшего 30 (!) таблеток данного препарата [17]. Нелепость данного случая в качестве иллюстрации токсичности лекарственных препаратов СЖ очевидна, поскольку в подобных ситуациях в отсутствие контроля родителей любой фармакологический препарат может быть дискредитирован. В качестве дополнительного аргумента против СЖ приводятся результаты экспериментального исследования по оценке влияния двух- и трехвалентных ПЖ на функцию печени и почек у крыс [18]. Результаты, подкрепленные фотографиями с отложением железа в органах, свидетельствуют, по мнению авторов, о токсическом влиянии препаратов двухвалентного железа по сравнению с трехвалентным. Правда, не учитывалось, что исследование проводилось на крысах без признаков дефицита железа, а это могло определять особенности феррокинетики. Поэтому эти данные экспериментальных исследований не могут безоговорочно переноситься в клиническую практику. Кроме того, токсические дозы (LD50) сульфата и глюконата железа для белых мышей практически одинаковы (11 и 13 мг/кг соответственно), что не дает оснований говорить о большей «токсичности» СЖ [19]. В последние несколько лет стали публиковаться описания случаев отложения железа в слизистой оболочке желудка (СОЖ) и двенадцатиперстной кишки (ДПК) у больных ЖДА на фоне лечения П.Ж. По мнению исследователей [20], случаи отложения железа в СОЖ и ДПК не являются редкостью при лечении препаратами солей железа и обычно исчезают после отмены П.Ж. Кроме того, отложение железа в СОЖ может встречаться при различных патологических состояниях (гемохроматоз, алкоголизм, варикозное расширение вен пищевода при портальной гипертензии, трансфузиях эритроцитов, при эрозивно-язвенных желудочных кровотечениях).
Правда, не учитывалось, что исследование проводилось на крысах без признаков дефицита железа, а это могло определять особенности феррокинетики. Поэтому эти данные экспериментальных исследований не могут безоговорочно переноситься в клиническую практику. Кроме того, токсические дозы (LD50) сульфата и глюконата железа для белых мышей практически одинаковы (11 и 13 мг/кг соответственно), что не дает оснований говорить о большей «токсичности» СЖ [19]. В последние несколько лет стали публиковаться описания случаев отложения железа в слизистой оболочке желудка (СОЖ) и двенадцатиперстной кишки (ДПК) у больных ЖДА на фоне лечения П.Ж. По мнению исследователей [20], случаи отложения железа в СОЖ и ДПК не являются редкостью при лечении препаратами солей железа и обычно исчезают после отмены П.Ж. Кроме того, отложение железа в СОЖ может встречаться при различных патологических состояниях (гемохроматоз, алкоголизм, варикозное расширение вен пищевода при портальной гипертензии, трансфузиях эритроцитов, при эрозивно-язвенных желудочных кровотечениях). Наличие локального воспалительного процесса, кровотечений, сочетанной патологии, сопутствующая лекарственная терапия способствуют отложению железа в слизистой оболочке у больных, леченых пероральными ПЖ [21]. Описание отдельных случаев эрозивных процессов в верхних отделах ЖКТ при применении СЖ не выходит за рамки спонтанных сообщений в отношении как количества, так и характера ПЭ, которые ранее не указывались в характеристике препарата. Эти сообщения о ПЭ иллюстрируют лишь специфические для данного класса препаратов проявления, присущие как ПЖ, так и другим фармакологическим препаратам и не могут быть основанием для исключения или ограничения использования препаратов СЖ в клинической практике. Ведь такие хорошо известные специфические для класса проявления, как эрозивно-язвенные поражения ЖКТ, даже с кровотечениями у нестероидных противовоспалительных препаратов и глюкокортикостероидов, геморрагии у антикоагулянтов, аллергические реакции, в том числе анафилактический шок у антибиотиков, никогда не служили поводом для отзыва этих групп препаратов с фармацевтического рынка.
Наличие локального воспалительного процесса, кровотечений, сочетанной патологии, сопутствующая лекарственная терапия способствуют отложению железа в слизистой оболочке у больных, леченых пероральными ПЖ [21]. Описание отдельных случаев эрозивных процессов в верхних отделах ЖКТ при применении СЖ не выходит за рамки спонтанных сообщений в отношении как количества, так и характера ПЭ, которые ранее не указывались в характеристике препарата. Эти сообщения о ПЭ иллюстрируют лишь специфические для данного класса препаратов проявления, присущие как ПЖ, так и другим фармакологическим препаратам и не могут быть основанием для исключения или ограничения использования препаратов СЖ в клинической практике. Ведь такие хорошо известные специфические для класса проявления, как эрозивно-язвенные поражения ЖКТ, даже с кровотечениями у нестероидных противовоспалительных препаратов и глюкокортикостероидов, геморрагии у антикоагулянтов, аллергические реакции, в том числе анафилактический шок у антибиотиков, никогда не служили поводом для отзыва этих групп препаратов с фармацевтического рынка. При упоминании о ПЭ любого фармакологического препарата, в том числе СЖ, всегда вспоминается высказывание известного отечественного интерниста Б.Е. Вотчала: «Если препарат лишен побочных эффектов, стоит задуматься, есть ли у него какие-либо эффекты вообще».
При упоминании о ПЭ любого фармакологического препарата, в том числе СЖ, всегда вспоминается высказывание известного отечественного интерниста Б.Е. Вотчала: «Если препарат лишен побочных эффектов, стоит задуматься, есть ли у него какие-либо эффекты вообще».
Уже в ранних попытках оценки переносимости ПЖ в проведенном рандомизированном двойном слепом исследовании, которое, казалось, предваряло современные оживленные дискуссии о переносимости различных пероральных ПЖ, показано, что побочные реакции ЖКТ наблюдались одинаково часто при применении в эквивалентных дозах препаратов солей железа трех групп — сульфата, фумарата, глюконата [22]. Более чем через полвека эти результаты подтвердились на большом клиническом материале. В обстоятельном системном обзоре, включавшем электронные базы данных, кохрановские обзоры, а также результаты клинических исследований и спонтанные сообщения о ПЭ, проведен анализ переносимости различных пероральных ПЖ у больных ЖДА. При этом проанализировано 111 исследований, включавших 10 695 пациентов [23]. Наименьшая частота ПЭ наблюдалась при применении СЖ, содержащего мукопротеазу (общие 4,1%, нарушения функции ЖКТ 3,7%). При дальнейшем анализе ПЭ данный ПЖ использован как референсный в регрессионной модели. Частота П.Э. при применении других ПЖ оказалась следующая: протеинсукцинилат железа — 7,3% (ЖКТ-ПЭ — 7%; отношение шансов — OШ по сравнению с референсным препаратом 1,96), глицинсульфат железа — 23,5% (ЖКТ-ПЭ — 18,5%; ОШ 5,90), глюконат железа — 30,9% (ЖКТ- ПЭ — 29,9%; ОШ 11,06), СЖ без мукопротеазы — 32,3% (ЖКТ-ПЭ — 30,2%; ОШ 11,21), фумарат железа — 47% (ЖКТ-ПЭ — 43,4%; ОШ 19,87).
Наименьшая частота ПЭ наблюдалась при применении СЖ, содержащего мукопротеазу (общие 4,1%, нарушения функции ЖКТ 3,7%). При дальнейшем анализе ПЭ данный ПЖ использован как референсный в регрессионной модели. Частота П.Э. при применении других ПЖ оказалась следующая: протеинсукцинилат железа — 7,3% (ЖКТ-ПЭ — 7%; отношение шансов — OШ по сравнению с референсным препаратом 1,96), глицинсульфат железа — 23,5% (ЖКТ-ПЭ — 18,5%; ОШ 5,90), глюконат железа — 30,9% (ЖКТ- ПЭ — 29,9%; ОШ 11,06), СЖ без мукопротеазы — 32,3% (ЖКТ-ПЭ — 30,2%; ОШ 11,21), фумарат железа — 47% (ЖКТ-ПЭ — 43,4%; ОШ 19,87).
Различие по частоте развития ПЭ при применении СЖ с мукопротеазой (препарат с замедленной формой высвобождения железа) и других ПЖ статистически значимо (p<0,001). Приведенные данные не только подтверждают хорошо известный факт ПЭ при применении пероральных ПЖ, но и уточняют частоту развития этих ПЭ при различных П.Ж. При этом частота развития ПЭ при использовании СЖ незначительно превышает таковую для глюконата железа и уступает фумарату железа. Наиболее важной в переносимости пероральных ПЖ следует считать не столько принадлежность препарата к конкретной соли железа (глюконат, сульфат, фумарат и т. д.), сколько лекарственную форму ПЖ, содержащую продукты, обеспечивающие замедленное высвобождение железа (СЖ с мукопротеазой). Достоверное различие по частоте развития ПЭ при использовании различных лекарственных форм СЖ позволяет критически оценивать результаты исследований о переносимости препарата, в том числе сообщения о различных ПЭ в виде нарушения функции ЖКТ без учета применяемой лекарственной формы (обычной или с замедленным высвобождением). В связи с этим уместно указать на особенность одного из препаратов на основе СЖ с замедленным высвобождением железа — сорбифер дурулес. Технология «дурулес» основана на наличии действующего вещества в биологически инертной пластиковой субстанции. Высвобождение этого действующего вещества происходит постепенно — вначале из поверхностных, а затем из более глубоких слоев. После полного высвобождения опустевший носитель разрушается и выводится из кишечника.
Наиболее важной в переносимости пероральных ПЖ следует считать не столько принадлежность препарата к конкретной соли железа (глюконат, сульфат, фумарат и т. д.), сколько лекарственную форму ПЖ, содержащую продукты, обеспечивающие замедленное высвобождение железа (СЖ с мукопротеазой). Достоверное различие по частоте развития ПЭ при использовании различных лекарственных форм СЖ позволяет критически оценивать результаты исследований о переносимости препарата, в том числе сообщения о различных ПЭ в виде нарушения функции ЖКТ без учета применяемой лекарственной формы (обычной или с замедленным высвобождением). В связи с этим уместно указать на особенность одного из препаратов на основе СЖ с замедленным высвобождением железа — сорбифер дурулес. Технология «дурулес» основана на наличии действующего вещества в биологически инертной пластиковой субстанции. Высвобождение этого действующего вещества происходит постепенно — вначале из поверхностных, а затем из более глубоких слоев. После полного высвобождения опустевший носитель разрушается и выводится из кишечника. Равномерное и постепенное высвобождение железа в малых количествах способствует меньшему раздражению слизистой оболочки кишечника и лучшей переносимости препарата, что немаловажно при длительной терапии П.Ж. Имеющиеся данные о переносимости и тем более опасности обычных лекарственных форм СЖ не могут автоматически переноситься на формы с замедленным высвобождением железа, которые в целом переносятся лучше [24]. Еще в 70-х годах прошлого столетия в трех рандомизированных исследованиях показана лучшая переносимость препаратов с замедленным высвобождением железа по сравнении обычными лекарственными формами ПЖ [25—27]. В системном обзоре 106 исследований, включавших более 10 тыс. больных, леченных различными пероральными ПЖ [28], показана статистически значимо более низкая частота нарушения функции ЖКТ при приеме ПЖ с замедленным высвобождением железа (3,7%) по сравнении с другими лекарственными формами СЖ (31,6%), в том числе фумаратом железа (44,8%).
Равномерное и постепенное высвобождение железа в малых количествах способствует меньшему раздражению слизистой оболочки кишечника и лучшей переносимости препарата, что немаловажно при длительной терапии П.Ж. Имеющиеся данные о переносимости и тем более опасности обычных лекарственных форм СЖ не могут автоматически переноситься на формы с замедленным высвобождением железа, которые в целом переносятся лучше [24]. Еще в 70-х годах прошлого столетия в трех рандомизированных исследованиях показана лучшая переносимость препаратов с замедленным высвобождением железа по сравнении обычными лекарственными формами ПЖ [25—27]. В системном обзоре 106 исследований, включавших более 10 тыс. больных, леченных различными пероральными ПЖ [28], показана статистически значимо более низкая частота нарушения функции ЖКТ при приеме ПЖ с замедленным высвобождением железа (3,7%) по сравнении с другими лекарственными формами СЖ (31,6%), в том числе фумаратом железа (44,8%).
При принятии решения о назначении ПЖ требуется учитывать соотношение пользы и риска, т. е. неизбежно возникает вопрос, озвученный в названии одной из статей о лечении ЖДА, — «Что важнее, эффективность или переносимость?» [29]. Так, польза препаратов СЖ в обеспечении качества жизни у менструирующих женщин с ЖДА может оправдывать назначение ПЖ данной группы, несмотря на реальность возникающих ПЭ [30].
е. неизбежно возникает вопрос, озвученный в названии одной из статей о лечении ЖДА, — «Что важнее, эффективность или переносимость?» [29]. Так, польза препаратов СЖ в обеспечении качества жизни у менструирующих женщин с ЖДА может оправдывать назначение ПЖ данной группы, несмотря на реальность возникающих ПЭ [30].
Пути предупреждения и снижения частоты развития ПЭ при применении препаратов СЖ. Для снижения частоты развития ПЭ на фоне лечения пероральными ПЖ рекомендуется следующее [31]:
— снижение суточной дозы,
— увеличения интервалов между приемом препарата,
— применение ПЖ с замедленным высвобождением железа (например, технология «дурулес»),
— прием ПЖ с пищей или молоком (при этом возможно снижение абсорбции железа),
— переход на ПЖ с более низким содержанием элементарного железа (имеется риск применения недостаточной дозировки железа),
— переход на жидкие лекарственные формы (более легкий подбор дозы),
— при подборе дозы возможно постепенное увеличение дозы до переносимой.
Проведенные в последнее время исследования абсорбции железа и влияющих на нее факторов при железодефиците могут служить поводом для пересмотра традиционных схем назначения П.Ж. Как известно, абсорбция железа регулируется белком гепсидином, продуцирующимся в печени. В одном исследовании [32] проводилась оценка абсорбции железа, меченного радиоактивным изотопом, у женщин с железодефицитом (ферритин <20 нг/мл) без анемии на фоне приема пероральных ПЖ в разной дозировке (от 40 до 80 мг элементарного железа). Показано, что при более высокой дозе и частом приеме ПЖ повышается уровень гепсидина, а это ведет к торможению абсорбции железа. Повышенный уровень гепсидина сохраняется около 48 ч после однократного приема ПЖ, в связи с чем абсорбция железа после приема очередной дозы препарата через сутки снижается под влиянием еще сохраняющегося повышенного уровня гепсидина.
Полученные данные требуют подтверждения и уточнения, поскольку исследование проводилось у женщин с железодефицитом без анемии, которые могут отвечать на ПЖ иначе, чем больные с клинически проявляющейся ЖДА. Тем не менее эти результаты являются принципиально важными, поскольку могут менять парадигму режима дозирования ПЖ (суточная доза и кратность приема) у больных ЖДА, что позволит предупреждать ПЭ или снижать частоту их развития.
Тем не менее эти результаты являются принципиально важными, поскольку могут менять парадигму режима дозирования ПЖ (суточная доза и кратность приема) у больных ЖДА, что позволит предупреждать ПЭ или снижать частоту их развития.
Есть основания считать, что назначение ПЖ с меньшим содержанием элементарного железа может обеспечить оптимальную биодоступность препарата и меньший риск развития ПЭ [33]. Подтверждением такого предположения могут служить результаты рандомизированного исследования с участием 90 больных ЖДА старше 80 лет. После приема в течение 2 мес пероральных ПЖ, содержащих 15, 50 и 150 мг элементарного железа в препарате, темпы повышения уровня гемоглобина и ферритина были примерно одинаковыми и не зависели от дозы [34]. При этом частота развития ПЭ была значительно меньше при назначении ПЖ с более низким содержанием элементарного железа.
Уменьшить нежелательное влияние на ЖКТ препаратов солей железа можно, принимая их во время еды или с молоком, хотя при этом возможно снижение абсорбции железа [35]. Назначение жидких форм ПЖ позволяет менять дозировку, но оказывается менее комфортным для больных, как и прием других препаратов в виде жидких лекарственных форм, что может стать одним из факторов снижения точности соблюдения больными схемы назначенного лечения. Кроме того, прием жидких лекарственных форм ПЖ может вызывать окрашивание зубов.
Назначение жидких форм ПЖ позволяет менять дозировку, но оказывается менее комфортным для больных, как и прием других препаратов в виде жидких лекарственных форм, что может стать одним из факторов снижения точности соблюдения больными схемы назначенного лечения. Кроме того, прием жидких лекарственных форм ПЖ может вызывать окрашивание зубов.
Одним из путей предупреждения ПЭ и снижения частоты их развития является применение ПЖ с замедленным высвобождением железа (например, технология «дурулес»), что обеспечивает поэтапное и длительное высвобождение активного ингредиента (ионов железа). Примечательно, что объем продаж одного из препаратов СЖ c замедленным высвобождением железо (сорбифер дурулес) превышает таковой всех других пероральных ПЖ и сохраняет стабильность на протяжении нескольких лет [36].
Использование препаратов СЖ с замедленным высвобождением железа позиционируется как клинический стандарт лечения ЖДА, независимо от показаний [37, 38].
СЖ сохраняет свои позиции и продолжает оставаться оптимальным пероральным ПЖ с точки зрения эффективности, переносимости, доступности, экономичности и востребованности пациентами. Имеющиеся единичные публикации о поражениях верхних и нижних отделов ЖКТ, не достигающих опасного уровня спонтанных сообщений, не могут служить основаниям для отказа или ограничения применения препарата в клинической практике. Основные пути снижения частоты развития ПЭ включают предпочтение лекарственных форм с замедленным высвобождением железа, использование меньших доз препарата, альтернирующий прием ПЖ (назначение через день), контроль за использованием сопутствующей лекарственной терапии. Сохраняющаяся плохая переносимость СЖ, а также отсутствие эффекта могут служить показанием к назначению препаратов железосодержащих комплексов внутрь или ПЖ парентерально.
Имеющиеся единичные публикации о поражениях верхних и нижних отделов ЖКТ, не достигающих опасного уровня спонтанных сообщений, не могут служить основаниям для отказа или ограничения применения препарата в клинической практике. Основные пути снижения частоты развития ПЭ включают предпочтение лекарственных форм с замедленным высвобождением железа, использование меньших доз препарата, альтернирующий прием ПЖ (назначение через день), контроль за использованием сопутствующей лекарственной терапии. Сохраняющаяся плохая переносимость СЖ, а также отсутствие эффекта могут служить показанием к назначению препаратов железосодержащих комплексов внутрь или ПЖ парентерально.
капсулы, 30 кБк — Энциклопедия лекарств РЛС
Аналоги
Все формы выпуска, дозировки, регистрационные удостоверения, производители лекарства, характеристики препарата
Железа сульфат, 59Fe (капсулы, 30 кБк), инструкция по медицинскому применению РУ № ЛСР-009614/09
Дата последнего изменения: 23. 06.2011
06.2011
Содержание
- ATX
- Фармакологическая группа
- Лекарственная форма
- Состав
- Свойства компонентов
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Фармако-терапевтическая группа
- Показания
- Противопоказания
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
ATX
V09XX Радиофармацевтические диагностические препараты прочие
Фармакологическая группа
Радиопрофилактические и радиотерапевтические средства
Лекарственная форма
Капсулы
Состав
В одной капсуле содержится:
Активные вещества:
— Железо-59 — 30 кБк
Вспомогательные вещества:
— Декстроза не более — 300 мг
— Капсула желатиновая (диоксид титана) — 2,5%
— Желатин — до — 100%
— Краситель пунцовый — 1,36%
— Железа (III) оксид- 0,85%
Свойства компонентов
Физико-химические свойства
Железа сульфат, 59 Fe — радиофармацевтический диагностический препарат представляет собой сульфат железа-59, адсорбированный на наполнителе (декстроза) в желатиновой капсуле. Активность железа-59 составляет 30 кБк на дату поставки. Допустимое отклонение значений активности железа-59 в каждой капсуле от номинала ± 10%.
Активность железа-59 составляет 30 кБк на дату поставки. Допустимое отклонение значений активности железа-59 в каждой капсуле от номинала ± 10%.
Радионуклид 59 Fe является бета и гамма-излучателем с периодом полураспада 44,5 дня.
Наиболее интенсивное гамма-излучение имеет энергии: 0,192 (2,8%) МэВ, 1,099 (56,4%) МэВ, 1,292 (43,3%) МэВ. Наиболее интенсивное бета-излучение 59 Fe имеет энергии: 0,274 (46%) МэВ, 0,467 (53%) МэВ, 1,566 (0,3%) МэВ.
Описание лекарственной формы
Капсула желатиновая № 1, твердая, корпус белого цвета, крышечка оранжевого цвета.
Содержимое капсулы — порошок белого цвета.
Фармакокинетика
Основное количество радиоактивного железа через 3 часа содержится в желудочно-кишечном тракте (желудок-3 6%, тонкий кишечник-3 3%, толстый кишечник-19% от введенного количества). Радиоактивность, обусловленная 59 Fe , в крови, почках, через три часа незначительно превышает фоновую, а в костном мозге, селезенке, мышечной ткани не превышает ее. Через 5 часов после введения радиоактивность в желудке и тонком кишечнике снижается до 14% и 12% соответственно и возрастает в толстом кишечнике до 33% от введенного количества, а через 24-48 часов из организма выводится 95% от введенной активности.
Через 5 часов после введения радиоактивность в желудке и тонком кишечнике снижается до 14% и 12% соответственно и возрастает в толстом кишечнике до 33% от введенного количества, а через 24-48 часов из организма выводится 95% от введенной активности.
Уровень накопления препарата в опухоли достигает 0,7 — 0,9% от введенного количества и не изменяется в течение 48 часов.
Фармакодинамика
Капсула, введенная натощак через рот, растворяется в желудке. Принцип действия препарата заключается в распространении железа с током крови и избирательном накоплении, в частности, в клетках опухолевой ткани.
Фармако-терапевтическая группа
Радиофармацевтическое диагностическое средство.
Показания
Рекомендуется использовать как скрининг метод выявления патологии молочной железы.
Противопоказания
У пациентов с нарушением акта глотания. Беременность, кормление грудью, возраст до 18 лет.
Способ применения и дозы
Препарат вводится перорально.
А. Методика проведения обследования.
За 24 часа до обследования пациент натощак принимает одну капсулу активностью 30 кБк. Спустя 24-36 часов после введения препарата измеряют излучение 59 Fe на двухканальном сцинтилляционном гамма-спектрометре от обеих молочных желез одновременно. Измерение проводят два раза: до введения препарата (собственный фон) и через 24-36 часов после введения. Продолжительность измерения 5-10 минут.
Б. Интерпретация результатов.
На полученных спектрограммах фиксируется уровень накопления препарата в каждой из молочных желез (с вычетом фоновых данных), на основании которых проводится сравнительный количественный анализ. Результаты исследования считаются положительными в случае превышения накопления РФП в одной из молочных желез в 1,4 раза и более по сравнению с контрлатеральной.
Лучевые нагрузки на органы и ткани пациента при использовании препарата
«Железа сульфат, 59 Fe», капсулы 30 кБк
Орган | мГр/кБк |
Надпочечники | 6?10-6 |
Мочевой пузырь | 5?10-6 |
Скелет | 4?10-6 |
Головной мозг | 4?10-6 |
Молочная железа | 2?10-6 |
Желчный пузырь | 5?10-6 |
Желудок | 1,2?10-5 |
Точный кишечник | 9?10-6 |
Верхний отдел толстого кишечника | 8?10-6 |
Нижний отдел толстого кишечника | 8?10-6 |
Почки | 1?10-5 |
Печень | 1,5?10-5 |
Легкие | 1?10-6 |
Мышцы | 5?10-6 |
Яичники | 3?10-6 |
Семенники | 2?10-6 |
Поджелудочная железа | 8?10-6 |
Красный костный мозг | 5?10-6 |
Кожа | 5?10-6 |
Вилочковая железа | 5?10-6 |
Матка | 7?10-6 |
Эквивалентная доза (мЗв/кБк) | 2?10-3 |
Побочные действия
Каких-либо побочных действий при применении препарата в диагностических целях не выявлено.
Взаимодействие
В используемых дозировках взаимодействие с другими лекарственными средствами не отмечалось.
Передозировка
Передозировка препарата маловероятна в связи с тщательным контролем вводимой активности в условиях специализированного стационара.
Особые указания
Работа с препаратом должна проводиться в соответствии с требованиями: «Основных санитарных правил обеспечения радиационной безопасности» (ОСПОРБ — 99), «Норм радиационной безопасности» (НРБ-99) и Методических указаний «Гигиенические требования по обеспечению радиационной безопасности при проведении радионуклидной диагностики с помощью радиофармпрепаратов» (МУ 2.6.1. 1892-04).
Форма выпуска
Капсулы 30 кБк на установленную дату поставки в герметически укупоренных флаконах по 10 или 15 капсул. Флакон с паспортом и инструкцией по медицинскому применению в комплекте упаковочном транспортном для радиоактивных веществ.
Условия отпуска из аптек
Реализации через аптечную сеть не подлежит. Отпускается только по заявкам в специализированные радиоизотопные лаборатории лечебно-диагностических учреждений.
Отпускается только по заявкам в специализированные радиоизотопные лаборатории лечебно-диагностических учреждений.
Условия хранения
Препарат хранят с соблюдением ОСПОРБ-99, в сухом прохладном, защищенном от света месте.
Срок годности
30 суток с даты изготовления. Не использовать после окончания срока годности.
Отзывы
Амбулаторное лечение распространенных форм анемии
ДЭВИД Р. ЛИТТЛ, M.D., M.S.
Семейный врач. 1999;59(6):1598-1604
Анемия является распространенным заболеванием с множеством основных причин. После установления этиологии многие формы анемии могут быть легко вылечены семейным врачом. Дефицит железа, наиболее распространенную форму анемии, можно лечить перорально или, реже, парентерально. Дефицит витамина B 12 традиционно лечили внутримышечными инъекциями, хотя также доступны пероральные и интраназальные препараты. Лечение дефицита фолиевой кислоты простое, основанное на пероральных добавках. Добавка фолиевой кислоты также рекомендуется женщинам детородного возраста, чтобы снизить риск дефектов нервной трубки. Текущие исследования сосредоточены на роли фолиевой кислоты в снижении риска преждевременных сердечно-сосудистых заболеваний.
Дефицит железа, наиболее распространенную форму анемии, можно лечить перорально или, реже, парентерально. Дефицит витамина B 12 традиционно лечили внутримышечными инъекциями, хотя также доступны пероральные и интраназальные препараты. Лечение дефицита фолиевой кислоты простое, основанное на пероральных добавках. Добавка фолиевой кислоты также рекомендуется женщинам детородного возраста, чтобы снизить риск дефектов нервной трубки. Текущие исследования сосредоточены на роли фолиевой кислоты в снижении риска преждевременных сердечно-сосудистых заболеваний.
Анемия — распространенный клинический синдром, который часто диагностируется и лечится семейным врачом. Сообщается, что распространенность анемии в Соединенных Штатах составляет от 29 до 30 случаев на 1000 женщин всех возрастов и шесть случаев на 1000 мужчин в возрасте до 45 лет, достигая пика в 18,5 случаев на 1000 мужчин старше 75 лет. 1
1
Анемия определяется как снижение ниже нормы общего объема эритроцитов (гематокрит) или концентрации гемоглобина в крови. 2 Нормальные значения гематокрита и гемоглобина зависят от возраста и пола (Таблица 1) . 2 Правильное ведение пациента с анемией требует точного этиологического диагноза. Опубликованные алгоритмы могут помочь врачу в определении причины анемии. 3 Дефицит железа, витамина B 12 и фолиевой кислоты относится к наиболее частым причинам. Эти формы анемии можно легко лечить в амбулаторных условиях.
Правообладатель не предоставлял права на воспроизведение данного объекта на электронных носителях. Отсутствующий элемент см. в оригинальной печатной версии этой публикации.
Дефицит железа является наиболее распространенной причиной анемии во всем мире. 2 У детей дефицит обычно вызывается диетой. 4 У взрослых причиной следует считать результат хронической кровопотери, пока не будет установлен окончательный диагноз. Как только будет определена основная причина дефицита железа, можно начинать заместительную терапию железом. Железо доступно в пероральной и парентеральной формах.
Как только будет определена основная причина дефицита железа, можно начинать заместительную терапию железом. Железо доступно в пероральной и парентеральной формах.
Пероральные препараты железа доступны как в виде двухвалентного, так и трехвалентного состояния. Соли двухвалентного железа всасываются гораздо легче и обычно предпочтительнее. 5 Общедоступные пероральные препараты (Таблица 2) включают сульфат железа, глюконат железа и фумарат железа (Гемоцит). Все три формы хорошо усваиваются, но различаются по содержанию элементарного железа. Сульфат железа является наименее дорогой и наиболее часто используемой пероральной добавкой железа.
| Preparation | Elemental iron (%) | Typical dosage | Elemental iron per dose | Cost (generic)* |
|---|---|---|---|---|
| Ferrous sulfate | 20 | 325 мг три раза в день | 65 мг | от 1,33 до 2,42 долларов США |
| Сульфат железа, высушенный (феосол) | 30 | 2090 мг три раза в день0073 | 65 мг | 6. 94 94 |
| Глюконат железа | 12 | 325 мг. | 106 мг | 9,00 (от 1,68 до 2,93) |
Для заместительной терапии железом большинство органов рекомендуют дозировку, эквивалентную 150–200 мг элементарного железа в день. 5,6 Однако недавние исследования показали, что элементарное железо в дозах всего 60 мг один или два раза в неделю полезно для отдельных групп населения. 7,8 Необходимы дальнейшие исследования для определения оптимального режима дозирования для заместительной терапии железом.
Стандартная суточная доза 325 мг сульфата железа, разделенная на три приема, обеспечит необходимое элементарное железо для пациентов, получающих заместительную терапию. Уровни гематокрита должны улучшиться в течение одного-двух месяцев после начала терапии; однако уровень ферритина в сыворотке является более точным показателем общего запаса железа в организме. Адекватное замещение железа обычно происходит, когда уровень ферритина в сыворотке достигает 50 мкг/л (8,9мкмоль на л). 9–11 В зависимости от причины и тяжести анемии, а также от продолжающейся кровопотери для восполнения дефицита железа обычно требуется прием препаратов железа от четырех до шести месяцев. Тем не менее, одно недавнее исследование показало, что заместительная терапия сохраняется в течение двух лет. 12 У пациентов с постоянной потребностью в железе для поддерживающей терапии может потребоваться суточная доза 325 мг сульфата железа. Это, конечно, зависит от количества железа в рационе пациента.
Адекватное замещение железа обычно происходит, когда уровень ферритина в сыворотке достигает 50 мкг/л (8,9мкмоль на л). 9–11 В зависимости от причины и тяжести анемии, а также от продолжающейся кровопотери для восполнения дефицита железа обычно требуется прием препаратов железа от четырех до шести месяцев. Тем не менее, одно недавнее исследование показало, что заместительная терапия сохраняется в течение двух лет. 12 У пациентов с постоянной потребностью в железе для поддерживающей терапии может потребоваться суточная доза 325 мг сульфата железа. Это, конечно, зависит от количества железа в рационе пациента.
Побочные эффекты пероральной заместительной терапии железом встречаются у большинства пациентов. Они в основном желудочно-кишечного происхождения и включают тошноту, запор, диарею и боль в животе. Чтобы свести к минимуму побочные эффекты, препараты железа следует принимать во время еды; однако это может снизить усвоение железа на 40-66 процентов. 5 Переход на другую соль железа или препарат с контролируемым высвобождением 13 также может уменьшить побочные эффекты. Тем не менее от 10 до 20 процентов пациентов прекращают прием препаратов железа из-за побочных эффектов.
Тем не менее от 10 до 20 процентов пациентов прекращают прием препаратов железа из-за побочных эффектов.
Для оптимальной доставки пероральные добавки железа должны быстро растворяться в желудке, чтобы железо могло всасываться в двенадцатиперстной кишке и верхних отделах тощей кишки. Препараты с кишечнорастворимой оболочкой малоэффективны, так как не растворяются в желудке. 13 Лекарственные взаимодействия также могут возникать у пациентов, получающих препараты железа перорально, что приводит к снижению всасывания железа или взаимодействию с другими препаратами (Таблица 3) . 5
Правообладатель не предоставлял права на воспроизведение данного объекта на электронных носителях. Отсутствующий элемент см. в оригинальной печатной версии этой публикации.
Доступны различные продукты, содержащие комбинации железа, витамина B 12 , фолиевой кислоты и других питательных веществ. Использование этих продуктов настоятельно не рекомендуется, за исключением пациентов с алиментарной анемией, связанной с очень плохим питанием или недоеданием. 14 Даже у этих пациентов предпочтительнее использование более специфической заместительной терапии. Было показано, что витамин С (аскорбиновая кислота) улучшает всасывание железа, что привело к созданию комбинированных продуктов, включающих железо и витамин С. На практике, однако, дополнительное количество железа, абсорбируемого с этим комбинированным продуктом, редко бывает клинически полезным и не оправдывает более высокую стоимость. 14 Другое недавнее исследование 15 показало, что дефицит цинка является фактором, способствующим развитию железодефицитной анемии у бегунов на выносливость, хотя для полного объяснения клинической значимости этой взаимосвязи потребуются дальнейшие исследования.
14 Даже у этих пациентов предпочтительнее использование более специфической заместительной терапии. Было показано, что витамин С (аскорбиновая кислота) улучшает всасывание железа, что привело к созданию комбинированных продуктов, включающих железо и витамин С. На практике, однако, дополнительное количество железа, абсорбируемого с этим комбинированным продуктом, редко бывает клинически полезным и не оправдывает более высокую стоимость. 14 Другое недавнее исследование 15 показало, что дефицит цинка является фактором, способствующим развитию железодефицитной анемии у бегунов на выносливость, хотя для полного объяснения клинической значимости этой взаимосвязи потребуются дальнейшие исследования.
Использование препаратов железа (или любых гематиновых агентов) для эмпирической терапии у пациентов с недифференцированными симптомами нецелесообразно. Во многих случаях эта практика может нанести вред пациенту. Например, введение железа ухудшит состояние больных с невыявленным гемохроматозом. 16 Применение фолиевой кислоты у пациентов с невыявленным дефицитом витамина B 12 вызовет временное улучшение гематологических показателей, но будет маскировать клинические симптомы дефицита витамина B 12 , позволяя неврологическому ухудшению продолжаться. 17
16 Применение фолиевой кислоты у пациентов с невыявленным дефицитом витамина B 12 вызовет временное улучшение гематологических показателей, но будет маскировать клинические симптомы дефицита витамина B 12 , позволяя неврологическому ухудшению продолжаться. 17
При лечении пациентов с подтвержденной железодефицитной анемией, которые не реагируют на пероральную заместительную терапию, врач должен попытаться определить причину резистентности к железу. Потенциальные причины включают продолжающуюся кровопотерю, неэффективное потребление и неэффективное всасывание (Таблица 4) . 18 Продолжающаяся кровопотеря может быть явной (например, менструация, геморрой) или скрытой (например, злокачественные новообразования желудочно-кишечного тракта, кишечные паразиты, побочные эффекты нестероидных противовоспалительных препаратов). Эти источники кровопотери следует оценивать при первичном обследовании пациента с железодефицитной анемией.
| Продолжающаяся кровопотеря | ||||||||||||||||||||||||||||
| Менструация | ||||||||||||||||||||||||||||
| Bleeding hemorrhoids | ||||||||||||||||||||||||||||
| Occult malignancy (especially gastrointestinal) | ||||||||||||||||||||||||||||
| NSAID use and gastrointestinal bleeding | ||||||||||||||||||||||||||||
| Intestinal parasites | ||||||||||||||||||||||||||||
| Ineffective iron intake | ||||||||||||||||||||||||||||
| Poor compliance | ||||||||||||||||||||||||||||
| Gastrointestinal side effects | ||||||||||||||||||||||||||||
| Кислотоснижающая терапия | ||||||||||||||||||||||||||||
| Неэффективное всасывание железа | ||||||||||||||||||||||||||||
| Malabsortion States | ||||||||||||||||||||||||||||
| Целиальная болезнь | ||||||||||||||||||||||||||||
| болезнь Корна | ||||||||||||||||||||||||||||
| Пернасовая анемия | ||||||||||||||||||||||||||||
| Persnuic Anemia | ||||||||||||||||||||||||||||
. Неэффективное потребление железа может быть результатом несоблюдения режима лечения, что часто связано с частыми желудочно-кишечными побочными эффектами перорального приема железа. Поглощение и всасывание железа могут быть нарушены при одновременном приеме препаратов, снижающих кислотность желудка, включая антациды, H 2 -блокаторы рецепторов и ингибиторы протонной помпы. 9 Напитки с кофеином, особенно чай, также снижают усвоение железа. 6,19 Препараты, которые в значительной степени взаимодействуют с пероральными добавками железа, перечислены в таблице 3 . Неэффективное всасывание железа также может быть результатом нарушений всасывания, например у пациентов с глютеновой болезнью, болезнью Крона или пернициозной анемией с ахлоргидрией. Операции на желудке также могут привести к нарушению всасывания железа. Чтобы определить наличие мальабсорбции железа, уровень железа в сыворотке крови следует измерить через два и четыре часа после приема пациентом 325 мг перорального сульфата железа. Если пациент не реагирует адекватно на пероральные препараты железа, следует рассмотреть парентеральное лечение декстраном железа (Infed). Конкретные показания для лечения парентеральным железом включают неспособность пациента переносить пероральные добавки железа, несоблюдение режима лечения, мальабсорбцию железа после операции по снижению кислотности или продолжающуюся кровопотерю. 19 Тяжесть анемии или стремление к ее быстрой коррекции не оправдывают использование парентеральной терапии железом. Независимо от пути доставки эритроциту требуется одинаковое время для использования дополнительного железа. 20 Непредсказуемая абсорбция и местные осложнения при внутримышечном введении делают внутривенный путь введения предпочтительным для парентерального введения железа. Декстран железа парентерально можно вводить однократно. Декстран железа для инъекций, содержащий 50 мг железа на мл, поставляется в 2-мл флаконе с одной дозой и доступен фармацевту по средней оптовой цене 37 долларов США. 21 Побочные реакции могут возникать при использовании декстрана железа для инъекций. Немедленные реакции включают головную боль, одышку, приливы, тошноту и рвоту, лихорадку, гипотонию, судороги, крапивницу, анафилаксию и боль в груди, животе или спине. Сначала пациенту следует дать небольшую тестовую дозу (0,5 мл), чтобы определить, не возникнет ли анафилактическая реакция. 22 Если пациент переносит тестируемую дозу, можно вводить полную дозу со скоростью 50 мг в минуту, до общей суточной дозы 100 мг. Витамин B12 Поскольку запасы витамина B 12 в организме достаточны на срок до пяти лет, дефицит обычно является результатом продолжительной неспособности организма усваивать его.
Большинство причин дефицита витамина B 12 , такие как пернициозная анемия и послеоперационная мальабсорбция, являются хроническими. В результате пациентам обычно требуется пожизненная поддерживающая терапия, состоящая из инъекций 1000 мкг цианокобаламина каждые один-три месяца 9.
Также доступны пероральные и интраназальные препараты витамина B 12 . Интраназальный гель, содержащий цианокобаламин (Наскобол), недавно был одобрен для поддерживающей терапии пациентов в гематологической ремиссии после внутримышечного введения витамина В 12 терапия различных состояний недостаточности. Введение этого продукта один раз в неделю обеспечивает дозу цианокобаламина 500 мкг. Гематологические параметры пациента должны быть в пределах нормы в начале терапии и должны тщательно контролироваться на протяжении всего лечения. Фолиевая кислота Дефицит фолиевой кислоты характеризуется мегалобластной анемией и низким уровнем фолиевой кислоты в сыворотке крови. Эффективное лечение дефицита фолиевой кислоты требует понимания его причины. Большинство пациентов с дефицитом фолиевой кислоты имеют недостаточное потребление, повышенную потребность в фолиевой кислоте или и то, и другое. Медикаментозная терапия антагонистами фолиевой кислоты, такими как метотрексат (ревматрекс), пириметамин (дараприм), триметоприм (пролоприм) или триамтерен (дирениум), также может привести к дефициту фолиевой кислоты. Лечение дефицита фолиевой кислоты простое. При отсутствии мальабсорбции фолиевой кислоты пероральный прием 1 мг фолиевой кислоты один раз в день восполнит запасы в организме примерно через три недели 9. Добавка фолиевой кислоты также рекомендуется женщинам детородного возраста для снижения частоты дефектов нервной трубки плода. Текущие рекомендации включают начало приема фолиевой кислоты в дозе 0,4 мг в день до зачатия. Большинство витаминов для беременных содержат такое количество фолиевой кислоты. Женщинам, которые ранее родили ребенка с дефектом нервной трубки, следует ежедневно принимать от 4 до 5 мг фолиевой кислоты. 31 Считается, что более высокие дозы не обеспечивают дополнительной защиты от дефектов нервной трубки. 32 В настоящее время проводятся исследования, чтобы определить, может ли добавка фолиевой кислоты снизить риск преждевременного атеросклеротического сердечно-сосудистого заболевания. 33 Повышенный уровень гомоцистеина в сыворотке крови связан с повышенным риском инфаркта миокарда, 34 инсульта 35 и, возможно, тромбоза глубоких вен. 36 Остается неясным, является ли повышенный уровень гомоцистеина в сыворотке непосредственно вовлеченным в патогенез этих событий или это просто маркер потенциального сердечно-сосудистого заболевания. Возможность снизить частоту возникновения дефектов нервной трубки и теоретическая возможность снижения риска сердечно-сосудистых заболеваний побудили некоторые органы питания рекомендовать рутинное обогащение хлеба и других пищевых продуктов фолиевой кислотой. 31 Однако, поскольку прием фолиевой кислоты частично корректирует гематологические нарушения дефицита витамина B 12 , но не связанные с ним неврологические нарушения, 10 другие эксперты рекомендовали, чтобы все продукты, обогащенные фолиевой кислотой, также включали витамин B 12 добавки 38 . Железосодержащие добавки — StatPearls — NCBI BookshelfНепрерывное обучение Железо — это лекарство, используемое для контроля и лечения железодефицитной анемии. Цели:
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме. ПоказанияДобавки железа показаны при железодефицитных состояниях, вторичных по отношению к таким состояниям, как железодефицитная анемия, дефицит железа без анемии, недостаточность питания, мальабсорбция, хроническое воспалительное состояние, кровопотеря или увеличение потребности организма в железе. Железо является важным минералом, необходимым для общего состояния здоровья. Истощенные запасы железа приводят к снижению выработки гемоглобина и циркулирующих эритроцитов в этом организме, что приводит к анемии. Симптомы дефицита железа могут проявляться в виде утомляемости, слабости, одышки, пикацизма и пагофагии, тахикардии, измененного психического статуса, гипотермии и повышенного риска инфекции.[1] Лечение в первую очередь направлено на пополнение запасов железа в организме и облегчение симптомов. Если не лечить, это может привести к неблагоприятным событиям, таким как задержка развития нервной системы у развивающихся детей и неблагоприятные исходы беременности для будущих матерей. Железосодержащие добавки различными путями, например, перорально или внутривенно, а также обогащение продуктов питания железом, могут помочь справиться с дефицитом железа и вылечить его.[3] Механизм действия Железо является важным компонентом организма. Роль добавок железа заключается в восполнении этих запасов железа и стимулировании эритропоэза и транспорта кислорода по всему телу. Транспорт железа происходит через переносчик двухвалентного металла 1 (DMT1) через клеточную мембрану, где он включается и хранится в виде ферритина в макрофагах. Затем эта форма преобразуется в абсорбируемый ион Fe2+, затем связывается трансферрином с различными участками тела, включая костный мозг, для синтеза эритроцитов. Железо соединяется с другими компонентами, такими как порфириновые и глобиновые цепи, с образованием гемоглобина, который переносит кислород из легких в другие органы тела.[4][5] ВведениеПероральные добавки железа
Внутривенное введение препаратов железа Альтернативой пероральному приему препаратов железа является внутривенное вливание; это может быть предпочтительнее у пациентов, которые:
Железо для внутримышечного введения доступно, но не является предпочтительным, так как пациенты будут испытывать сильную боль в месте инъекции и непостоянную абсорбцию. Побочные эффектыНаиболее распространенными побочными эффектами являются желудочно-кишечные, такие как тошнота/рвота, запор или диарея, метеоризм, металлический привкус, окрашивание зубов или расстройство эпигастральной области. Пациенты могут чувствовать себя некомфортно из-за изменения калибра и цвета стула на зеленый или «черный как смоль». Многие пероральные препараты железа (фумарат железа, глюконат железа, сульфат железа) связаны с более сильными побочными эффектами со стороны желудочно-кишечного тракта, чем железо внутривенно или плацебо.[9]][10 Пациенты могут уменьшить побочные эффекты, принимая добавки железа по скорректированному режиму (т. е. три раза в неделю вместо ежедневного) или принимая их с пищей, хотя это может снизить всасывание и быть менее удобным для пациента. что может привести к несоблюдению. Побочными эффектами внутривенного введения железа могут быть инфузионные реакции и анафилаксия. Железо может снижать всасывание других лекарств, образуя нерастворимый комплекс с этими агентами. ПротивопоказанияПациенты с состояниями перегрузки железом, такими как наследственный гемохроматоз, гемосидероз, или с гемолитической анемией в анамнезе. МониторингЛабораторные исследования, подтверждающие дефицит железа, включают низкий уровень железа в сыворотке, низкую насыщенность трансферрина и высокую общую железосвязывающую способность (ОЖСС). Для пациентов, получающих пероральное железо, пациентам необходимо будет вернуться в офис для повторного анализа крови, чтобы контролировать переносимость лекарства, и им необходимо будет принимать добавки в течение нескольких месяцев. У тех, кто получает железо внутривенно, уровни должны быть в пределах нормы через шесть недель терапии. Добавки железа можно прекратить, как только в организме появятся достаточные запасы железа и трансферрина. Если есть неадекватный ответ на пероральную терапию, выясните причины: такие как несоблюдение режима, снижение всасывания или желудочно-кишечное кровотечение, превышающее количество добавок железа. Токсичность Токсичность часто зависит от дозы и может проявляться сердечно-сосудистой, метаболической, центральной нервной и печеночной нестабильностью и повреждением. Симптомы передозировки включают начальное желудочно-кишечное расстройство, которое медленно перерастает в острую метаболическую энцефалопатию, судороги, тахикардию, метаболический ацидоз, аритмию, гипоксию. Количества элементарного железа до 20 мг/кг обычно хорошо переносятся, но могут вызывать легкие желудочно-кишечные симптомы. Количества от 20 до 60 мг/кг являются токсичными от легкой до умеренной, а более 60 мг/кг могут вызывать серьезные симптомы и заболеваемость из-за циркуляторного коллапса. Случайное проглатывание железа детьми в возрасте до 6 лет было ведущим случаем отравления со смертельным исходом.[12] Передозировку железа можно лечить с помощью промывания желудка с помощью хелатора железа, такого как дефероксамин, или процедур обеззараживания желудочно-кишечного тракта, таких как растворы для лаважа и промывание всего кишечника.[13] Улучшение результатов работы команды здравоохраненияИнициирование приема добавок железа для лечения железодефицитного состояния часто осуществляется лечащим врачом, однако иногда им могут управлять специалисты, включая гематолога, гастроэнтеролога или нефролога, в зависимости от основной причины анемии. На ранних стадиях анемия может обнаруживаться при обычном анализе крови. Первоначальное тестирование включает полный анализ крови (CBC) с дифференциальным анализом, который включает такие значения, как количество лейкоцитов, гемоглобин, гематокрит, количество эритроцитов, индексы эритроцитов. Основной поставщик медицинских услуг и другие медицинские работники несут ответственность за то, чтобы у пациента не было подозрений на железодефицитную анемию на основании общего анализа крови и на получение ненужных добавок железа без полного обследования. Необходимость координации помощи всех медицинских работников межпрофессиональной бригады, участвующей в ведении пациента, является рекомендуемым подходом для облегчения симптомов и улучшения результатов. Контрольные вопросы
Ссылки
| ||||||||||||||||||||||||||||

 Отсутствие повышения уровня железа по крайней мере на 115 мкг/дл (20,6 мкмоль/л) по сравнению со значением до лечения указывает на плохую абсорбцию железа. 6
Отсутствие повышения уровня железа по крайней мере на 115 мкг/дл (20,6 мкмоль/л) по сравнению со значением до лечения указывает на плохую абсорбцию железа. 6  Общая доза, необходимая для восполнения запасов в организме, определяется массой тела и дефицитом гемоглобина. Дозировка может быть рассчитана по следующей формуле: 5 :
Общая доза, необходимая для восполнения запасов в организме, определяется массой тела и дефицитом гемоглобина. Дозировка может быть рассчитана по следующей формуле: 5 : Пернициозная анемия, болезнь Крона и другие кишечные расстройства являются наиболее частыми причинами дефицита витамина B 12 . Внутримышечные, пероральные или интраназальные препараты доступны для замены B 12 (Таблица 5) . Традиционный подход к лечению состоит во внутримышечных инъекциях цианокобаламина. У пациентов с тяжелой формой витамина B 12 рекомендуется ежедневная инъекция 1000 мкг цианокобаламина в течение пяти дней, а затем еженедельные инъекции в течение четырех недель. 23 Инъекции цианокобаламина хорошо переносятся и редко вызывают побочные эффекты. Гематологическое улучшение должно начаться в течение пяти-семи дней, а дефицит должен исчезнуть через три-четыре недели лечения. Однако для появления признаков улучшения неврологических проявлений витамина В9 потребуется шесть месяцев терапии или дольше.0009 12 дефицит. Полное или частичное разрешение неврологической симптоматики наблюдается у 80% пациентов. 24 Неврологическое улучшение менее вероятно у пациентов с тяжелой или длительной недостаточностью, а также у пациентов с менее тяжелой сопутствующей анемией.
Пернициозная анемия, болезнь Крона и другие кишечные расстройства являются наиболее частыми причинами дефицита витамина B 12 . Внутримышечные, пероральные или интраназальные препараты доступны для замены B 12 (Таблица 5) . Традиционный подход к лечению состоит во внутримышечных инъекциях цианокобаламина. У пациентов с тяжелой формой витамина B 12 рекомендуется ежедневная инъекция 1000 мкг цианокобаламина в течение пяти дней, а затем еженедельные инъекции в течение четырех недель. 23 Инъекции цианокобаламина хорошо переносятся и редко вызывают побочные эффекты. Гематологическое улучшение должно начаться в течение пяти-семи дней, а дефицит должен исчезнуть через три-четыре недели лечения. Однако для появления признаков улучшения неврологических проявлений витамина В9 потребуется шесть месяцев терапии или дольше.0009 12 дефицит. Полное или частичное разрешение неврологической симптоматики наблюдается у 80% пациентов. 24 Неврологическое улучшение менее вероятно у пациентов с тяжелой или длительной недостаточностью, а также у пациентов с менее тяжелой сопутствующей анемией.
 0013 25 (Таблица 6) . Чтобы определить адекватность поддерживающей терапии, следует измерить уровень кобаламина в сыворотке крови. Врачу может потребоваться серийное измерение уровня кобаламина, поскольку неврологические симптомы дефицита витамина B 12 не всегда коррелируют с тяжестью анемии. 24,26 Однако повышенный уровень гомоцистеина в сыворотке или уровень метилмалоновой кислоты в моче могут быть более чувствительными индикаторами 27 витамина B 12 недостаток 27 .
0013 25 (Таблица 6) . Чтобы определить адекватность поддерживающей терапии, следует измерить уровень кобаламина в сыворотке крови. Врачу может потребоваться серийное измерение уровня кобаламина, поскольку неврологические симптомы дефицита витамина B 12 не всегда коррелируют с тяжестью анемии. 24,26 Однако повышенный уровень гомоцистеина в сыворотке или уровень метилмалоновой кислоты в моче могут быть более чувствительными индикаторами 27 витамина B 12 недостаток 27 . Эти пути введения ранее не считались практичными. 28 Однако пациенты с пернициозной анемией будут поглощать от 1 до 2 процентов перорально принятого кобаламина без необходимости внутреннего фактора. 23 Лечение этих пациентов высокими пероральными дозами витамина B 12 , такими как от 1000 до 2000 мкг в день, может быть альтернативой парентеральной терапии. Комбинированные продукты, содержащие витамин B 12 и внутренний фактор, доступны, но плохо усваиваются. Эти препараты часто вызывают аллергическую сенсибилизацию, поэтому их использование не рекомендуется. 14
Эти пути введения ранее не считались практичными. 28 Однако пациенты с пернициозной анемией будут поглощать от 1 до 2 процентов перорально принятого кобаламина без необходимости внутреннего фактора. 23 Лечение этих пациентов высокими пероральными дозами витамина B 12 , такими как от 1000 до 2000 мкг в день, может быть альтернативой парентеральной терапии. Комбинированные продукты, содержащие витамин B 12 и внутренний фактор, доступны, но плохо усваиваются. Эти препараты часто вызывают аллергическую сенсибилизацию, поэтому их использование не рекомендуется. 14  Предварительные сообщения предполагают, что интраназальный цианокобаламин также может быть эффективен в качестве заместительной терапии у пациентов с дефицитом витамина B 12 , хотя необходимы дальнейшие исследования для подтверждения его долгосрочной эффективности. 29
Предварительные сообщения предполагают, что интраназальный цианокобаламин также может быть эффективен в качестве заместительной терапии у пациентов с дефицитом витамина B 12 , хотя необходимы дальнейшие исследования для подтверждения его долгосрочной эффективности. 29  0013 30 (Таблица 5) .
0013 30 (Таблица 5) . Если обнаружится, что повышенный уровень гомоцистеина связан с атеросклеротическим процессом, прием фолиевой кислоты может снизить этот уровень, тем самым снижая риск неблагоприятных сердечно-сосудистых событий. 37
Если обнаружится, что повышенный уровень гомоцистеина связан с атеросклеротическим процессом, прием фолиевой кислоты может снизить этот уровень, тем самым снижая риск неблагоприятных сердечно-сосудистых событий. 37  Это упражнение иллюстрирует показания, действие и противопоказания для приема добавок железа в качестве ценного средства при лечении железодефицитных состояний, таких как железодефицитная анемия, железодефицитная недостаточность без анемии, недостаточность питания, мальабсорбция, кровопотеря или увеличение потребность в железе. В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие значение для членов медицинской бригады при лечении пациентов с железосодержащими препаратами. Дефицит и сопутствующие состояния.
Это упражнение иллюстрирует показания, действие и противопоказания для приема добавок железа в качестве ценного средства при лечении железодефицитных состояний, таких как железодефицитная анемия, железодефицитная недостаточность без анемии, недостаточность питания, мальабсорбция, кровопотеря или увеличение потребность в железе. В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие значение для членов медицинской бригады при лечении пациентов с железосодержащими препаратами. Дефицит и сопутствующие состояния.
 Группами риска являются женщины детородного возраста, у которых ежемесячные менструации и беременность являются частой причиной анемии.[2] Пожилые люди чаще имеют диету с низким содержанием железа и вялотекущую желудочно-кишечную кровопотерю из-за гастрита или основного злокачественного новообразования. Пациенты с хроническим заболеванием почек или находящиеся на гемодиализе часто имеют дефицит железа и не могут стимулировать почки к выработке эритропоэтина, что еще больше усугубляет анемию. У некоторых людей могут быть нарушения всасывания (такие как болезнь Уиппла, избыточный бактериальный рост в тонком кишечнике (SIBO), глютеновая болезнь, пернициозная анемия), когда они не могут эффективно переваривать железо из своего рациона.
Группами риска являются женщины детородного возраста, у которых ежемесячные менструации и беременность являются частой причиной анемии.[2] Пожилые люди чаще имеют диету с низким содержанием железа и вялотекущую желудочно-кишечную кровопотерю из-за гастрита или основного злокачественного новообразования. Пациенты с хроническим заболеванием почек или находящиеся на гемодиализе часто имеют дефицит железа и не могут стимулировать почки к выработке эритропоэтина, что еще больше усугубляет анемию. У некоторых людей могут быть нарушения всасывания (такие как болезнь Уиппла, избыточный бактериальный рост в тонком кишечнике (SIBO), глютеновая болезнь, пернициозная анемия), когда они не могут эффективно переваривать железо из своего рациона. Его основная роль заключается в хранении и транспортировке железа (в виде миоглобина и гемоглобина) по всему телу. При дефиците железа синтез гемоглобина невозможен, что приводит к микроцитарной анемии из-за образования мелких эритроцитов.
Его основная роль заключается в хранении и транспортировке железа (в виде миоглобина и гемоглобина) по всему телу. При дефиците железа синтез гемоглобина невозможен, что приводит к микроцитарной анемии из-за образования мелких эритроцитов.
 Он также может окрашивать кожу.[8]
Он также может окрашивать кожу.[8] К ним относятся метилдофа/леводопа, фторхинолоны, пенициллин или тетрациклины.
К ним относятся метилдофа/леводопа, фторхинолоны, пенициллин или тетрациклины. Эта ситуация должна побудить к дополнительному скринингу других основных этиологий в дополнение к недостаточному потреблению железа, повышенной потребности в железе и потерям железа, например, по причинам желудочно-кишечного тракта, таким как инфекция H. pylori, аутоиммунный гастрит и скрининговая колоноскопия на колоректальный рак.[11]
Эта ситуация должна побудить к дополнительному скринингу других основных этиологий в дополнение к недостаточному потреблению железа, повышенной потребности в железе и потерям железа, например, по причинам желудочно-кишечного тракта, таким как инфекция H. pylori, аутоиммунный гастрит и скрининговая колоноскопия на колоректальный рак.[11] [10]
[10] Полезен также подсчет ретикулоцитов. При бессимптомном течении пациента можно контролировать с помощью ежегодного общего анализа крови, чтобы проверить наличие каких-либо изменений. При наличии симптомов необходимы более агрессивные методы для выявления основной причины. Если подозревается дефицит железа, у этих пациентов должны быть проведены исследования на содержание железа, чтобы проверить уровень сывороточного железа, общую железосвязывающую способность (ОЖСС), насыщение трансферрина и уровни ферритина, чтобы определить, является ли это железодефицитной анемией, наиболее вероятной причиной микроцитарной анемии. по сравнению с другими этиологиями. Другие тесты, которые может назначить клиницист, это гемосидерин и гепсидин, но они не обязательны. После подтверждения железодефицитной анемии можно начинать прием препаратов железа. [Уровень 5]
Полезен также подсчет ретикулоцитов. При бессимптомном течении пациента можно контролировать с помощью ежегодного общего анализа крови, чтобы проверить наличие каких-либо изменений. При наличии симптомов необходимы более агрессивные методы для выявления основной причины. Если подозревается дефицит железа, у этих пациентов должны быть проведены исследования на содержание железа, чтобы проверить уровень сывороточного железа, общую железосвязывающую способность (ОЖСС), насыщение трансферрина и уровни ферритина, чтобы определить, является ли это железодефицитной анемией, наиболее вероятной причиной микроцитарной анемии. по сравнению с другими этиологиями. Другие тесты, которые может назначить клиницист, это гемосидерин и гепсидин, но они не обязательны. После подтверждения железодефицитной анемии можно начинать прием препаратов железа. [Уровень 5] Анемия является серьезной глобальной проблемой здравоохранения, и медицинские работники должны координировать свои действия, чтобы убедиться, что, если пациент не улучшается с помощью пероральных добавок железа, попробовать другой способ введения или проверить другую основную причину анемии. ] [Уровень 5] Если их анемия действительно вызвана дефицитом железа, то добавки должны иметь ощутимые улучшения при повторном общем анализе крови и анализе крови.[16] [Уровень 1]
Анемия является серьезной глобальной проблемой здравоохранения, и медицинские работники должны координировать свои действия, чтобы убедиться, что, если пациент не улучшается с помощью пероральных добавок железа, попробовать другой способ введения или проверить другую основную причину анемии. ] [Уровень 5] Если их анемия действительно вызвана дефицитом железа, то добавки должны иметь ощутимые улучшения при повторном общем анализе крови и анализе крови.[16] [Уровень 1] 2016 27 фев;387(10021):907-16. [PubMed: 26314490]
2016 27 фев;387(10021):907-16. [PubMed: 26314490] Старение (Олбани, штат Нью-Йорк). 2016 Май;8(5):1150-2. [Бесплатная статья PMC: PMC4931859] [PubMed: 27208799]
Старение (Олбани, штат Нью-Йорк). 2016 Май;8(5):1150-2. [Бесплатная статья PMC: PMC4931859] [PubMed: 27208799] , Паласиос С., Хая-Паласуэлос Дж., Сирия-Рекасенс М., Манасанч Дж., Перес-Эдо Л. Переносимость различных пероральных добавки железа: систематический обзор. Curr Med Res Opin. 2013 апр; 29(4):291-303. [PubMed: 23252877]
, Паласиос С., Хая-Паласуэлос Дж., Сирия-Рекасенс М., Манасанч Дж., Перес-Эдо Л. Переносимость различных пероральных добавки железа: систематический обзор. Curr Med Res Opin. 2013 апр; 29(4):291-303. [PubMed: 23252877]