Как лечить железодефицитную анемию. Какие препараты железа наиболее эффективны. Какие методы профилактики анемии существуют у беременных. Как выбрать оптимальный препарат железа.
Что такое железодефицитная анемия
Железодефицитная анемия (ЖДА) — это состояние, при котором в организме наблюдается недостаток железа, что приводит к снижению уровня гемоглобина в крови. Это самый распространенный тип анемии, особенно часто встречающийся у беременных женщин и детей.
Основные причины развития ЖДА:
- Недостаточное поступление железа с пищей
- Нарушение всасывания железа в кишечнике
- Повышенная потребность в железе (беременность, период роста)
- Хронические кровопотери
При дефиците железа нарушается образование гемоглобина — белка, отвечающего за транспорт кислорода в организме. Это приводит к кислородному голоданию тканей и органов.
Симптомы железодефицитной анемии
Основные симптомы ЖДА:
- Бледность кожи и слизистых
- Слабость, повышенная утомляемость
- Головокружение
- Одышка при физической нагрузке
- Учащенное сердцебиение
- Ломкость ногтей, выпадение волос
- Извращение вкуса (желание есть мел, землю)
При появлении этих симптомов следует обратиться к врачу для проведения анализа крови и назначения лечения.

Диагностика железодефицитной анемии
Для диагностики ЖДА проводятся следующие исследования:
- Общий анализ крови — оценка уровня гемоглобина, эритроцитов, цветового показателя
- Биохимический анализ крови — определение уровня сывороточного железа, ферритина, трансферрина
- Анализ кала на скрытую кровь — для исключения кровотечений из ЖКТ
Критерии диагностики ЖДА:
- Снижение уровня гемоглобина менее 120 г/л у женщин и 130 г/л у мужчин
- Снижение уровня сывороточного железа менее 12,5 мкмоль/л
- Снижение уровня ферритина менее 30 мкг/л
Лечение железодефицитной анемии
Основные принципы лечения ЖДА:
- Устранение причины дефицита железа
- Назначение препаратов железа
- Коррекция питания
Препараты железа для лечения ЖДА
Для лечения ЖДА применяются препараты железа для перорального и парентерального введения.
Основные группы пероральных препаратов железа:
- Препараты двухвалентного железа (сульфат, фумарат, глюконат железа)
- Препараты трехвалентного железа (гидроксид полимальтозный комплекс)
Наиболее часто используются препараты двухвалентного железа, так как они лучше всасываются в кишечнике. Однако они чаще вызывают побочные эффекты со стороны ЖКТ.

Препараты трехвалентного железа (например, Мальтофер) лучше переносятся, но несколько медленнее восполняют дефицит железа.
Парентеральные препараты железа (железа карбоксимальтозат, железа сахарат) применяются при тяжелой анемии, нарушении всасывания железа в кишечнике.
Схемы лечения ЖДА
Стандартная схема лечения ЖДА включает:
- Прием 100-200 мг элементарного железа в сутки
- Длительность лечения 3-6 месяцев
- Контроль общего анализа крови через 2-4 недели
Важно продолжать прием препаратов железа еще 3 месяца после нормализации уровня гемоглобина для восполнения тканевых запасов железа.
Профилактика железодефицитной анемии
Основные методы профилактики ЖДА:
- Сбалансированное питание с достаточным содержанием железа
- Профилактический прием препаратов железа в группах риска (беременные, дети)
- Своевременное лечение заболеваний, вызывающих кровопотери
Беременным женщинам рекомендуется профилактический прием 30-60 мг элементарного железа в сутки со второго триместра беременности.
Выбор оптимального препарата железа
При выборе препарата железа следует учитывать следующие факторы:

- Степень тяжести анемии
- Переносимость препарата
- Наличие сопутствующих заболеваний ЖКТ
- Стоимость лечения
Препараты двухвалентного железа обеспечивают более быстрое повышение уровня гемоглобина, но чаще вызывают побочные эффекты. Они предпочтительны при средней и тяжелой анемии.
Препараты трехвалентного железа лучше переносятся и могут применяться длительно. Они оптимальны для профилактики и лечения легкой анемии.
Парентеральные препараты железа назначаются при тяжелой анемии, плохой переносимости пероральных форм.
Заключение
Железодефицитная анемия — распространенное заболевание, которое хорошо поддается лечению при своевременной диагностике. Правильный выбор препарата железа и соблюдение схемы лечения позволяют быстро устранить дефицит железа и нормализовать уровень гемоглобина. Важную роль играет также профилактика ЖДА в группах риска.
Эффективность и переносимость препаратов железа в профилактике и лечении анемии у беременных » Акушерство и Гинекология
В представленной статье рассмотрены вопросы эффективности и приемлемости пероральных препаратов для лечения железодефицитной анемии во время беременности. Приведены сведения о скорости восстановления гематологических параметров, частоте и выраженности побочных эффектов различных солей двухвалентного железа и гидроксид полимальтозного комплекса трехвалентного железа. Показано, что при одинаковой клинико-лабораторной эффективности препараты трехвалентного железа в составе гидроксид полимальтозного комплекса показывают более высокую степень переносимости и безопасности в профилактике и лечении железодефицитных состояний у беременных.
Анемия является одним из наиболее часто встречающихся патологических состояний во время беременности и послеродового периода. В зависимости от степени индустриального развития страны частота анемии у беременных колеблется от 5,7 до 75%, составляя в среднем 41,8%. Это означает, что ежегодно 56 млн женщин во всем мире нуждаются в лечении в связи с анемией [33]. При этом частота анемии многократно возрастает от I триместра беременности к III.
Это означает, что ежегодно 56 млн женщин во всем мире нуждаются в лечении в связи с анемией [33]. При этом частота анемии многократно возрастает от I триместра беременности к III.
Наиболее неблагоприятными в отношении распространенности анемии у беременных являются регионы Африки (55,8%), Азии (41,6%), Латинской Америки с Карибскими островами (31,1%) и Океании (30,4%). Однако и в относительно благополучных регионах, таких как Западная Европа, анемия встречается почти у каждой пятой беременной (18,7%) [34]. В Российской Федерации в последние годы частота встречаемости анемии во время беременности возрастала, и в настоящее время она составляет 35% [5, 7].
На фоне анемии нарушается перенос и депонирование кислорода, что затрудняет обеспечение жизненно важной функции – дыхания и ведет к метаболическому дисбалансу. При анемии во время беременности в 3–4 раза возрастает частота преждевременных родов и плацентарной недостаточности, в 2–3 раза – аномалий родовой деятельности и кровотечений в родах, в 2 раза – инфекционно-воспалительных осложнений в послеродовом периоде [2, 8, 11, 28].
Железодефицитная анемия (ЖДА) является наиболее частой формой анемии у беременных, на ее долю приходится более 90%. Женскому организму необходимо 1,5–1,7 мг железа в сут, а при повышенной потере железа, например во время беременности, при повышенном объеме менструальных кровопотерь и т. д. потребность возрастает. Во время беременности потребность в железе возрастает с 0,8 мг/сут в I триместре до 6–7 мг/сут во второй ее половине [23].
Для обеспечения потребностей развивающегося плода беременной необходимо затратить около 300 мг железа. За время нормально протекающей беременности естественные потери этого микроэлемента составят около 200–300 мг, еще около 500 мг требуется на обеспечение физиологического усиления эритропоэза, 200–250 мг теряется во время родов. В течение всей беременности при нормальном питании здоровая женщина получает с пищей около 700–800 мг железа. Следовательно, еще необходимо использовать 400–500 мг железа, которые расходуются из депо. В связи с этим даже незначительный латентный дефицит железа, предшествовавший наступлению беременности, представляет опасность быстрого истощения депо и развития осложнений во время беременности.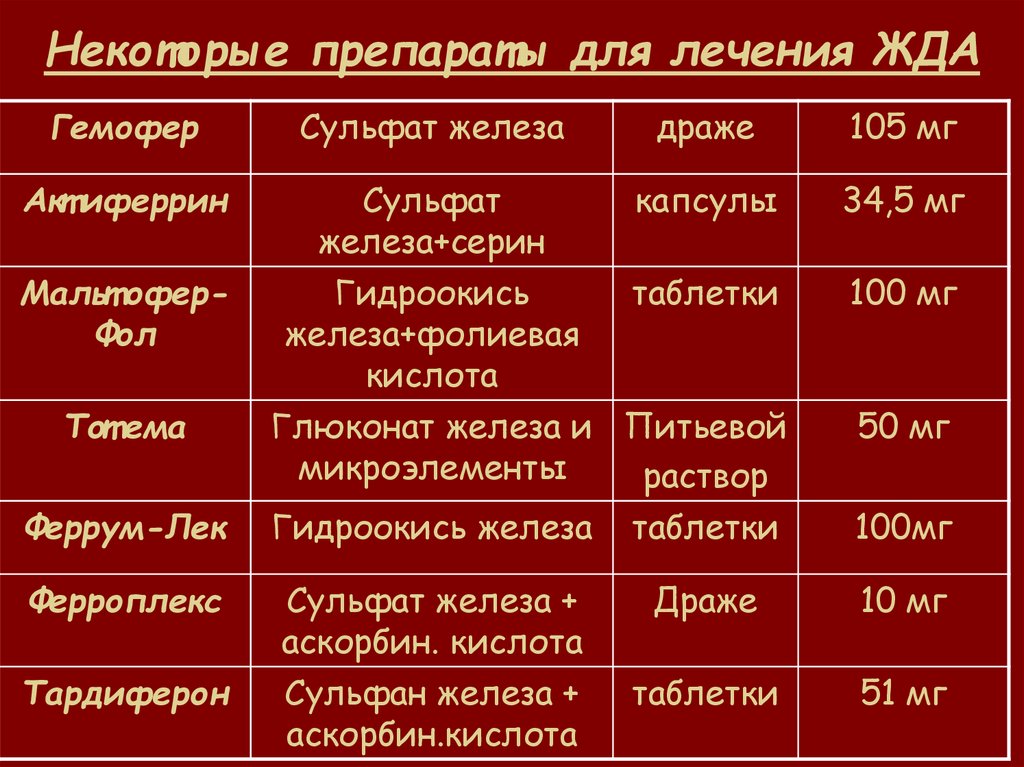
Обычно при постановке диагноза анемии у беременных опираются на рекомендованную ВОЗ нижнюю границу уровня гемоглобина в 110 г/л. Однако число женщин с низким резервом железа (уровень сывороточного ферритина менее 12 мкг/л) с 15 до 24 нед беременности увеличивается в 6 раз и продолжает возрастать к родам. При этом у подавляющего большинства женщин (90%) уровень гемоглобина выше 110 г/л, что определяет недооценку железодефицитного состояния [33].
Недостаток железа отражается как на внутриутробном, так и внеутробном развитии ребенка. При нормальном течении беременности у здоровой женщины ионы железа транспортируются через плаценту активно. Однако при недостатке поступления железа к плоду вследствие исходного дефицита у матери, сниженном транспорте и усвоении при плацентарной недостаточности, осложнениях беременности его накопление в депо происходит недостаточно.
При дефиците железа у матери ребенок, находящийся на грудном вскармливании, продолжает испытывать недостаток его поступления. Для таких детей характерны большая потеря массы тела после рождения и медленное восстановление, нарушения отпадения пуповинного остатка и эпителизации пупочной ранки, более высокая частота инфекционно-воспалительных заболеваний. При ЖДА у матери, частота анемии у детей в возрасте одного года достигает 68%, что неблагоприятно отражается на их умственном и моторном развитии, снижает сопротивляемость организма к инфекциям.
Для таких детей характерны большая потеря массы тела после рождения и медленное восстановление, нарушения отпадения пуповинного остатка и эпителизации пупочной ранки, более высокая частота инфекционно-воспалительных заболеваний. При ЖДА у матери, частота анемии у детей в возрасте одного года достигает 68%, что неблагоприятно отражается на их умственном и моторном развитии, снижает сопротивляемость организма к инфекциям.
Цикл эритропоэза является длительным процессом и поэтому для обеспечения стабильно нормального уровня гемоглобина при лечении ЖДА во время беременности необходим продолжительный прием препаратов для последовательного обеспечения ее купирования, насыщения депо (восстановления запасов) и поддерживающей терапии. Кроме того следует учитывать, что находящееся в пище железо усваивается только на 10–20%, поэтому необходимо увеличение количества поступающего в организм железа в 5–10 раз, чтобы обеспечить суточную потребность [4].
В связи с высокой частотой и тяжестью осложнений ЖДА с целью медикаментозной профилактики ВОЗ рекомендует рутинно назначать 60 мг железа и 400 мг фолиевой кислоты ежедневно с 12 нед беременности и до срока родов. При развитии анемии дозу железа увеличивают в два раза (UNICEF/UNU/WHO, 2001). В стандарте наблюдения за течением нормальной беременности (амбулаторно-поликлиническая помощь) Минздравсоцразвития России (№ 662, 2006 г.) предусматривается использование железосодержащих препаратов (таких как железа гидроксид полимальтозат или фумарат) в терапевтической дозе на протяжении 1–3 мес. В некоторых странах разработаны программы профилактики анемии во время беременности, основанные на еженедельном приеме железа (обычно 60 мг) и фолиевой кислоты (обычно 2,8 мг) по 3 мес с полугодовым интервалом женщинами репродуктивного возраста, имеющими сохраненный меструальный цикл; ежедневном приеме железа и фолиевой кислоты (30 мг и 0,4 мг) с ранних сроков беременности в регионах, где анемия не является распространенной проблемой, и ежедневном приеме 60 мг и 0,4 мг железа и фолиевой кислоты – там, где ЖДА встречается часто [17, 19]. В завершение программы рекомендуется продолжение приема препарата в течение 6 мес после родов.
При развитии анемии дозу железа увеличивают в два раза (UNICEF/UNU/WHO, 2001). В стандарте наблюдения за течением нормальной беременности (амбулаторно-поликлиническая помощь) Минздравсоцразвития России (№ 662, 2006 г.) предусматривается использование железосодержащих препаратов (таких как железа гидроксид полимальтозат или фумарат) в терапевтической дозе на протяжении 1–3 мес. В некоторых странах разработаны программы профилактики анемии во время беременности, основанные на еженедельном приеме железа (обычно 60 мг) и фолиевой кислоты (обычно 2,8 мг) по 3 мес с полугодовым интервалом женщинами репродуктивного возраста, имеющими сохраненный меструальный цикл; ежедневном приеме железа и фолиевой кислоты (30 мг и 0,4 мг) с ранних сроков беременности в регионах, где анемия не является распространенной проблемой, и ежедневном приеме 60 мг и 0,4 мг железа и фолиевой кислоты – там, где ЖДА встречается часто [17, 19]. В завершение программы рекомендуется продолжение приема препарата в течение 6 мес после родов.
В настоящее время наиболее распространенной формой профилактики и лечения железодефицитных состояний и анемии является пероральный прием железосодержащих препаратов. В большинстве наблюдений парентеральный путь не имеет преимуществ усвоения и показан при нарушении всасывания в желудочно-кишечном тракте или необходимости срочного насыщения организма железом (тяжелая форма анемии, прогрессирующие нарушения, предстоящая кровопотеря). Наиболее часто для парентерального введения используют железа (III) гидроксид сахарозный или полимальтозный комплекс [10, 12, 31]. Внутримышечное и внутривенное введение препаратов железа может сочетаться с аллергическими реакциями, вплоть до анафилактического шока, болями и нарушениями окраски кожи в месте инъекции, головными болями и венозными тромбозами [15, 16, 27].
Расчет необходимой дозы препарата осуществляют в зависимости от запаса железа в депо по уровню сывороточного ферритина (SF) 1 мкг/л SF=8 мг железа. Нормальное содержание ферритина у здоровых женщин 32–60 мкг/л, что соответствует 356–480 мг железа в депо. При уровне ферритина свыше 60 мкг/л прием препаратов железа не показан. Границей, определяющей явный дефицит железа, является уровень ферритина менее 12 мкг/л. В то же время многие исследователи критически низким уровнем или даже отсутствием запаса железа у беременных считают содержание сывороточного ферритина менее 20–30 мкг/л [22, 33]. При таком подходе число женщин, которым показан прием препаратов железа при подготовке и на протяжении беременности, возрастает.
При уровне ферритина свыше 60 мкг/л прием препаратов железа не показан. Границей, определяющей явный дефицит железа, является уровень ферритина менее 12 мкг/л. В то же время многие исследователи критически низким уровнем или даже отсутствием запаса железа у беременных считают содержание сывороточного ферритина менее 20–30 мкг/л [22, 33]. При таком подходе число женщин, которым показан прием препаратов железа при подготовке и на протяжении беременности, возрастает.
Препараты для лечения ЖДА могут быть отнесены в одну из двух групп: двухвалентного или трехвалентного железа. Первыми появились препараты в виде солей двухвалентного железа: сульфата, фумарата, глюконата, хлорида железа. Широкая распространенность препаратов на основе солей двухвалентного железа обусловлена в первую очередь высокой степенью растворимости и диссоциации, что и определяет хорошее всасывание в кишечнике.
Вместе с тем пероральный прием железосодержащих препаратов нередко сопровождается побочными явлениями. Наиболее распространенными из них являются металлический привкус во рту, тошнота, рвота, боли в животе, запор или диарея. Реже встречаются такие побочные проявления, как гипотензия и геморрой [11]. Обычно эти побочные проявления зависят от дозы и проявляются при приеме натощак.
Наиболее распространенными из них являются металлический привкус во рту, тошнота, рвота, боли в животе, запор или диарея. Реже встречаются такие побочные проявления, как гипотензия и геморрой [11]. Обычно эти побочные проявления зависят от дозы и проявляются при приеме натощак.
Кроме того, было обнаружено, что применение солевых препаратов железа (II), особенно с профилактической целью (перорально), сопровождается нарастающим оксидативным стрессом [13, 29].
Для снижения частоты и степени выраженности побочных эффектов солевых препаратов железа (II) беременные вынуждены принимать их вместе с пищей. Однако совмещение приема железа и пищи не рекомендовано инструкцией по применению, так как нарушает всасывание лечебного препарата. Особенно неблагоприятно для усвоения препаратов железа сочетание с жирной пищей, молочными продуктами, кофе и, особенно, чаем. Также абсорбцию железа нарушает его сочетание с кальцием.
В попытке избежать побочных эффектов препаратов железа предлагаются альтернативные режимы приема, в том числе прерывистые или низкодозированные, но они более эффективны как превентивные, а не лечебные схемы [25, 27].
Так как одной из главных причин плохой переносимости препаратов железа являются свободные ионы, входящие в их состав и освобождающиеся при всасывании простой соли в желудочно-кишечном тракте, то в последние годы все большее распространение получают не ионные препараты железа – трехвалентное железо в соединении с веществом большой молекулярной массы. К таким препаратам относится железа (III) гидроксид полимальтозат. В связи с большой молекулярной массой гидроксид полимальтозат диффундирует через слизистую оболочку желудочно-кишечного тракта в 40 раз медленнее, чем двухвалентное железо, которое проникает по градиенту концентрации. Структура комплекса подобна таковой у естественного соединения железа – ферритина, и железо данного комплекса абсорбируется только путем активного всасывания, в основном в двенадцатиперстной и тощей кишке. Железо-связывающие белки, находящиеся на поверхности кишечного эпителия, поглощают железо (III) из комплекса посредством конкурентного обмена лигандами. Механизм активного всасывания не допускает передозировки или интоксикации препаратом. Комплекс железа (III) гидроксид полимальтозат стабилен, в физиологических условиях не высвобождает ионы железа и не обладает прооксидантными свойствами, присущими солям железа (II). Этими качествами объясняется меньшая частота побочных эффектов и более высокий уровень приемлемости препаратов на его основе. В отличие от солей железа компоненты пищи не снижают биодоступность железа в полимальтозном комлексе [18], и поэтому препараты железа (III) гидроксид полимальтозата можно принимать с пищей, что не только не снижает, но увеличивает его усвоение [9].
Механизм активного всасывания не допускает передозировки или интоксикации препаратом. Комплекс железа (III) гидроксид полимальтозат стабилен, в физиологических условиях не высвобождает ионы железа и не обладает прооксидантными свойствами, присущими солям железа (II). Этими качествами объясняется меньшая частота побочных эффектов и более высокий уровень приемлемости препаратов на его основе. В отличие от солей железа компоненты пищи не снижают биодоступность железа в полимальтозном комлексе [18], и поэтому препараты железа (III) гидроксид полимальтозата можно принимать с пищей, что не только не снижает, но увеличивает его усвоение [9].
Сравнивая эффективность сульфата железа (II) с таковой гидроксид полимальтозного комплекса (III) у детей от 1 до 6 лет, A.V. Bopche и соавт. (2009) указали на более высокий прирост уровня гемоглобина у детей, получавших двухвалентное железо. Однако частота побочных эффектов составила 17% против 7,6% у комплекса трехвалентного железа. При этом частота гастроинтестинальных побочных эффектов у сульфата железа была в 2,5 раза выше [14]. Подобные результаты были получены B. Yasa и соавт. (2011), которые при изучении эффективности, переносимости и приемлемости лечения сульфатом железа обнаружили, что его применение также более чем в два раза чаще сопровождалось побочными эффектами, чем при приеме гидроксид полимальтозного комплекса (ГПК). При этом для сульфата железа было характерным более частое сочетание нескольких побочных гастроинтестинальных эффектов (тошноты, запора, болей в животе, рис. 1) [35]. В результате приемлемость ГПК по шкале Wong-Baker оказалась достоверно лучше (1,63±0,56 против 2,14±0,75; p=0,001, рис. 2).
Подобные результаты были получены B. Yasa и соавт. (2011), которые при изучении эффективности, переносимости и приемлемости лечения сульфатом железа обнаружили, что его применение также более чем в два раза чаще сопровождалось побочными эффектами, чем при приеме гидроксид полимальтозного комплекса (ГПК). При этом для сульфата железа было характерным более частое сочетание нескольких побочных гастроинтестинальных эффектов (тошноты, запора, болей в животе, рис. 1) [35]. В результате приемлемость ГПК по шкале Wong-Baker оказалась достоверно лучше (1,63±0,56 против 2,14±0,75; p=0,001, рис. 2).
В другом исследовании, проведенном у взрослых, при отсутствии различий в уровнях гемоглобина, достигнутых в течение 2 мес лечения, частота побочных эффектов в группе пациентов, получавших лечение сульфатом железа, составила 34,1%, тогда как у принимавших ГПК железа в эквивалентной дозе она была в 2 раза ниже (14,9%; p<0,001) [31].
Проводя мониторирование протокола ведения больных «Железодефицитная анемия», Н. И. Некрасова и соавт. (2009) показали, что частота запоров и дискомфорта в области эпигастрия была в более чем в 3–10 раз выше при приеме препарата на основе сульфата железа, чем гидроксид полимальтозата. При этом в связи с выраженностью побочных эффектов 14% больных отказались от дальнейшего лечения сульфатом железа. В результате, несмотря на бóльшую стоимость, лечение ГПК железа оказалось экономически оправданным, особенно при сопутствующей патологии желудочно-кишечного тракта.
И. Некрасова и соавт. (2009) показали, что частота запоров и дискомфорта в области эпигастрия была в более чем в 3–10 раз выше при приеме препарата на основе сульфата железа, чем гидроксид полимальтозата. При этом в связи с выраженностью побочных эффектов 14% больных отказались от дальнейшего лечения сульфатом железа. В результате, несмотря на бóльшую стоимость, лечение ГПК железа оказалось экономически оправданным, особенно при сопутствующей патологии желудочно-кишечного тракта.
Исследование эффективности пероральной формы ГПК железа (III) (200–300 мг/сут) в лечении ЖДА различной степени тяжести у беременных показало, что первые признаки коррекции анемии появляются уже в конце первой нед лечения. В первую очередь это отмечалось у женщин с легкой степенью анемии, у которых в 15% процентах случаев был достигнут нормальный уровень гемоглобина. Кроме того, в большинстве наблюдений при легкой анемии и у каждой третьей женщины с анемией средней тяжести было отмечено появление ретикулоцитоза [1]. Следует отметить, что улучшение клинических данных несколько опережало гематологические показатели. Через две нед показатели гемоглобина нормализовались у 39,4% женщин, а через 28 дней только у 9,09% сохранились признаки анемии, при этом у одной беременной низкий уровень гемоглобина не соответствовал нормальным значениям ферритина, что указывало на отсутствие дефицита железа. Профилактическое назначение 100 мг ГПК железа (III) в группе риска позволило предупредить развитие ЖДА у 87% женщин группы риска этого осложнения.
Следует отметить, что улучшение клинических данных несколько опережало гематологические показатели. Через две нед показатели гемоглобина нормализовались у 39,4% женщин, а через 28 дней только у 9,09% сохранились признаки анемии, при этом у одной беременной низкий уровень гемоглобина не соответствовал нормальным значениям ферритина, что указывало на отсутствие дефицита железа. Профилактическое назначение 100 мг ГПК железа (III) в группе риска позволило предупредить развитие ЖДА у 87% женщин группы риска этого осложнения.
Эффективная профилактика и лечение при железодефицитном состоянии сочетались с благоприятными клиническими результатами: быстрой динамикой разрешения клинических проявлений анемии, меньшей частотой фетоплацентарной недостаточности и преэклампсии.
В исследовании сходного дизайна В.А. Бурлева и соавт. (2006) было показано, что прием 100 мг железа в составе ГПК беременными с латентным дефицитом железа позволяет поддерживать необходимые уровни сывороточного железа, ферритина при отсутствии изменений содержания трансферрина и коэффициента насыщения трансферрина железом.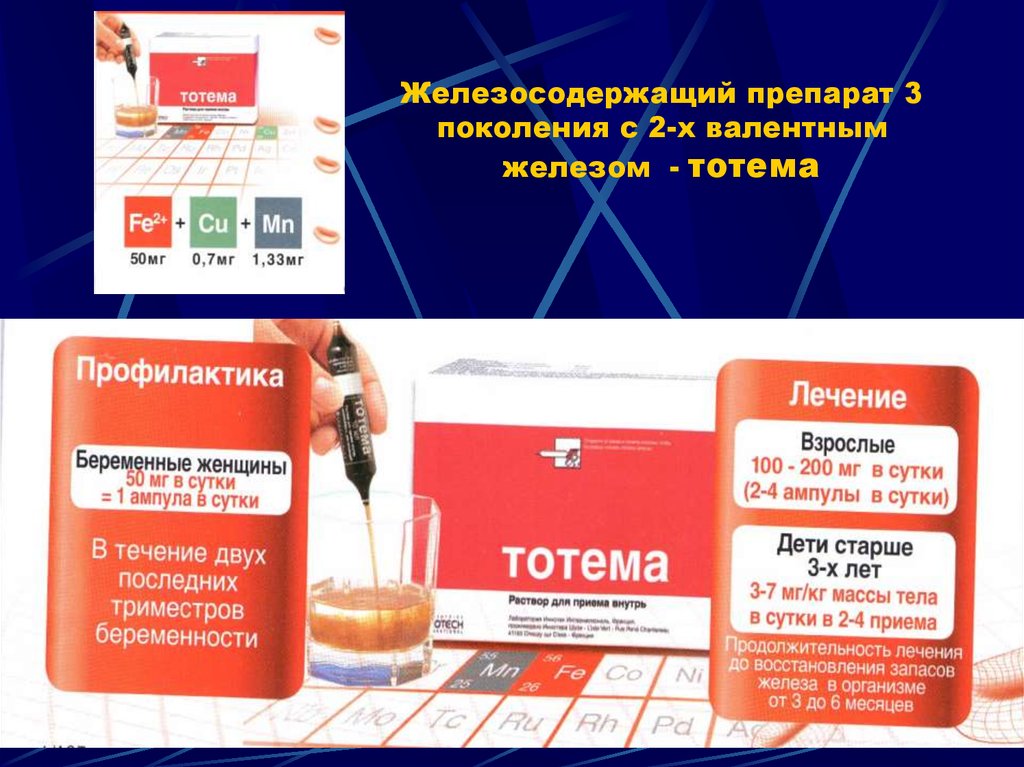 Прием 200–300 мг железа при ЖДА позволял достоверно повысить уровни сывороточного железа, ферритина и повысить коэффициент насыщения трансферрина железом.
Прием 200–300 мг железа при ЖДА позволял достоверно повысить уровни сывороточного железа, ферритина и повысить коэффициент насыщения трансферрина железом.
В 2011 г. были получены результаты многоцентрового рандомизированного контролируемого исследования эффективности и безопасности полимальтозного комплекса и сульфата железа у беременных с ЖДА [24]. Результаты показали, что после приема эквивалентных доз препаратов железа (III и II) прирост показателей гемоглобина на 60-й и 90-й дни лечения был одинаковыми, тогда как концентрация ферритина оказалась выше в группе женщин, принимавших полимальтозат железа. Комплаентность (по числу возвращенных упаковок препаратов) была достоверно хуже в группе принимавших сульфат железа (1,53 против 2,97; р=0,015). Наконец, частота побочных эффектов также оказалась достоверно выше при лечении солью двухвалентного железа (29,3 против 56,4%; р=0,015; рис. 3).
Сукцинат и глюконат железа, так же как сульфат, показывают высокую скорость восстановления уровня гемоглобина, однако уступают ГПК в переносимости [20, 21]. В экспериментальном исследовании сравнение сульфата, аминохелата и ГПК железа показало, что последний обладает наименьшей токсичностью в отношении тканей желудочно-кишечного тракта [31]. Также более высокую переносимость, лучшую абсорбцию и предсказуемость гематологического ответа показал ГПК по сравнению с фумаратом железа [26].
В экспериментальном исследовании сравнение сульфата, аминохелата и ГПК железа показало, что последний обладает наименьшей токсичностью в отношении тканей желудочно-кишечного тракта [31]. Также более высокую переносимость, лучшую абсорбцию и предсказуемость гематологического ответа показал ГПК по сравнению с фумаратом железа [26].
Таким образом, при одинаковой клинико-лабораторной эффективности с солями двухвалентного железа, препараты трехвалентного железа в составе ГПК показывают более высокую степень переносимости, что при отсутствии риска передозировки и необходимости соблюдения режима приема препарата натощак повышает степень их комплаентности и расширяет возможности применения в профилактике и лечении железодефицитных состояний у беременных.
1.Баев О.Р. Диагностика и лечение железодефицитной анемии беременных. Вопросы гинекологии, акушерства и перинатологии. 2005; 4(2): 14—9.
2.Баев О.Р., Буданов П.В., Рыбин М.В. Профилактика железодефицита у беременных – основа лечения анемии и ассоциированных осложнений беременности.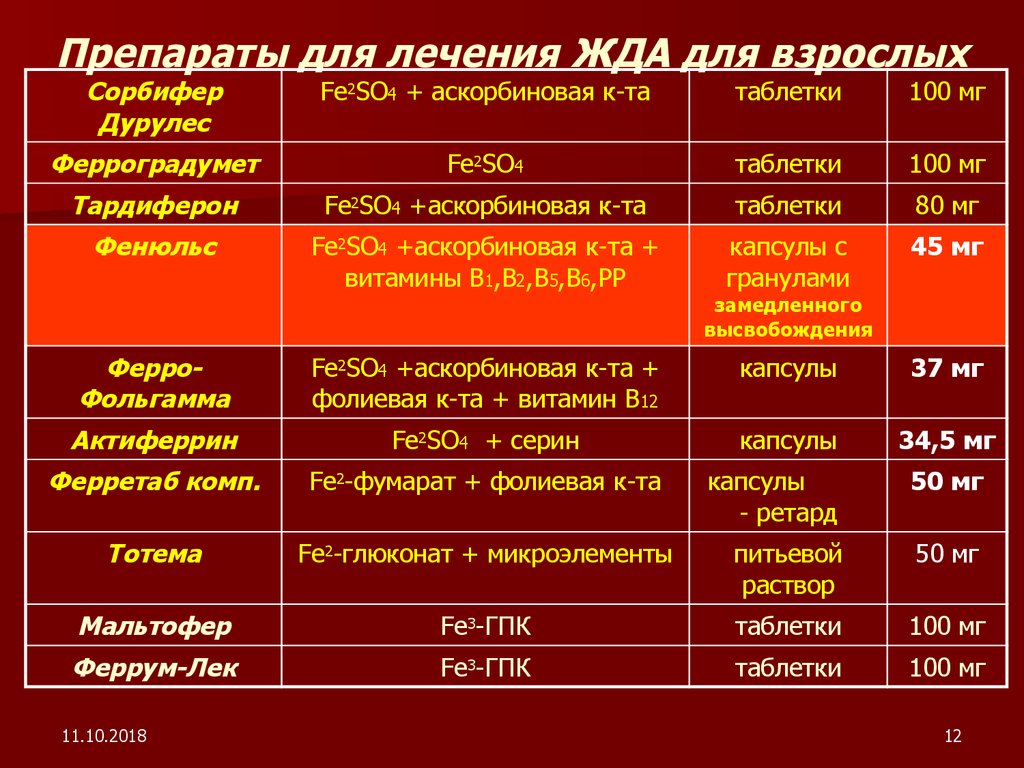 Вопросы гинекологии, акушерства и перинатологии. 2006; 5(4): 89–92.
Вопросы гинекологии, акушерства и перинатологии. 2006; 5(4): 89–92.
3.Бурлев В.А., Коноводова Е.Н., Орджоникидзе Н.В., Серов В.Н., Елохина Т.Б., Ильясова Н.А. Лечение беременных с латентным дефицитом железа. Российский вестник акушера-гинеколога. 2006; 1: 64–8.
4.Воробьев А.И. (ред.) Руководство по гематологии. т.1–2. М.: Ньюдиамед; 2002.
5.Радзинский В.Е., Ордиянц И.М. Альтернативные подходы к анемии беременных. Акушерство и гинекология. 2007; 3: 65–7.
6.Об утверждении стандарта медицинской помощи женщинами с нормальным течением беременности. Приказ Минздравсоцразвития Российской Федерации N 662 от 14 сентября 2006 г. М.; 2006.
7.Основные показатели здоровья матери и ребенка, деятельность службы охраны детства и родовспоможения в Российской Федерации. Министерство здравоохранения и социального развития Российской Федерации, ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения». М.; 2011. http://www.minzdravsoc.ru/docs/mzsr/stat/119
8. Тихомиров А.Л., Сарсания С.И. Рациональная терапия и современные принципы диагностики железодефицитных состояний в акушерско-гинекологической практике. Фарматека. 2009; 175(1): 32–9.
Тихомиров А.Л., Сарсания С.И. Рациональная терапия и современные принципы диагностики железодефицитных состояний в акушерско-гинекологической практике. Фарматека. 2009; 175(1): 32–9.
9.Шилина Е.А., Бреусенко Л.Е., Шалина Р.И. Сравнение эффективности применения различных препаратов железа у беременных с железодефицитной анемией в третьем триместре беременности. Consilium medicum. 2001; 4: 16–8.
10.Al R.A., Unlubilgin E., Kandemir O., Yalvac S., Cakir L., Haberal A. Intravenous versus oral iron for treatment of anemia in pregnancy a randomized trial. Obstet. Gynecol. 2005; 106(6): 1335–40.
11.Banhidy F., Acs N., Puhó E.H., Czeizel A.E. Iron deficiency anemia: pregnancy outcomes with or without iron supplementation. Nutrition. 2011; 27(1): 65–72.
12.Breymann Ch., Honneger Ch., Holzgreve W., Surbek D. Diagnosis and treatment of iron-deficiency anaemia during pregnancy and postpartum. Arch. Gynecol. Obstet. 2010; 282(5): 577–80.
13.Bhatla N., Kaul N., Lal N., Kriplani A., Agarwal N. , Saxena R., Gupta S.K. Comparison of effect of daily versus weekly iron supplementation during pregnancy on lipid peroxidation. J. Obstet. Gynaecol. Res. 2009; 35(3): 438–45.
, Saxena R., Gupta S.K. Comparison of effect of daily versus weekly iron supplementation during pregnancy on lipid peroxidation. J. Obstet. Gynaecol. Res. 2009; 35(3): 438–45.
14.Bopche A. V., Dwivedi R., Mishra R., Patel G.S. Ferrous sulfate versus iron polymaltose complex for treatment of iron deficiency anemia in children. Indian Pediatr. 2009; 46(10): 883–5.
15.Casanova Bruno F. Iron deficiency anemia in pregnancy. Postgrad. Obstet. Gynecol. 2006; 26: 1–5.
16.Cuervo L.G., Mahomed K. Treatments for iron deficiency anaemia in pregnancy. Cochrane Database Syst. Rev. 2001; (2): CD003094.
17. Gautam C.S., Saha L., Sekhri K., Saha P.K. Iron deficiency in pregnancy and the rationality of iron supplements prescribed during pregnancy. Medscape J. Med. 2008; 10(12): 283–4.
18.Geisser P., Müller A. Pharmacokinetics of iron salts and ferric hydroxide- carbohydrate complexes. Arzneimittelforschung. 1987; 37(1A): 100–4.
19. Goonewardene M., Shehata M., Hamad A. Anaemia in pregnancy. Best Pract. Res. Clin. Obstet. Gynaecol. 2012; 26(1): 3–24.
Best Pract. Res. Clin. Obstet. Gynaecol. 2012; 26(1): 3–24.
20.Haliotis F.A., Papanastasiou D.A. Comparative study of tolerability and efficacy of iron protein succinylate versus iron hydroxide polymaltose complex in the treatment of iron deficiency in children. Int. J. Clin. Pharmacol. Ther. 1998; 36(6): 320–5.
21.Jaber L., Rigler S., Taya A., Tebi F., Baloum M., Yaniv I. et al. Iron zpolymaltose versus ferrous gluconate in the prevention of iron deficiency anemia of infancy. J. Pediatr. Hematol. Oncol. 2010; 32(8): 585–8.
22.Milman N. Prepartum anaemia: prevention and treatment. Ann. Hematol. 2008; 87(12): 949–59.
23.Mukherji J. Iron deficiency anemia in pregnancy. Rational Drug Bull. 2002; 12: 2–5.
24.Ortiz R., Tobll i J.E., Romero J.D., Monterrosa B., Frer C., Macagno E., Breymann C. Efficacy and safety of oral iron(III) polymaltose complex versus ferrous sulfate in pregnant women with iron-deficiency anemia: a multicenter, randomized, controlled study. J. Matern.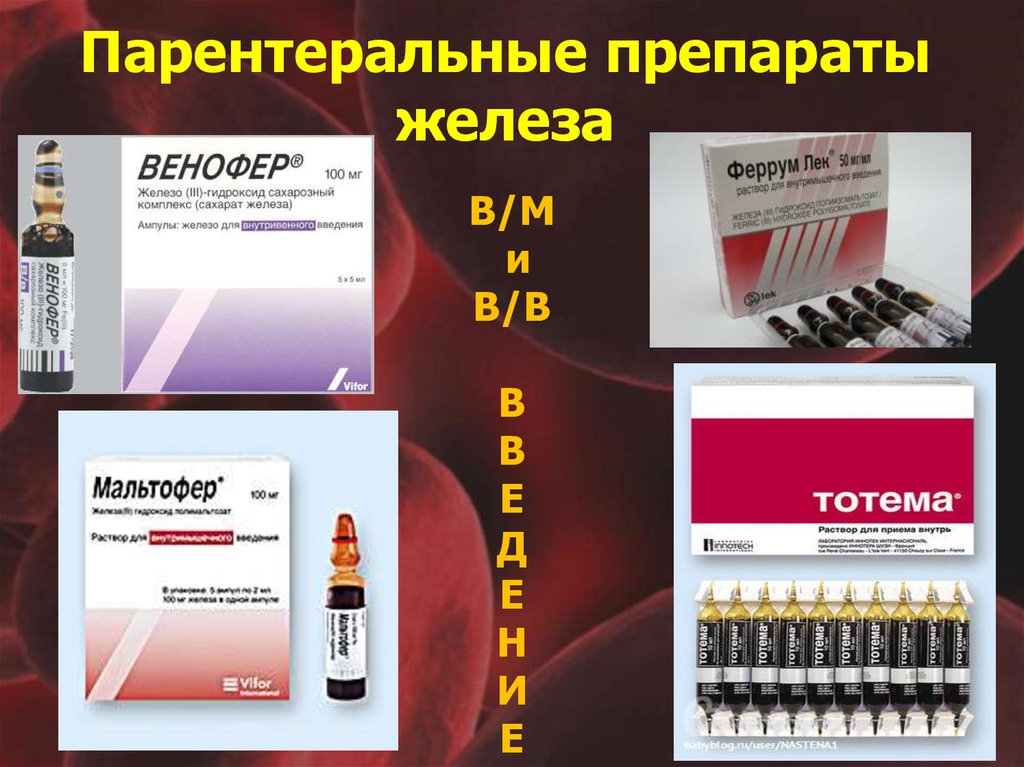 Fetal Neonatal Med. 2011; 24(11): 1–6.
Fetal Neonatal Med. 2011; 24(11): 1–6.
25.Peña-Rosas J.P., Viteri F.E. Effects and safety of preventive oral iron or iron+folic acid supplementation for women during pregnancy. Cochrane Database Syst. Rev. 2009; (4): CD004736.
26.Reddy P.S., Adsul B.B., Gandewar K., Korde K.M., Desai A. Evaluation of efficacy and safety of iron polymaltose complex and folic acid (Mumfer) vs iron formulation (ferrous fumarate) in female patients with anaemia. J. Indian Med. Assoc. 2001; 99(3): 154–5.
27.Reveiz L., Gyte G.M.L., Cuervo L.G., Cassasbuenas A. Treatments for iron-deficiency anaemia in pregnancy. 2011; (10): CD003094. DOI: 10.1002/14651858.CD003094.pub3.
28.Scholl T.O. Iron status during pregnancy: setting the stage for mother and infant. Am. J. Clin. Nutr. 2005; 81(5): 1218S–22S.
29.Tiwari A.K., Mahdi A.A., Chandyan S., Zahra F., Godbole M.M., Jaiswar S.P. et al. Oral iron supplementation leads to oxidative imbalance in anemic women: a prospective study. Clin. Nutr. 2011; 30(2): 188–93.
30.Toblli J.E., Brignoli R. Iron(III)-hydroxide polymaltose complex in iron deficiency anemia / review and meta-analysis. Arzneimittelforschung. 2007; 57(6A): 431–8.
31.Toblli J.E., Cao G., Olivieri L., Angerosa M. Comparative study of gastrointestinal tract and liver toxicity of ferrous sulfate, iron amino chelate and iron polymaltose complex in normal rats. Pharmacology. 2008; 82(2): 127–37.
32.Van Wyck D.B., Martens M.G., Seid M.H., Baker J.B., Mangione A. Intravenous ferric carboxymaltose compare with oral iron in the treatment of postpartum anemia: a randomized controlled trial. Obstet. Gynecol. 2007; 110(2,pt1): 267–78.
33.Walsh T., O’Broin S.D., Cooley S. Laboratory assessment of iron status in pregnancy. Clin. Chem. Lab. Med. 2011; 49(7): 1225–30.
34.World Health Organization. In: de Benoist B., Mclean E., Egli I., Cogswell M., eds. Worldwide prevalence of anaemia 1993–2005. WHO Global Database on Anaemia. Geneva: World Health Organization, 2008 (NLM: WH 155).
35.Yasa B., Agaoglu L., Unuvar E. Efficacy, tolerability, and acceptability of iron hydroxide polymaltose complex versus ferrous sulfate: A randomized trial in pediatric patients with iron deficiency anemia. Int. J. Pediatr. 2011: 524520. Epub 2011 Oct 31.
Баев Олег Радомирович, доктор медицинских наук, профессор, заведующий родильным отделением ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова им. академика В.И. Кулакова Минздравсоцразвития России; профессор кафедры акушерства, гинекологии, перинатологии и репродуктологии ГБОУ ВПО Первого МГМУ им. И.М. Сеченова Минздравсоцразвития России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон 8 (495) 438-11-88. E-mail: [email protected]
Как лечить дефицит железа
Железодефицитная анемия (ЖДА)— самый распространённый подвид анемии, состояние организма, ассоциированное с дефицитом железа, на фоне чего происходит снижение гемоглобина и эритроцитов, наблюдается кислородное голодание органов. Данное состояние может возникнуть у всех возрастных групп и слоев населения. Но особенно часто возникает у беременных женщин и детей. ЖДА порождает нарушения кроветворения, сбои в работе сердечно-сосудистой системы, ослабляет иммунитет, вызывает отклонения в работе репродуктивных органов и т. д.
Данное состояние может возникнуть у всех возрастных групп и слоев населения. Но особенно часто возникает у беременных женщин и детей. ЖДА порождает нарушения кроветворения, сбои в работе сердечно-сосудистой системы, ослабляет иммунитет, вызывает отклонения в работе репродуктивных органов и т. д.
Ольга Андреевна Марданова
Врач-пульмонолог, врач-терапевт
Задать вопрос
Проводит диагностику заболеваний органов дыхания с использованием данных объективного обследования, а также дополнительных методов исследования, включая специфические анализы крови, исследование функции внещнего дыхания, пульсоксиметрии, измерение уровня NO в выдыхаемом воздухе, рентгенографии и компьютерной томографии органов грудной клетки.
Что такое железодефицитная анемия
Так называют продолжительный дефицит железа у человека, спровоцировавший снижение гемоглобина ниже референсных значений. В результате чего формируются различные патологии организма, связанные с неполноценным газообменом. Состояние, когда в организме есть дефицит железа, но пока не произошло снижение уровня гемоглобина называется латентным железодецитом.
В результате чего формируются различные патологии организма, связанные с неполноценным газообменом. Состояние, когда в организме есть дефицит железа, но пока не произошло снижение уровня гемоглобина называется латентным железодецитом.
Для железодефицитной анемии свойственно бессилие, головокружение, выпадение волос, замедление обмена веществ, головные боли и другие изменения состояния. Дефицит железа может быть следствием как малого поступлении железа с едой, так и нарушения его усвоения или излишнего расходования.
Симптомы ЖДАДля ЖДА свойственно развитие 2-х синдромов: сидеропенического и анемического.
Первый на фоне дефицита железа нарушает метаболические процессы. Поэтому при ЖДА могут появляться:
- сухость кожи, шелушение и трещины;
- расслоение ногтей, появление на них полос, развитие ониходистрофии;
- хейлит;
- стоматит;
- ухудшение состояния волос, выпадение, сечение, потеря упругости и блеска;
- желание есть мел, известь, землю и т.
 д;
д; - желание вдыхать токсичные запахи, например, лака, бензина, клея и пр;
- заболевания ЖКТ;
- кашель, ощущение кома в горле, трудности при глотании.
Наиболее характерным признаком, который наблюдается у многих больных анемией, является бледность с приобретением зеленоватого оттенка кожи.
Анемический синдром возникает вследствие нарушения газообмена на фоне падения гемоглобина. Главными его проявлениями являются:
- слабость;
- дискомфорт в области сердца;
- быстрая утомляемость;
- одышка при физических нагрузках;
- тахикардия;
- дневная сонливость;
- пятна перед глазами;
- головокружения;
- головные боли;
- потеря сознания;
- снижение артериального давления.
Зачастую снижение железа, а значит и продуцируемого гемоглобина, проходит плавно. Поэтому многие органы и системы успевают адаптироваться. Самочувствие больных в это время ухудшается, но так как это происходит медленно, пациенты не чувствуют изменений и списывают симптомы на переутомление.
- Прелатентный дефицит железа. Уменьшается железо, пребывающее в костный мозг и снижается объем ферритина. При этом сохраняется адекватный уровень сывороточного железа, эритроцитов и гемоглобина. Симптомы на этой стадии чаще всего отсутствуют.
- Латентный дефицит железа. Здесь его запасы уже истощаются. Организм направляет бóльшую его долю для синтеза гемоглобина, поэтому его количество сохраняется в нормальных пределах. При этом латентный дефицит железа уже начинает влиять на тканевый обмен, что приводит к возникновению первых предпосылок анемического и сидеропенического синдромов.

- ЖДА. Уровень железа падает, его запасы истощаются, уменьшается уровень сывороточного железа, гемоглобина и эритроцитов.
ЖДА имеет разные степени тяжести, это зависит от уровня гемоглобина. В нормальном состоянии у женщин на каждый литр крови должно быть 120—140 грамм гемоглобина. Для мужчин нормой считаются 130—160 грамм/л. На основании концентрации гемоглобина выделяют 3 уровня тяжести ЖДА:
Диагностика заболеванияДля диагностики анемии обращаются к терапевту, гематологу или педиатру. Пациента опрашивают, собирают жалобы, разбирают рацион и т. д. Затем берется анализ крови с лейкоцитарной формулой. Появляется возможность выявить не только уменьшение гемоглобина и эритроцитов, но и другие изменения:
- цветового показателя крови — меньше 0,8;
- среднего объема эритроцита — менее 70 мкм3;
- среднего содержания гемоглобина в эритроците — менее 24 пг;
- гематокрит — менее 40% для мужчин и менее 35% для женщин;
- СОЭ.

При выявлении изменений назначается биохимический анализ крови. Исследуется:
- уровень ферритина;
- уровень сывороточного железа;
- общая железосвязывающая способность сыворотки;
- концентрация эритропоэтина;
- показатель насыщения трансферрина железом.
При наличии анемии выискивают причины ее развития. Для этого назначаются:
- анализа кала на наличие скрытой крови;
- рентген;
- КТ;
- эндоскопическое исследование;
- УЗИ органов брюшной полости и проч.
Часто в этих случаях нужны консультации узконаправленных специалистов, занимающихся лечением заболеваний, провоцирующих ЖДА — уролог, акушер-гинеколог, гастроэнтеролог и др.
Лечение ЖДАПри железодефицитной анемии нужно, конечно же, восполнять дефицит. В таких ситуациях пациентам назначается лечение железосодержащими препаратами и диета. Однако часто бывают ситуации, когда начинать лечение стоит не с восполнения дефицита, а с лечения основного заболевания. Не всегда стоит спешить с приёмом железосодержащих препаратов, особенно осторожно и сомнительно нужно относиться к назначениям уколов и капельниц железа.
Однако часто бывают ситуации, когда начинать лечение стоит не с восполнения дефицита, а с лечения основного заболевания. Не всегда стоит спешить с приёмом железосодержащих препаратов, особенно осторожно и сомнительно нужно относиться к назначениям уколов и капельниц железа.
Их прием составляет основу лечения железодефицитной анемии, поскольку компенсировать нехватку этого микроэлемента только коррекцией рациона очень сложно.
Для пациента подбирают медикамент в соответствии с его возрастом, тяжестью ЖДА и прочим. Сегодня препаратов подобного рода великое множество, причем регулярно выходят новые, более совершенные формы.
- Nan-O-Fer — капсулы, разработанные с учетом особенностей усвоения железа. Является одним из самых назначаемых средств для лечения ЖДА, поскольку в его составе липосомальное железо представлено в форме пирофосфата, а чтобы улучшить его всасывание в состав введены витамины В12, В6 и фолиевая кислота.
 Это гарантирует быстрое восполнение недостатка железа при употреблении всего 1-ой капсулы в сутки;
Это гарантирует быстрое восполнение недостатка железа при употреблении всего 1-ой капсулы в сутки; - Тотема — раствор выпускается в ампулах и содержит медь, марганец и глюконат железа. Его принимают, растворив ампулу в воде. Напиток не может похвастаться приятным вкусом, часто провоцирует запор, дискомфорт в животе и металлический привкус во рту, а потому пациенты отказываются от такого лечения;
- Сорбифер Дурулес — таблетки, в составе которых есть сульфат железа и аскорбиновая кислота. Может вызывать побочные эффекты и неприятный металлический привкус во рту;
- Мальтофер — линейка препаратов в форме капель, сиропа и жевательных таблеток. Минусом средства является их высокая цена и высокий риск развития побочек;
- Ферум Лек — препарат для введения, хотя есть и пероральные формы.
Все лекарства при анемии назначаются курсом, длительность которых определяет врач по результатам анализов крови. Нельзя принимать препараты без рецепта врача, так как переизбыток железа может вызвать развитие серьезных последствий:
- поражение зубов;
- поражение печени, развитие цирроза;
- сахарный диабет;
- сердечно-сосудистые патологии;
- тяжелые аллергии.

При железодефицитной анемии нужно скорректировать меню и ввести в рацион продукты, в которых железо содержится в усвояемой форме:
- телятина, баранина, говядина (в особенности печень), кролик;
- язык;
- яичный желток;
- шиповник;
- морская капуста;
- чернослив;
- бобовые;
- гречка.
Также советуют употреблять продукты, в которых содержание витамина C наиболее высокое:
Из-за фосфатов, фитинов и щавелевой кислоты, которых много в некоторых овощах и зерновых, плохо усваивается железо из пищи и лекарств. Точно также влияет и танин, который есть в чае, кофе и какао.
Почему железо не усваивается?- не та форма препарата, неверная дозировка и время приема;
- приём препаратов железа сочетается с продуктами, мешающими усвоению, например, кофе или молочная продукция;
- мало необходимых ко-факторов усвоения в пище;
- что-то не так с усвоением в ЖКТ.

В желудке расщепляются белки и высвобождаются микроэлементы. Если есть проблемы с кислотностью или хронический гастрит, то минералы и белки будут в дефиците.
Из-за нарушения его микрофлоры питательные вещества плохо усваиваются.
Уникальные пробиотические добавки, например, Симбионты Кутушова, заживляют стенки кишечника, прогоняя патогенов, которые разрушают стенку кишечника. Бактерии в его составе сдерживают рост патогенной флоры, поэтому ими можно восстановить уровень железа даже без приема препаратов. Они сделаны из натуральных компонентов, не имеют противопоказаний и разрешены к применению с младенческого возраста.
Принимает участие в усвоение жиров и жирорастворимых витаминов. Застой желчи, дискинезия ослабляет иммунитет, провоцирует сухость кожи, выпадение волос.
Ферменты поджелудочной железы и кишечника расщепляют пищевые белки, жиры и углеводы на молекулы и помогают им усваиваться. Недостаточная их выработка вызывает дефициты и воспаления.
ПрофилактикаПредотвратить развитие анемии гораздо проще, чем ее лечить. Для этого рекомендуется:
Для этого рекомендуется:
- ежегодно в целях профилактики сдавать общий анализ крови;
- обеспечить нужное поступление железа с пищей;
- своевременно лечить нарушения ЖКТ;
- принимать железосодержащие препараты во время беременности.
Исходя из всего вышесказанного, с железодефицитной анемией может столкнуться каждый, но при должном отношении к своему здоровью можно вовремя заметить изменения и начать лечение. Если диагностировать ЖДА на начальных стадиях,то возможен благоприятных исход, и у пациента получится восстановить оптимальный уровень микроэлемента. Ведь, чем ниже уровень железа становится со временем, тем сложнее его потом восстановить.
Отличие от других микроцитарных анемий
Железодефицитная анемия должна быть дифференцирована от других микроцитарных анемий (см. таблицу Дифференциальная диагностика микроцитарной анемии вследствие снижения выработки эритроцитов [Differential Diagnosis of Microcytic Anemia Due to Decreased RBC Production] Дифференциальная диагностика микроцитарной анемии, вызванной снижением выработки эритроцитов ). Если у пациента с микроцитарной анемией наличие дефицита железа было исключено с помощью специальных методов исследования, необходимо подозревать наличие
Если у пациента с микроцитарной анемией наличие дефицита железа было исключено с помощью специальных методов исследования, необходимо подозревать наличие
Лечение железодефицитной aнемии
Пероральные препараты железа
Реже препараты железа для парентерального введения
Применение препаратов железа без определения причины заболевания – бесполезная практика; источник кровотечения должен быть установлен даже в случае наличия анемии легкой степени.
Препараты перорального железа назначаются в виде солей двухвалентного железа (сульфат железа, глюконат железа, фумарат железа) или сахарида трехвалентного железа за 30 минут до еды (пища или антациды могут снижать абсорбцию железа). Как правило, начальная доза составляет 60 мг элементарного железа (например, в виде 325 мг сульфата железа) 1 раз в день или через день (1 Справочные материалы по лечению Дефицит железа является наиболее частой причиной анемии и обычно обусловлен кровопотерей; мальабсорбция, к примеру такая, как при целиакии, является гораздо менее распространенной причиной…. Прочитайте дополнительные сведения ). Большие дозы в основном не всасываются из-за увеличения продукции гепсидина, но усиливают побочные эффекты, особенно запор или другие расстройства ЖКТ. Аскорбиновая кислота в форме таблеток (500 мг) или апельсиновый сок повышают абсорбцию железа, не вызывая при этом желудочно-кишечных расстройств.
Прочитайте дополнительные сведения ). Большие дозы в основном не всасываются из-за увеличения продукции гепсидина, но усиливают побочные эффекты, особенно запор или другие расстройства ЖКТ. Аскорбиновая кислота в форме таблеток (500 мг) или апельсиновый сок повышают абсорбцию железа, не вызывая при этом желудочно-кишечных расстройств.
Препараты железа для парентерального применения имеют большую терапевтическую эффективность, чем пероральные препараты, однако они могут вызывать различные нежелательные явления, чаще всего аллергические или инфузионные реакции (например, лихорадку, артралгию, миалгию). Серьезные анафилактоидные реакции Анафилактоидные реакции Анафилаксия – острая, угрожающая жизни, IgE-опосредованная аллергическая реакция, которая отмечается у предварительно сенсибилизированных пациентов при повторной встрече со знакомым антигеном… Прочитайте дополнительные сведения , более широко распространенные в прошлом, были в основном вызваны высоким молекулярным весом декстрана железа, который больше не доступен. Препараты железа применяются у пациентов, которые не переносят пероральные препараты либо не могут их принимать, а также у пациентов, постоянно теряющих большие количества крови в связи с сосудистыми заболеваниями (такими как наследственная геморрагическая телеангиэктазия Наследственная геморрагическая телеангиэктазия Наследственная геморрагическая телеангиэктазия является наследственным заболеванием сосудистой мальформации, передаваемым как аутосомно-доминантный признак, и поражает как мужчин, так и женщин… Прочитайте дополнительные сведения ). Дозу железа, вводимого парентерально, должен определять врач-гематолог.
Препараты железа применяются у пациентов, которые не переносят пероральные препараты либо не могут их принимать, а также у пациентов, постоянно теряющих большие количества крови в связи с сосудистыми заболеваниями (такими как наследственная геморрагическая телеангиэктазия Наследственная геморрагическая телеангиэктазия Наследственная геморрагическая телеангиэктазия является наследственным заболеванием сосудистой мальформации, передаваемым как аутосомно-доминантный признак, и поражает как мужчин, так и женщин… Прочитайте дополнительные сведения ). Дозу железа, вводимого парентерально, должен определять врач-гематолог.
Курс лечения пероральными или парентеральными препаратами железа должен продолжаться ≥ 6 месяцев после нормализации уровня гемоглобина для восполнения запасов железа в тканях.
Ответ на лечение оценивается в серии измерений уровня гемоглобина до нормализации эритроцитарных показателей. В течение первых 2 недель наблюдается незначительный подъем уровня гемоглобина, затем его скорость возрастает до 0,7–1 г/неделю до нормализации показателей. Анемия должна быть устранена в течение 2 месяцев. Неполный ответ на лечение свидетельствует о длительном кровотечении, наличии основного инфекционного или онкологического заболевания, недостаточном поступлении железа с пищей или мальабсорбции железа в ЖКТ. Если симптомы анемии, такие как усталость, слабость и одышка, не уменьшаются после устранения анемии, следует искать альтернативную причину.
Анемия должна быть устранена в течение 2 месяцев. Неполный ответ на лечение свидетельствует о длительном кровотечении, наличии основного инфекционного или онкологического заболевания, недостаточном поступлении железа с пищей или мальабсорбции железа в ЖКТ. Если симптомы анемии, такие как усталость, слабость и одышка, не уменьшаются после устранения анемии, следует искать альтернативную причину.
Поглощение железа: сравнение перорального железа, связанного с гемом, с неорганическим сульфатом железа. | Кровь
Пропустить пункт назначения
Только публикация| 16 ноября 2007 г.
Декстер Т. Эстрада, доктор медицины,
Кеннет А. Шварц, MD
Blood (2007) 110 (11): 3752.
https://doi.org/10.1182/blood.V110.11.3752.3752
Citation
Dexter T. Estrada, Kenneth A.; Поглощение железа: сравнение перорального приема железа, связанного с гемом, и неорганического сульфата железа. . Кровь 2007; 110 (11): 3752. doi: https://doi.org/10.1182/blood.V110.11.3752.3752
. Кровь 2007; 110 (11): 3752. doi: https://doi.org/10.1182/blood.V110.11.3752.3752
Скачать файл цитирования:
- Ris (Zotero)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- КонецПримечание
- РефВоркс
- Бибтекс
Пероральные препараты железа являются эффективным методом лечения железодефицитной анемии. Однако современные препараты неорганического железа имеют значительные побочные эффекты со стороны желудочно-кишечного тракта, что иногда мешает пациентам соблюдать назначенное им железо. Всасывание железа, связанного с гемом, в кишечнике происходит по другому пути, чем неорганическое железо. Железо, связанное с гемом, также может иметь меньше побочных эффектов со стороны желудочно-кишечного тракта, поскольку оно присутствует в красном мясе и других специально приготовленных продуктах. Если можно будет показать, что пероральное железо, связанное с гемом, всасывается так же легко, как пероральное неорганическое железо, то пациенты, которые не переносят неорганическое железо, получат менее дорогую альтернативу парентеральному железу, которое является дорогостоящим и может вызвать опасный для жизни риск анафилаксии. Цель этого исследования заключалась в том, чтобы определить, существует ли значительная разница между пероральным всасыванием железа, связанного с гемом, в виде супа из приготовленной бычьей крови и неорганического сульфата железа. Для участия в этом исследовании были набраны десять нормальных взрослых субъектов, и было получено информированное согласие. У всех субъектов были нормальные исходные показатели сывороточного железа натощак и ферритина. После получения крови для сывороточного железа натощак испытуемые принимали приготовленный суп из бычьей крови, содержащий 18 мг элементарного гемового железа. Повторные исследования железа проводились через 2 часа после приема препарата гемового железа.
Если можно будет показать, что пероральное железо, связанное с гемом, всасывается так же легко, как пероральное неорганическое железо, то пациенты, которые не переносят неорганическое железо, получат менее дорогую альтернативу парентеральному железу, которое является дорогостоящим и может вызвать опасный для жизни риск анафилаксии. Цель этого исследования заключалась в том, чтобы определить, существует ли значительная разница между пероральным всасыванием железа, связанного с гемом, в виде супа из приготовленной бычьей крови и неорганического сульфата железа. Для участия в этом исследовании были набраны десять нормальных взрослых субъектов, и было получено информированное согласие. У всех субъектов были нормальные исходные показатели сывороточного железа натощак и ферритина. После получения крови для сывороточного железа натощак испытуемые принимали приготовленный суп из бычьей крови, содержащий 18 мг элементарного гемового железа. Повторные исследования железа проводились через 2 часа после приема препарата гемового железа. После 2-недельного периода вымывания у тех же 10 субъектов был взят исходный уровень сывороточного железа с последующим приемом внутрь 18 мг элементарного железа в виде неорганического эликсира сульфата железа. Сывороточное железо снова измеряли через 2 часа после приема сульфата железа. Среднее увеличение сывороточного железа после приема препарата крови крупного рогатого скота составило 18,5 мкг/дл. Для сравнения, среднее увеличение сывороточного железа после приема сульфата железа составило 37,9.микрограмм/дл. Анализ парного Т-теста не показал каких-либо существенных различий в увеличении сывороточного железа от исходного уровня до 2 часов между двумя препаратами железа (P>0,1112). Ни один из субъектов не сообщал о каких-либо побочных эффектах после приема внутрь любого препарата. В заключение, гемовое железо, принимаемое внутрь в виде приготовленного супа из бычьей крови, хорошо переносится, вызывает повышение концентрации сывороточного железа, сравнимое с концентрацией сульфата железа, и поддерживает принцип, согласно которому разумное количество железа может абсорбироваться из гем.
После 2-недельного периода вымывания у тех же 10 субъектов был взят исходный уровень сывороточного железа с последующим приемом внутрь 18 мг элементарного железа в виде неорганического эликсира сульфата железа. Сывороточное железо снова измеряли через 2 часа после приема сульфата железа. Среднее увеличение сывороточного железа после приема препарата крови крупного рогатого скота составило 18,5 мкг/дл. Для сравнения, среднее увеличение сывороточного железа после приема сульфата железа составило 37,9.микрограмм/дл. Анализ парного Т-теста не показал каких-либо существенных различий в увеличении сывороточного железа от исходного уровня до 2 часов между двумя препаратами железа (P>0,1112). Ни один из субъектов не сообщал о каких-либо побочных эффектах после приема внутрь любого препарата. В заключение, гемовое железо, принимаемое внутрь в виде приготовленного супа из бычьей крови, хорошо переносится, вызывает повышение концентрации сывороточного железа, сравнимое с концентрацией сульфата железа, и поддерживает принцип, согласно которому разумное количество железа может абсорбироваться из гем.
Темы:
сульфат железа, гемовое железо, усвоение железа, железо, лекарственная форма эликсира, побочные эффекты, гем, анафилаксия, ферритин, железодефицитная анемия
Раскрытие информации: Нет соответствующих конфликтов интересов, о которых следует заявить.
Войдите через свое учреждение
Руководство по пероральным добавкам железа – клинические корреляции
Cindy Fei, MD
Рецензировано экспертами
Дефицит железа является наиболее распространенной причиной анемии в Соединенных Штатах. Несмотря на это, существует множество вопросов, связанных с лучшим выбором добавок. Какой препарат железа лучше всего назначить? Помогают ли новые препараты, такие как таблетки с кишечнорастворимой оболочкой? Как долго вы лечитесь? Ниже приводится обзор литературы по этим вопросам.
Чтобы лучше понять режимы дозирования, давайте сначала рассмотрим метаболизм железа.
В организме содержится приблизительно 45 мг/кг элементарного железа, из которых две трети находится в форме гемоглобина, 15-20% в форме хранения, 10% в виде миоглобина и 5% в виде других железосодержащих ферментов. Железо в основном циркулирует по телу в замкнутой системе и перерабатывается из старых эритроцитов, при этом существенные потери происходят только при больших кровотечениях. Менее 0,1% общего количества железа теряется в среднем ежедневно с мочой, потом, фекалиями, кожными выделениями, менструациями и родами. Эти последние два сценария объясняют пропорционально меньшее количество железа у женщин, хранящееся в виде ферритина или гемосидерина в печени и макрофагах. В целом, 1-2 мг железа в день необходимо восполнять перорально, чтобы покрыть эти физиологические потери, причем у женщин потребность в железе выше.[1] Рекомендованная правительством диетическая норма железа (8 мг/день для мужчин и женщин в постменопаузе по сравнению с 18 мг/день для женщин в период менструации) покрывает только этот минимум и не может восполнить потери железа за пределами физиологического состояния. [2] Это несоответствие объясняет, почему для лечения железодефицитной анемии требуется дополнительный прием железа.
[2] Это несоответствие объясняет, почему для лечения железодефицитной анемии требуется дополнительный прием железа.
При отсутствии массивного кровотечения явная железодефицитная анемия развивается прогрессирующим образом. Снижение запасов железа в форме ферритина является первым признаком несоответствия потребности в железе, поскольку железо мобилизуется из печени и ретикулоэндотелиальной системы. Однако сывороточное железо, общая железосвязывающая способность (ЖССЖ) и морфология эритроцитов остаются нормальными до тех пор, пока запасы железа не будут исчерпаны. После этого уровни железа в сыворотке снижаются, в то время как TIBC увеличивается в попытке повысить абсорбцию железа. Дисфункциональный эритропоэз и микроцитоз возникают только тогда, когда насыщение трансферрина падает ниже 15%. Только в этот момент развивается анемия и низкий уровень гемоглобина.[3]
Препараты с добавками железа
Пероральные добавки с железом предлагают более надежный путь восполнения запасов железа. Наиболее часто назначаемые препараты, соли железа, включают сульфат железа, глюконат железа и фумарат железа. Эти формы железа (Fe+2) более растворимы, чем пищевая форма железа (Fe+3), с усвояемостью в два раза выше. Предполагаемая скорость всасывания солей двухвалентного железа составляет 10-15%, при этом в небольшом, но рандомизированном контролируемом исследовании не было обнаружено различий в всасываемости между тремя основными препаратами.[4] Три состава сульфата железа действуют одинаково, повышая уровень гемоглобина на 0,25 г/дл в день по сравнению со средним базовым уровнем гемоглобина 5 г/дл в одном исследовании.[5] Низкая скорость всасывания приводит к менее чем идеальной дозировке трех таблеток в день, чтобы восполнить дефицит железа. Например, одна таблетка сульфата железа 325 мг содержит 60 мг элементарного железа, поэтому прием три раза в день обеспечивает 180 мг элементарного железа в день, что находится в пределах рекомендуемого дневного диапазона 150-200 мг для пациентов с дефицитом железа.
Наиболее часто назначаемые препараты, соли железа, включают сульфат железа, глюконат железа и фумарат железа. Эти формы железа (Fe+2) более растворимы, чем пищевая форма железа (Fe+3), с усвояемостью в два раза выше. Предполагаемая скорость всасывания солей двухвалентного железа составляет 10-15%, при этом в небольшом, но рандомизированном контролируемом исследовании не было обнаружено различий в всасываемости между тремя основными препаратами.[4] Три состава сульфата железа действуют одинаково, повышая уровень гемоглобина на 0,25 г/дл в день по сравнению со средним базовым уровнем гемоглобина 5 г/дл в одном исследовании.[5] Низкая скорость всасывания приводит к менее чем идеальной дозировке трех таблеток в день, чтобы восполнить дефицит железа. Например, одна таблетка сульфата железа 325 мг содержит 60 мг элементарного железа, поэтому прием три раза в день обеспечивает 180 мг элементарного железа в день, что находится в пределах рекомендуемого дневного диапазона 150-200 мг для пациентов с дефицитом железа. Предполагая скорость всасывания 10%, 500 мг биодоступного железа, накопленного после одного месяца терапии, должны быть доступны для производства 500 мл эритроцитарной массы или увеличения гемоглобина на 2 г/дл.[6]
Предполагая скорость всасывания 10%, 500 мг биодоступного железа, накопленного после одного месяца терапии, должны быть доступны для производства 500 мл эритроцитарной массы или увеличения гемоглобина на 2 г/дл.[6]
Следует отметить, что рандомизированное контролируемое исследование показало, что постепенно увеличивающиеся дозы железа у пожилых людей с железодефицитной анемией не давали никаких дополнительных преимуществ в отношении уровня железа и фактически вызывали большее желудочно-кишечное расстройство. Пациенты в возрасте 80 лет и старше с железодефицитной анемией были рандомизированы для приема 15 мг, 50 мг или 150 мг элементарного железа в день, что приводило к сопоставимому повышению уровня гемоглобина и ферритина через 60 дней без каких-либо статистически значимых различий между тремя группами. Однако более высокие дозы приводили к статистически значимому увеличению дискомфорта в животе, тошноты, рвоты, диареи, запоров и черного стула.[7] Это говорит о том, что пожилые люди могут получать менее одной таблетки сульфата железа в день без ущерба для эффективности.
Пероральная терапия железом печально известна своими побочными эффектами, а именно запорами, диареей, изжогой, тошнотой и болью в эпигастральной области, которые могут беспокоить до 20% пациентов и ограничивают соблюдение различных препаратов железа. Предполагаемый уровень приверженности колеблется в пределах 40-60%.[8] Побочные эффекты со стороны верхних отделов желудочно-кишечного тракта, такие как тошнота и боль в эпигастральной области, в большей степени зависят от дозы, и их можно контролировать с помощью более низких или менее частых дозировок на начальном этапе. Напротив, более низкие желудочно-кишечные эффекты, такие как измененные привычки кишечника, менее связаны с дозировкой.] Стратегия приема железа во время еды, чтобы свести к минимуму желудочно-кишечные расстройства, к сожалению, ухудшает всасывание железа на целых 50% в одном небольшом исследовании. [10]
Рандомизированное контролируемое исследование не показало каких-либо статистически значимых различий в побочных эффектах со стороны желудочно-кишечного тракта между эквивалентными дозами трех различных препаратов на основе солей двухвалентного железа. [11] Это открытие было подтверждено в систематическом обзоре 111 исследований, в которых сравнивались различные составы солей двухвалентного железа в дозах 80-120 мг элементарного железа в день.[12]
[11] Это открытие было подтверждено в систематическом обзоре 111 исследований, в которых сравнивались различные составы солей двухвалентного железа в дозах 80-120 мг элементарного железа в день.[12]
Препараты с энтеросолюбильным покрытием
В свете этих ограничивающих терапию побочных эффектов на рынок поступили новые препараты железа с энтеросолюбильным покрытием в попытке уменьшить распространенность желудочно-кишечных расстройств и сократить график дозирования. Однако это происходит за счет всасывания, поскольку железо может не всасываться в двенадцатиперстной кишке. Сравнение между энтеросолюбильным покрытием и эликсиром сульфата железа у здоровых добровольцев не показало статистически значимого увеличения концентрации железа в сыворотке по сравнению с исходным уровнем в группе, покрытой энтеросолюбильным покрытием. Предполагаемая биодоступность препарата с кишечнорастворимой оболочкой составила 30% от обычного перорального препарата [13] 9.0003
Ниферекс
Другой препарат под названием Ниферекс, комплекс полисахарида и железа, предназначен для минимизации желудочно-кишечных расстройств за счет задержки высвобождения железа в кишечнике. Эта комбинация трехвалентного железа и низкомолекулярного полисахарида содержит 150 мг элементарного железа. Препарат с отсроченным высвобождением вызывает опасения относительно неадекватного всасывания в кишечнике. В рандомизированном открытом исследовании, сравнивавшем эквивалентные суточные дозы Ниферекса и фумарата железа, у пациентов с железодефицитной анемией было достигнуто статистически более высокое увеличение гемоглобина через 12 недель в группе, получавшей железо (2,84 против Ниферекса 0,60, p <0,0001). Статистически значимое увеличение ферритина и среднего эритроцитарного объема также наблюдалось у пациентов, принимавших сульфат железа, а не Ниферекс, в то время как группа, получавшая двухвалентное железо, страдала от тошноты и диареи значительно чаще [14].
Эта комбинация трехвалентного железа и низкомолекулярного полисахарида содержит 150 мг элементарного железа. Препарат с отсроченным высвобождением вызывает опасения относительно неадекватного всасывания в кишечнике. В рандомизированном открытом исследовании, сравнивавшем эквивалентные суточные дозы Ниферекса и фумарата железа, у пациентов с железодефицитной анемией было достигнуто статистически более высокое увеличение гемоглобина через 12 недель в группе, получавшей железо (2,84 против Ниферекса 0,60, p <0,0001). Статистически значимое увеличение ферритина и среднего эритроцитарного объема также наблюдалось у пациентов, принимавших сульфат железа, а не Ниферекс, в то время как группа, получавшая двухвалентное железо, страдала от тошноты и диареи значительно чаще [14].
Витамин С
Предполагается, что аскорбиновая кислота улучшает усвоение за счет восстановления железа до двухвалентного состояния Fe+2 для оптимизации его растворимости. Повышение дозы витамина С продемонстрировало дозозависимый ответ на абсорбцию железа при одновременном применении у здоровых добровольцев: от отсутствия изменений в абсорбции сульфата железа при дозах аскорбиновой кислоты ниже 100 мг до 48% увеличения абсорбции элементарного железа при приеме 30 мг аскорбиновой кислоты при приеме 500 мг аскорбиновой кислоты. 15] Хотя долгосрочные исследования не проводились, относительно безвредный характер витамина С приводит к низкому порогу одновременного применения с железом.
15] Хотя долгосрочные исследования не проводились, относительно безвредный характер витамина С приводит к низкому порогу одновременного применения с железом.
Реакция на терапию препаратами железа
Назначение добавок железа двоякое: обратить вспять анемию и пополнить запасы железа. Ожидаемый ответ на курс препаратов железа — ретикулоцитоз через 3–5 дней с пиком через неделю, за которым вскоре следует повышение уровня гемоглобина. Ответ гемоглобина должен быть заметен через три недели после начала терапии.[16] Увеличение гемоглобина на 1 г/дл через месяц считается адекватным ответом.[17] Существует мало исследований по оптимальной продолжительности терапии, но приемлемым режимом является продолжение терапии в течение трех месяцев после нормализации гемоглобина, чтобы пополнить запасы железа в соответствии с рекомендациями Британского общества гастроэнтерологов.[18]
Выводы
Железодефицитную анемию можно лечить пероральными препаратами железа, наиболее часто назначаемой формой которых является сульфат железа 325 мг три раза в день, с возможностью более низких и менее частых дозировок у пожилых людей. Три препарата солей двухвалентного железа имеют схожие побочные эффекты, биодоступность и эффективность. Расстройство желудочно-кишечного тракта является распространенным побочным эффектом, который ограничивает приверженность пациентов терапии препаратами железа. Предлагаемые стратегии, позволяющие избежать этого, включают снижение дозы, прием железа во время еды или выбор препаратов с кишечнорастворимой оболочкой или комплекса полисахарид-железо (ниферекс). Однако все эти стратегии ухудшают всасывание железа и могут привести к субоптимальным клиническим результатам. Наконец, необходимы дальнейшие исследования в области одновременного применения витамина С и оптимальной продолжительности терапии препаратами железа.
Три препарата солей двухвалентного железа имеют схожие побочные эффекты, биодоступность и эффективность. Расстройство желудочно-кишечного тракта является распространенным побочным эффектом, который ограничивает приверженность пациентов терапии препаратами железа. Предлагаемые стратегии, позволяющие избежать этого, включают снижение дозы, прием железа во время еды или выбор препаратов с кишечнорастворимой оболочкой или комплекса полисахарид-железо (ниферекс). Однако все эти стратегии ухудшают всасывание железа и могут привести к субоптимальным клиническим результатам. Наконец, необходимы дальнейшие исследования в области одновременного применения витамина С и оптимальной продолжительности терапии препаратами железа.
Доктор Синди Фэй является жителем внутренней медицины в Медицинском центре NYU Langone
. Рассматривается Дэвид Грин, Медицина, Медицинский центр NYU Langone
Изображение. 1. Бриттенхэм, GM. Патофизиология гомеостаза железа. В: Хоффман Р., Бенц Э.Дж., Зильберштейн Л.Е., ред. Гематология: основные принципы и практика. 6-е изд. Филадельфия: Эльзевир Сондерс, 2013: 427–436.
В: Хоффман Р., Бенц Э.Дж., Зильберштейн Л.Е., ред. Гематология: основные принципы и практика. 6-е изд. Филадельфия: Эльзевир Сондерс, 2013: 427–436.
2. Национальные институты здравоохранения: Управление пищевых добавок. Информационный бюллетень о пищевых добавках: железо. 24 августа 2007 г. По состоянию на 9 ноября 2013 г. http://ods.od.nih.gov/factsheets/Iron-HealthProfessional/
3. Adamson JW. Дефицит железа и другие гипопролиферативные анемии. В: Лонго Д.Л., Фаучи А.С., Каспер Д.Л., ред. Харрисон в сети. 18-е изд. Доступ к медицине. www.accessmedicine.com
4. Brise H, Hallberg L. Всасываемость различных соединений железа. Acta Med Scand Приложение 1962; 376: 23-37. http://www.ncbi.nlm.nih.gov/pubmed/13873149
5. Притчард Дж.А. Регенерация гемоглобина при тяжелой железодефицитной анемии. JAMA 1966;195(9): 97-100. http://www.ncbi.nlm.nih.gov/pubmed/5951874
6. Аллейн М., Хорн М.К. и Миллер Дж.Л. Индивидуальное лечение железодефицитной анемии у взрослых. Am Jour of Med 2008; 121: 943-948. http://www.ncbi.nlm.nih.gov/pubmed/18954837
Am Jour of Med 2008; 121: 943-948. http://www.ncbi.nlm.nih.gov/pubmed/18954837
7. Rimon E, Kagansky N, Kagansky M, et al. Не даем ли мы слишком много железа? Терапия низкими дозами железа эффективна у восьмидесятилетних. Am J of Med 2005; 118(10): 1142-1147. http://www.ncbi.nlm.nih.gov/pubmed/16194646
8. Кансело-Идальго М.Дж., Каштелу-Бранко С., Паласиос С. и др. Переносимость различных пероральных добавок железа: систематический обзор. Текущие медицинские исследования и мнения. 2013;29(4): 291-303. http://www.ncbi.nlm.nih.gov/pubmed/23252877
9. Alleyne
10. Brise H. Влияние приема пищи на всасывание железа при пероральной терапии препаратами железа. Acta Med Scanda Suppl 1962; 376: 39-45. http://www.ncbi.nlm.nih.gov/pubmed/13873153
11. Hallberg L, Rytinger L, and Solvell L. Побочные эффекты пероральной терапии железом: двойное слепое исследование различных соединений железа в таблетках форма. Acta Med Scand Приложение 1966;459:3-10. http://www. ncbi.nlm.nih.gov/pubmed/5957969
ncbi.nlm.nih.gov/pubmed/5957969
12. Cancelo
13. Walker SE, Paton TW, Cowan DH. Биодоступность железа в пероральных препаратах сульфата железа у здоровых добровольцев. Canadian Med Assoc Jour 1989;141(6):543-547. http://www.ncbi.nlm.nih.gov/pubmed/2776093
14. Liu T, Lin S, Chang C, Yang W, Chen T. Сравнение комбинированного продукта фумарата железа и полисахаридного комплекса железа для перорального применения. лечение железодефицитной анемии: тайваньское исследование. Int J Гематол. 2004; 80: 416-420. http://www.ncbi.nlm.nih.gov/pubmed/15646652
15. Brise H, Hallberg L. Влияние аскорбиновой кислоты на усвоение железа. Acta Med Scand Suppl 1962; 376: 51-58. http://www.ncbi.nlm.nih.gov/pubmed/13873150
16. Brittenham GM. Нарушения гомеостаза железа: дефицит железа и перегрузка. В: Хоффман Р., Бенц Э.Дж., Зильберштейн Л.Е., ред. Гематология: основные принципы и практика. 6-е изд. Филадельфия: Эльзевир Сондерс, 2013: 437–449.
17. Шорт М.В.
