Как развивается анемия при ХПН. Почему возникает дефицит железа у пациентов с почечной недостаточностью. Какие препараты железа эффективны при анемии на фоне ХПН. Как правильно применять препараты железа при почечной анемии.
Анемия при хронической почечной недостаточности
Анемия является частым осложнением хронической почечной недостаточности (ХПН). Она развивается уже на ранних стадиях заболевания и прогрессирует по мере снижения функции почек. Основные причины развития анемии при ХПН:
- Снижение выработки эритропоэтина почками
- Дефицит железа
- Хроническое воспаление
- Уремическая интоксикация
При ХПН анемия характеризуется нормохромными нормоцитарными эритроцитами в крови и гипоплазией эритроидных клеток в костном мозге. По мере прогрессирования уремии развивается дефицит железа, и кроветворение становится железодефицитным.
Причины дефицита железа при ХПН
Основные факторы, приводящие к дефициту железа у пациентов с ХПН:

- Кровопотери (явные и скрытые)
- Недостаточное поступление железа с пищей
- Нарушение всасывания железа в желудочно-кишечном тракте
- Повышенная потребность в железе на фоне лечения эритропоэтином
- Хроническое воспаление
Особенно высок риск развития дефицита железа у пациентов на гемодиализе из-за регулярных кровопотерь. Потеря 1 мл крови приводит к потере 0,3-0,5 мг железа.
Оценка запасов железа в организме
Для оценки запасов железа используют следующие лабораторные показатели:
- Сывороточное железо
- Общая железосвязывающая способность сыворотки
- Насыщение трансферрина железом
- Уровень ферритина в сыворотке
- Содержание гемоглобина в ретикулоцитах
- Процент гипохромных эритроцитов
Однако при ХПН интерпретация этих показателей может быть затруднена из-за наличия хронического воспаления. Наиболее точно отражают функциональный дефицит железа содержание гемоглобина в ретикулоцитах и процент гипохромных эритроцитов.
Особенности анемии при различных причинах ХПН
Тяжесть анемии может зависеть от этиологии ХПН. У пациентов с диабетической нефропатией анемия развивается раньше и протекает тяжелее. При иммуновоспалительных заболеваниях (системная красная волчанка, васкулиты) сохраняющаяся активность воспаления создает дополнительные условия для развития анемии и железодефицита.

Исследования показывают, что у пациентов с ХПН на фоне системных заболеваний соединительной ткани распространенность анемии и дефицита железа выше, чем при первичных нефритах. Это может быть связано с:
- Подавлением эритропоэза провоспалительными цитокинами
- Нарушением высвобождения железа из макрофагов
- Аутоиммунным гемолизом
- Потерей эритропоэтина и железа с мочой при выраженной протеинурии
Лечение дефицита железа при ХПН
Основные принципы коррекции дефицита железа у пациентов с ХПН:
- На начальных стадиях ХПН эффективны пероральные препараты железа
- При выраженной ХПН часто требуется внутривенное введение железа
- Дозу подбирают индивидуально под контролем показателей обмена железа
- Препараты железа комбинируют с эритропоэтином
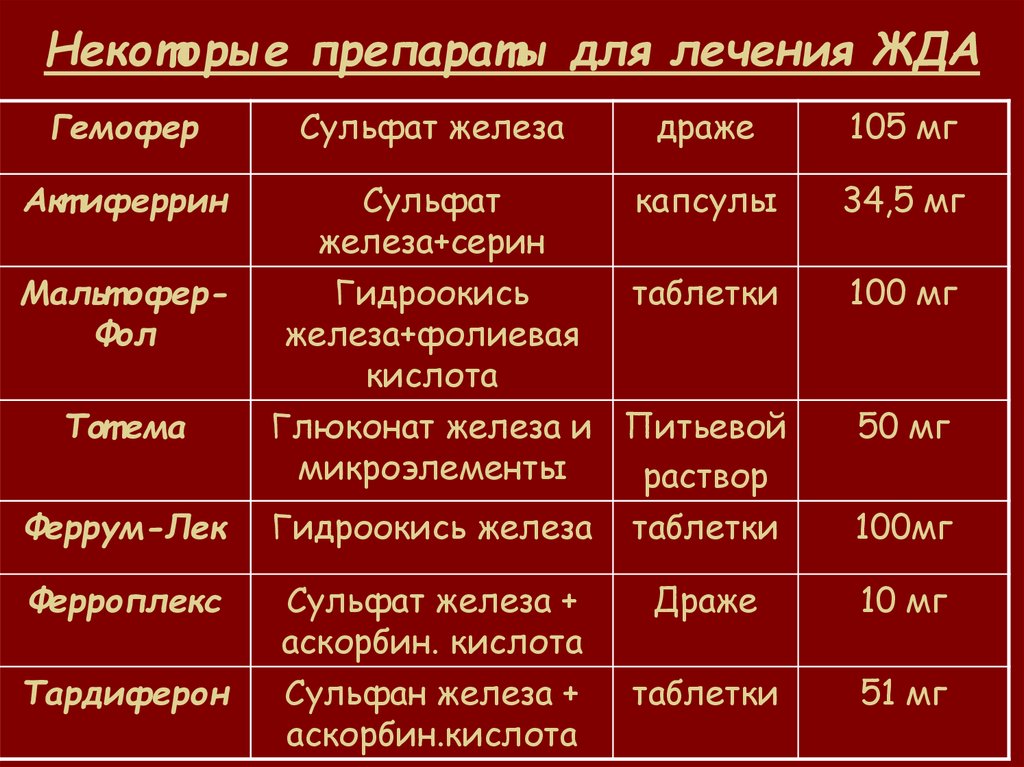
Пероральные препараты железа
На начальных и умеренных стадиях ХПН (СКФ более 30 мл/мин) эффективны пероральные препараты железа. Преимущества имеют препараты трехвалентного железа:
- Полимальтозный комплекс гидроокиси железа (мальтофер)
- Железа (III) гидроксид сахарозный комплекс
Они лучше переносятся, чем препараты двухвалентного железа, и их можно принимать независимо от приема пищи. Рекомендуемая доза — 200-300 мг элементарного железа в сутки.

Внутривенные препараты железа
При выраженной ХПН (СКФ менее 30 мл/мин) часто требуется внутривенное введение препаратов железа:
- Железа (III) гидроксид сахарозный комплекс (венофер)
- Железа карбоксимальтозат
Внутривенное введение позволяет быстро восполнить запасы железа и повысить эффективность терапии эритропоэтином. Стандартная доза — 100 мг 1-2 раза в неделю.
Эффективность лечения препаратами железа
Адекватная коррекция дефицита железа позволяет:
- Повысить уровень гемоглобина
- Уменьшить потребность в эритропоэтине
- Улучшить качество жизни пациентов
- Снизить риск сердечно-сосудистых осложнений
По данным исследований, у большинства пациентов с ХПН удается достичь целевого уровня гемоглобина (≥12 г/дл) при комбинированной терапии эритропоэтином и препаратами железа.
Побочные эффекты терапии железом
При применении препаратов железа возможны следующие побочные эффекты:
- Диспепсические явления при пероральном приеме
- Флебиты и подкожные кровоизлияния при внутривенном введении
- Аллергические реакции
- Гемосидероз при передозировке
Для снижения риска осложнений важно тщательно подбирать дозу препаратов железа и контролировать показатели обмена железа.

Заключение
Коррекция дефицита железа является важным компонентом лечения анемии при ХПН. Выбор препарата и способа введения зависит от стадии ХПН и выраженности дефицита железа. Адекватная терапия препаратами железа в сочетании с эритропоэтином позволяет эффективно корригировать анемию у большинства пациентов с ХПН.
Page not found — Heart Failure Matters
Новости Рекомендации ESC по диагностике и лечению сердечной недостаточности: что нужно знать пациентам Подробнее
Выбрать язык
Home » Error 404: Page not found
- Увеличить размер текста Уменьшить размер текста
- Распечатать эту страницу
- Послать страницу по электронной почте
К сожалению, запрашиваемая страница не найдена.
Скорее всего, страница, которую вы ищете, больше не существует или переведена в другой раздел.
Чтобы найти нужную страницу, воспользуйтесь меню слева или картой сайта.
Если проблема не устраняется и даже после поиска невозможно найти нужный ресурс, обратитесь к нам по электронной почте: [email protected].
Благодарим вас!
Рекомендации Европейского общества кардиологов (ESC) по диагностике и лечению сердечной недостаточности
Что нужно знать пациентам
Это руководство для пациентов, подготовленное Европейским обществом кардиологов (European Society of Cardiology, ESC), представляет собой краткий обзор наиболее актуальных научно обоснованных рекомендаций по диагностике и лечению сердечной недостаточности.
В частности, оно призвано помочь пациентам понять:
- какие основные виды сердечной недостаточности существуют;
- какие лекарственные препараты используются для лечения сердечной недостаточности;
- какие устройства могут использоваться;
- почему важна полноценная реабилитация;
- как важно заботиться о себе и контролировать свое состояние.

Узнать больше
Загрузить рекомендации
АНИМИРОВАННОЕ ПУТЕШЕСТВИЕ ПО СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Серия простых и увлекательных анимационных видео, объясняющих сердечную недостаточность и ее лечение
Эти видео рассказывают о том, как работает здоровое сердце, что происходит при сердечной недостаточности и как различные методы лечения помогают улучшать состояние вашего здоровья
Как работает здоровое сердце
Что происходит при сердечной недостаточности
Как сердце и другие органы адаптируются к сердечной недостаточности
Как сердечная недостаточность вызывает задержку жидкости
Как инфаркт миокарда может вызывать сердечную недостаточность
Как нарушение работы клапанов вызывает сердечную недостаточность
Как вазодилататоры действуют при сердечной недостаточности
Как работают диуретики при сердечной недостаточности
Как работают вспомогательные системы кровообращения при сердечной
ВИДЕО ПАЦИЕНТОВ И ОБСЛУЖИВАЮЩЕГО ПЕРСОНАЛА
В этом разделе вы можете увидеть, услышать или прочитать интервью с другими пациентами, страдающими сердечной недостаточностью или людьми, которые осуществляют уход
Пациент на фитнес-тренировке
Пациент с имплантируемым кардиовертером-дефибриллятором (ИКД)
ИЛЖ как подготовка к трансплантации
Изменение образа жизни и сохранение оптимизма
Жизнь с устройствами для лечения сердечной недостаточности
Сложности с постановкой диагноза
Жизнь с искусственным левым желудочком (ИЛЖ)
ЗАЙДИТЕ НА НАШУ СТРАНИЧКУ НА FACEBOOK
И поделитесь своим мнением и опытом с другими пациентами, членами их семей и лицами, осуществляющими уход.
https://www.facebook.com/heartfailurematters
heartfailurematters.org — сайт Европейского общества кардиологов
Сайт heartfailurematters.org создан под руководством Ассоциации специалистов по сердечной недостаточности при Европейском обществе кардиологов (ESC). ESC — мировой лидер в открытии и распространении передовых методов сердечно-сосудистой медицины. Наши члены и ответственные лица — медицинские работники, которые добровольно делятся своим временем и знаниями в качестве специалистов в области кардиологии в Европе и за ее пределами.
Препараты железа в лечении анемии у больных с ХПН | #10/05
Анемия развивается уже на ранней стадии хронической почечной недостаточности (ХПН) и нарастает пропорционально снижению скорости клубочковой фильтрации (СКФ) [8, 9].
В генезе анемии при хроническом заболевании почек основная роль принадлежит снижению способности почек синтезировать эритропоэтин в количествах, адекватных для поддержания гемопоэза [2, 8]. Анемия при ХПН характеризуется наличием нормохромных нормоцитарных эритроцитов в крови и гипоплазией эритроидных клеток в костном мозге [8, 9]. Однако в дальнейшем по мере нарастания уремии вследствие нарушения всасывания железа в желудочно-кишечном тракте, кровопотерь или из-за повышенного расхода железа при лечении препаратами эпоэтина развивается дефицит железа, и кроветворение становится железодефицитным [2, 4, 8].
Анемия при ХПН характеризуется наличием нормохромных нормоцитарных эритроцитов в крови и гипоплазией эритроидных клеток в костном мозге [8, 9]. Однако в дальнейшем по мере нарастания уремии вследствие нарушения всасывания железа в желудочно-кишечном тракте, кровопотерь или из-за повышенного расхода железа при лечении препаратами эпоэтина развивается дефицит железа, и кроветворение становится железодефицитным [2, 4, 8].
Коррекция анемии у больных с ХПН основывается на сочетанном применении препаратов эпоэтина и железа [3, 8, 9].
Способы, дозы и кратность введения препаратов эпоэтина для лечения анемии у больных на разных стадиях хронического заболевания почек определены как американскими (NKF-K/DOQI, 2002), так и европейскими (EBPG, 2004) рекомендациями [8, 9], но в отношении препаратов железа на додиализном периоде ХПН таких правил нет.
Для полной реализации пролиферативных возможностей эритроидного ростка необходимо, чтобы содержание железа в организме соответствовало уровню эритропоэтина. При недостаточном поступлении железа в костный мозг снижается продукция эритроцитов, а при глубоком дефиците железа нарушается синтез гемоглобина и развивается железодефицитное кроветворение [3, 7].
При недостаточном поступлении железа в костный мозг снижается продукция эритроцитов, а при глубоком дефиците железа нарушается синтез гемоглобина и развивается железодефицитное кроветворение [3, 7].
Железо является компонентом гема — структурной единицы гемоглобина, осуществляющей связывание, транспорт и перенос кислорода к акцепторам клеток и тканям. Железо в составе гема связывается с хромопротеидами тканей, обеспечивающими процессы биологического окисления [2, 4].
Обмен и транспорт железа. Железо всасывается путем активного транспорта в проксимальном отделе тонкой кишки и особенно интенсивно в двенадцатиперстной кишке (дуоденальных энтероцитах), причем этот процесс регулируется содержанием железа в организме и потребностями в нем. При снижении запасов железа его всасывание увеличивается в строго контролируемых количествах.
Железо может всасываться только тогда, когда оно находится в виде растворимых комплексов. В кислой среде желудка образуются комплексы железа с аскорбиновой кислотой, аминокислотами, моно- и дисахаридами; они находятся в растворенном виде и при более высоком рН двенадцатиперстной и тощей кишок. С пищей в организм железо поступает в виде ферро (Fe2+)-и преимущественно ферри (Fe3+)-иона [2, 4]. В сутки с пищей поступает 15–20 мг железа, а всасывается лишь 0,5–1 мг у мужчин и 1–2 мг у женщин детородного возраста.
С пищей в организм железо поступает в виде ферро (Fe2+)-и преимущественно ферри (Fe3+)-иона [2, 4]. В сутки с пищей поступает 15–20 мг железа, а всасывается лишь 0,5–1 мг у мужчин и 1–2 мг у женщин детородного возраста.
Получены данные о том, что всасывание железа регулируется рецепторами трансферрина и ферритином [7]. Часть железа после поступления в энтероцит остается в нем и выводится при его отмирании и слущивании. Чем больше запасы железа в организме, тем большее его количество выводится таким путем.
В норме для эритропоэза используется главным образом железо, высвобождающееся при разрушении отживших эритроцитов (рис. 1). Макрофаги захватывают это железо и передают его трансферрину — гликопротеиду плазмы. Каждая молекула трансферрина может связать две молекулы Fe3+, что соответствует 1,14 мкг железа на 1 мг трансферрина. Считается, что, связывая железо, трансферрин одновременно предохраняет ткани от действия активных радикалов кислорода, а также тормозит рост микробов, нуждающихся в железе [2, 7].
Поступление комплекса трансферрин–Fe3+ в эритроидные клетки костного мозга происходит с помощью трансмембранных специфических рецепторов, которые содержатся во всех клетках, однако 80% всех рецепторов локализованы на мембранах эритроидных предшественников в костном мозге. Поступающее в эритроидные клетки железо накапливается в митохондриях и используется для синтеза гема. После этого трансферрин-рецепторный комплекс возвращается на поверхность клетки, трансферрин вновь оказывается в плазме и включается в транспортный цикл, а рецептор остается на поверхности клеток — предшественников эритроцитов. Полученное эритроидными клетками костного мозга железо используется для синтеза гемоглобина, а железо, не включенное в гемоглобин, откладывается в виде ферритина. Небольшое количество железа захватывают другие клетки организма, главным образом гепатоциты. В них железо идет на синтез гемсодержащих ферментов и ферритина тканей (железо запасов) (рис. 1).
При потребности в железе происходит его всасывание в составе гема, который образуется в просвете кишечника при расщеплении гемоглобина и поступает в энтероциты целиком без распада на составляющие. Железо в составе гема усваивается лучше, чем элементарное железо (например, из злаков и овощей).
Железо в составе гема усваивается лучше, чем элементарное железо (например, из злаков и овощей).
В работах последнего времени установлено, что скорость всасывания железа как у здоровых, так и больных с ХПН определяется его запасами в организме, однако включение абсорбированного железа в эритроциты у больных ХПН происходит медленнее, чем у здоровых людей (в течение 30 дней против 3–8,6 суток) [7, 8].
У здоровых людей запасы железа составляют от 600 до 1000 мг. Содержание и распределение железа в организме оценивают с помощью лабораторных методов. Сывороточная концентрация железа отражает процент содержания в организме железа, связанного с трансферрином. Общая железосвязывающая способность сыворотки — это общее количество железа, которое может связаться с трансферрином, т. е. данный показатель отражает количество свободного трансферрина. В норме сывороточная концентрация железа составляет 9–27 мкмоль/л (50–150 мкг/дл), а общая железосвязывающая способность сыворотки — 5–64 мкмоль/л (300–360 мкг/дл). Рассчитывают также насыщение трансферрина железом — процентное отношение связанного с трансферрином железа к общей железосвязывающей способности сыворотки. В норме этот показатель составляет 30–50%, при дефиците железа падает ниже 20%, а клинически значимая перегрузка железом определяется при насыщении трансферрина свыше 50–60%.
Рассчитывают также насыщение трансферрина железом — процентное отношение связанного с трансферрином железа к общей железосвязывающей способности сыворотки. В норме этот показатель составляет 30–50%, при дефиците железа падает ниже 20%, а клинически значимая перегрузка железом определяется при насыщении трансферрина свыше 50–60%.
Железо депонируется в виде ферритина и гемосидерина. Белок апоферритин связывает свободное двухвалентное железо (F2+) и сохраняет его в виде трехвалентного (F3+). В макрофагах ферритин может быть превращен в форму гемосидерина. Железо ферритина при необходимости быстро используется для синтеза гема, в то время как железо гемосидерина гораздо медленнее включается в метаболизм. Сывороточная концентрация ферритина находится в равновесии с содержанием ферритина в тканях и отражает величину запасов железа в организме. Нормальные значения сывороточной концентрации ферритина для мужчин составляют 50–150 мкг/л, а для женщин — 15–50 мкг/л. Уровень ферритина < 15 мкг/л указывает на истощение запасов железа. При этом снижается и синтез апоферритина.
Уровень ферритина < 15 мкг/л указывает на истощение запасов железа. При этом снижается и синтез апоферритина.
К наиболее ценным методам оценки железодефицитного эритропоэза относят изучение пунктата костного мозга после окраски на берлинскую лазурь. Отсутствие синих гранул гемосидерина в ретикулоэндотелиальных клетках, отсутствие эритробластов, содержащих гранулы негемового железа (сидеробластов) в мазках костно-мозгового пунктата — очень значимый критерий железодефицитного эритропоэза.
В последнее время в качестве альтернативы этому методу предлагают исследовать (радиоиммунологически) содержание в сыворотке растворимых рецепторов к трансферрину; при истинном дефиците железа в организме уровень трансферриновых рецепторов оказывается повышен. Метод изучения трансферриновых рецепторов особенно ценен в проведении дифференциального диагноза с анемией хронических заболеваний, также характеризующейся железодефицитным эритропоэзом, но в отличие от железодефицитной анемии при ней интерпретация изменений стандартных показателей обмена железа часто бывает затруднительна.
Причины дефицита железа при ХПН. У больных с ХПН дефицит железа развивается главным образом вследствие кровопотерь — оккультных и ятрогенных (включая неоправданные анализы крови), но также при недостаточном поступлении с пищей (длительное пребывание на диете с ограничением белка) и уменьшении его абсорбции в желудочно-кишечном тракте (из-за ахалазии), назначении фосфатсвязывающих гелей, карбоната кальция, цитратных смесей. Аскорбиновая кислота повышает всасывание Fe3+ и в меньшей степени Fe2+ [6, 7].
Лечение анемии препаратами эпоэтина у больных ХПН увеличивает потребность в железе, поскольку для синтеза 1 г гемоглобина у больных ХПН требуется 3,47 мг железа [2, 7]. В результате лечение эпоэтином становится одной из причин развития железодефицита у больных с ХПН наряду с кровопотерями, особенно у пациентов на гемодиализе: потеря 1 мл крови приводит, в зависимости от уровня гемоглобина, к потере от 0,3 до 0,5 мг железа [2, 4].
При ХПН повышена продукция многих маркеров воспаления и эндотелиальной дисфункции С-реактивного белка: гомоцистеина, ферритина, фибриногена, ингибитора активатора плазминогена-1, аполипопротеина В, интерлейкина-6, лептина и др. [7, 8]. Это позволяет рассматривать ХПН как состояние, которое сопровождается хроническим воспалением, провоцируемым оксидативным стрессом. В тканях железо катализирует реакции окисления с образованием свободных радикалов кислорода (Fe2+ + O2 > Fe3+ + O2— и Fe2+ + H2O2 > OH + OH— + Fe3+), нарушающих синтез ДНК, влияющих на активность ряда ферментов, вызывающих пероксидацию полиненасыщенных липидов клеточных мембран [2, 7]. В этой ситуации традиционные маркеры дефицита железа — насыщение трансферрина сыворотки железом, уровень сывороточного ферритина — не могут быть достоверными показателями запасов железа в организме. Недавнее исследование S. Fishbane и соавторов [5] показало, что количество гипохромных эритроцитов или содержание гемоглобина в ретикулоцитах более точно отражает функциональный дефицит железа, чем указанные показатели — ферритин сыворотки и показатель насыщения трансферрина.
Fishbane и соавторов [5] показало, что количество гипохромных эритроцитов или содержание гемоглобина в ретикулоцитах более точно отражает функциональный дефицит железа, чем указанные показатели — ферритин сыворотки и показатель насыщения трансферрина.
У больных с ХПН с нормальными или даже повышенными запасами железа в организме может развиться функциональный дефицит железа (табл. 1) — состояние, при котором скорость мобилизации железа из депо становится недостаточной для обеспечения возросших потребностей костного мозга в процессе эритропоэза, стимулированного эпоэтином. На фоне лечения эпоэтином пролиферирующим эритробластам необходимо все большее количество железа, что приводит к быстрому поступлению его из трансферрина и истощению лабильного пула железа. При уменьшении лабильного пула железа уровень сывороточного ферритина тоже падает. Для мобилизации и растворения железа, хранящегося в виде гемосидерина, требуется определенное время. В результате уменьшается количество поступающего в костный мозг железа, что приводит к развитию его функционального дефицита.
Функциональный дефицит железа является одной из наиболее распространенных причин резистентности анемии к лечению препаратами эпоэтина.
До настоящего времени остается открытым вопрос, зависят ли тяжесть и скорость прогрессирования железодефицитной анемии от этиологии ХПН. Считают, что за исключением сахарного диабета, при других этиологических вариантах ХПН существенных различий в распространенности анемии не имеется [8, 9].
Однако в последние годы получены данные о том, что у пациентов с иммуновоспалительными заболеваниями (системная красная волчанка, ревматоидный артрит, системные васкулиты) на стадии ХПН, особенно при быстропрогрессирующем течении почечной недостаточности, сохраняется выработка провоспалительных цитокинов, в первую очередь интерлейкина-1, интерферона γ, которые могут подавлять выработку эритропоэтина, высвобождение железа из макрофагов и пролиферацию предшественников эритроидных клеток, создавая дополнительные условия для развития и поддержания анемии и железодефицитного кроветворения. Кроме того, эти заболевания могут сопровождаться тяжелым аутоиммунным гемолизом и угнетением гранулоцитопоэза Т-лимфоцитами (синдром Фелти), что усложняет генез анемии и требует внесения корректив в лечение [6]. При сохраняющейся на стадии ХПН активности нефрита определенную роль в развитии анемии и дефицита железа отводят протеинурии: при высокой протеинурии с мочой может теряться значительное количество эпоэтина, железа, трансферрина [7, 9].
Кроме того, эти заболевания могут сопровождаться тяжелым аутоиммунным гемолизом и угнетением гранулоцитопоэза Т-лимфоцитами (синдром Фелти), что усложняет генез анемии и требует внесения корректив в лечение [6]. При сохраняющейся на стадии ХПН активности нефрита определенную роль в развитии анемии и дефицита железа отводят протеинурии: при высокой протеинурии с мочой может теряться значительное количество эпоэтина, железа, трансферрина [7, 9].
Среди наблюдавшихся нами 165 больных с ХПН 3–4-й стадии (по классификации NKF-DOQI) у 55 больных ХПН была результатом нефрита, развившегося в рамках системных васкулитов, системной красной волчанки.
Распространенность анемии (гемоглобин < 12 г/дл) и дефицита железа (коэффициент насыщенности трансферрина железом < 20%) у этих 55 больных (2-я группа) была статистически значимо более высокой, чем у остальных 110 больных (1-я группа) с ХПН в результате первичного нефрита (рис. 2, 3). Наши наблюдения подтверждают данные В. А. Добронравова, А. В. Смирнова [1] о том, что уровень железодефицитной анемии коррелирует с выраженностью протеинурии и гипоальбуминемии.
А. Добронравова, А. В. Смирнова [1] о том, что уровень железодефицитной анемии коррелирует с выраженностью протеинурии и гипоальбуминемии.
Лечение дефицита железа у больных с ХПН
По данным исследований [3], проводившихся в последнее время, у больных с начальной и умеренной стадиями ХПН (скорость клубочковой фильтрации < 60… 30 мл/мин/1,73 м2) биодоступность железа, вводимого внутривенно и перорально, примерно одинакова, поэтому восполнить дефицит железа у этих больных можно, назначая им препараты железа внутрь.
| Рисунок 2. Распространенность анемии и дефицита железа у больных с ХПН в исходе нефрита при болезнях соединительной ткани (n = 55) |
Многоцентровое двойное слепое, сравнительное исследование, в котором приняли участие 126 больных с железодефицитной анемией, показало, что полимальтозный комплекс гидроокиси железа (трехвалентное железо) в дозе 200 мг в день внутрь оказался эффективным для лечения анемии, причем его эффект сравним с воздействием традиционно используемого для этой цели сульфата железа (двухвалентное железо) [7]. У больных при приеме трехвалентного железа реже регистрировались диспептические расстройства или усиление оксидативного стресса, чем при приеме сульфата железа. Положительной стороной назначения полимальтозного комплекса гидроокиси железа является то, что на всасывание железа при использовании этого препарата не оказывает влияние прием пищи, тогда как сульфатное железо необходимо принимать за 2 ч до еды.
У больных при приеме трехвалентного железа реже регистрировались диспептические расстройства или усиление оксидативного стресса, чем при приеме сульфата железа. Положительной стороной назначения полимальтозного комплекса гидроокиси железа является то, что на всасывание железа при использовании этого препарата не оказывает влияние прием пищи, тогда как сульфатное железо необходимо принимать за 2 ч до еды.
Симптомы плохой переносимости пероральных препаратов железа связывают с образованием в начальных отделах тонкого кишечника (место всасывания) свободных ионов Fe2+, вызывающих раздражение слизистой оболочки. Соли Fe3+ всасываются менее активно, чем Fe2+, но они меньше повреждают слизистую желудочно-кишечного тракта [6, 7].
Необходимы специальные исследования для того, чтобы определить оптимальные поддерживающие дозы новых препаратов железа, которые бы обеспечивали эритрон достаточным количеством железа, не вызывая избыточного накопления железа.
Все 165 наблюдаемых нами больных с ХПН в фазе коррекции анемии (первые 4 мес лечения) получали рекормон в дозе 20 ЕД/кг массы тела 3 раза в неделю совместно с железом (мальтофер 200–300 мг в день) внутрь. У большинства больных доза мальтофера была достаточной для обеспечения эритропоэза, однако у 20 (36,4%) больных ХПН в исходе нефрита при болезнях соединительной ткани (2-я группа) с тяжелой ХПН (СКФ < 20 мл/мин/1,73 м2) развился относительный дефицит железа, потребовавший внутривенного введения железа (венофер 100 мг в неделю). После ликвидации дефицита железа у всех этих больных потребность в рекормоне снизилась на 50%.
У всех наблюдаемых больных удалось достичь целевого уровня гемоглобина (≥ 12 г/дл), после чего недельная доза рекормона была уменьшена вдвое, а баланс железа в организме (KHT > 20%) у всех больных, за исключением 20 пациентов 2-й группы, удавалось поддерживать благодаря ежедневному приему мальтофера в дозе 200 мг в день внутрь. У 20 больных 2-й группы доза внутривенного железа была уменьшена до 100 мг 1 раз в 2 нед. Среди 20 больных 2-й группы, получавших железо внутривенно, у 7 (35%) отмечалось развитие флебитов, подкожных кровоизлияний. Для устранения флебитов применяли повязки с гепариновой мазью, непрямые антикоагулянты, дезагреганты внутрь, в двух случаях оказались эффективны антибиотики внутримышечно.
У 20 больных 2-й группы доза внутривенного железа была уменьшена до 100 мг 1 раз в 2 нед. Среди 20 больных 2-й группы, получавших железо внутривенно, у 7 (35%) отмечалось развитие флебитов, подкожных кровоизлияний. Для устранения флебитов применяли повязки с гепариновой мазью, непрямые антикоагулянты, дезагреганты внутрь, в двух случаях оказались эффективны антибиотики внутримышечно.
Считают, что кардиотоксичность избытка железа в значительной степени обусловлена оксидантным стрессом [3]. Витамин Е способен нейтрализовать ряд цитотоксических эффектов ионов железа [3, 5], получены также данные о самостоятельном кардиопротективном и антианемическом эффекте витамина E [3].
| Рисунок 3. Распространенность анемии и дефицита железа у больных с ХПН в исходе первичного нефрита (n = 110) |
Таким образом, назначение трехосновного железа в дозе 200–300 мг в день внутрь является достаточно для удовлетворения потребности эритропоэза у подавляющего большинства больных на додиализной стадии ХПН, получающих лечение препаратами эпоэтина.
Судить о балансе железа при ХПН позволяет мониторинг концентрации ферритина крови (резервного железа), показателя насыщения трансферрина (транспортное железо) и процента гипохромных эритроцитов (содержание железа в костном мозге). Однако последний показатель может быть определен только с помощью специальных анализаторов клеток крови Technikon H 3 — System или Advia 120 (Bayer Diagnostics).
Чтобы достичь максимальной эффективности препаратов эпоэтина, оптимальные значения сывороточного ферритина должны составлять 200 мкг/л, насыщение трансферрина > 20%, а количество гипохромных эритроцитов < 5%. При лечении эпоэтином в фазе поддержания целевого уровня гемоглобина (> 12 г/дл) оба параметра следует контролировать ежеквартально. Если доля гипохромных эритроцитов > 10% или содержание гемоглобина в эритроците < 29 пг, это является показанием для внутривенного введения железа [3].
Таким образом, ранняя коррекция анемии на додиализном периоде ХПН важна для повышения качества жизни и лучшей подготовки больного к периоду лечения программным гемодиализом. При раннем начале терапии антианемическими препаратами у больных ХПН при переводе их на гемодиализ требуются меньшие дозы эпоэтина для достижения целевого уровня гемоглобина, кроме того, у них отмечается меньше сердечно-сосудистых осложнений.
При раннем начале терапии антианемическими препаратами у больных ХПН при переводе их на гемодиализ требуются меньшие дозы эпоэтина для достижения целевого уровня гемоглобина, кроме того, у них отмечается меньше сердечно-сосудистых осложнений.
Литература
- Добронравов В. А., Смирнов А. В. Анемия и хроническая болезнь почек//Анемия. 2005. № 2. С. 2–8.
- Ермоленко В. М., Хасабов Н. Н., Михайлова Н. А. Рекомендации по применению препаратов железа у больных с хронической почечной недостаточностью//Анемия. 2005. № 2. С. 9–25.
- Шеффер Р. М., Гаше К., Хух Р., Краффт А. Железное письмо: рекомендации по лечению железодефицитной анемии//Анемия. 2005. № 2. С. 37–45.
- Шостка Г. Д. Дефицит железа//Анемия. 2004. № 1. С. 11–18.
- Fishbane S., Ungureanu V., Maesaka J. et al. The safety of intravenous iron de[tran in hemodialysis patients//Am. J. Kidney Dis. 1996; 28: 529-534.
- Jacobs P.
 , Wood I., Bird A. R. Better tolerance of iron polymaltose complex compared with ferrous sulfate in the treatment of amemia//Hematology. 2000; 5: 77–83.
, Wood I., Bird A. R. Better tolerance of iron polymaltose complex compared with ferrous sulfate in the treatment of amemia//Hematology. 2000; 5: 77–83. - Langstaff F. J., Geisser P., Heil W. G., Browdler J. M. Treatment of iron-deficiency anemia: a lower incidence of adverse effects with Ferrum Hausmann that ferrous sulphate//Brit. Journal of Clin. Reserch. 1993; 4: 191–198.
- NKF-K/DOQI Clinical Practice Guidelines for Anemia of Chronic Kidney Disease: update//Am. J. Kidney Dis. 2001; 37: 1: 182–238.
- Revised European Best Practice Guidelines for the Management of anemia in Patients with Chronic Renal Failure//Nephrol. Dial. Transplant. 2004; 19: 2: 2–45.
Ю. С. Милованов, доктор медицинских наук
Л. В. Козловская, доктор медицинских наук, профессор
Л. Ю. Милованова
ММА им. И. М. Сеченова, Москва
Железосодержащие добавки — StatPearls — NCBI Bookshelf
Непрерывное обучение
Железо — это лекарство, используемое для контроля и лечения железодефицитной анемии. Это упражнение иллюстрирует показания, действие и противопоказания для приема добавок железа в качестве ценного средства при лечении железодефицитных состояний, таких как железодефицитная анемия, железодефицитная недостаточность без анемии, недостаточность питания, мальабсорбция, кровопотеря или увеличение потребность в железе. В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие значение для членов медицинской бригады при лечении пациентов с железосодержащими препаратами. Дефицит и сопутствующие состояния.
Это упражнение иллюстрирует показания, действие и противопоказания для приема добавок железа в качестве ценного средства при лечении железодефицитных состояний, таких как железодефицитная анемия, железодефицитная недостаточность без анемии, недостаточность питания, мальабсорбция, кровопотеря или увеличение потребность в железе. В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие значение для членов медицинской бригады при лечении пациентов с железосодержащими препаратами. Дефицит и сопутствующие состояния.
Цели:
Определить механизм действия и введение препаратов железа.
Опишите побочные эффекты и противопоказания к приему препаратов железа.
Рассмотрите соответствующий мониторинг и токсичность добавок железа.
Кратко опишите межпрофессиональные групповые стратегии по улучшению координации помощи и коммуникации для оптимизации приема препаратов железа и улучшения результатов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Добавки железа показаны при железодефицитных состояниях, вторичных по отношению к таким состояниям, как железодефицитная анемия, дефицит железа без анемии, недостаточность питания, мальабсорбция, хроническое воспалительное состояние, кровопотеря или увеличение потребности организма в железе. Железо является важным минералом, необходимым для общего состояния здоровья. Истощенные запасы железа приводят к снижению выработки гемоглобина и циркулирующих эритроцитов в этом организме, что приводит к анемии. Симптомы дефицита железа могут проявляться в виде утомляемости, слабости, одышки, пикацизма и пагофагии, тахикардии, измененного психического статуса, гипотермии и повышенного риска инфекции.[1]
Лечение в первую очередь направлено на пополнение запасов железа в организме и облегчение симптомов. Если не лечить, это может привести к неблагоприятным событиям, таким как задержка развития нервной системы у развивающихся детей и неблагоприятные исходы беременности для будущих матерей. Группами риска являются женщины детородного возраста, у которых ежемесячные менструации и беременность являются частой причиной анемии.[2] Пожилые люди чаще имеют диету с низким содержанием железа и вялотекущую желудочно-кишечную кровопотерю из-за гастрита или основного злокачественного новообразования. Пациенты с хроническим заболеванием почек или находящиеся на гемодиализе часто имеют дефицит железа и не могут стимулировать почки к выработке эритропоэтина, что еще больше усугубляет анемию. У некоторых людей могут быть нарушения всасывания (такие как болезнь Уиппла, избыточный бактериальный рост в тонком кишечнике (SIBO), глютеновая болезнь, пернициозная анемия), когда они не могут эффективно переваривать железо из своего рациона.
Группами риска являются женщины детородного возраста, у которых ежемесячные менструации и беременность являются частой причиной анемии.[2] Пожилые люди чаще имеют диету с низким содержанием железа и вялотекущую желудочно-кишечную кровопотерю из-за гастрита или основного злокачественного новообразования. Пациенты с хроническим заболеванием почек или находящиеся на гемодиализе часто имеют дефицит железа и не могут стимулировать почки к выработке эритропоэтина, что еще больше усугубляет анемию. У некоторых людей могут быть нарушения всасывания (такие как болезнь Уиппла, избыточный бактериальный рост в тонком кишечнике (SIBO), глютеновая болезнь, пернициозная анемия), когда они не могут эффективно переваривать железо из своего рациона.
Железосодержащие добавки различными путями, например перорально или внутривенно, а также обогащение продуктов питания железом, могут помочь справиться с дефицитом железа и вылечить его.[3]
Механизм действия
Железо является важным компонентом организма.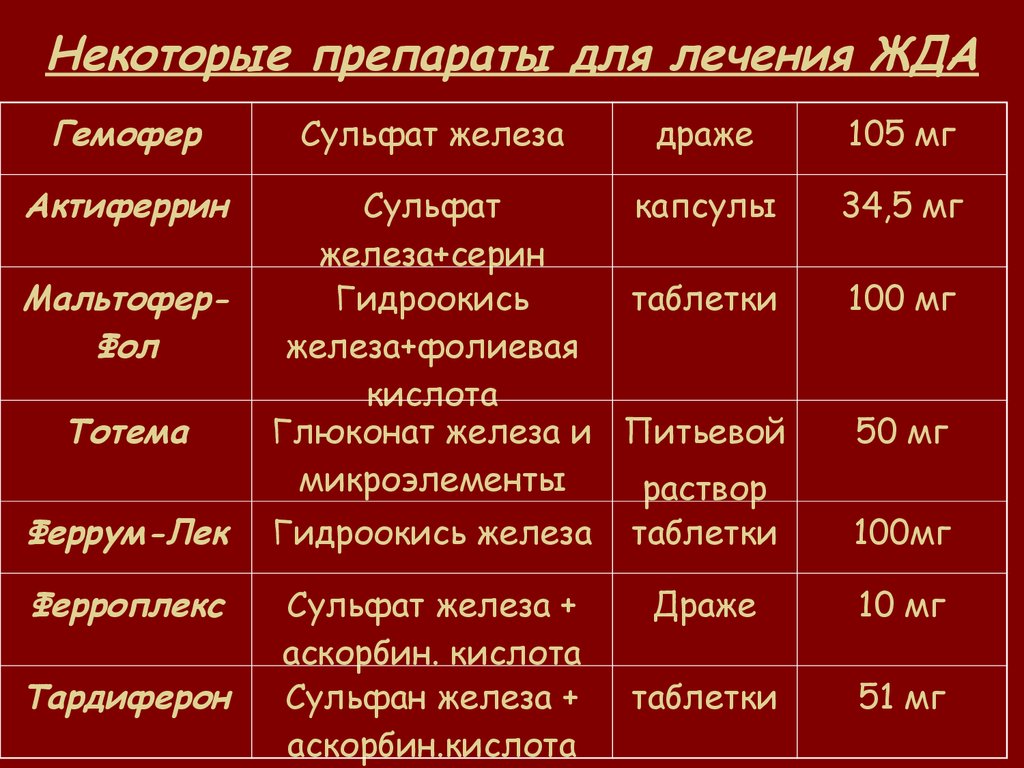 Его основная роль заключается в хранении и транспортировке железа (в виде миоглобина и гемоглобина) по всему телу. При дефиците железа синтез гемоглобина невозможен, что приводит к микроцитарной анемии из-за образования мелких эритроцитов.
Его основная роль заключается в хранении и транспортировке железа (в виде миоглобина и гемоглобина) по всему телу. При дефиците железа синтез гемоглобина невозможен, что приводит к микроцитарной анемии из-за образования мелких эритроцитов.
Роль добавок железа заключается в восполнении этих запасов железа и стимулировании эритропоэза и транспорта кислорода по всему телу. Транспорт железа происходит через переносчик двухвалентного металла 1 (DMT1) через клеточную мембрану, где он включается и хранится в виде ферритина в макрофагах. Затем эта форма преобразуется в абсорбируемый ион Fe2+, затем связывается трансферрином с различными участками тела, включая костный мозг, для синтеза эритроцитов. Железо соединяется с другими компонентами, такими как порфириновые и глобиновые цепи, с образованием гемоглобина, который переносит кислород из легких в другие органы тела.[4][5]
Введение
Пероральные добавки железа
Пероральная заместительная терапия железом является наиболее экономически эффективной и легкодоступной для широкой публики, так как сульфат железа (20% элементарного железа), глюконат железа (12% элементарного железа) и фумарат (33% элементарного железа).

Для лучшего усвоения рекомендуется принимать железо по крайней мере за 30 минут до еды или за 2 часа до приема других лекарств.
Если пациент не переносит побочных эффектов со стороны желудочно-кишечного тракта, его можно принимать с небольшим количеством пищи.
Избегайте приема с молоком, кальцием и антацидами, продуктами с высоким содержанием клетчатки или кофеином.
В некоторых исследованиях было предложено принимать железо с апельсиновым соком или с добавками витамина С для улучшения усвоения.[6]
Внутривенное введение препаратов железа
Альтернативой пероральному приему препаратов железа является внутривенное вливание; это может быть предпочтительнее у пациентов, которые:
Непереносимость перорального приема железа из-за побочных эффектов
Беременные женщины, у которых уже наблюдается сильная тошнота и рвота
Те, у кого был обходной желудочный анастомоз, когда сниженная секреция желудка ухудшает всасывание железа
- 4 Те, у кого имеют нарушения всасывания, препятствующие адекватному всасыванию в организм (такие как болезнь Уиппла, SIBO, глютеновая болезнь, пернициозная анемия) 7]
Железо для внутримышечного введения доступно, но не является предпочтительным, поскольку пациенты будут испытывать сильную боль в месте инъекции и непостоянную абсорбцию. Он также может окрашивать кожу.[8]
Он также может окрашивать кожу.[8]
Побочные эффекты
Наиболее распространенными побочными эффектами являются желудочно-кишечные, такие как тошнота/рвота, запор или диарея, метеоризм, металлический привкус, окрашивание зубов или боли в эпигастрии. Пациенты могут чувствовать себя некомфортно из-за изменения калибра и цвета стула на зеленый или «черный как смола». Многие пероральные препараты железа (фумарат железа, глюконат железа, сульфат железа) связаны с более сильными побочными эффектами со стороны желудочно-кишечного тракта, чем железо внутривенно или плацебо.[9]][10 Пациенты могут уменьшить побочные эффекты, принимая добавки железа по скорректированному режиму (т. е. три раза в неделю вместо ежедневного) или принимая их с пищей, хотя это может снизить всасывание и быть менее удобным для пациента. что может привести к несоблюдению.
Побочными эффектами внутривенного введения железа могут быть инфузионные реакции и анафилаксия.
Железо может снижать всасывание других лекарств, образуя нерастворимый комплекс с этими агентами.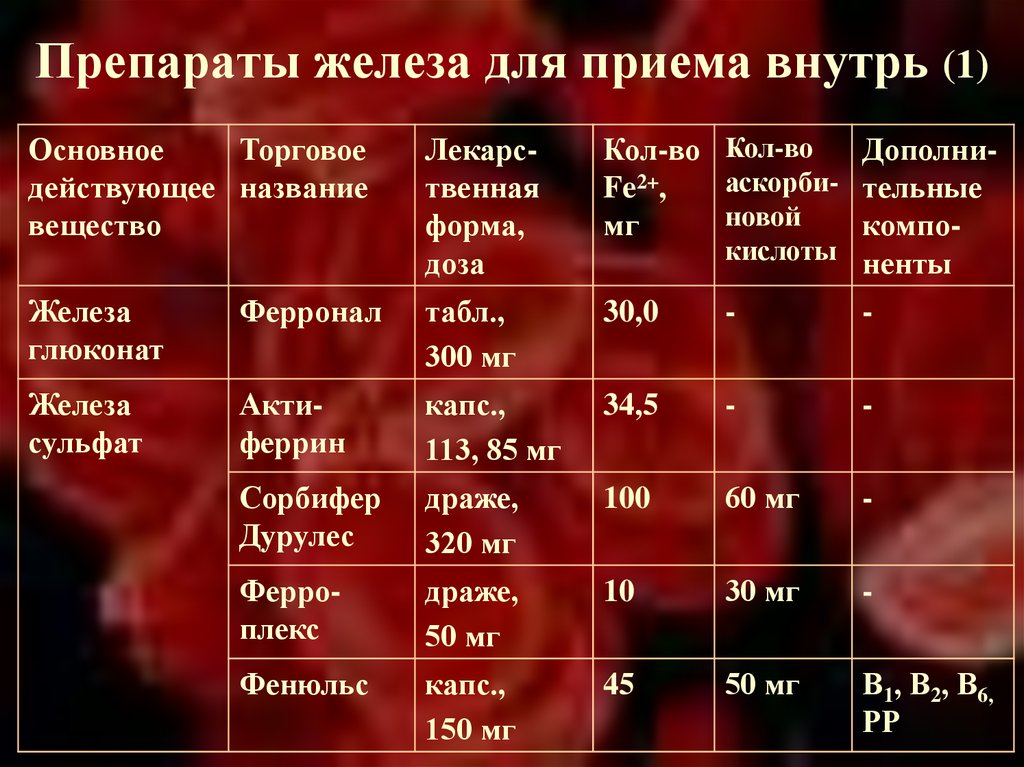 К ним относятся метилдофа/леводопа, фторхинолоны, пенициллин или тетрациклины.
К ним относятся метилдофа/леводопа, фторхинолоны, пенициллин или тетрациклины.
Противопоказания
Пациенты с состояниями перегрузки железом, такими как наследственный гемохроматоз, гемосидероз, или с гемолитической анемией в анамнезе.
Мониторинг
Лабораторные показатели, подтверждающие дефицит железа, включают низкий уровень железа в сыворотке, низкую насыщенность трансферрина и высокую общую железосвязывающую способность (ОЖСС). Для пациентов, получающих пероральное железо, пациентам необходимо будет вернуться в офис для повторного анализа крови, чтобы контролировать переносимость лекарства, и им необходимо будет принимать добавки в течение нескольких месяцев. У тех, кто получает железо внутривенно, уровни должны быть в пределах нормы через шесть недель терапии. Добавки железа можно прекратить, как только в организме появятся достаточные запасы железа и трансферрина.
Если есть неадекватный ответ на пероральную терапию, выясните причины: такие как несоблюдение режима, снижение всасывания или желудочно-кишечное кровотечение, превышающее количество добавок железа. Эта ситуация должна побудить к дополнительному скринингу других основных этиологий в дополнение к недостаточному потреблению железа, повышенной потребности в железе и потерям железа, например, по причинам желудочно-кишечного тракта, таким как инфекция H. pylori, аутоиммунный гастрит и скрининговая колоноскопия на колоректальный рак.[11]
Эта ситуация должна побудить к дополнительному скринингу других основных этиологий в дополнение к недостаточному потреблению железа, повышенной потребности в железе и потерям железа, например, по причинам желудочно-кишечного тракта, таким как инфекция H. pylori, аутоиммунный гастрит и скрининговая колоноскопия на колоректальный рак.[11]
Токсичность
Токсичность часто зависит от дозы и может проявляться сердечно-сосудистой, метаболической, центральной нервной и печеночной нестабильностью и повреждением. Симптомы передозировки включают начальное желудочно-кишечное расстройство, которое медленно перерастает в острую метаболическую энцефалопатию, судороги, тахикардию, метаболический ацидоз, аритмию, гипоксию. Количества элементарного железа до 20 мг/кг обычно хорошо переносятся, но могут вызывать легкие желудочно-кишечные симптомы. Количества от 20 до 60 мг/кг являются токсичными от легкой до умеренной, а более 60 мг/кг могут вызывать серьезные симптомы и заболеваемость из-за циркуляторного коллапса. [10]
[10]
Случайное проглатывание железа детьми в возрасте до 6 лет было ведущим случаем отравления со смертельным исходом.[12]
Передозировку железа можно лечить с помощью промывания желудка с помощью хелатора железа, такого как дефероксамин, или процедур обеззараживания желудочно-кишечного тракта, таких как растворы для лаважа и промывание всего кишечника.[13]
Улучшение результатов работы команды здравоохранения
Начало приема препаратов железа для лечения железодефицитного состояния часто осуществляется лечащим врачом, однако иногда им могут управлять специалисты, включая гематолога, гастроэнтеролога или нефролога, в зависимости от основной причины анемии.
На ранних стадиях при обычном анализе крови может обнаруживаться анемия. Первоначальное тестирование включает общий анализ крови (ОАК) с дифференциальным анализом, который включает такие значения, как количество лейкоцитов, гемоглобин, гематокрит, количество эритроцитов, индексы эритроцитов. Полезен также подсчет ретикулоцитов.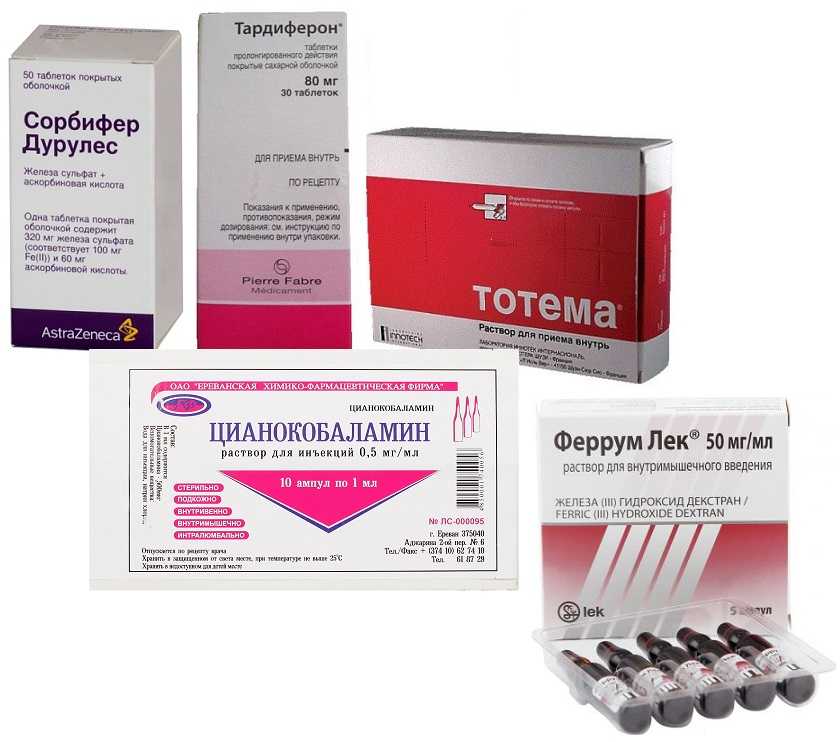 При бессимптомном течении пациента можно контролировать с помощью ежегодного общего анализа крови, чтобы проверить наличие каких-либо изменений. При наличии симптомов необходимы более агрессивные методы для выявления основной причины. Если подозревается дефицит железа, у этих пациентов должны быть проведены исследования железа, чтобы проверить уровень сывороточного железа, общую железосвязывающую способность (ОЖСС), насыщение трансферрина и уровни ферритина, чтобы определить, является ли это железодефицитной анемией, наиболее вероятной причиной микроцитарной анемии. по сравнению с другими этиологиями. Другие тесты, которые может назначить клиницист, это гемосидерин и гепсидин, но они не обязательны. После подтверждения железодефицитной анемии можно начинать прием препаратов железа. [Уровень 5]
При бессимптомном течении пациента можно контролировать с помощью ежегодного общего анализа крови, чтобы проверить наличие каких-либо изменений. При наличии симптомов необходимы более агрессивные методы для выявления основной причины. Если подозревается дефицит железа, у этих пациентов должны быть проведены исследования железа, чтобы проверить уровень сывороточного железа, общую железосвязывающую способность (ОЖСС), насыщение трансферрина и уровни ферритина, чтобы определить, является ли это железодефицитной анемией, наиболее вероятной причиной микроцитарной анемии. по сравнению с другими этиологиями. Другие тесты, которые может назначить клиницист, это гемосидерин и гепсидин, но они не обязательны. После подтверждения железодефицитной анемии можно начинать прием препаратов железа. [Уровень 5]
Основной поставщик медицинских услуг и другие медицинские работники несут ответственность за то, чтобы на основании общего анализа крови не предполагалось, что у пациента имеется железодефицитная анемия и что он получает ненужные препараты железа без полного обследования. Анемия является серьезной глобальной проблемой здравоохранения, и медицинские работники должны координировать свои действия, чтобы убедиться, что, если пациент не улучшается при приеме пероральных добавок железа, попробовать другой способ введения или проверить другую основную причину анемии. ] [Уровень 5] Если их анемия действительно вызвана дефицитом железа, то добавки должны иметь ощутимые улучшения при повторном общем анализе крови и анализе крови.[16] [Уровень 1]
Анемия является серьезной глобальной проблемой здравоохранения, и медицинские работники должны координировать свои действия, чтобы убедиться, что, если пациент не улучшается при приеме пероральных добавок железа, попробовать другой способ введения или проверить другую основную причину анемии. ] [Уровень 5] Если их анемия действительно вызвана дефицитом железа, то добавки должны иметь ощутимые улучшения при повторном общем анализе крови и анализе крови.[16] [Уровень 1]
Необходимость координации помощи всех медицинских работников межпрофессиональной бригады, участвующей в ведении пациента, является рекомендуемым подходом для облегчения симптомов и улучшения результатов.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Железодефицитная анемия. Ланцет.
 2016 27 фев;387(10021):907-16. [PubMed: 26314490]
2016 27 фев;387(10021):907-16. [PubMed: 26314490]- 2.
Low MS, Speedy J, Styles CE, De-Regil LM, Pasricha SR. Ежедневные добавки железа для улучшения анемии, состояния железа и здоровья у менструирующих женщин. Cochrane Database Syst Rev. 2016 Apr 18;4:CD009747. [PubMed: 27087396]
- 3.
Zimmermann MB, Hurrell RF. Пищевой дефицит железа. Ланцет. 2007 11 августа; 370 (9586): 511-20. [PubMed: 17693180]
- 4.
Гейссер П., Буркхардт С. Фармакокинетика и фармакодинамика препаратов железа. Фармацевтика. 2011 04 января; 3(1):12-33. [Бесплатная статья PMC: PMC3857035] [PubMed: 24310424]
- 5.
Эмс Т., Сент-Люсия К., Хьюкер М.Р. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 21 апреля 2022 г. Биохимия, поглощение железа. [PubMed: 28846259]
- 6.
Лейн Диджей, Янссон П.Дж., Ричардсон Д.Р. Бонни и Клайд: Витамин С и железо являются соучастниками преступления при железодефицитной анемии и его потенциальной роли в пожилом возрасте.
 Старение (Олбани, штат Нью-Йорк). 2016 Май;8(5):1150-2. [Бесплатная статья PMC: PMC4931859] [PubMed: 27208799]
Старение (Олбани, штат Нью-Йорк). 2016 Май;8(5):1150-2. [Бесплатная статья PMC: PMC4931859] [PubMed: 27208799]- 7.
Брегман Д.Б., Моррис Д., Кох Т.А., Хе А., Гуднаф Л.Т. Уровни гепсидина позволяют прогнозировать отсутствие реакции на пероральную терапию препаратами железа у пациентов с железодефицитной анемией. Am J Гематол. 2013 г., февраль 88(2):97-101. [PubMed: 23335357]
- 8.
Auerbach M, Ballard H, Glaspy J. Клинические обновления: внутривенное введение железа при анемии. Ланцет. 2007 г. 05 мая; 369 (9572): 1502-1504. [PubMed: 17482969]
- 9.
Толкин З., Стечер Л., Мандер А.П., Перейра Д.И., Пауэлл Дж.Дж. Добавки сульфата железа вызывают значительные побочные эффекты со стороны желудочно-кишечного тракта у взрослых: систематический обзор и метаанализ. ПЛОС Один. 2015;10(2):e0117383. [Бесплатная статья PMC: PMC4336293] [PubMed: 25700159]
- 10.
Кансело-Идальго М.Дж., Каштелу-Бранко С.
 , Паласиос С., Хая-Паласуэлос Дж., Сирия-Рекасенс М., Манасанч Дж., Перес-Эдо Л. Переносимость различных пероральных добавки железа: систематический обзор. Curr Med Res Opin. 2013 апр; 29(4):291-303. [PubMed: 23252877]
, Паласиос С., Хая-Паласуэлос Дж., Сирия-Рекасенс М., Манасанч Дж., Перес-Эдо Л. Переносимость различных пероральных добавки железа: систематический обзор. Curr Med Res Opin. 2013 апр; 29(4):291-303. [PubMed: 23252877]- 11.
Hershko C, Camaschella C. Как я лечу необъяснимую рефрактерную железодефицитную анемию. Кровь. 2014 16 января; 123 (3): 326-33. [PubMed: 24215034]
- 12.
Мехта М., Гарпуре В., Рагхаван К. Острое отравление железом. Индийский J Педиатр. 1997 г., июль-август; 64(4):485-93. [PubMed: 10771877]
- 13.
Манн К.В., Пиччиотти М.А., Спевак Т.А., Дурбин Д.Р. Лечение острой передозировки железа. Клин Фарм. 1989 июнь;8(6):428-40. [PubMed: 2663331]
- 14.
Шриер С.Л. Итак, вы знаете, как лечить железодефицитную анемию. Кровь. 2015 22 октября; 126 (17): 1971. [PubMed: 26494915]
- 15.
Auerbach M, Schrier S. Лечение дефицита железа становится модным.
 Ланцет Гематол. 2017 ноябрь;4(11):e500-e501. [PubMed: 2
Ланцет Гематол. 2017 ноябрь;4(11):e500-e501. [PubMed: 2- 58]
- 16.
Хетцель Д., Штраус В., Бернард К., Ли З., Урбониен А., Аллен Л.Ф. Фаза III, рандомизированное, открытое исследование ферумокситола по сравнению с сахарозой железа для лечения железодефицитной анемии у пациентов с неудовлетворительной пероральной терапией железом в анамнезе. Am J Гематол. 2014 июнь; 89 (6): 646-50. [Бесплатная статья PMC: PMC4225478] [PubMed: 24639149]
Железосодержащие добавки — StatPearls — NCBI Bookshelf
Программа непрерывного образования
Железо — это лекарство, используемое для контроля и лечения железодефицитной анемии. Это упражнение иллюстрирует показания, действие и противопоказания для приема добавок железа в качестве ценного средства при лечении железодефицитных состояний, таких как железодефицитная анемия, железодефицитная недостаточность без анемии, недостаточность питания, мальабсорбция, кровопотеря или увеличение потребность в железе. В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие значение для членов медицинской бригады при лечении пациентов с железосодержащими препаратами. Дефицит и сопутствующие состояния.
В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие значение для членов медицинской бригады при лечении пациентов с железосодержащими препаратами. Дефицит и сопутствующие состояния.
Цели:
Определить механизм действия и введение препаратов железа.
Опишите побочные эффекты и противопоказания к приему препаратов железа.
Рассмотрите соответствующий мониторинг и токсичность добавок железа.
Кратко опишите межпрофессиональные групповые стратегии по улучшению координации помощи и коммуникации для оптимизации приема препаратов железа и улучшения результатов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Добавки железа показаны при железодефицитных состояниях, вторичных по отношению к таким состояниям, как железодефицитная анемия, дефицит железа без анемии, недостаточность питания, мальабсорбция, хроническое воспалительное состояние, кровопотеря или увеличение потребности организма в железе. Железо является важным минералом, необходимым для общего состояния здоровья. Истощенные запасы железа приводят к снижению выработки гемоглобина и циркулирующих эритроцитов в этом организме, что приводит к анемии. Симптомы дефицита железа могут проявляться в виде утомляемости, слабости, одышки, пикацизма и пагофагии, тахикардии, измененного психического статуса, гипотермии и повышенного риска инфекции.[1]
Железо является важным минералом, необходимым для общего состояния здоровья. Истощенные запасы железа приводят к снижению выработки гемоглобина и циркулирующих эритроцитов в этом организме, что приводит к анемии. Симптомы дефицита железа могут проявляться в виде утомляемости, слабости, одышки, пикацизма и пагофагии, тахикардии, измененного психического статуса, гипотермии и повышенного риска инфекции.[1]
Лечение в первую очередь направлено на пополнение запасов железа в организме и облегчение симптомов. Если не лечить, это может привести к неблагоприятным событиям, таким как задержка развития нервной системы у развивающихся детей и неблагоприятные исходы беременности для будущих матерей. Группами риска являются женщины детородного возраста, у которых ежемесячные менструации и беременность являются частой причиной анемии.[2] Пожилые люди чаще имеют диету с низким содержанием железа и вялотекущую желудочно-кишечную кровопотерю из-за гастрита или основного злокачественного новообразования. Пациенты с хроническим заболеванием почек или находящиеся на гемодиализе часто имеют дефицит железа и не могут стимулировать почки к выработке эритропоэтина, что еще больше усугубляет анемию. У некоторых людей могут быть нарушения всасывания (такие как болезнь Уиппла, избыточный бактериальный рост в тонком кишечнике (SIBO), глютеновая болезнь, пернициозная анемия), когда они не могут эффективно переваривать железо из своего рациона.
Пациенты с хроническим заболеванием почек или находящиеся на гемодиализе часто имеют дефицит железа и не могут стимулировать почки к выработке эритропоэтина, что еще больше усугубляет анемию. У некоторых людей могут быть нарушения всасывания (такие как болезнь Уиппла, избыточный бактериальный рост в тонком кишечнике (SIBO), глютеновая болезнь, пернициозная анемия), когда они не могут эффективно переваривать железо из своего рациона.
Железосодержащие добавки различными путями, например перорально или внутривенно, а также обогащение продуктов питания железом, могут помочь справиться с дефицитом железа и вылечить его.[3]
Механизм действия
Железо является важным компонентом организма. Его основная роль заключается в хранении и транспортировке железа (в виде миоглобина и гемоглобина) по всему телу. При дефиците железа синтез гемоглобина невозможен, что приводит к микроцитарной анемии из-за образования мелких эритроцитов.
Роль добавок железа заключается в восполнении этих запасов железа и стимулировании эритропоэза и транспорта кислорода по всему телу. Транспорт железа происходит через переносчик двухвалентного металла 1 (DMT1) через клеточную мембрану, где он включается и хранится в виде ферритина в макрофагах. Затем эта форма преобразуется в абсорбируемый ион Fe2+, затем связывается трансферрином с различными участками тела, включая костный мозг, для синтеза эритроцитов. Железо соединяется с другими компонентами, такими как порфириновые и глобиновые цепи, с образованием гемоглобина, который переносит кислород из легких в другие органы тела.[4][5]
Транспорт железа происходит через переносчик двухвалентного металла 1 (DMT1) через клеточную мембрану, где он включается и хранится в виде ферритина в макрофагах. Затем эта форма преобразуется в абсорбируемый ион Fe2+, затем связывается трансферрином с различными участками тела, включая костный мозг, для синтеза эритроцитов. Железо соединяется с другими компонентами, такими как порфириновые и глобиновые цепи, с образованием гемоглобина, который переносит кислород из легких в другие органы тела.[4][5]
Введение
Пероральные добавки железа
Пероральная заместительная терапия железом является наиболее экономически эффективной и легкодоступной для широкой публики, так как сульфат железа (20% элементарного железа), глюконат железа (12% элементарного железа) и фумарат (33% элементарного железа).
Для лучшего усвоения рекомендуется принимать железо по крайней мере за 30 минут до еды или за 2 часа до приема других лекарств.
Если пациент не переносит побочных эффектов со стороны желудочно-кишечного тракта, его можно принимать с небольшим количеством пищи.
Избегайте приема с молоком, кальцием и антацидами, продуктами с высоким содержанием клетчатки или кофеином.
В некоторых исследованиях было предложено принимать железо с апельсиновым соком или с добавками витамина С для улучшения усвоения.[6]
Внутривенное введение препаратов железа
Альтернативой пероральному приему препаратов железа является внутривенное вливание; это может быть предпочтительнее у пациентов, которые:
Непереносимость перорального приема железа из-за побочных эффектов
Беременные женщины, у которых уже наблюдается сильная тошнота и рвота
Те, у кого был обходной желудочный анастомоз, когда сниженная секреция желудка ухудшает всасывание железа
- 4 Те, у кого имеют нарушения всасывания, препятствующие адекватному всасыванию в организм (такие как болезнь Уиппла, SIBO, глютеновая болезнь, пернициозная анемия) 7]
Железо для внутримышечного введения доступно, но не является предпочтительным, поскольку пациенты будут испытывать сильную боль в месте инъекции и непостоянную абсорбцию. Он также может окрашивать кожу.[8]
Он также может окрашивать кожу.[8]
Побочные эффекты
Наиболее распространенными побочными эффектами являются желудочно-кишечные, такие как тошнота/рвота, запор или диарея, метеоризм, металлический привкус, окрашивание зубов или боли в эпигастрии. Пациенты могут чувствовать себя некомфортно из-за изменения калибра и цвета стула на зеленый или «черный как смола». Многие пероральные препараты железа (фумарат железа, глюконат железа, сульфат железа) связаны с более сильными побочными эффектами со стороны желудочно-кишечного тракта, чем железо внутривенно или плацебо.[9]][10 Пациенты могут уменьшить побочные эффекты, принимая добавки железа по скорректированному режиму (т. е. три раза в неделю вместо ежедневного) или принимая их с пищей, хотя это может снизить всасывание и быть менее удобным для пациента. что может привести к несоблюдению.
Побочными эффектами внутривенного введения железа могут быть инфузионные реакции и анафилаксия.
Железо может снижать всасывание других лекарств, образуя нерастворимый комплекс с этими агентами. К ним относятся метилдофа/леводопа, фторхинолоны, пенициллин или тетрациклины.
К ним относятся метилдофа/леводопа, фторхинолоны, пенициллин или тетрациклины.
Противопоказания
Пациенты с состояниями перегрузки железом, такими как наследственный гемохроматоз, гемосидероз, или с гемолитической анемией в анамнезе.
Мониторинг
Лабораторные показатели, подтверждающие дефицит железа, включают низкий уровень железа в сыворотке, низкую насыщенность трансферрина и высокую общую железосвязывающую способность (ОЖСС). Для пациентов, получающих пероральное железо, пациентам необходимо будет вернуться в офис для повторного анализа крови, чтобы контролировать переносимость лекарства, и им необходимо будет принимать добавки в течение нескольких месяцев. У тех, кто получает железо внутривенно, уровни должны быть в пределах нормы через шесть недель терапии. Добавки железа можно прекратить, как только в организме появятся достаточные запасы железа и трансферрина.
Если есть неадекватный ответ на пероральную терапию, выясните причины: такие как несоблюдение режима, снижение всасывания или желудочно-кишечное кровотечение, превышающее количество добавок железа. Эта ситуация должна побудить к дополнительному скринингу других основных этиологий в дополнение к недостаточному потреблению железа, повышенной потребности в железе и потерям железа, например, по причинам желудочно-кишечного тракта, таким как инфекция H. pylori, аутоиммунный гастрит и скрининговая колоноскопия на колоректальный рак.[11]
Эта ситуация должна побудить к дополнительному скринингу других основных этиологий в дополнение к недостаточному потреблению железа, повышенной потребности в железе и потерям железа, например, по причинам желудочно-кишечного тракта, таким как инфекция H. pylori, аутоиммунный гастрит и скрининговая колоноскопия на колоректальный рак.[11]
Токсичность
Токсичность часто зависит от дозы и может проявляться сердечно-сосудистой, метаболической, центральной нервной и печеночной нестабильностью и повреждением. Симптомы передозировки включают начальное желудочно-кишечное расстройство, которое медленно перерастает в острую метаболическую энцефалопатию, судороги, тахикардию, метаболический ацидоз, аритмию, гипоксию. Количества элементарного железа до 20 мг/кг обычно хорошо переносятся, но могут вызывать легкие желудочно-кишечные симптомы. Количества от 20 до 60 мг/кг являются токсичными от легкой до умеренной, а более 60 мг/кг могут вызывать серьезные симптомы и заболеваемость из-за циркуляторного коллапса. [10]
[10]
Случайное проглатывание железа детьми в возрасте до 6 лет было ведущим случаем отравления со смертельным исходом.[12]
Передозировку железа можно лечить с помощью промывания желудка с помощью хелатора железа, такого как дефероксамин, или процедур обеззараживания желудочно-кишечного тракта, таких как растворы для лаважа и промывание всего кишечника.[13]
Улучшение результатов работы команды здравоохранения
Начало приема препаратов железа для лечения железодефицитного состояния часто осуществляется лечащим врачом, однако иногда им могут управлять специалисты, включая гематолога, гастроэнтеролога или нефролога, в зависимости от основной причины анемии.
На ранних стадиях при обычном анализе крови может обнаруживаться анемия. Первоначальное тестирование включает общий анализ крови (ОАК) с дифференциальным анализом, который включает такие значения, как количество лейкоцитов, гемоглобин, гематокрит, количество эритроцитов, индексы эритроцитов. Полезен также подсчет ретикулоцитов. При бессимптомном течении пациента можно контролировать с помощью ежегодного общего анализа крови, чтобы проверить наличие каких-либо изменений. При наличии симптомов необходимы более агрессивные методы для выявления основной причины. Если подозревается дефицит железа, у этих пациентов должны быть проведены исследования железа, чтобы проверить уровень сывороточного железа, общую железосвязывающую способность (ОЖСС), насыщение трансферрина и уровни ферритина, чтобы определить, является ли это железодефицитной анемией, наиболее вероятной причиной микроцитарной анемии. по сравнению с другими этиологиями. Другие тесты, которые может назначить клиницист, это гемосидерин и гепсидин, но они не обязательны. После подтверждения железодефицитной анемии можно начинать прием препаратов железа. [Уровень 5]
При бессимптомном течении пациента можно контролировать с помощью ежегодного общего анализа крови, чтобы проверить наличие каких-либо изменений. При наличии симптомов необходимы более агрессивные методы для выявления основной причины. Если подозревается дефицит железа, у этих пациентов должны быть проведены исследования железа, чтобы проверить уровень сывороточного железа, общую железосвязывающую способность (ОЖСС), насыщение трансферрина и уровни ферритина, чтобы определить, является ли это железодефицитной анемией, наиболее вероятной причиной микроцитарной анемии. по сравнению с другими этиологиями. Другие тесты, которые может назначить клиницист, это гемосидерин и гепсидин, но они не обязательны. После подтверждения железодефицитной анемии можно начинать прием препаратов железа. [Уровень 5]
Основной поставщик медицинских услуг и другие медицинские работники несут ответственность за то, чтобы на основании общего анализа крови не предполагалось, что у пациента имеется железодефицитная анемия и что он получает ненужные препараты железа без полного обследования. Анемия является серьезной глобальной проблемой здравоохранения, и медицинские работники должны координировать свои действия, чтобы убедиться, что, если пациент не улучшается при приеме пероральных добавок железа, попробовать другой способ введения или проверить другую основную причину анемии. ] [Уровень 5] Если их анемия действительно вызвана дефицитом железа, то добавки должны иметь ощутимые улучшения при повторном общем анализе крови и анализе крови.[16] [Уровень 1]
Анемия является серьезной глобальной проблемой здравоохранения, и медицинские работники должны координировать свои действия, чтобы убедиться, что, если пациент не улучшается при приеме пероральных добавок железа, попробовать другой способ введения или проверить другую основную причину анемии. ] [Уровень 5] Если их анемия действительно вызвана дефицитом железа, то добавки должны иметь ощутимые улучшения при повторном общем анализе крови и анализе крови.[16] [Уровень 1]
Необходимость координации помощи всех медицинских работников межпрофессиональной бригады, участвующей в ведении пациента, является рекомендуемым подходом для облегчения симптомов и улучшения результатов.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Железодефицитная анемия. Ланцет.
 2016 27 фев;387(10021):907-16. [PubMed: 26314490]
2016 27 фев;387(10021):907-16. [PubMed: 26314490]- 2.
Low MS, Speedy J, Styles CE, De-Regil LM, Pasricha SR. Ежедневные добавки железа для улучшения анемии, состояния железа и здоровья у менструирующих женщин. Cochrane Database Syst Rev. 2016 Apr 18;4:CD009747. [PubMed: 27087396]
- 3.
Zimmermann MB, Hurrell RF. Пищевой дефицит железа. Ланцет. 2007 11 августа; 370 (9586): 511-20. [PubMed: 17693180]
- 4.
Гейссер П., Буркхардт С. Фармакокинетика и фармакодинамика препаратов железа. Фармацевтика. 2011 04 января; 3(1):12-33. [Бесплатная статья PMC: PMC3857035] [PubMed: 24310424]
- 5.
Эмс Т., Сент-Люсия К., Хьюкер М.Р. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 21 апреля 2022 г. Биохимия, поглощение железа. [PubMed: 28846259]
- 6.
Лейн Диджей, Янссон П.Дж., Ричардсон Д.Р. Бонни и Клайд: Витамин С и железо являются соучастниками преступления при железодефицитной анемии и его потенциальной роли в пожилом возрасте.
 Старение (Олбани, штат Нью-Йорк). 2016 Май;8(5):1150-2. [Бесплатная статья PMC: PMC4931859] [PubMed: 27208799]
Старение (Олбани, штат Нью-Йорк). 2016 Май;8(5):1150-2. [Бесплатная статья PMC: PMC4931859] [PubMed: 27208799]- 7.
Брегман Д.Б., Моррис Д., Кох Т.А., Хе А., Гуднаф Л.Т. Уровни гепсидина позволяют прогнозировать отсутствие реакции на пероральную терапию препаратами железа у пациентов с железодефицитной анемией. Am J Гематол. 2013 г., февраль 88(2):97-101. [PubMed: 23335357]
- 8.
Auerbach M, Ballard H, Glaspy J. Клинические обновления: внутривенное введение железа при анемии. Ланцет. 2007 г. 05 мая; 369 (9572): 1502-1504. [PubMed: 17482969]
- 9.
Толкин З., Стечер Л., Мандер А.П., Перейра Д.И., Пауэлл Дж.Дж. Добавки сульфата железа вызывают значительные побочные эффекты со стороны желудочно-кишечного тракта у взрослых: систематический обзор и метаанализ. ПЛОС Один. 2015;10(2):e0117383. [Бесплатная статья PMC: PMC4336293] [PubMed: 25700159]
- 10.
Кансело-Идальго М.Дж., Каштелу-Бранко С.
 , Паласиос С., Хая-Паласуэлос Дж., Сирия-Рекасенс М., Манасанч Дж., Перес-Эдо Л. Переносимость различных пероральных добавки железа: систематический обзор. Curr Med Res Opin. 2013 апр; 29(4):291-303. [PubMed: 23252877]
, Паласиос С., Хая-Паласуэлос Дж., Сирия-Рекасенс М., Манасанч Дж., Перес-Эдо Л. Переносимость различных пероральных добавки железа: систематический обзор. Curr Med Res Opin. 2013 апр; 29(4):291-303. [PubMed: 23252877]- 11.
Hershko C, Camaschella C. Как я лечу необъяснимую рефрактерную железодефицитную анемию. Кровь. 2014 16 января; 123 (3): 326-33. [PubMed: 24215034]
- 12.
Мехта М., Гарпуре В., Рагхаван К. Острое отравление железом. Индийский J Педиатр. 1997 г., июль-август; 64(4):485-93. [PubMed: 10771877]
- 13.
Манн К.В., Пиччиотти М.А., Спевак Т.А., Дурбин Д.Р. Лечение острой передозировки железа. Клин Фарм. 1989 июнь;8(6):428-40. [PubMed: 2663331]
- 14.
Шриер С.Л. Итак, вы знаете, как лечить железодефицитную анемию. Кровь. 2015 22 октября; 126 (17): 1971. [PubMed: 26494915]
- 15.
Auerbach M, Schrier S. Лечение дефицита железа становится модным.

