Какие препараты используются для лечения гельминтозов у свиней. Как выбрать эффективное средство от глистов. Каковы особенности применения антигельминтных препаратов у свиней. Как правильно проводить профилактику гельминтозов в свиноводстве.
Гельминтозы свиней: экономический ущерб и основные возбудители
Гельминтозы наносят существенный экономический ущерб свиноводству. У свиней паразитируют три основных типа гельминтов:
- Трематоды (сосальщики)
- Цестоды (ленточные черви)
- Нематоды (круглые черви)
Большинство гельминтов локализуются в желудочно-кишечном тракте, но некоторые поражают печень, сердце, бронхи и другие органы. Паразиты отравляют организм животного продуктами жизнедеятельности, нарушают работу важнейших систем организма. Это приводит к снижению привесов, а в тяжелых случаях — к гибели как поросят, так и взрослых животных.
Признаки гельминтозов у свиней
Каковы основные симптомы заражения свиней глистами? Наиболее характерные признаки гельминтозов у свиней:

- Нарушения со стороны ЖКТ — поносы, рвота
- Респираторные симптомы — кашель, истечения из носа
- Повышение температуры тела (особенно у поросят)
- Снижение или усиление аппетита
- Скрежетание зубами
- Отставание в росте, слабые привесы
- Апатия, вялость, шаткая походка
- Анемия
При высокой интенсивности инвазии могут наблюдаться отеки, нервные явления, острая сердечная недостаточность. Своевременное выявление этих симптомов позволяет вовремя начать лечение.
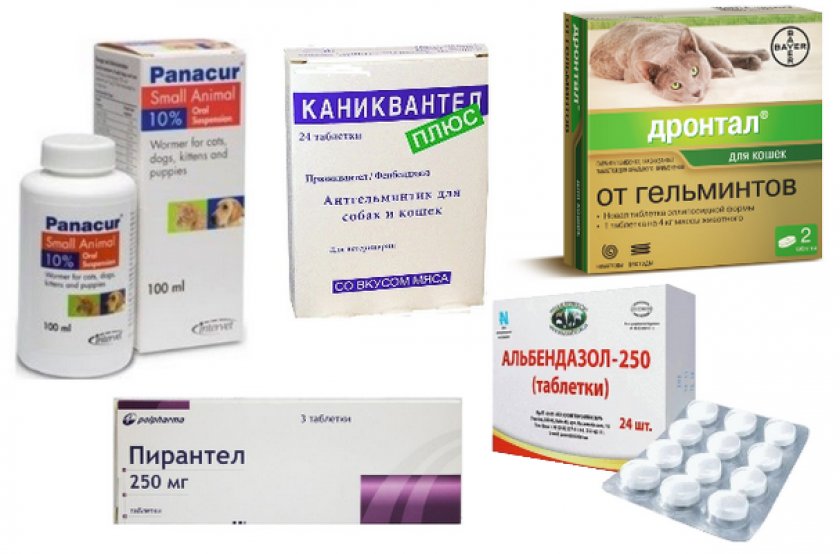
Эффективные препараты от гельминтов для свиней
Какие лекарства лучше использовать для дегельминтизации свиней? На сегодняшний день выбор антигельминтных препаратов для свиней достаточно широк. Лечение можно проводить как индивидуальным, так и групповым способом.
Альбен
Препарат широкого спектра действия на основе альбендазола. Эффективен против ленточных, круглых и плоских червей. Выпускается в форме гранул и таблеток. Дозировка:
- Гранулы — 5 г на 100 кг массы животного
- Таблетки — 1 таблетка на 35 кг массы
Альбендазол оказывает губительное действие не только на взрослых гельминтов, но и на их яйца. Это позволяет снизить зараженность мест содержания животных.

Фебтал
Иверсан
Раствор для орального применения на основе ивермектина. Эффективен против нематод ЖКТ и легких, а также против эктопаразитов (вши, блохи, клещи). Дозировка — 1 мл препарата на 100 кг массы тела, однократно.
Особенности применения антигельминтных препаратов у свиней
На что нужно обратить внимание при дегельминтизации свиней?
- При групповом способе дачи препарата важно обеспечить равномерное потребление лекарства всеми животными
- Необходимо строго соблюдать дозировки, указанные в инструкции
- Следует учитывать сроки ожидания перед убоем на мясо после дегельминтизации
- Для повышения эффективности рекомендуется проводить повторную обработку через 10-14 дней
Профилактика гельминтозов в свиноводстве
Как предотвратить заражение свиней глистами? Основные меры профилактики гельминтозов:

- Регулярные профилактические обработки поголовья
- Соблюдение ветеринарно-санитарных правил содержания животных
- Борьба с грызунами — переносчиками гельминтов
- Дегельминтизация свиноматок за 2 недели до опороса
- Обработка поросят в возрасте 35 дней и 2,5-3 месяца
- Регулярные исследования кала на наличие яиц гельминтов
- Профилактическая дегельминтизация всех вновь поступающих животных
Почему важна регулярная дегельминтизация свиней?
Регулярные антигельминтные обработки позволяют:
- Снизить заболеваемость и падеж молодняка
- Улучшить привесы и конверсию корма
- Сократить затраты на лечение животных
- Повысить качество свинины
- Предотвратить распространение гельминтозов
Только системный подход к профилактике и своевременное лечение позволяют минимизировать ущерб от гельминтозов в современном свиноводстве.
Как выбрать эффективное средство от глистов для свиней?
При выборе антигельминтного препарата для свиней следует учитывать следующие факторы:
- Спектр действия препарата
- Форма выпуска и удобство применения
- Возможность группового применения
- Безопасность для животных разных возрастных групп
- Отсутствие негативного влияния на качество мяса
- Экономическая эффективность
Рекомендуется периодически менять используемые препараты для предотвращения развития резистентности у паразитов.

Новые тенденции в борьбе с гельминтозами свиней
Какие инновации появляются в области лечения и профилактики глистных инвазий у свиней?
- Разработка комплексных препаратов широкого спектра действия
- Создание пролонгированных форм антигельминтиков
- Применение растительных компонентов с антипаразитарным действием
- Использование пробиотиков для повышения резистентности организма
- Разработка вакцин против некоторых видов гельминтов
- Внедрение экспресс-методов диагностики гельминтозов
Эти инновационные подходы позволяют повысить эффективность борьбы с паразитарными заболеваниями в свиноводстве.
Экологические аспекты применения антигельминтных препаратов
Использование противопаразитарных средств в животноводстве имеет не только положительные, но и потенциально негативные последствия:
- Накопление остатков препаратов в организме животных
- Выведение активных компонентов с навозом в окружающую среду
- Воздействие на почвенную микрофлору и фауну
- Развитие резистентности у паразитов
Поэтому важно соблюдать рекомендованные дозировки и схемы применения антигельминтиков, а также искать альтернативные методы борьбы с паразитами.

Экономическая эффективность дегельминтизации свиней
Регулярное проведение противопаразитарных обработок позволяет существенно повысить рентабельность свиноводства за счет:
- Увеличения среднесуточных привесов на 10-15%
- Снижения затрат корма на единицу прироста на 8-12%
- Уменьшения падежа молодняка на 5-7%
- Повышения сохранности поголовья на 3-5%
- Улучшения качества и выхода мясной продукции
Затраты на проведение дегельминтизации обычно окупаются за счет полученной дополнительной продукции в 3-5-кратном размере.
Как правильно организовать противопаразитарные мероприятия на свиноферме?
Для эффективной борьбы с гельминтозами на свиноводческом предприятии необходимо:
- Разработать комплексную программу профилактики и лечения паразитарных заболеваний
- Проводить регулярный мониторинг зараженности животных
- Обеспечить своевременное проведение дегельминтизации всех возрастных групп
- Контролировать качество и эффективность проводимых обработок
- Соблюдать санитарно-гигиенические требования при содержании животных
- Проводить дезинвазию помещений и выгульных площадок
- Обучать персонал правилам проведения противопаразитарных мероприятий
Только комплексный подход позволит добиться устойчивого снижения уровня заболеваемости гельминтозами в хозяйстве.

Препараты от гельминтов (глистов) для свиней
Опубликовано: 17.08.2022 Время на чтение: 7 мин. 5369
Поделитесь:
Гельминтные заболевания наносят существенный экономический ущерб. У свиней, как и у других животных, паразитируют три типа гельминтов – это трематоды (сосальщики), цестоды (ленточные черви) и нематоды (круглые черви). Большинство из них локализуются в желудочно-кишечном тракте, но некоторые поражают печень, сердце, бронхи и другие органы. Паразиты отравляют организм животного продуктами жизнедеятельности, нарушают нормальную работу дыхательной, пищеварительной, сердечно–сосудистой систем, из-за чего снижаются привесы, в тяжелых случаях отмечается гибель как поросят, так и взрослых животных.
Содержание
- Признаки гельминтоза у свиней
- Список препаратов
- Профилактика от глистов у свиней
Признаки гельминтоза у свиней
Чаще всего признаками гельминтозов у свиней является нарушения со стороны желудочно-кишечного тракта в виде поносов, рвоты. Но довольно часто, особенно при массовой миграции личинок аскарид, может наблюдаться расстройство со стороны дыхательной системы, проявляющееся кашлем, истечениями из носа, в тяжелых случаях повышением температуры тела, особенно у поросят, а при наложении вторичной микрофлоры развивается бронхопневмония. Из общих признаков у свиней отмечают: снижение аппетита, но в некоторых случаях может быть и усиление аппетита, наблюдается скрежетание зубами, при этом животные отстают в росте, либо слабо набирают мышечную массу. Как правило, животные более апатичны, имеют шаткую походку, вялость, зачастую отмечается анемия. При высокой интенсивности инвазии наблюдаются отеки подгрудка, нервные явления, острая сердечная недостаточность.
Но довольно часто, особенно при массовой миграции личинок аскарид, может наблюдаться расстройство со стороны дыхательной системы, проявляющееся кашлем, истечениями из носа, в тяжелых случаях повышением температуры тела, особенно у поросят, а при наложении вторичной микрофлоры развивается бронхопневмония. Из общих признаков у свиней отмечают: снижение аппетита, но в некоторых случаях может быть и усиление аппетита, наблюдается скрежетание зубами, при этом животные отстают в росте, либо слабо набирают мышечную массу. Как правило, животные более апатичны, имеют шаткую походку, вялость, зачастую отмечается анемия. При высокой интенсивности инвазии наблюдаются отеки подгрудка, нервные явления, острая сердечная недостаточность.
Список препаратов
 «Альбен»® и «Фебтал»® – препараты широкого спектра действия, которые воздействуют на ленточных, круглых и плоских червей. Так, препарат от глистов для свиней «Альбен»® в своем составе содержит альбендазол. Выпускается в виде гранул и в таблетках. Эффективен как при инвазии каким-то одним видом гельминтов, так и при инвазии несколькими видами паразитических червей. Альбендазол оказывает губительное действие на яйца гельминтов, благодаря чему снижается зараженность мест выгула и содержания. Применяется для лечебно-профилактической обработки однократно, в гранулах дозировка составляет 5,0 гр на 100 кг массы тела животного, а таблетки применяют из расчета 1 таблетка на 35 кг массы тела животного. Если средство от глистов для свиней задается групповым способом, то рассчитанную дозу «Альбен»® гранул смешивают с концентрированным кормом из расчета корма на 1 животное 150–200 гр. После тщательного перемешивания смесь задают свиньям из расчета на группу животных в 10–100 голов. Свиньи должны иметь возможность свободно подойти к кормушке, чтобы все получили необходимую порцию препарата.
«Альбен»® и «Фебтал»® – препараты широкого спектра действия, которые воздействуют на ленточных, круглых и плоских червей. Так, препарат от глистов для свиней «Альбен»® в своем составе содержит альбендазол. Выпускается в виде гранул и в таблетках. Эффективен как при инвазии каким-то одним видом гельминтов, так и при инвазии несколькими видами паразитических червей. Альбендазол оказывает губительное действие на яйца гельминтов, благодаря чему снижается зараженность мест выгула и содержания. Применяется для лечебно-профилактической обработки однократно, в гранулах дозировка составляет 5,0 гр на 100 кг массы тела животного, а таблетки применяют из расчета 1 таблетка на 35 кг массы тела животного. Если средство от глистов для свиней задается групповым способом, то рассчитанную дозу «Альбен»® гранул смешивают с концентрированным кормом из расчета корма на 1 животное 150–200 гр. После тщательного перемешивания смесь задают свиньям из расчета на группу животных в 10–100 голов. Свиньи должны иметь возможность свободно подойти к кормушке, чтобы все получили необходимую порцию препарата.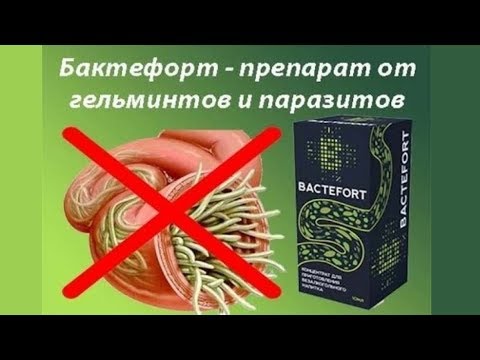
«Фебтал»® в гранулах эффективен при аскаридозе, эзофагостомозе, стронгилоидозе, трихоцефалезе и метастронгилезе свиней из расчета 2,3 гр. гранул на 100 кг массы тела животных. Применение возможно индивидуальным или групповым способом в смеси с кормом. При даче гранул «Фебтала»® необходимо внимательно следить за потреблением корма, чтобы все животным досталась порция. Убой животных на мясо разрешается через 14 дней после последней антигельминтной обработки.
«Иверсан»® – раствор для орального применения. В своем составе содержит ивермектин и витамин Е. Эффективен против нематод желудочно-кишечного тракта и легких, блох, вшей, власоедов, пухопероедов, кровососок, саркоптоидных и гамазовых клещей, паразитирующих у свиней. При гельминтных заболеваниях «Иверсан»® задается свиньям индивидуально или групповым способом, с водой для поения из расчета 1 мл препарата на 100 кг массы тела животного, однократно. При групповом способе дачи препарата свиньям требуемое количество препарата разводят в 1/3 воды, потребляемой свиньями за сутки. Убой на мясо свиней допускается спустя 21 после последней дачи препарата.
Убой на мясо свиней допускается спустя 21 после последней дачи препарата.
Профилактика от глистов у свиней
Профилактика заражения глистами, как в крупных свиноводческих хозяйствах, так и на фермерских усадьбах заключается в регулярных профилактических обработках поголовья, соблюдении ветеринарно-санитарных правил содержания животных, а также в систематической борьбе с грызунами, которые являются резервуарами и разносчиками гельминтных заболеваний. Для борьбы с грызунами отлично подходят препараты «Амус»® и «Ратимор супер-М»®.
Приобрести лекарственные и родентицидные средства можно здесь.
Самым главным оружием в борьбе с гельминтозами является регулярность антигельминтных обработок. Дегельминтизации должны подвергаться свиноматки за две недели до опороса. Всех родившихся поросят первый раз обрабатываю в возрасте 35 дней, повторно в возрасте 2,5–3 месяца. Также необходимо регулярно проводить исследования кала откормочного поголовья и при обнаружении яиц гельминтов проводить дегельминтизацию. Все поголовье, которое прибывает на откорм должно быть подвергнуто профилактической дегельминтизации.
Все поголовье, которое прибывает на откорм должно быть подвергнуто профилактической дегельминтизации.
Гельминтозы наносят огромный вред свиноводству, который складывается из падежа молодняка, снижения привесов, увеличения затрат на корм и лечение животных. В современных условиях и при наличии эффективных антигельминтных препаратов минимизировать ущерб стало гораздо проще, главное в этом деле – регулярность профилактических обработок и системный поход.
Автор: АВЗ
Добавить комментарий
Оцените статью
Поделитесь:
Назад к списку советов
Другие советы по теме
Глисты у коровы
Читать далее
Препараты от глистов для телят
Читать далее
Препараты от паразитов и инфекций
Домой
Товары для здоровья
Недомогания
Препараты от паразитов и инфекций
Препараты от паразитов и инфекций
Лечениe чесоткиОт вшей
Kategooria
Käsimüügiravim (2)
Medical goods (2)
Kaubamärk
GRINDEKS (1)
KIDSNER (1)
PARANIT (1)
Фильтр
4 Товары По позиции По скидке % Дешёвые первыми Сначала самые дорогие От А до Я От Я до А Название активного вещества A-Z
Безрецептурные лекарства
Benzotal salv 200MG/G N1 30 г
Активное вещество / Состав
bensüülbensoaat
0 0
11,53 €
Посмотреть больше
Безрецептурные лекарства
Permetriin LMP 50 mg/g geel
Активное вещество / Состав
permetriin
0 0
13,40 €
Посмотреть больше
Paranit täivastane šampoon 200 мл
0 0
20,29 €
KIDSNER лосьон для удаления вшей 75 мл
0 0
15,99 €
После добавления препарата по рецепту в корзину, у вас есть 15 минут что бы оформить заказ. По истичению 15 минут препарат удалиться из Вашей корзины автоматически. Если вы желаете продолжить покупку, нажмите на кнопку «Да» и сессия продолжется еще на 15
По истичению 15 минут препарат удалиться из Вашей корзины автоматически. Если вы желаете продолжить покупку, нажмите на кнопку «Да» и сессия продолжется еще на 15
Working hours are ending in 15 minutes. Would you like to extend your session by 15 minutes and continue shopping?
Подготовка проб паразитических гельминтов для таксономического исследования
Аль-Амура, М. Ф., Хассен, З. А., и Аль-Мханави, Б. Х. (2012). Методика окрашивания гельминтозов с использованием экстракта красной свеклы ( Beta vulgaris L.). Basrah Journal of Veterinary Research, 11 (1), 283–292.
Перекрёстная ссылка Google Scholar
Анандараджан В., Ногучи К., Олексак Дж., Гротусен Г., Терлеки Д. и Ногучи Э. (2020). Генетическое исследование реакции на повреждение ДНК, вызванное формальдегидом, у Schizosaccharomyces pombe . Current Genetics, 66 (3), 593–605.
 https://doi.org/10.1007/s00294-020-01057-z
https://doi.org/10.1007/s00294-020-01057-zCrossRef КАС пабмед Google Scholar
Анантафрути, М. Т., Майпанич, В., Муенну, К., Пубампен, С., и Сангуанкиат, С. (2002). Анкилостомоз школьников на юге Таиланда. Журнал тропической медицины и общественного здравоохранения Юго-Восточной Азии, 33 (3), 468–473.
ПабМед Google Scholar
Анантафрути М. Т., Окамото М., Юнуан Т., Сагуанкиат С., Кусолсук Т., Сато М., Сато М. О., Сако Ю., Вайкагул Дж. и Ито А. (2010). Молекулярно-серологическое исследование тениоза и цистицеркоза в провинции Канчанабури, Таиланд. Parasitology International, 59 (3), 326–330. https://doi.org/10.1016/j.parint.2010.03.007
CrossRef пабмед Google Scholar
Эндрюс П., Томас Х., Польке Р. и Зойберт Дж. (1983). Празиквантел. Обзоры медицинских исследований, 3 (2), 147–200.
 https://doi.org/10.1002/med.2610030204
https://doi.org/10.1002/med.2610030204CrossRef КАС пабмед Google Scholar
Энтони, Р. М., Рутицкий, Л. И., Урбан, Дж. Ф. Дж., Стадекер, М. Дж., и Гаузе, В. К. (2007). Защитные иммунные механизмы при гельминтозах. Обзоры природы. Иммунология, 7 (12), 975–987. https://doi.org/10.1038/nri2199
CrossRef КАС пабмед ПабМед Центральный Google Scholar
Ауриккьо, П., Катеначчи, Л.С., Сантос, К.Р., и Бритто, Ф.Б. (2014). Протокол использования убитых на дороге или выброшенных на берег животных в качестве материала для исследований и обучения. SITIENTIBUS série Ciências Biológicas, 14 , 1–6. https://doi.org/10.13102/scb237
CrossRef Google Scholar
Беккер, Б., Мелхорн, Х., Эндрюс, П., Томас, Х., и Эккерт, Дж. (1980). Световые и электронные микроскопические исследования влияния празиквантела на Schistosoma mansoni , Dicrocoelium dendriticum и Fasciola hepatica (Trematoda) in vitro.
 Zeitschrift Fur Parasitenkunde (Берлин, Германия), 63 (2), 113–128. https://doi.org/10.1007/BF00927527
Zeitschrift Fur Parasitenkunde (Берлин, Германия), 63 (2), 113–128. https://doi.org/10.1007/BF00927527CrossRef КАС Google Scholar
Бекназарова М., Миллстид С., Робертсон Г., Уилли Х. и Росс К. (2017). Валидация DESS как метода сохранения ДНК для обнаружения Strongyloides spp. в собачьих фекалиях. Международный журнал экологических исследований и общественного здравоохранения, 14 (6). https://doi.org/10.3390/ijerph24060624
Берляндия, Б. (1961). Использование ледяной уксусной кислоты для уничтожения паразитических нематод в целях сбора. Природа, 191 (4795), 1320–1321. https://doi.org/10.1038/1911320a0
CrossRef КАС пабмед Google Scholar
Берляндия, Б. (1961). Использование ледяной уксусной кислоты для уничтожения паразитических нематод в целях сбора. Природа, 191 (4795), 1320–1321.
 https://doi.org/10.1038/1911320a0
https://doi.org/10.1038/1911320a0CrossRef КАС пабмед Google Scholar
Бизанти, М., Ганасси, С., и Мандриоли, М. (2009 г.). Сравнительный анализ различных фиксирующих растворов по консервации насекомых для молекулярных исследований. Entomologia Experimentalis et Applicata, 130 (3), 290–296. https://doi.org/10.1111/j.1570-7458.2008.00821.x
CrossRef КАС Google Scholar
Бланкеспур, Х.Д., и Улмер, М.Дж. (1970). Гельминты шести видов летучих мышей Айовы. Труды Академии наук Айовы, 77 (30), 200–206.
Google Scholar
Байлунд Г., Банг Б. и Викгрен К. (1977). Испытания с новым соединением (празиквантел) против Diphyllobothrium latum . Journal of Helminthology, 51 (2), 115–119. https://doi.org/10.1017/s0022149x00007343
CrossRef КАС пабмед Google Scholar
Чай Ж.
 -Ю. (2013). Лечение празиквантелом трематодных и цестодных инфекций: обновление. Инфекция и химиотерапия, 45 (1), 32–43. https://doi.org/10.3947/ic.2013.45.1.32
-Ю. (2013). Лечение празиквантелом трематодных и цестодных инфекций: обновление. Инфекция и химиотерапия, 45 (1), 32–43. https://doi.org/10.3947/ic.2013.45.1.32CrossRef КАС Google Scholar
Креллен Т., Сититаворн П., Питаксакулрат О., Хунтикео Н., Медли Г. Ф. и Холлингсворт Т. Д. (2021). На пути к доказательной борьбе с Opisthorchis viverrini . Тенденции паразитологии, 37 (5), 370–380. https://doi.org/10.1016/j.pt.2020.12.007
перекрестная ссылка КАС пабмед Google Scholar
Круз, AC (1991). Лечение тениоза человека на Филиппинах: обзор. Журнал тропической медицины и общественного здравоохранения Юго-Восточной Азии, 22 (Приложение), 271–274.
ПабМед Google Scholar
Фукацу, Т. (1999). Сохранение ацетона: практический метод молекулярного анализа.
 Молекулярная экология, 8 (11), 1935–1945 гг. https://doi.org/10.1046/j.1365-294x.1999.00795.x
Молекулярная экология, 8 (11), 1935–1945 гг. https://doi.org/10.1046/j.1365-294x.1999.00795.xCrossRef КАС пабмед Google Scholar
Гэлбрет, К. Э., Хоберг, Э. П., Кук, Дж. А., Армиен, Б., Белл, К. С., Кэмпбелл, М. Л., Даннум, Дж. Л., Дурсахинхан, А. Т., Экерлин, Р. П., Гарднер, С. Л., Грейман, С. Э., Хенттонен , Х., Хименес, Ф. А., Келер, А. В. А., Нямсурен, Б., Ткач, В. В., Торрес-Перес, Ф., Цветкова, А., и Хоуп, А. Г. (2019). Создание интегрированной инфраструктуры для изучения биоразнообразия: полевые коллекции и архивы млекопитающих и паразитов. Journal of Mammology, 100 (2), 382–393. https://doi.org/10.1093/jmammal/gyz048
CrossRef пабмед ПабМед Центральный Google Scholar
Гарднер, С.Л., Фишер, Р.Н., и Барри, С.Дж. (2012). Сбор и сохранение паразитов при обследовании биоразнообразия рептилий. Преподавательские публикации Лаборатории паразитологии Гарольда В.
 Мантера, 738 , 114–121.
Мантера, 738 , 114–121.Google Scholar
Гарвин, М.С., Бейтс, Дж.М., и Кинселла, Дж.М. (1997). Полевые методы сбора и сохранения паразитических гельминтов у птиц с новыми географическими и хозяевскими записями паразитических нематод из Боливии. Орнитологические монографии, 48 , 261–266. http://www.jstor.org/stable/40157537.
Перекрёстная ссылка Google Scholar
Гетце, Э., и Юнгблут, М.Дж. (2013). Ацетоновая консервация для молекулярных исследований зоопланктона. Journal of Plankton Research, 35 (5), 972–981. https://doi.org/10.1093/plankt/fbt035
CrossRef КАС Google Scholar
Гриззл, У. Э., Фреденбург, Дж. Л., и Майерс, Р. Б. (2008). 4 — Фиксация тканей. В JD Bancroft & M. Gamble (Eds.), Теория и практика гистологических методов (6-е изд., стр. 53–74). Черчилль Ливингстон.
 https://doi.org/10.1016/B978-0-443-10279-0.50011-7
https://doi.org/10.1016/B978-0-443-10279-0.50011-7CrossRef Google Scholar
Хенеди, А.М., и Эль-Азази, О.М.Е. (2013). Простая методика окрашивания платигельминтов лактофеноловым хлопковым синим. Журнал Египетского общества паразитологии, 43 (2), 419–423. https://doi.org/10.12816/0006398
CrossRef пабмед Google Scholar
Эрбрето, В., Джиттапалапонг, С., Реркамнуайчоке, В., Шаваль, Ю., Коссон, Дж. Ф., и Моран, С. (2011). В V. Herbreteau, S. Jittapalapong, W. Rerkamnuaychoke, Y. Chaval, JF Cosson и S. Morand (Eds.), Протоколы полевых и лабораторных исследований на грызунах (1-е изд.). Издательство Касетсартского университета.
Google Scholar
Жюстин, Дж.-Л., Бриан, М.Дж., и Брей, Р.А. (2012). Быстрый и простой метод, пригодный для использования в полевых условиях, для сбора паразитов в подходящем состоянии как для морфологических, так и для молекулярных исследований.
 Parasitology Research, 111 (1), 341–351. https://doi.org/10.1007/s00436-012-2845-6
Parasitology Research, 111 (1), 341–351. https://doi.org/10.1007/s00436-012-2845-6CrossRef пабмед Google Scholar
Каваниши М., Мацуда Т. и Яги Т. (2014). Генотоксичность формальдегида: молекулярная основа повреждения и мутации ДНК. Frontiers in Environmental Science, 2 , 36. https://doi.org/10.3389/fenvs.2014.00036
CrossRef Google Scholar
Кенеди, М.Дж. (1979). Основные методы подготовки образцов в паразитологии . Рукописные отчеты IDRC.
Google Scholar
Латиф, М., Заргар, С.А., Хан, А.Р., Назир, М., и Шукат, А. (2008). Успешное лечение никлозамид- и празиквантел-резистентной инфекции бычьего цепня нитазоксанидом. Международный журнал инфекционных заболеваний, 12 (1), 80–82. https://doi.org/10.1016/j.ijid.2007.04.017
Перекрёстная ссылка КАС пабмед Google Scholar
Левек, Б.
 , Истон, А. В., Кулс, П., Альбонико, М., Эйм, С., Жильяр, Дж. С., Кайзер, Дж., Монтрезор, А., Причард, Р., Вламинк, Дж. ., & Vercruysse, J. (2018). Оптимальные сроки послелечебного отбора проб для оценки эффективности антигельминтных препаратов в отношении инфекций Ascaris у человека. Международный журнал паразитологии: лекарства и лекарственная устойчивость, 8 (1), 67–69. https://doi.org/10.1016/j.ijpddr.2017.12.004
, Истон, А. В., Кулс, П., Альбонико, М., Эйм, С., Жильяр, Дж. С., Кайзер, Дж., Монтрезор, А., Причард, Р., Вламинк, Дж. ., & Vercruysse, J. (2018). Оптимальные сроки послелечебного отбора проб для оценки эффективности антигельминтных препаратов в отношении инфекций Ascaris у человека. Международный журнал паразитологии: лекарства и лекарственная устойчивость, 8 (1), 67–69. https://doi.org/10.1016/j.ijpddr.2017.12.004CrossRef пабмед ПабМед Центральный Google Scholar
Лутц, Х.Л., Ткач, В.В., и Векштейн, Дж.Д. (2017). Методы изучения симбионтов птиц на образцах. В MS Webster (Ed.), . Расширенный образец: новые рубежи в коллекционных орнитологических исследованиях (1-е изд., стр. 28). КПР Пресс.
Google Scholar
Майпанич В., Сато М., Пубампен С., Сангуанкиат С., Кусолсук Т., Тэнкхам У. и Вайкагул Дж. (2011). Аномальные ленточные черви Taenia saginata в Таиланде.
 Журнал тропической медицины и общественного здравоохранения Юго-Восточной Азии, 42 (5), 1065–1071.
Журнал тропической медицины и общественного здравоохранения Юго-Восточной Азии, 42 (5), 1065–1071.ПабМед Google Scholar
Мархаба З. и Ханилоо А. (2018). Окраска паразитических гельминтов экстрактами Allium cepa , Juglans regia и Rubia tinctorum : подход к травяным красителям. Иранский журнал паразитологии, 13 (2), 293–300.
ПабМед ПабМед Центральный Google Scholar
May, HG (1922). Уничтожение, окрашивание и установка паразитических нематод. Труды Американского микроскопического общества, 41 (2), 103–105.
Перекрёстная ссылка Google Scholar
Наэм, С., Паган, К., и Надлер, С.А. (2010). Структурное восстановление нематод и скребней, зафиксированных в высокопроцентном спирте с помощью раствора ДЭСС и регидратации. Журнал паразитологии, 96 (4), 809–811.
 https://doi.org/10.1645/GE-2402.1
https://doi.org/10.1645/GE-2402.1CrossRef пабмед Google Scholar
Остерман Линд, Э., Эйскер, М., Нильссон, О., Уггла, А., и Хеглунд, Дж. (2003). Изгнание мелких стронгильных нематод (cyathostomin spp) после дегельминтизации лошадей на конезаводе в Швеции. Ветеринарная паразитология, 115 (4), 289–299. https://doi.org/10.1016/s0304-4017(03)00200-0
CrossRef КАС пабмед Google Scholar
Пирсон, Р. Д., и Хьюлетт, Э. Л. (1985). Терапия никлозамидом при инфекциях, вызванных ленточными червями. Летопись внутренней медицины, 102 (4), 550–551. https://doi.org/10.7326/0003-4819-102-4-550
CrossRef КАС пабмед Google Scholar
Перера, Д. Р., Вестерн, К. А., и Шульц, М. Г. (1970). Никлозамид для лечения цестодозов. Клинические испытания в США. Американский журнал тропической медицины и гигиены, 19 (4), 610–612.
 https://doi.org/10.4269/ajtmh.1970.19.610
https://doi.org/10.4269/ajtmh.1970.19.610CrossRef КАС пабмед Google Scholar
Пунекар, Н.С., Суреш Кумар, С.В., Джаяшри, Т.Н., и Анурадха, Р. (2003). Выделение геномной ДНК из высушенного ацетоном Аспергиллезный мицелий . Информационный бюллетень по генетике грибов, 50 , 15–16.
Перекрёстная ссылка Google Scholar
Шелл, Южная Каролина (ред.). (1970). Как узнать трематод . ВМ. К. Браун.
Google Scholar
Шмидт, Г. Д. (1986). Справочник CRC по идентификации ленточных червей . КПР Пресс.
Google Scholar
Сайнхорст, Дж. В. (1959). Экспресс-метод переноса нематод с фиксатора на безводный глицерин. Nematologica, 4 (1), 67–69. https://doi.org/10.1163/187529259X00381
CrossRef Google Scholar
Сепульведа, М.
 С., и Кинселла, Дж.М. (2013). Сбор и идентификация гельминтов в дикой природе. Журнал визуализированных экспериментов, 82 , e51000. https://doi.org/10.3791/51000
С., и Кинселла, Дж.М. (2013). Сбор и идентификация гельминтов в дикой природе. Журнал визуализированных экспериментов, 82 , e51000. https://doi.org/10.3791/51000Перекрёстная ссылка КАС Google Scholar
Тавараджа, Р., Мудимбайманнар, В.К., Элизабет, Дж., Рао, Великобритания, и Ранганатан, К. (2012). Химические и физические основы рутинной фиксации формальдегида. Журнал патологии полости рта и челюстно-лицевой области, 16 (3), 400–405. https://doi.org/10.4103/0973-029X.102496
CrossRef пабмед ПабМед Центральный Google Scholar
Траян, AC (1973). Быстрый лактофенол-глицериновый метод консервирования нематод. Труды Вашингтонского гельминтологического общества, 40 (2), 296–297.
Google Scholar
Вайкагул Дж., Йонгсуксантигул П., Раттанавитун У., Радомиос П.
 , Кодзима С. и Такеучи Т. (2008). Паразитологический мониторинг программы борьбы с гельминтами в Северном Таиланде. Журнал тропической медицины и общественного здравоохранения Юго-Восточной Азии, 39 (6), 1008–1014.
, Кодзима С. и Такеучи Т. (2008). Паразитологический мониторинг программы борьбы с гельминтами в Северном Таиланде. Журнал тропической медицины и общественного здравоохранения Юго-Восточной Азии, 39 (6), 1008–1014.ПабМед Google Scholar
Вайкагул, Дж., и Тэнкхэм, У. (2014). Глава 2 — Сбор переносимых рыбой трематод от окончательного хозяина. В J. Waikagul & U. Thaenkham (Eds.), Подходы к исследованию систематики рыбных трематод (стр. 17–37). Академическая пресса. https://doi.org/10.1016/B978-0-12-407720-1.00002-9
CrossRef Google Scholar
Ванас, М. К., Рашед, А. А., Аль Шариф, А. М., Аль Аттар, М. Н., и Абдалла, Х. М. (1995). Морфоанатомические исследования личинок трематод рода Brachylaima (Brachylaimidae) наземной улитки Monacha obstructa. Журнал Египетского общества паразитологии, 25 (2), 407–415.
КАС пабмед Google Scholar
Йодер, М.
 , Де Лей, И. Т., Кинг, И. В., Мундо-Окампо, М., Манн, Дж., Блакстер, М., Пойрас, Л., и Лей, П. Д. (2006). DESS: универсальное решение для сохранения морфологии и экстрагируемой ДНК нематод. Нематология, 8 (3), 367–376. https://doi.org/10.1163/156854106778493448
, Де Лей, И. Т., Кинг, И. В., Мундо-Окампо, М., Манн, Дж., Блакстер, М., Пойрас, Л., и Лей, П. Д. (2006). DESS: универсальное решение для сохранения морфологии и экстрагируемой ДНК нематод. Нематология, 8 (3), 367–376. https://doi.org/10.1163/156854106778493448CrossRef КАС Google Scholar
Захабиун Ф., Саджади С. М. и Эсфандиари Ф. (2015). Разработка метода закрепления двойного стекла с использованием формальдегидного спирта, азокармина, лактофенола (FAAL) и его оценка для постоянного закрепления мелких нематод. Иранский журнал паразитологии, 10 (4), 617–624.
ПабМед ПабМед Центральный Google Scholar
Загрузить ссылки
CDC — DPDx — Диагностические процедуры
Калибровка микроскопов с помощью окулярного микрометра:
Правильно откалиброванный микроскоп имеет решающее значение, поскольку размер является важной характеристикой для идентификации паразитов. В этом разделе предполагается, что диск окулярного микрометра был установлен в один из окуляров и что имеется предметный столик для калибровки окулярного микрометра. Эта калибровка должна быть выполнена для каждого из объективов микроскопа.
В этом разделе предполагается, что диск окулярного микрометра был установлен в один из окуляров и что имеется предметный столик для калибровки окулярного микрометра. Эта калибровка должна быть выполнена для каждого из объективов микроскопа.
Поместите предметный столик-микрометр на предметный столик микроскопа и сосредоточьтесь на шкале микрометра, пока не сможете различать большие (0,1 мм) и маленькие (0,01 мм) деления шкалы. Отрегулируйте предметный микрометр так, чтобы линия «0» на окулярном микрометре совпадала с линией «0» на предметном микрометре. Не изменяя настройки предметного столика, найдите точку, как можно более удаленную от двух наложенных нулевых линий, где две другие линии также точно накладываются друг на друга. Определите количество окулярных микрометрических промежутков, а также количество миллиметров на предметном микрометре между двумя точками наложения.
Например: Предположим, что 48 глазных микрометров (единиц) равны 0,6 мм. Рассчитайте количество мм/окулярного микрометра пространства.
0,6 мм x 48 глазных микрометров = 0,0125 мм/окулярный микрометр пространства
Поскольку большинство размеров микроорганизмов дается в мкм, а не в мм, рассчитанное выше значение необходимо преобразовать в мкм, умножив его на 1000 мкм/мм.
Например:
0,125 мм межзрачкового пространства × 1000 мкм/мм = 12,5 мкм/мкм межглазного пространства
Таким образом, в данном случае 1 глазной микрометр (единица) эквивалентен 12,5 мкм.
Выполните описанные выше шаги для каждой цели. Калибровочные показания должны быть вывешены на каждом микроскопе, и микроскоп следует повторно калибровать после каждой чистки или замены объективов или окуляров.
Подготовка влажного препарата:
Рисунок A
Перед подготовкой влажного препарата микроскоп необходимо откалибровать. Объективы и окуляры, используемые для процедуры калибровки, должны использоваться для всех измерений на микроскопе. Калибровочные коэффициенты всегда должны быть вывешены сбоку микроскопа.
Простейшие трофозоиты, цисты, ооцисты, яйца и личинки гельминтов можно увидеть и идентифицировать с помощью метода идентификации влажного препарата. Для подготовки влажного препарата возьмите предметное стекло и образец стула. Возьмите небольшое количество образца и поместите его на предметное стекло микроскопа. Если образец стула все еще несколько твердый, добавьте в образец одну или две капли физиологического раствора и перемешайте. В идеале на одном предметном стекле можно приготовить два мазка, один из которых можно окрасить йодом. Толщина влажного крепления должна быть Рисунок A справа иллюстрирует.
При желании покровное стекло можно запечатать. Препарат из вазелина и парафина в соотношении 1:1 можно нанести ватным тампоном, как показано на рис. справа. Его необходимо нагреть примерно до 70°C как для смешивания, так и для использования. Запечатывание покровного стекла препятствует перемещению микроорганизмов при использовании объективов с масляной иммерсией и предотвращает высыхание препарата. Чтобы запечатать, закрепите четыре угла, поместив каплю горячего герметика, чтобы закрепить покровное стекло. Распределить тонким слоем по краям. При желании можно использовать другие подходящие герметизирующие препараты.
Чтобы запечатать, закрепите четыре угла, поместив каплю горячего герметика, чтобы закрепить покровное стекло. Распределить тонким слоем по краям. При желании можно использовать другие подходящие герметизирующие препараты.
Систематически сканируйте всю область покровного стекла, используя объектив 10×, как показано на рис. C справа. Если видно что-то подозрительное, может потребоваться большее увеличение.
ПРЕДОСТЕРЕЖЕНИЕ: Поднесение объективов с большим увеличением слишком близко к краю предметного стекла приведет к тому, что герметик размажет объектив и помешает работе опторов.
Подготовка окрашенных препаратов:
Окрашенные препараты используются для идентификации простейших трофозоитов и цист, а также для подтверждения вида. Он также позволяет консультироваться и ставить диагноз, когда это необходимо, а также обеспечивает постоянную регистрацию наблюдаемых организмов. Перед началом исследования микроскоп необходимо откалибровать. Позитивные слайды микроскопа, а также справочный материал (планшеты, фотографии, цифровые изображения) должны быть доступны на рабочей станции для сравнения морфологических деталей и организмов. Обратитесь к разделу окрашивания стула для получения дополнительной информации о том, какие красители использовать.
Позитивные слайды микроскопа, а также справочный материал (планшеты, фотографии, цифровые изображения) должны быть доступны на рабочей станции для сравнения морфологических деталей и организмов. Обратитесь к разделу окрашивания стула для получения дополнительной информации о том, какие красители использовать.
Обычно для приготовления перманентно окрашенных предметных стекол используются 3 × 1 предметные стекла. Если образец не консервирован, подготовьте тонкий ровный мазок материала, нанеся штрихи на предметное стекло вперед и назад палочкой-аппликатором. При необходимости разбавьте фекалии физиологическим раствором. Для образцов, фиксированных ПВА, нанесите две или три капли образца на предметное стекло и перекатывающим движением или похлопывающими движениями вверх-вниз равномерно распределите образец, чтобы покрыть площадь размером примерно 22 на 22 мм покровного стекла. В отношении других фиксаторов ознакомьтесь с инструкциями производителя.
После завершения процесса окрашивания систематически исследуйте мазок под микроскопом, используя масляный объектив 100×. Обследовать не менее 200–300 нефтеиммерсионных полей. Укажите простейшие, рассматриваемые как трофозоиты и/или цисты, если применимо.
Обследовать не менее 200–300 нефтеиммерсионных полей. Укажите простейшие, рассматриваемые как трофозоиты и/или цисты, если применимо.
УФ-флуоресцентная микроскопия Процедура:
Демонстрация ооцист Cyclospora во влажных препаратах значительно улучшается при использовании УФ-флуоресцентной микроскопии. Несмотря на возраст экземпляра или пробы, 9Ооцисты 0495 Cyclospora имеют интенсивный синий цвет при наблюдении под флуоресцентным микроскопом (фильтр УФ-возбуждения настроен на 330-365 нм). Если этот набор фильтров недоступен, можно получить менее интенсивную зеленую флуоресценцию при синем возбуждении (450–490 нм). При микроскопии в светлом поле (дифференциально-интерференционный контраст или ДИК) ооцисты Cyclospora выглядят как преломляющие сферы (8-10 мкм) с отчетливой стенкой ооцисты. Использование как светлопольной (DIC), так и флуоресцентной микроскопии обеспечивает эффективный и надежный подход к диагностике. Тем не менее, он не дает постоянного окрашенного предметного стекла, которое можно архивировать.
