Какие препараты помогают нормализовать микрофлору кишечника. Как правильно восстановить баланс кишечной микрофлоры. Когда необходимо применять пробиотики и пребиотики. Какие натуральные средства эффективны для оздоровления микрофлоры.
Важность здоровой микрофлоры кишечника
Микрофлора кишечника играет огромную роль в поддержании здоровья человека. Она участвует в процессах пищеварения, синтезе витаминов, укреплении иммунитета, защите от патогенных микроорганизмов. Нарушение баланса кишечной микрофлоры может привести к различным проблемам со здоровьем:
- Расстройствам пищеварения
- Снижению иммунитета
- Аллергическим реакциям
- Воспалительным процессам в кишечнике
- Нарушениям обмена веществ
Поэтому так важно поддерживать нормальный состав микрофлоры и при необходимости восстанавливать его с помощью специальных препаратов и методов.
Основные причины нарушения микрофлоры кишечника
Существует ряд факторов, которые могут привести к дисбалансу кишечной микрофлоры:

- Прием антибиотиков
- Неправильное питание
- Стрессы
- Острые кишечные инфекции
- Снижение иммунитета
- Хронические заболевания ЖКТ
- Злоупотребление алкоголем
При наличии этих факторов риска важно обратить внимание на состояние микрофлоры кишечника и принять меры по ее восстановлению.
Эффективные препараты для нормализации микрофлоры
Для восстановления баланса кишечной микрофлоры применяются следующие группы препаратов:
Пробиотики
Это препараты, содержащие живые полезные бактерии. Наиболее распространенные виды пробиотиков:
- Бифидобактерии
- Лактобактерии
- Энтерококки
- Бактерии рода Bacillus
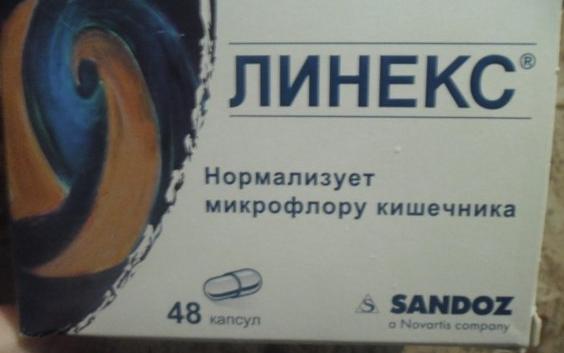
Примеры эффективных пробиотиков: Линекс, Бифиформ, Аципол, Бифидумбактерин.
Пребиотики
Эти вещества стимулируют рост собственной полезной микрофлоры кишечника. К пребиотикам относятся:
- Инулин
- Олигофруктоза
- Лактулоза
- Пищевые волокна
Популярные препараты-пребиотики: Хилак форте, Лактофильтрум, Дюфалак.
Симбиотики
Комбинированные препараты, сочетающие пробиотики и пребиотики. Например, Нормобакт, Бифилакт БГ, Максилак.

Энтеросорбенты
- Активированный уголь
- Смекта
- Полисорб
- Энтеросгель
Как правильно принимать препараты для восстановления микрофлоры
Для достижения максимального эффекта важно соблюдать следующие правила приема препаратов:
- Начинать с небольших доз, постепенно увеличивая их
- Принимать препараты курсом не менее 2-4 недель
- Соблюдать рекомендованную схему приема
- Не принимать пробиотики одновременно с антибиотиками
- Хранить препараты согласно инструкции
- Сочетать прием препаратов с правильным питанием
Натуральные средства для оздоровления микрофлоры
- Кисломолочные продукты (йогурт, кефир, ряженка)
- Квашеная капуста
- Морская капуста
- Семена льна
- Топинамбур
- Чеснок
- Овощи и фрукты, богатые клетчаткой
Диетические рекомендации при восстановлении микрофлоры
Правильное питание играет важную роль в нормализации кишечной микрофлоры. Рекомендуется придерживаться следующих принципов:

- Ограничить употребление сахара и сладостей
- Исключить из рациона фаст-фуд и полуфабрикаты
- Употреблять больше овощей, фруктов, цельнозерновых продуктов
- Включить в меню ферментированные продукты
- Пить достаточное количество чистой воды
- Ограничить алкоголь и газированные напитки
Когда необходимо обратиться к врачу
В некоторых случаях для восстановления микрофлоры кишечника требуется консультация гастроэнтеролога. Следует обратиться к специалисту при наличии следующих симптомов:
- Длительная диарея или запоры
- Боли в животе
- Вздутие и метеоризм
- Тошнота, рвота
- Резкая потеря веса
- Повышение температуры тела
Врач проведет необходимые обследования и назначит индивидуальную схему лечения с учетом состояния пациента.
Профилактика нарушений микрофлоры кишечника
Чтобы избежать дисбаланса кишечной микрофлоры, рекомендуется соблюдать следующие меры профилактики:
- Правильное сбалансированное питание
- Регулярные физические нагрузки
- Своевременное лечение заболеваний ЖКТ
- Соблюдение правил гигиены
- Ограничение приема антибиотиков
- Борьба со стрессом
- Отказ от вредных привычек
Заключение
Восстановление и поддержание здоровой микрофлоры кишечника — важный аспект заботы о своем здоровье. Правильное применение пробиотиков, пребиотиков и других препаратов в сочетании со здоровым образом жизни позволяет нормализовать состав кишечной микрофлоры и улучшить общее самочувствие. При наличии серьезных нарушений необходимо обратиться к врачу для подбора индивидуальной схемы лечения.

Препарати для відновлення мікрофлори кишечника — купити в Україні
- Товари
- Ціни в аптеках
Товарів: 136
Сортування: За рейтингомВід дешевихВід дорогих
Вид:
Перейти до кошика
Огляд
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Огляд
Перейти до кошика
Перейти до кошика
Разом дешевше
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Разом дешевше
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Перейти до кошика
Знижка
Редакторська група
Дата створення: 27.
Значення мікрофлори кишечника
Здорова мікрофлора кишечника являє собою певний набір бактерій, взаємозв’язок і життєдіяльність яких приносить користь органам шлунково-кишкового тракту, самопочуттю і імунітету людини.
Корисні мікроорганізми беруть активну участь в травному процесі, засвоєнні вітамінів, білків. Однак поряд з корисними бактеріями в кишечнику організму також знаходяться шкідливі мікроорганізми, які сприяють утворенню процесів гниття і бродіння.
Порушення тонкого балансу співвідношення корисних і шкідливих бактерій може нашкодити здоров’ю людини. Нормалізувати роботу кишечника шляхом відновлення мікрофлори можливо за допомогою правильно підібраних харчових добавок.
Харчові добавки для боротьби з дисбактеріозом
БАДи, призначені для поліпшення стану мікрофлори кишечника, сприяють відновленню балансу мікроорганізмів, що знаходяться в шлунково-кишковому тракті. Це дає можливість усунути причини різних захворювань і налагодити процес травлення на належному рівні.
Біологічно активні добавки, позитивно впливають на формування мікрофлори кишечника, володіють наступними лікувальними властивостями:
- усувають кишкові розлади;
- відновлюють порушений баланс мікрофлори;
- насичують мікрофлору корисними бактеріями;
- покращують імунітет;
- усувають шкідливі речовини;
- нормалізують обмін речовин;
- покращують моторну функцію кишечника;
- усувають кишкові кольки та здуття живота у дітей;
- активізують власні ресурси організму.
На сайті «Аптеки 9-1-1» представлені різні БАДи для відновлення мікрофлори кишечника. Наші консультанти допоможуть вам зорієнтуватися в асортименті препаратів і вибрати відповідні дієтичні добавки для кожного конкретного випадку.
Поширені запитання
Які недорогі товари в категорії Вітаміни для мікрофлори кишечника?
Які найкращі бренди в категорії Вітаміни для мікрофлори кишечника?
Які найпопулярніші товари в категорії Вітаміни для мікрофлори кишечника?
Скільки коштують товари в категорії Вітаміни для мікрофлори кишечника?
Ціни на товари в категорії Вітаміни для мікрофлори кишечника починаються від 69. 10 грн.
10 грн.
Вітаміни для мікрофлори кишечника ціна в Аптеці 911
| Назва | Ціна |
|---|---|
| Дієтична добавка для регулювання мікрофлори кишечника Лактіалє Синбіотик (пробіотик+пребіотик) капсули 2 блістера по 15 шт | 237.60 грн. |
| ГастроПро капсули для відновлення мікрофлори кишечника упаковка 14 шт | 110.00 грн. |
| Зафакол 3D таблетки вкриті оболонкою для нормалізації стану та регуляції функціонування кишечника упаковка 30 шт | 421.54 грн. |
| Капсули для регулювання мікрофлори кишечника Йогурт Комфорт 30 шт | 70.19 грн. |
| Краплі дитячі для регулювання мікрофлори кишечника Біогая Пробіотик флакон 5 мл | 422.14 грн. |
Недостаточно заботиться только о микрофлоре! | Щотижневик АПТЕКА
Нарушение микрофлоры кишечника — актуальная и часто обсуждаемая проблема. Казалось бы, ничего нового по этой теме уже нельзя сказать, все известно. Однако следует помнить, что наш организм — единая система, и микрофлора является ее частью. Поэтому невозможно рассматривать ее изолировано от места, где она обитает. А значит, состояние места обитания кишечной микрофлоры не менее важно, чем ее баланс.
Казалось бы, ничего нового по этой теме уже нельзя сказать, все известно. Однако следует помнить, что наш организм — единая система, и микрофлора является ее частью. Поэтому невозможно рассматривать ее изолировано от места, где она обитает. А значит, состояние места обитания кишечной микрофлоры не менее важно, чем ее баланс.
Наш пищеварительный тракт является органом с наибольшей протяженностью. Но при этом он помещается в относительно небольшом человеке. Так, длина пищевой трубки составляет почти 9 м, а площадь ее поверхности — около 400 м2! За всю жизнь через нее проходит приблизительно 60 т пищи. И справиться с этой едой кишечнику помогает микрофлора. Она формирует сложную самоорганизующуюся, саморегулирующуюся и саморазвивающуюся экосистему. В нее входит более 50 родов, насчитывающих около 500 видов различных бактерий. Масса всех микроорганизмов, обитающих в нашем кишечнике, равна массе печени и достигает 1,5 кг, благодаря чему они получили название микробный орган. Такое количество бактерий вполне оправдано. Они выполняют ряд важных функций: участвуют в регуляции иммунной системы организма и физиологической моторики пищеварительного тракта, синтезе витаминов группы В и витамина К, жирных кислот и полиаминов, принимают участие в переваривании пищи, дальнейшем всасывании питательных веществ в кровь, защищают кишечную стенку от колонизации патогенной, условно-патогенной микрофлорой и прикрепления к ней других чужеродных микроорганизмов, повышают скорость обновления клеток кишечника. В составе основной (облигатной) нормальной кишечной микрофлоры присутствуют молочнокислые бактерии (бифидо- и лактобактерии), кишечные палочки, бактероиды, пептострептококки, энтерококки. Все они позволяют человеку не отвлекаться на работу кишечника в повседневной жизни.
Такое количество бактерий вполне оправдано. Они выполняют ряд важных функций: участвуют в регуляции иммунной системы организма и физиологической моторики пищеварительного тракта, синтезе витаминов группы В и витамина К, жирных кислот и полиаминов, принимают участие в переваривании пищи, дальнейшем всасывании питательных веществ в кровь, защищают кишечную стенку от колонизации патогенной, условно-патогенной микрофлорой и прикрепления к ней других чужеродных микроорганизмов, повышают скорость обновления клеток кишечника. В составе основной (облигатной) нормальной кишечной микрофлоры присутствуют молочнокислые бактерии (бифидо- и лактобактерии), кишечные палочки, бактероиды, пептострептококки, энтерококки. Все они позволяют человеку не отвлекаться на работу кишечника в повседневной жизни.
Все вышесказанное большинству из нас очень хорошо известно. Но вот о взаимосвязи состояния слизистой оболочки кишечника и физиологической микрофлоры говорят не так часто. Тем не менее, результатом взаимодействия клеток эпителия и микроорганизмов является формирование сложной структуры — так называемого приэпителиального слизистого барьера. Он представляет собой биопленку, состоящую из слизи, молекул секреторного IgA, нормальной микрофлоры и ее метаболитов. Именно эта биопленка защищает слизистую оболочку кишечника от негативного воздействия различных физических и химических факторов, проникновения патогенных микробов и различных токсинов. Этот барьер обеспечивает также устойчивость к колонизации, конкуренцию с патогенными микроорганизмами за питательные вещества, витамины, минералы и метаболиты, синтез специальных бактериоцинов, которые ингибируют размножение патогенных штаммов. Такой компонент, как секреторный IgA также связывает антигены вирусов и бактерий, не позволяет им прикрепляться к слизистым оболочкам, связывает пищевые антигены и аллергены, способные провоцировать аллергические реакции. Наконец, от состояния слизистой оболочки кишечника и формирующегося на ней приэпителиального слизистого барьера зависит способность нормальной микрофлоры прикрепляться к эпителию кишечника. Поэтому если слизистая оболочка кишечника повреждена, то и восстановить баланс нормальной микрофлоры довольно затруднительно.
Он представляет собой биопленку, состоящую из слизи, молекул секреторного IgA, нормальной микрофлоры и ее метаболитов. Именно эта биопленка защищает слизистую оболочку кишечника от негативного воздействия различных физических и химических факторов, проникновения патогенных микробов и различных токсинов. Этот барьер обеспечивает также устойчивость к колонизации, конкуренцию с патогенными микроорганизмами за питательные вещества, витамины, минералы и метаболиты, синтез специальных бактериоцинов, которые ингибируют размножение патогенных штаммов. Такой компонент, как секреторный IgA также связывает антигены вирусов и бактерий, не позволяет им прикрепляться к слизистым оболочкам, связывает пищевые антигены и аллергены, способные провоцировать аллергические реакции. Наконец, от состояния слизистой оболочки кишечника и формирующегося на ней приэпителиального слизистого барьера зависит способность нормальной микрофлоры прикрепляться к эпителию кишечника. Поэтому если слизистая оболочка кишечника повреждена, то и восстановить баланс нормальной микрофлоры довольно затруднительно.
Нет, мы не будем утверждать, что дисбаланс кишечной микрофлоры достиг размеров эпидемии и возникает буквально у каждого. На самом деле, нередко нарушение баланса кишечной микрофлоры протекает практически бессимптомно. И в случае, если мы имеем дело всего лишь с дисбалансом нормальной микрофлоры, восстановить это равновесие не так уж и сложно: часто это происходит само по себе, без какого-либо нашего вмешательства, или же при употреблении кисломолочных продуктов.
Но вот когда мы сталкиваемся с различными диспептическими явлениями (вздутие живота, периодическая боль в эпигастрии, тяжесть и дискомфорт, возникающие после еды, диарея и расстройства стула) — самое время задуматься: быть может, мы имеем дело с повреждением энтероцитов — клеток эпителия кишечника?
Именно на фоне такого повреждения эпителия слизистой оболочки кишечника, снижается уровень активности пристеночных ферментов, в частности лактазы. Как результат — ухудшается переваривание белков, жиров и углеводов, развивается вторичная лактазная недостаточность. Это значит, что нарушается гидролиз лактозы (молочного сахара). Нерасщепленный молочный сахар накапливается в просвете тонкой кишки, из-за чего повышается осмотическое давление, увеличивается объем содержимого толстой кишки, что приводит к избыточному поступлению жидкости в просвет кишечника, нарушению реабсорбции воды и электролитов из просвета кишечника. Все это проявляется таким симптомом, как диарея.
Это значит, что нарушается гидролиз лактозы (молочного сахара). Нерасщепленный молочный сахар накапливается в просвете тонкой кишки, из-за чего повышается осмотическое давление, увеличивается объем содержимого толстой кишки, что приводит к избыточному поступлению жидкости в просвет кишечника, нарушению реабсорбции воды и электролитов из просвета кишечника. Все это проявляется таким симптомом, как диарея.
Вторичная лактазная недостаточность усугубляет дисбаланс микрофлоры кишечника. Накопление нерасщепленной лактозы в просвете кишечника сопровождается активным размножением условно-патогенных микроорганизмов. Это становится причиной появления таких симптомов, как метеоризм, боль и урчание в животе, ощущение тяжести и т.п.
Стоит ли говорить о том, что для устранения всех состояний, которые мы перечисляли выше — диареи, скопления газов, урчания и колик в животе — недостаточно лишь улучшить состояние кишечной микрофлоры. Необходимо еще обратить внимание на слизистую оболочку кишечника.
Позаботиться не только о нормализации состава микрофлоры, но и помочь восстановить нормальную функцию слизистой оболочки кишечника поможет препарат ЛАКТОВИТ ФОРТЕ.
Наиболее важной отличительной особенностью этого лекарственного средства является его комплексный состав, в который входят: Bacillus coagulans (Lb. sporogenes), фолиевая кислота и витамин В12. Благодаря этому обеспечивается двойное действие препарата.
1. Восстановление нормальной микрофлоры кишечника: Bacillus coagulans продуцируют молочную кислоту, которая обладает антагонистической активностью в отношении патогенных и условно-патогенных микроорганизмов, а также создает благоприятные условия для формирования нормального микробиоценоза кишечника. Споры бактерий Bacillus coagulans, содержащиеся в капсулах ЛАКТОВИТ ФОРТЕ, активизируются в желудке, после чего в двенадцатиперстной кишке трансформируются в живую вегетативную форму и создают благоприятные условия для формирования нормального микробиоценоза кишечника за счет выделения L (+) молочной кислоты. Это лекарственное средство также стимулирует рост собственной микрофлоры, в том числе бифидобактерий, угнетает рост и размножение патогенной флоры (сальмонелл, шигелл, клостридий, стрептококков). В ходе своей жизнедеятельности эти бактерии осуществляют ферментативное расщепление белков, жиров и сложных углеводов (в том числе при дефиците лактазы у детей).
Это лекарственное средство также стимулирует рост собственной микрофлоры, в том числе бифидобактерий, угнетает рост и размножение патогенной флоры (сальмонелл, шигелл, клостридий, стрептококков). В ходе своей жизнедеятельности эти бактерии осуществляют ферментативное расщепление белков, жиров и сложных углеводов (в том числе при дефиците лактазы у детей).
2. Восстановление слизистой оболочки кишечника. Фолиевая кислота (витамин В9) и цианокобаламин (витамин В12), входящие в состав препарата ЛАКТОВИТ ФОРТЕ, принимают участие в синтезе нуклеиновых кислот и белков, действуют сообща и способствуют восстановлению слизистой оболочки кишечника. Также этому способствует L (+) молочная кислота, вырабатываемая бактерией Bacillus coagulans и являющаяся энергетическим субстратом для слизистой кишечника.
Кому же рекомендовано принимать ЛАКТОВИТ ФОРТЕ? Кто нуждается в восстановлении не только микрофлоры, но и функции слизистой оболочки кишечника? Прежде всего, пациентам с жалобами на вздутие живота, периодическую боль в эпигастрии, тяжесть и дискомфорт после еды, диарею или расстройства стула — все эти симптомы могут свидетельствовать о том, что кроме дисбаланса микрофлоры произошло и повреждение слизистой оболочки кишечника.
В качестве второй категории следует отметить больных, которые применяют антибактериальные препараты. Ведь сегодня специалистам хорошо известно, что некоторые антибиотики оказывают непосредственное токсическое воздействие на слизистую оболочку кишечника (неомицин, тетрациклин) (Хавкин А.И., Жихарева Н.С., 2006).
Наконец, остается выяснить последнее: как принимают ЛАКТОВИТ ФОРТЕ? Тем более, что для удобства наших больших и маленьких пациентов он представлен в форме не только капсул, но и саше.
Так, например, у взрослых и детей препарат применяют 2 раза в сутки за 40 мин до еды. Разовая и суточная дозы определяются в зависимости от возраста (схема).
Детям в возрасте до 2 лет лекарственное средство можно принимать непосредственно перед кормлением по ½ капсуле/пакетику (раскрыв и растворив капсулу/содержимое пакетика в воде или молоке), в возрасте старше 2 лет — по 1 капсуле/пакетику; взрослым — 1–2 капсулы/пакетика.
ПРЕИМУЩЕСТВА препарата ЛАКТОВИТ ФОРТЕ
обладает двойным действием – способствует восстановлению микрофлоры и слизистой оболочки кишечника:
1. препятствует росту патогенных бактерий и способствует стимуляции роста собственной лактофлоры, в том числе при дисбиозе на фоне антибиотикотерапии;
препятствует росту патогенных бактерий и способствует стимуляции роста собственной лактофлоры, в том числе при дисбиозе на фоне антибиотикотерапии;
2. содержит фолиевую кислоту (витамин В9) и цианокобаламин (витамин В12), оказывающие синергичное действие и восстанавливающие слизистую оболочку кишечника
Информация для профессиональной деятельности медицинских и фармацевтических специалистов
ЛАКТОВИТ ФОРТЕ (LAKTOVIT FORTE). Состав и форма выпуска. Капсулы, № 30: молочнокислые бактерии — 120 000 000 спор; кислота фолиевая — 1,5 мг; цианокобаламин — 15 мкг; Порошок. д/п орал. сусп. пакетик 4 г, № 10: молочнокислые бактерии — 120 000 000 спор; кислота фолиевая — 1,5 мг; цианокобаламин — 15 мкг. Показания. Взрослым и детям (начиная с первых месяцев жизни) при хроническом колите различной этиологии, в том числе неспецифическом язвенном колите; дисбактериозе, возникшем в результате применения антибиотиков, сульфаниламидных препаратов и т.д.; после перенесенных острых кишечных инфекций; при наличии дисфункции пищеварительного тракта или выделении патогенных и условно-патогенных бактерий; в акушерско-гинекологической практике при неспецифических воспалительных заболеваниях половых органов и предродовой подготовке у беременных, входящих в группу риска, с нарушением чистоты вагинального секрета III–IV степени; в составе комплексной терапии при крапивнице, экземе, диатезе у детей, атопическом дерматите. Применение. Взрослым и детям внутрь 2 раза в сутки за 40 мин до еды. Детям в возрасте до 2 лет можно принимать препарат непосредственно перед кормлением по ½ капсуле/пакетику (раскрыв и растворив капсулу/содержимое пакетика в воде или молоке), старше 2 лет и взрослым — по 1 капсулы/пакетика; взрослым — 1–2 капсулы/пакетика. Противопоказания. Гиперчувствительность к лактозе или другим компонентам препарата. Побочные эффекты. При медицинском применении препарата ЛАКТОВИТ ФОРТЕ в рекомендуемых дозах возникновение побочных реакций маловероятно. В редких случаях — аллергические реакции; незначительная диарея; очень редко — периферический сосудистый тромбоз.
Применение. Взрослым и детям внутрь 2 раза в сутки за 40 мин до еды. Детям в возрасте до 2 лет можно принимать препарат непосредственно перед кормлением по ½ капсуле/пакетику (раскрыв и растворив капсулу/содержимое пакетика в воде или молоке), старше 2 лет и взрослым — по 1 капсулы/пакетика; взрослым — 1–2 капсулы/пакетика. Противопоказания. Гиперчувствительность к лактозе или другим компонентам препарата. Побочные эффекты. При медицинском применении препарата ЛАКТОВИТ ФОРТЕ в рекомендуемых дозах возникновение побочных реакций маловероятно. В редких случаях — аллергические реакции; незначительная диарея; очень редко — периферический сосудистый тромбоз.
Р.с. МЗ Украины № UA/0160/01/01 от 12.12.2008 г. до 12.12.2013 г. (капсулы), № UA/0160/02/01 от 24.09.2008 г. до 24.09.2013 г. (порошок).
Представительство «Мили Хелскере» в Украине: 01032, Киев, бульв. Тараса Шевченко, 33Б, 5-й этаж; тел./факс: +38 (044) 498-13-34, 498-13-35.
Пресс-служба «Еженедельника АПТЕКА»
Лактовіт ФортеВосстановление метаболической активности кишечной микробиоты у больных бронхиальной астмой
На этой странице Оценены возможности коррекции содержания и профиля короткоцепочечных жирных кислот (КЦЖК) в кале больных бронхиальной астмой. Фон . Установлено, что высокое биологическое разнообразие кишечных микроорганизмов способствует выработке необходимых SCFAs, которые индуцируют иммунорегуляторные пути и способствуют противовоспалительному ответу. Исследование . В нашем исследовании обследована группа из 30 больных аллергической бронхиальной астмой (БА). Все пациенты были проверены на наличие SIBO путем определения спектра SCFAs. Для лечения СИБР 10 больным исследуемой группы назначали рифаксимин в дозе 200 мг 3 раза в день в течение недели; остальным 10 пациентам был назначен рифаксимин в той же дозе с последующим приемом пробиотика «Лактобаланс» в капсулах 3 раза в день в течение месяца. Остальным 10 больным без СИБР в составе комплексной терапии БА был назначен месячный курс пробиотиков. Всем больным сразу после 1-месячного курса пробиотической терапии были проведены исследования КЦЖК. Результаты . Отмечена нормализация спектра КЖК и анаэробного индекса у всех обследованных больных. На фоне приема пробиотиков у больных без СИБР выявлено увеличение общего содержания жирных кислот (), уксусной и масляной кислот ().
Фон . Установлено, что высокое биологическое разнообразие кишечных микроорганизмов способствует выработке необходимых SCFAs, которые индуцируют иммунорегуляторные пути и способствуют противовоспалительному ответу. Исследование . В нашем исследовании обследована группа из 30 больных аллергической бронхиальной астмой (БА). Все пациенты были проверены на наличие SIBO путем определения спектра SCFAs. Для лечения СИБР 10 больным исследуемой группы назначали рифаксимин в дозе 200 мг 3 раза в день в течение недели; остальным 10 пациентам был назначен рифаксимин в той же дозе с последующим приемом пробиотика «Лактобаланс» в капсулах 3 раза в день в течение месяца. Остальным 10 больным без СИБР в составе комплексной терапии БА был назначен месячный курс пробиотиков. Всем больным сразу после 1-месячного курса пробиотической терапии были проведены исследования КЦЖК. Результаты . Отмечена нормализация спектра КЖК и анаэробного индекса у всех обследованных больных. На фоне приема пробиотиков у больных без СИБР выявлено увеличение общего содержания жирных кислот (), уксусной и масляной кислот (). Курс рифаксимина с последующим введением пробиотиков приводил к снижению относительного количества изокислот и соотношения изокислоты/кислоты у исследуемых больных по сравнению с больными, получавшими рифаксимин только для лечения СИБР (). Заключение . Полученные результаты демонстрируют потенциальную возможность влияния препарата на состав и количество активных бактериальных метаболитов в кишечном биотопе; что подтверждается восстановлением кишечного микробиоценоза и среды обитания микроорганизмов.
Курс рифаксимина с последующим введением пробиотиков приводил к снижению относительного количества изокислот и соотношения изокислоты/кислоты у исследуемых больных по сравнению с больными, получавшими рифаксимин только для лечения СИБР (). Заключение . Полученные результаты демонстрируют потенциальную возможность влияния препарата на состав и количество активных бактериальных метаболитов в кишечном биотопе; что подтверждается восстановлением кишечного микробиоценоза и среды обитания микроорганизмов.
1. Введение
Желудочно-кишечный тракт содержит большую, сложную и динамичную популяцию микроорганизмов, оказывающих заметное влияние на здоровье человека [1–4]. Взаимоотношения кишечной микробиоты и продуктов ее метаболизма с организмом хозяина играют ключевую роль в созревании иммунной системы, пищеварении, детоксикации, выработке витаминов, предотвращении адгезии патогенных бактерий и т. д. [2, 5–7].
Короткоцепочечные жирные кислоты (КЦЖК) имеют наибольшее функциональное значение во всем спектре бактериальных метаболитов (газы, окси- и дикарбоновые кислоты, биогенные амины, аминокислоты и др. ) [7–9]. В монокарбоновой кислоте SCFA могут содержать от одного до шести атомов углерода. Эти кислоты (уксусная, пропионовая и масляная) образуются из сахаролитической микрофлоры за счет бактериальной ферментации неперевариваемых волокон в толстой кишке [7, 8].
) [7–9]. В монокарбоновой кислоте SCFA могут содержать от одного до шести атомов углерода. Эти кислоты (уксусная, пропионовая и масляная) образуются из сахаролитической микрофлоры за счет бактериальной ферментации неперевариваемых волокон в толстой кишке [7, 8].
Изменение состава кишечной микробиоты и/или низкое биологическое разнообразие микроорганизмов ассоциировалось со снижением образования КЦЖК. В свою очередь, это привело к поляризации иммунного ответа в сторону Т-хелперов 2 типа и формированию провоспалительных реакций, что было показано в экспериментальных и клинических исследованиях [5, 8–13].
Молекулярные механизмы, которые помогают SCFAs снижать иммунные реакции, опосредованные Th-2, постоянно совершенствуются. Установлена также возможность влияния КЦЖК на активность ядерного фактора транскрипции, фактора некроза опухоли-альфа и взаимодействие с рецепторами распознавания антигенов, рецепторами G-белков полиморфноядерных нейтрофилов и др. [3, 8, 9].
Количество и соотношение КЦЖК могут отражать не только состав кишечного биотопа, но и функциональную активность присутствующих представителей бактерий [8, 9, 12, 13].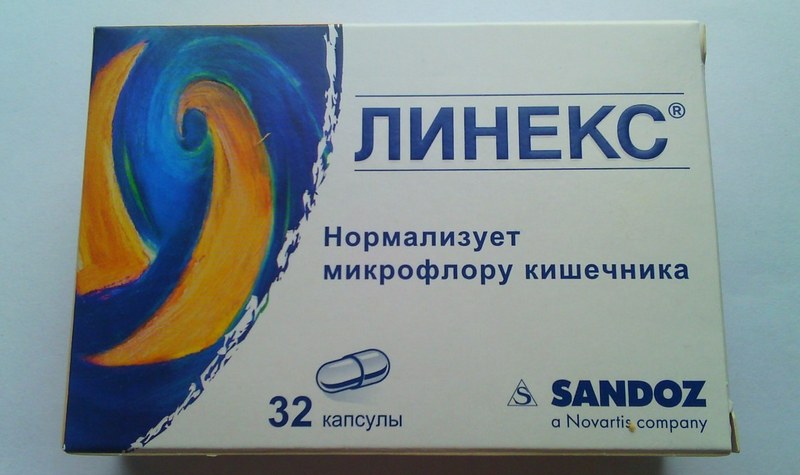
Целью исследования явилось изучение возможности коррекции содержания и профиля короткоцепочечных жирных кислот (КЦЖК) в кале больных аллергической бронхиальной астмой.
2. Материалы и методы
2.1. Вопросы этики, участники и дизайн исследования
Это проспективное рандомизированное контролируемое исследование было одобрено Локальным этическим комитетом Первого МГМУ им. Сеченова, Российская Федерация (протокол № 05-18) 16 мая 2018 г. и было проведено в соответствии с Хельсинкской декларацией. Цель исследования была разъяснена потенциальным участникам, и от пациентов были получены подписанные согласия до их включения в исследование.
В период с июня 2018 г. по октябрь 2018 г. было включено 30 пациентов с обострением аллергической бронхиальной астмы (16 женщин и 14 мужчин) со средним возрастом лет и длительностью анамнеза лет (рис. 1). Все больные находились на лечении в Клинике пропедевтики внутренних болезней Василенко. Критерии включения: персистирующая-средняя степень тяжести бронхиальной астмы на фоне приема комбинированных препаратов, содержащих бета-2-адреномиметики длительного действия и ингаляционные глюкокортикоиды (стандарт базисной терапии бронхиальной астмы). Критериями исключения являлись прием антибактериальных препаратов в течение предшествующих 3 мес, а также любые пробиотики и пребиотики, ингибиторы протонной помпы и сахароснижающие препараты в исследовании. Всем пациентам были проведены общепринятые клинико-лабораторные исследования, в том числе анализы крови, мокроты, мочи и биохимические исследования крови. Перед исследованием у больных определяли уровень иммуноглобулинов (класса А, G и Е), С-реактивного белка, рентгенологическое исследование легких, функцию внешнего дыхания.
Критериями исключения являлись прием антибактериальных препаратов в течение предшествующих 3 мес, а также любые пробиотики и пребиотики, ингибиторы протонной помпы и сахароснижающие препараты в исследовании. Всем пациентам были проведены общепринятые клинико-лабораторные исследования, в том числе анализы крови, мокроты, мочи и биохимические исследования крови. Перед исследованием у больных определяли уровень иммуноглобулинов (класса А, G и Е), С-реактивного белка, рентгенологическое исследование легких, функцию внешнего дыхания.
Все пациенты дополнительно обследованы с помощью водородного дыхательного теста с лактулозой на наличие синдрома интенсивного избыточного бактериального роста (СИБР) в тонкой кишке. По полученным результатам теста 20 пациентов с положительным тестом на СИБР были случайным образом разделены на 2 группы (по 10 человек в каждой). Процесс рандомизации осуществлялся с использованием компьютерной таблицы рандомизации. Остальные 10 пациентов с отрицательным тестом на SIBO были отнесены к третьей группе.
Первую группу составили 10 больных с положительным тестом на SIBO (SIBO(+)) и им назначали рифаксимин в дозе 200 мг 3 раза в день в течение недели на фоне стандартного лечения БА. Вторую группу составили 10 пациентов с положительным тестом на СИБР (СИБР (+)), но они принимали рифаксимин в дозе 200 мг 3 раза в день в течение недели вместе с назначением пробиотика Лактобаланс. Пробиотик «Лактобаланс» был назначен в капсулах для приема 3 раза в день в течение месяца, где каждая капсула содержала три миллиарда пробиотических микроорганизмов (не менее 1 капсулы): их было 9.0007 Lactobacillus gassery KS-13, Lactobacillus gasser LAC-343, Lactobacillus ramnosus LCS-742, Bifidobacterium bifidum G9-1, Bifidobacterium longum MM-236, Bifidobacterium longum MM-236 M, Bifidobacterium infantis M-63, Bifidobacterium breve M16V тип T, и Bifidobacterium lactis B1-04 в капсуле. Третью группу составили 10 больных аллергической астмой без выявленного СИБР (СИБР(-)) и они принимали пробиотик Лактобаланс, так как он входил в стандартную терапию лечения БА в группе. В контрольную группу вошли 17 здоровых добровольцев (средний возраст лет, с 9самки и 8 самцов). Все исследуемые группы были сопоставимы между собой по возрасту () и полу (). Группы пациентов были сопоставимы по анамнезу () и тяжести заболевания ().
В контрольную группу вошли 17 здоровых добровольцев (средний возраст лет, с 9самки и 8 самцов). Все исследуемые группы были сопоставимы между собой по возрасту () и полу (). Группы пациентов были сопоставимы по анамнезу () и тяжести заболевания ().
Исследование КЦЖК проводили в течение месяца после начала лечения (т.е. по окончании приема пробиотиков).
2.2. Диагностика
Для диагностики синдрома интенсивного избыточного бактериального роста (СИБР) в тонкой кишке проведен водородный дыхательный тест с лактулозой Gastrolyzer (Bedfont Scientific Ltd).
Спектр КЦЖК определяли методом газожидкостной хроматографии. Исследование проводили на газовом хроматографе «Хромос GH-1000» с пламенно-ионизационным детектором. Абсолютное и относительное содержание уксусной (С 2 ), пропионовой (С 3 ) и масляной (С 4 ) кислот, уровень изокислот и отношение изокислот к кислотам (isoCn/Cn) а также значения анаэробного индекса () [14].
2.
 3. Статистический анализ
3. Статистический анализСтатистический анализ результатов проводили с помощью программы Statistica 10 (StatSoft Inc., США).
3. Результаты исследования
На первом этапе исследования изучали уровень и спектр КЦЖК в фекалиях больных аллергической и неаллергической БА и группы здоровых добровольцев. Результаты этого исследования опубликованы в Журнале Клиники и Практики 2019, № 9. Достоверное снижение общего содержания КЦЖК (), а также абсолютных концентраций уксусной, пропионовой и масляной кислот () у больных БА (независимо от фенотипа заболевания). Выявлен измененный спектр КЦЖК: анаэробный метаболизм микрофлоры определялся у 84% больных, аэробный метаболизм микрофлоры определялся у 16% обследованных больных. Значения анаэробного индекса варьировали в соответствии с метаболическим профилем КЦЖК. Зафиксирован резкий сдвиг показателя в сторону отрицательных значений для анаэробного типа () и в зону противоположных значений для аэробного типа [10].
Получив результаты первого этапа нашего исследования, мы предприняли попытку скорректировать состав кишечной микробиоты в группе больных аллергической бронхиальной астмой.
По результатам исследования установлено, что назначение терапии для лечения СИБР способствовало снижению количества изокислот, а уровень пропионовой кислоты у больных, получавших длительную терапию (антибиотик+пробиотик). Уровень остальных КЦЖК, как и общее содержание их, после лечения в этих группах не изменился (табл. 1).
У больных 3-й группы (СИБР (-)), которым не требовалось назначение антибактериального препарата, выявлено достоверное повышение общего содержания КЦЖК, уксусной и масляной кислот. Также отмечено снижение количества изокислот (табл. 2).
В ходе исследования мы определяли спектр КЦЖК. После проведения направленной терапии, корректирующей микробиоту кишечного биотопа, соотношение КЦЖК и уксусной : пропионовой : масляной было неотличимо у всех обследуемых больных от контрольной группы (табл. 3, рис. 2). Такие результаты были получены для контрольной группы на первом этапе нашего исследования (опубликовано в «Клинике и практике» 2019 г.)., № 9).
В группе больных, принимавших рифаксимин + лактобаланс, относительное содержание изокислот и соотношение изокислоты/кислоты достоверно снижались по сравнению с контрольной группой () и группой больных, принимавших только рифаксимин (). Снижение этих показателей также было выявлено у больных, принимавших только Лактобаланс, что также подтверждалось улучшением преэпителиального и эпителиального уровней кишечника в ответ на пробиотическую терапию. Применяемое лечение также способствовало нормализации значений анаэробного индекса во всех исследуемых группах () (рис. 3).
4. Обсуждение
Комменсальная микробиота постоянно взаимодействует с иммунной системой, обучая иммунные клетки реагировать на антигены [1, 2, 7]. Макрофаги, нейтрофилы и дендритные клетки, а также другие типы клеток, включая эпителиальные, находятся в тесном контакте с микробиотой, активируя тем самым мембраны и внутриклеточные белки, распознающие антигены [3, 7, 9].
Установлено, что высокое биологическое разнообразие кишечных микроорганизмов способствует выработке необходимых SCFAs, которые индуцируют иммунорегуляторные пути и способствуют противовоспалительному ответу [6–9]. Напротив, низкое биологическое разнообразие кишечных микроорганизмов связано со снижением продукции КЦЖК, что приводит к поляризации иммунного ответа и сдвигу его в сторону Т-хелперов 2 типа [1, 4, 6–9, 12].
Напротив, низкое биологическое разнообразие кишечных микроорганизмов связано со снижением продукции КЦЖК, что приводит к поляризации иммунного ответа и сдвигу его в сторону Т-хелперов 2 типа [1, 4, 6–9, 12].
Как отмечалось ранее, изменение КЦЖК свидетельствует о нарушениях микробиоценоза кишечного биотопа у больных БА [8, 9, 11]. Это может быть одной из причин развития заболевания и, возможно, из-за изменения экскреции СО2 и Н3 в результате нарушений вентиляции и перфузии легких приводит к смещению окислительно-восстановительного потенциала внутрипросветной кишечной среды. у больных БА [11]. Наличие СИБР в тонкой кишке у большинства исследованных больных аллергической БА (по нашим данным — 63%) свидетельствует о более выраженных нарушениях микробного сообщества и может рассматриваться как фактор, отягощающий течение БА [10, 11].
Результатом представленного исследования являются выявленные изменения синтеза КЦЖК при лечении БА с СИБР по двум схемам (антибиотик и антибиотик + пробиотик), а также на фоне назначения пробиотического препарата больным без СИБО.
Прием пробиотика Лактобаланс после курса рифаксимина приводил к снижению относительного количества изокислот и соотношения изокислоты/кислоты по сравнению с больными, получавшими рифаксимин только для лечения СИБР (). Аналогичные изменения () были получены и у больных, принимавших пробиотический препарат в составе комплексной терапии БА. Полученные результаты отражают положительное влияние пробиотических культур на состояние слизистой оболочки кишечника и свидетельствуют о восстановлении преэпителиального и эпителиального слоев в целом, а также нормализации состава микробиоты с протеолитической активностью [4, 5, 8, 9].
Изменения содержания КЦЖК в кале через месяц лечения SIBO не выявлено. На наш взгляд, это связано именно с наличием СИБР в тонкой кишке, что отражает значительную дестабилизацию микробного сообщества кишечного биотопа. Применение антибактериальных препаратов у этих больных, с одной стороны, приводило к избирательной контаминации тонкой кишки, что в конечном итоге способствовало нормализации профиля КЦЖК. С другой стороны, увеличить образование КЦЖК в бактериях в указанный интервал времени не удалось.
С другой стороны, увеличить образование КЦЖК в бактериях в указанный интервал времени не удалось.
У больных 3-й группы, получавших пробиотик в составе комплексной терапии БА, за короткий срок наблюдения выявлено достоверное повышение общего содержания КЖК (), уксусной и масляной кислот (), что свидетельствовало о положительное влияние пробиотического препарата Лактобаланс на активацию эндогенной флоры и нормализацию ее метаболической активности.
У всех пациентов после лечения, направленного на изменение состава кишечной микробиоты, спектр КЦЖК и значения анаэробного индекса были аналогичны последующим значениям для контрольной группы ().
Таким образом, полученные нами результаты демонстрируют потенциальную возможность воздействия препарата на состав и количество активных бактериальных метаболитов в кишечном биотопе. Представленные результаты свидетельствуют о необходимости дальнейшего изучения изменений кишечной микробиоты при заболевании БА. Очевидно, что для достижения референтных значений количества КЦЖК потребуется более длительный период пробиотической терапии. Пока мы не можем ответить на следующие вопросы: изменится ли количество и спектр КЦЖК, если больным БА и СИБР назначать только пробиотический препарат? Влияет ли коррекция микрофлоры на течение астмы? Это будет оценено в результате дальнейшего наблюдения за этими пациентами.
Пока мы не можем ответить на следующие вопросы: изменится ли количество и спектр КЦЖК, если больным БА и СИБР назначать только пробиотический препарат? Влияет ли коррекция микрофлоры на течение астмы? Это будет оценено в результате дальнейшего наблюдения за этими пациентами.
Доступность данных
Данные, использованные для подтверждения результатов данного исследования, представлены в диссертации, с которой вы можете ознакомиться по ссылке https://www.dissercat.com/content/mikrobiota-kishechnika-i-dykhatelnykh-putei -как-патогенетическое-звено-бронхиально-астмы.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Все авторы внесли вклад в разработку концепции, обзор литературы и анализ данной статьи; Рукопись написали Нино Поцхерашвили, Натия Джахая, Константин Ивашкин, Анастасия Курбатова, Кира Крючкова и Виктория Заборова; Оксана Зольникова, Владимир Ивашкин и Мариуш Озимек критически просмотрели и отредактировали рукопись; все авторы одобрили окончательный вариант.
Ссылки
Д. Эртюрк-Хасдемир и Д. Л. Каспер, «Резидентные комменсалы, формирующие иммунитет», Current Opinion in Immunology , vol. 25, нет. 4, стр. 450–455, 2013 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Б. П. Ганеш и Дж. Версалович, «Конверсия просвета и иммунорегуляция с помощью пробиотиков», Frontiers in Pharmacology , vol. 6, статья 269, 2015.
Посмотреть по адресу:
Сайт издателя | Академия Google
B. S. Berthon, L. K. Macdonald-Wicks, P. G. Gibson и L. G. Wood, «Исследование связи между потреблением пищи, тяжестью заболевания и воспалением дыхательных путей при астме», Respirology , vol. 18, нет. 3, стр. 447–454, 2013 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A.
 Trompette, E. S. Gollwitzer, K. Yadava et al., «Кишечная микробиота, метаболизм пищевых волокон влияет на аллергические заболевания дыхательных путей и гемопоэз», Природная медицина , том. 20, нет. 2, стр. 159–166, 2014.
Trompette, E. S. Gollwitzer, K. Yadava et al., «Кишечная микробиота, метаболизм пищевых волокон влияет на аллергические заболевания дыхательных путей и гемопоэз», Природная медицина , том. 20, нет. 2, стр. 159–166, 2014.Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Герритсен, Х. Смидт, Г. Т. Рийкерс и В. М. де Вос, «Кишечная микробиота в здоровье и болезнях человека: влияние пробиотиков», Genes & Nutrition , vol. 6, нет. 3, стр. 209–240, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. М. Феррейра, А. Т. Виейра, М. А. Виноло, Ф. А. Оливейра, Р. Кури и Ф. С. Мартинс, «Центральная роль микробиоты кишечника при хронических воспалительных заболеваниях», Journal of Immunology Research , vol. 2014 г., идентификатор статьи 689492, 12 страниц, 2014 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Л. Г. Вуд, Н. Шиваппа, Б. С. Бертон, П. Г. Гибсон и Дж. Р. Хеберт, «Диетический воспалительный индекс связан с риском астмы, функцией легких и системным воспалением при астме», Clinical and Experimental Allergy , vol. . 45, нет. 1, стр. 177–183, 2015.
Посмотреть по адресу:
Google Scholar
Б. Серда, М. Перес, Х. Д. Перес-Сантьяго, Х. Ф. Торнеро-Агилера, Р. Гонсалес-Солтеро и М. Ларроса, «Модификация микробиоты кишечника: еще одна часть головоломки о пользе физических упражнений для здоровья». ?» Границы физиологии , том. 7, статья 51, 2016.
Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Sun, W. Wu, Z. Liu и Y. Cong, «Короткоцепочечные жирные кислоты метаболитов микробиоты, GPCR и воспалительные заболевания кишечника», Журнал гастроэнтерологии , том.
 52, нет. 1, стр. 1–8, 2017 г.
52, нет. 1, стр. 1–8, 2017 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Ивашкин В., Зольникова О., Поцхерашвили Н. и др., «Метаболическая активность кишечной микрофлоры у больных бронхиальной астмой», Clinics and Practice , vol. 9, нет. 1, с. 1126, 2019.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Ивашкин В., Зольникова О., Поцхерашвили Н., Трухманов А., Кокина Н., Джахая Н. Коррекция состава микрофлоры кишечника для комплексной терапии аллергической бронхиальной астмы, Итальянский медицинский журнал. , том. 12, нет. 4, стр. 260–264, 2018.
Посмотреть по адресу:
Сайт издателя | Google Scholar
F. Frati, C. Salvatori, C. Incorvaia et al., «Роль микробиома при астме: кишечник — ось легких», International Journal of Molecular Sciences , vol.
 20, нет. 1, 2018.
20, нет. 1, 2018.Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Kim, Y. Qie, J. Park и C. H. Kim, «Микробные метаболиты кишечника подпитывают реакцию антител хозяина», Cell Host & Microbe , vol. 20, нет. 2, стр. 202–214, 2016 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Ардатская М.Д., Иконников Н.С., Минушкин О.Н. Способ разделения смеси жирных кислот фракции с2-с6 методом газожидкостной хроматографии, 2002, Патент Российской Федерации RU2002119447/15A.
Посмотреть по адресу:
Google Scholar
Copyright
Copyright © 2022 Mariusz Ozimek et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.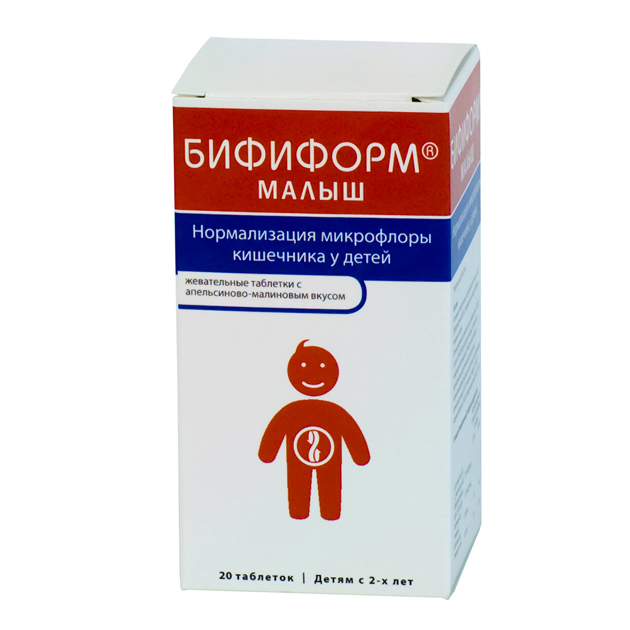
Лаборатория гомеостаза кишечника | РИКЕН
Руководитель группы: Кения Хонда (доктор медицины, доктор философии)
- Страница на японском языке
Резюме исследований
Пищеварительный тракт млекопитающих содержит около тысячи видов комменсальных микроорганизмов, которые гомеостатически взаимодействуют с хозяином. Наша команда сосредоточена на иммунологических характеристиках микробиоты и пытается определить ответственных членов микробиоты и производных от них факторов, которые глубоко влияют на иммунную систему. Наша долгосрочная цель — разработать способ манипулирования и нормализации состава микробиоты кишечника для лечения различных болезненных состояний, таких как воспалительное заболевание кишечника (ВЗК), аутоиммунитет, аллергия и рак.
Основные направления исследований
- Медицина, стоматология и фармация
- Биологические науки
- Биология
Ключевые слова
- Микрофлора кишечника
- Микробиота
- Иммунитет слизистых оболочек
Избранные публикации
Статьи, отмеченные звездочкой (*), основаны на исследованиях, проведенных вне RIKEN.
- 1. Тайсс К.А., Леви М., Корем Т., Дохналова Л., Шапиро Х., Джайтин Д.А., Дэвид Э., Винтер Д.Р., Гури-БенАри М., Татировский Э., Туганбаев Т., Федеричи С., Змора Н., Зееви Д., Дори -Бачаш М., Певзнер-Фишер М., Картвелишвили Э., Брандис А., Хармелин А., Шиболет О., Халперн З., Хонда К., Амит И., Сегал Э., Элинав Э.:
«Программы дневной ритмичности микробиоты, принимающие транскриптомные колебания».
Cell, 167(6):1495-1510 (2016). - 2.Мэтьюсон Н.Д., Дженк Р., Мэтью А.В., Кенигскнехт М., Ханаш А., Тубай Т., Оравец-Уилсон К., Ву С.Р., Сунь Й., Росси С., Фудзивара Х., Бьюн Дж., Шоно Й., Линдеманс С., Калафиоре М., Schmidt TC, Honda K, Young VB, Pennathur S, van den Brink M, Reddy P:
«Метаболиты кишечного микробиома модулируют повреждение эпителиальных клеток кишечника и смягчают реакцию «трансплантат против хозяина». 903:00 Нац. Иммунол. 17(5):505 (2016). - 3.Honda K, Littman DR:
«Микробиота в адаптивном иммунном гомеостазе и заболеваниях».
Природа, 535:75-84 (2016). - 4.Ramanan D, Bowcutt R, Lee SC, Tang MS, Kurtz ZD, Ding Y, Honda K, Gause WC, Blaser MJ, Bonneau RA, Lim YA, Loke P, Cadwell K:
«Гельминтная инфекция способствует резистентности к колонизации через иммунитет 2 типа».
Наука, 352(6285):608-612 (2016). - 5. Таноуэ Т., Атараши К., Хонда К.:
«Развитие и поддержание кишечных регуляторных Т-клеток».
Нац. Rev. Immunol., 16(5):295-309 (2016). - 6. Атараши К., Таноуэ Т., Андо М., Камада Н., Нагано Й., Нарушима С., Суда В., Имаока А., Сетояма Х., Нагамори Т., Исикава Э., Сима Т., Хара Т., Кадо С., Джиннохара Т., Оно Х. , Кондо Т., Тойока К., Ватанабэ Э., Ёкояма С., Токоро С., Мори Х., Ногучи Ю., Морита Х., Иванов И.И., Сугияма Т., Нуньес Г., Кэмп Дж.Г., Хаттори М., Умесаки Ю., Хонда К.:
«Th27 Cell Индукция адгезией микробов к эпителиальным клеткам кишечника».
Cell, 163:367-380 (2015). - 7. Атараши К., Таноуэ Т., Осима К., Суда В.
 , Нагано Ю., Нисикава Х., Фукуда С., Сайто Т., Нарушима С., Хасэ К., Ким С., Фриц Дж. В., Уилмес П., Уэха С., Мацусима К., Оно Х. , Олле Б., Сакагучи С., Танигучи Т., Морита Х., Хаттори М., Хонда К.:
, Нагано Ю., Нисикава Х., Фукуда С., Сайто Т., Нарушима С., Хасэ К., Ким С., Фриц Дж. В., Уилмес П., Уэха С., Мацусима К., Оно Х. , Олле Б., Сакагучи С., Танигучи Т., Морита Х., Хаттори М., Хонда К.:
«Индукция Treg рационально подобранной смесью штаммов клостридий из микробиоты человека».
Природа, 500:232-236 (2013). - 8.Honda K, Littman DR:
«Микробиом при инфекционных заболеваниях и воспалении».
Annu Rev Immunol., 30:759-95 (2012). - 9.* Атараши К., Таноуэ Т., Шима Т., Имаока А., Кувахара Т., Момосе Й., Ченг Г., Ямасаки С., Сайто Т., Оба Й., Танигути Т., Такеда К., Хори С., Иванов ИИ., Умесаки Й., Ито K, Honda K:
«Индукция регуляторных Т-клеток толстой кишки местными видами Clostridium».
Наука, 331:337-41 (2011). - 10.*Иванов И.И., Атараши К., Манель Н., Броди Э.Л., Шима Т., Караоз У., Вэй Д., Гольдфарб К.С., Санти К.А., Линч С.В., Таноуэ Т., Имаока А., Ито К., Такеда К., Умесаки Ю., Хонда К, Литтман ЗП:
«Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями».
Cell, 139:485-98 (2009).
Последние результаты исследований
23 января 2023 г.
Кишечный микроб расщепляет пищеварительный фермент трипсин в толстой кишке19 февраля 2016 г.
Хорошие соседи — хорошая защита27 сентября 2013 г.
Кишечные бактерии демонстрируют «общинный дух»
События
- Клеточные симпозиумы, иммунология нового поколения
Ссылки по теме
Члены лаборатории
Главный исследователь
- Кения Хонда
- Руководитель группы
Основные элементы
- Казутака Мурата
- Научный сотрудник
- Такаши Оя
- Научный сотрудник
- Хидеки Терадзима
- Специальный научный сотрудник с докторской степенью
- Саёко Саэгуса
- Технический персонал II
- Михо Такекава
- Технический персонал II
Контактная информация
4F, North Research Building
1-7-22 Suehiro-cho, Tsurumi-ku,
Yokohama City, Kanagawa,
230-0045, Япония
Тел.
