Как нормализовать микрофлору кишечника. Какие симптомы указывают на дисбактериоз. Чем опасно нарушение микробиома. Какие препараты помогают восстановить баланс микрофлоры. Как питание влияет на здоровье кишечника.
Что такое микрофлора кишечника и почему она важна
Микрофлора кишечника — это сообщество микроорганизмов, населяющих желудочно-кишечный тракт человека. Она включает в себя сотни видов бактерий, грибов и других микроорганизмов, общим числом около 100 триллионов клеток. Нормальная микрофлора играет важнейшую роль в поддержании здоровья человека:
- Участвует в пищеварении и усвоении питательных веществ
- Синтезирует витамины группы B и K
- Поддерживает иммунитет
- Защищает от патогенных микроорганизмов
- Участвует в регуляции обмена веществ
- Влияет на работу нервной системы
Нарушение баланса микрофлоры, называемое дисбактериозом, может приводить к различным проблемам со здоровьем. Поэтому так важно поддерживать нормальный состав кишечной микробиоты.

Причины нарушения микрофлоры кишечника
Существует множество факторов, способных негативно повлиять на состав кишечной микрофлоры:
- Прием антибиотиков
- Неправильное питание
- Стрессы
- Инфекционные заболевания ЖКТ
- Злоупотребление алкоголем
- Гормональные нарушения
- Возрастные изменения
- Экологические факторы
- Курение
- Недостаток сна
Даже кратковременное воздействие этих факторов может нарушить хрупкий баланс микрофлоры. Особенно опасно длительное и комбинированное влияние нескольких причин.
Симптомы нарушения микрофлоры кишечника
- Нарушения стула (запоры, поносы)
- Вздутие живота, метеоризм
- Боли и дискомфорт в животе
- Снижение аппетита
- Тошнота, отрыжка
- Слабость, утомляемость
- Кожные высыпания, аллергические реакции
- Частые простудные заболевания
При появлении этих симптомов стоит обратиться к врачу для диагностики и лечения дисбактериоза. Своевременная коррекция микрофлоры поможет избежать более серьезных проблем со здоровьем.
Методы диагностики нарушений микрофлоры
Для выявления дисбактериоза применяются следующие методы:

- Копрологическое исследование кала
- Бактериологический посев кала
- Анализ кала на дисбактериоз
- Водородный дыхательный тест
- Анализ крови на антитела к условно-патогенной микрофлоре
- ПЦР-диагностика состава микрофлоры
Наиболее информативным является комплексное обследование, включающее несколько методов. Это позволяет получить полную картину состояния микрофлоры.
Как восстановить микрофлору кишечника
Существует несколько основных подходов к нормализации кишечной микрофлоры:
1. Диетотерапия
Правильное питание — основа здоровой микрофлоры. Рекомендуется:
- Употреблять больше клетчатки (овощи, фрукты, цельнозерновые продукты)
- Есть ферментированные продукты (йогурт, кефир, квашеная капуста)
- Ограничить сахар и рафинированные углеводы
- Включить в рацион пребиотики (лук, чеснок, бананы, спаржа)
2. Пробиотики
Препараты, содержащие живые полезные бактерии. Наиболее изученные штаммы:
- Lactobacillus acidophilus
- Bifidobacterium bifidum
- Lactobacillus rhamnosus
- Saccharomyces boulardii
3. Пребиотики
Вещества, стимулирующие рост полезных бактерий. К ним относятся:

- Инулин
- Фруктоолигосахариды
- Галактоолигосахариды
- Лактулоза
4. Синбиотики
Комбинированные препараты, содержащие и про-, и пребиотики. Обладают усиленным действием.
5. Энтеросорбенты
Помогают очистить кишечник от токсинов и создать благоприятные условия для роста полезной микрофлоры.
Препараты для восстановления микрофлоры
На фармацевтическом рынке представлено множество средств для нормализации кишечной микробиоты. Наиболее популярные:
- Линекс
- Бифиформ
- Энтерол
- Хилак форте
- Нормобакт
- Бактистатин
- Флорин форте
- Бифидумбактерин
Выбор конкретного препарата должен осуществляться врачом с учетом индивидуальных особенностей пациента и результатов обследования.
Народные средства для восстановления микрофлоры
В качестве дополнения к основной терапии можно использовать некоторые народные методы:
- Отвар ромашки
- Настой семян льна
- Прополис
- Чай с имбирем
- Квашеная капуста
- Морковный сок
Однако следует помнить, что народные средства не могут заменить полноценное лечение под наблюдением врача.

Профилактика нарушений микрофлоры
Чтобы избежать проблем с кишечной микробиотой, рекомендуется:
- Соблюдать правила здорового питания
- Избегать стрессов
- Ограничить употребление алкоголя
- Отказаться от курения
- Своевременно лечить заболевания ЖКТ
- Разумно подходить к приему антибиотиков
При необходимости приема антибиотиков следует одновременно принимать пробиотики для профилактики дисбактериоза.
Влияние микрофлоры на иммунитет
Кишечная микробиота играет важнейшую роль в формировании и поддержании иммунитета. Около 70% иммунных клеток сосредоточено именно в кишечнике. Нормальная микрофлора:
- Стимулирует созревание иммунных клеток
- Активирует выработку антител
- Повышает барьерную функцию слизистой кишечника
- Подавляет рост патогенных микроорганизмов
- Участвует в синтезе противовоспалительных веществ
Нарушение микробиома может приводить к снижению иммунитета и повышенной восприимчивости к инфекциям.
Связь микрофлоры и психического здоровья
В последние годы активно изучается влияние кишечной микробиоты на работу мозга и психическое состояние человека. Установлено, что микрофлора:

- Участвует в синтезе нейромедиаторов (серотонин, дофамин)
- Влияет на активность гипоталамо-гипофизарно-надпочечниковой оси
- Модулирует воспалительные процессы в нервной системе
- Воздействует на формирование поведенческих реакций
Нарушения микробиома могут быть связаны с развитием депрессии, тревожных расстройств, аутизма и других психических проблем.
Микрофлора и аллергические заболевания
Дисбаланс кишечной микробиоты может играть важную роль в развитии аллергических реакций. Это связано с несколькими механизмами:
- Нарушение барьерной функции кишечника
- Изменение иммунного ответа
- Снижение активности регуляторных T-клеток
- Усиление выработки провоспалительных цитокинов
Восстановление нормального состава микрофлоры может помочь в профилактике и лечении аллергических заболеваний.
Роль микробиома в метаболизме
- Усвоение питательных веществ
- Синтез витаминов
- Регуляцию аппетита
- Метаболизм желчных кислот
- Энергетический обмен
Нарушения микрофлоры могут приводить к ожирению, сахарному диабету 2 типа и другим метаболическим расстройствам.

Микробиота и воспалительные заболевания кишечника
Изменения состава кишечной микрофлоры играют важную роль в патогенезе воспалительных заболеваний кишечника (ВЗК), таких как болезнь Крона и язвенный колит. При ВЗК наблюдается:
- Снижение разнообразия микрофлоры
- Уменьшение количества полезных бактерий
- Увеличение числа патогенных микроорганизмов
- Нарушение взаимодействия микробиоты с иммунной системой
Коррекция микрофлоры может быть эффективным дополнением к стандартной терапии ВЗК.
Заключение
Микрофлора кишечника играет ключевую роль в поддержании здоровья человека. Нарушения микробиома могут приводить к широкому спектру заболеваний — от проблем с пищеварением до психических расстройств. Своевременная диагностика и коррекция дисбактериоза с помощью правильного питания, про- и пребиотиков позволяет избежать многих проблем со здоровьем. Регулярная забота о состоянии кишечной микробиоты должна стать важной частью здорового образа жизни каждого человека.
Как полноценно восстановить баланс микрофлоры кишечника?
Тема восстановления микрофлоры кишечника в последние годы особенно популярна, учитывая современный темп жизни. Вредная и жирная пища, неправильный питьевой режим, вредные привычки, плохая экология, сидячий образ жизни, бесконтрольный прием лекарств… Огромное количество факторов в прямом смысле убивают кишечную микрофлору. Именно поэтому все чаще звучит вопрос: «Как полноценно восстановить микрофлору кишечника за короткий срок?». Сегодня это стало возможным! В аптеках появилась новинка Мультифлора Макси с рекордным1 содержанием 55 млрд. КОЕ живых бактерий, для полноценного восстановления микрофлоры кишечника, производства компании «Эвалар».
Почему Мультифлора Макси Эвалар?
1. 55 млрд. КОЕ живых бактерий в 1 капсуле, тогда как в самом популярном пробиотике – 4,5 миллиардов КОЕ.
Чем выше показатель КОЕ в пробиотике, тем больше полезных бактерий достигнет кишечника и быстрее заселит его слизистую оболочку, повышая количественный и качественный состав микрофлоры. Таким образом, Мультифлора Макси – мультиштаммовый пробиотик, который содержит рекордное1 количество живых бактерий и способствует полноценному восстановлению микрофлоры кишечника.
2. Защита от кислой среды желудка
Считается, что пробиотикам сложно добраться до кишечника в неизменном виде через агрессивную кислотную среду желудка. Часть полезных бактерий просто погибает, не достигнув своей цели. Именно поэтому Мультифлора Макси состоит из кислотоустойчивых пробиотических организмов, которые помещены в кишечнорастворимую капсулу. Благодаря этому сохраняется пробиотическая активность и стабильность полезных бактерий.
3. Такие капсулы с защищенными полезными бактериями не требуют хранения в холодильнике.
4. Кроме того, Мультифлора Макси содержит пребиотик, который является пищей полезных бактерий и стимулирует их рост.
Мультифлора Макси с рекордным содержанием 55 млрд. КОЕ живых бактерий способствует:
- ускоренному восстановлению и дальнейшему росту нормальной микрофлоры кишечника;
- улучшению пищеварения и нормализации работы всего желудочно-кишечного тракта;
- укреплению иммунитета и защите от вирусных инфекций;
- улучшению состояния при синдроме раздраженного кишечника, кишечных инфекциях.
Мультифлора Макси Эвалар:
- подходит взрослым и детям со 2 недели жизни2
- имеет удобный прием – 1 капсула в день
- произведена в соответствии с международным стандартом качества GMP
- не содержит диоксид титана, ГМО, глютена и сахара
Мультифлора Макси – максимальная забота о микрофлоре кишечника. Почувствуй разницу!
Почувствуй разницу!
Препараты из статьи:
диета при нарушении микрофлоры, причины и симптомы
Перекусы на ходу, преобладание в рационе фаст фуда и не самых полезных снэков, алкоголь и хронические стрессы — вот основные причины нарушения качественного и количественного состава флоры кишечника. Опасно ли это? Весьма! Ведь
микрофлора кишечника — настоящий дирижер оркестра нашего организма.
Нарушения микрофлоры кишечника или дисбактериоз или дисбиоз – диагноз, который существует, казалось бы, только в нашей стране. Между тем, симптомы заболевания весьма очевидны, поэтому отрицать его нет смысла.
Роль кишечника в организме
По сути, она управляет всем:
- Здоровьем и внешним состоянием нашей кожи
- Состоятельностью пищеварения
- Качеством усвоения полезных нутриентов — витаминов и минералов
- Ну и, наконец, нашим иммунитетом или защитным потенциалом организма, который помогает противостоять бактериальным и вирусным инфекциям
Очень важно следить не только за здоровьем кишечника в целом, но и за составом его микробиоты. Своевременная корректировка этих показателей помогает улучшить пищеварение и усвоение полезных веществ, внешний вид кожи и защитные силы организма.
Своевременная корректировка этих показателей помогает улучшить пищеварение и усвоение полезных веществ, внешний вид кожи и защитные силы организма.
Что это такое дисбактериоз
Дисбактериоз представляет собой качественное и количественное нарушение микрофлоры.
Такие изменения чаще всего касаются кишечника и влекут за собой ряд симптомов:
- проблемы со стулом
- сыпь и раздражение на коже
- повышенную склонность к аллергии
- снижение иммунитета
При частых аллергических реакциях, высыпаниях на коже и раздражении рекомендуется сдать анализ кала на дисбактериоз с определением чувствительности к бактериофагам.
Обратите внимание! Коррекция качественного и количественного состава микрофлоры в комплексе с десенсибилизирующими средствами дает более выраженный лечебный эффект.
Нарушение микрофлоры кишечника у женщин
Такие проблемы возникают как у женщин, так и у мужчин. И протекают такие патологии одинаково. Дисбактериоз наблюдается в любом возрасте, патология может развиваться в том числе и у совсем маленьких детей.
И протекают такие патологии одинаково. Дисбактериоз наблюдается в любом возрасте, патология может развиваться в том числе и у совсем маленьких детей.
Чаще всего страдает микрофлора кишечника — вполне понятно. Почему? Читайте дальше!
Причины нарушения микрофлоры кишечника
Причины проблем с микрофлорой весьма разнообразны, состав нашей флоры очень чувствителен к воздействию внешних раздражителей.
Поэтому он может изменяться в результате:
- Применения антибактериальных средств
- Нерационального питания, особенно строгих диет и резких ограничений
- Заболеваний кишечника, в том числе острых инфекций
- Острого и хронического стресса
- Частого употребления алкоголя и курения
- Нарушения гормонального фона
При использовании антибактериальных средств рекомендуется поддерживать кишечник с помощью пре- и пробиотиков, для профилактики формирования дисбактериоза. Наши специалисты на дистанционной консультации по телефону или по видеосвязи помогут составить план лечения и подобрать подходящие препараты.
Наши специалисты на дистанционной консультации по телефону или по видеосвязи помогут составить план лечения и подобрать подходящие препараты.
Как понять что микрофлора кишечника нарушена?
Каждого из нас заботит вопрос — какие отмечаются симптомы, если нарушена микрофлора кишечника. Отвечаем!
Как правило, в первую очередь обращает на себя внимание нарушение пищеварения и проблемы со стулом. Пациент жалуется на вздутие живота, понос или, напротив, запор, а также отрыжку, неприятные ощущения в животе.
Нарушения пищеварения, безусловно, самым негативным образом сказываются на усвоении питательных веществ, витаминов и минералов.
Помимо этого нарушение качественного и количественного состава полезной микробиоты приводит к высыпаниям на коже, а также значительно повышает склонность к аллергизации.
Обратите внимание! Изменение физиологического состава микрофлоры мешает формированию адекватного ответа иммунитета и снижает защитный потенциал организма, в результате чего человек страдает от частых ОРВИ и обострений хронических заболеваний.
Лечение дисбактериоза
Оценили симптомы дисбактериоза, нашли у себя ряд из них? Тогда очень важно сдать анализ кала на дисбактериоз с определением чувствительности к бактериофагам и/или антибактериальным средствам. Такое исследование поможет не только определить проблему, но и подобрать максимально эффективное лечение.
А теперь давайте разберемся, как наладить микрофлору кишечника у взрослого человека.
Итак, в терапии дисбактериоза назначается:
- Корректировка питания — рекомендованы овощи, ягоды и фрукты, которые содержат большое количество клетчатки. Она в свою очередь является натуральной «щеткой» для кишечника — очищает от токсинов и шлаков, стимулирует усвоение витаминов и минералов, нормализует перистальтику и профилактирует запор. Также рекомендованы кисломолочные продукты, которые способствуют росту и размножению полезной микробиоты кишечника.
-
Бактериофаги – они назначаются прицельно, исходя из результатов анализа кала.
 Такие препараты аккуратно корректируют флору и налаживают качественную работу кишечника.
Такие препараты аккуратно корректируют флору и налаживают качественную работу кишечника. - Пре- и пробиотики — средства, которые способствуют росту и развитию полезной микробиоты кишечника.
- Антибактериальные препараты — средства, к которым прибегают в тяжелых случаях, когда деликатные варианты препаратов (биактериофаги, пре- и пробиотики) не дают ожидаемого эффекта.
Не принимайте антибиотики без назначения врача! Самолечение — это не выход. Последствия от бесконтрольного приема антибиотиков могут вызвать самые разнообразные проблемы со здоровьем! Если вы почувствовали недомогание, то сразу же звоните нашим врачам. Они на связи с вами круглосуточно и точно знают, как помочь вам при любых проблемах с кишечником.
Как предупредить нарушение микрофлоры кишечника
Для того, чтобы снизить вероятность возникновения дисбиоза кишечника, рекомендуется:
-
Обеспечить себе правильное питание, богатое клетчаткой (овощи, фрукты и ягоды) – это позволяет нормализовать перистальтику кишечника и создать максимально благоприятные условия для формирования здоровой и полезной микробиоты кишечника.
- Использовать антибактериальные средства только под «прикрытием» пробиотиков — препаратов, которые содержат лакто- и бифидобактерии — интервал в использовании таких средств должен составлять не менее трех часов.
Частые вопросы
Какие будут симптомы, если нарушена микрофлора кишечника?
+
Обращает на себя внимание нарушение пищеварения и проблемы со стулом, причем может быть как понос, так и запор. Помимо этого может появляться сыпь на коже, склонность к аллергическим реакциям и снижение защитного потенциала организма (отсюда частые ОРВИ и обострения хронических заболеваний).
Что будет, если дисбиоз не лечить?
+
Как уже рассказывалось выше, качественный и количественный состав, а точнее соотношение полезных бактерий в кишечнике отвечает за огромное количество функций в организме. Поэтому, если дисбактериоз не корректировать, появляются прыщи и высыпания на коже, склонность к аллергическим реакциям, нарушения пищеварения и снижение иммунитета с частыми ОРВИ. Помимо этого появляется вздутие живота, которое с одной стороны не является истинным заболеванием, а с другой создает множество дискомфорта и проблем для человека.
Поэтому, если дисбактериоз не корректировать, появляются прыщи и высыпания на коже, склонность к аллергическим реакциям, нарушения пищеварения и снижение иммунитета с частыми ОРВИ. Помимо этого появляется вздутие живота, которое с одной стороны не является истинным заболеванием, а с другой создает множество дискомфорта и проблем для человека.
Как понять, что я справлюсь самостоятельно или что мне нужно обратиться за помощью к доктору?
+
Как правило, нормализовать микрофлору кишечника можно в домашних условиях. Для этого достаточно сдать анализ кала на дисбактериоз с определением чувствительности к бактериофагам. Исследование выявляет нарушения, а также фаги, которые могут их скорректировать. Помогает в этом доктор, самостоятельно составить правильную схему лечения практически невозможно.
Я все-таки хотела бы подлечить живот средствами народной медицины, какие наиболее актуальны в случае дисбактериоза?
+
– Восстановление микрофлоры кишечника народными средствами и альтернативной медициной в официальной медицине не используется. Полезно правильное питание (ограничить употребление быстрых углеводов, есть кисломолочные продукты, растительную клетчатку), вести здоровый образ жизни (соблюдение режима труда и отдыха, правильное реагирование на стрессы, физическая активность).
Полезно правильное питание (ограничить употребление быстрых углеводов, есть кисломолочные продукты, растительную клетчатку), вести здоровый образ жизни (соблюдение режима труда и отдыха, правильное реагирование на стрессы, физическая активность).
Чем восстановить микрофлору кишечника?
+
Баланс микрофлоры можно и нужно восстанавливать — это важно состояния и функционирования кишечника и для здоровья в целом. Потому врачи настоятельно рекомендуют сдавать анализы кала не просто так, а прицельно, определяя чувствительность к бактериофагам, а в тяжелых случаях и к антибиотикам. Это помогает подобрать максимально эффективные средства для коррекции ситуации.
Чем чревато нарушение микрофлоры кишечника у женщин?
+
На самом деле, тем же, что и у мужчин — то есть, в первую очередь «проблемам с животом». Основные жалобы — это вздутие, нарушение стула ( у некоторых запор, а у других, напротив, понос), ощущение тяжести после еды и увеличение нижней части живота. Также обращает на себя внимание значительное ухудшение качества кожи и склонность к аллергическим высыпаниям. Ну и, наконец, происходит нарушение главной — иммунной — функции. Организм становится беззащитным перед вирусными атаками, поэтому при нарушении качественного и/или количественного состава флоры женщина частенько болеет.
Основные жалобы — это вздутие, нарушение стула ( у некоторых запор, а у других, напротив, понос), ощущение тяжести после еды и увеличение нижней части живота. Также обращает на себя внимание значительное ухудшение качества кожи и склонность к аллергическим высыпаниям. Ну и, наконец, происходит нарушение главной — иммунной — функции. Организм становится беззащитным перед вирусными атаками, поэтому при нарушении качественного и/или количественного состава флоры женщина частенько болеет.
Публикуем только проверенную информацию
Автор статьи
Черепенько Людмила Викентьевна врач — терапевт • врач – кардиолог
Стаж 37 лет
Консультаций 9715
Статей 130
Специалист с большим опытом работы в области лечения и профилактики сердечно-сосудистых заболеваний, а также их последствий. Участвует, вступает на медицинских конференциях, семинарах, лекциях Байер.
Участвует, вступает на медицинских конференциях, семинарах, лекциях Байер.
Пробиотики нормализуют ось кишечник-мозг-микробиота у мышей с иммунодефицитом
1. Bailey MT. Содействующая роль кишечной микробиоты в вызванном стрессором повышении восприимчивости к кишечной инфекции и системной иммуномодуляции. Хорм Бихав 62: 286–294, 2012 [PubMed] [Google Scholar]
2. Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, Deng Y, Blennerhassett P, Macri J, McCoy KD, Verdu EF , Коллинз С.М. Кишечная микробиота влияет на центральные уровни нейротропного фактора головного мозга и поведение мышей. Гастроэнтерология 141: 599–609, 609.e1–3, 2011 [PubMed] [Google Scholar]
3. Bercik P, Park AJ, Sinclair D, Khoshdel A, Lu J, Huang X, Deng Y, Blennerhassett PA, Fahnestock M, Moine Д., Бергер Б., Хейзинга Дж. Д., Кунце В., Маклин П. Г., Бергонцелли Г. Э., Коллинз С. М., Верду Э. Ф. Анксиолитический эффект Bifidobacterium longum NCC3001 включает вагусные пути связи между кишечником и мозгом. Нейрогастроэнтерол Мотил
23: 1132–1139, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
Нейрогастроэнтерол Мотил
23: 1132–1139, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
4. Bonaz BL, Bernstein CN. Взаимодействие мозга и кишечника при воспалительных заболеваниях кишечника. Гастроэнтерология 144: 36–49, 2013 [PubMed] [Google Scholar]
5. Браво Дж. А., Форсайт П., Чу М. В., Эскаравэдж Э., Савиньяк Х. М., Динан Т. Г., Биненшток Дж., Крайан Дж. Ф. Прием внутрь штамма Lactobacillus регулирует эмоциональное поведение и экспрессию центрального рецептора ГАМК у мышей через блуждающий нерв. Proc Natl Acad Sci USA 108: 16050–16055, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
6. Брынских А., Уоррен Т., Чжу Дж., Кипнис Дж. Адаптивный иммунитет влияет на обучаемость у мышей. Мозг Поведение Иммунитет 22: 861–869, 2008 [PubMed] [Google Scholar]
7. Cameron HL, Perdue MH. Стресс нарушает барьерную функцию кишечника мышей: улучшение с помощью глюкагоноподобного пептида-2. J Pharmacol Exp Ther 314: 214–220, 2005 [PubMed] [Google Scholar]
8. Cao Y, Shen J, Ran ZH. Связь между сокращением и воспалительным заболеванием кишечника: метаанализ и систематический обзор литературы. Гастроэнтерол Рез Практ
2014: 872725, 2014 [бесплатная статья PMC] [PubMed] [Google Scholar]
Cao Y, Shen J, Ran ZH. Связь между сокращением и воспалительным заболеванием кишечника: метаанализ и систематический обзор литературы. Гастроэнтерол Рез Практ
2014: 872725, 2014 [бесплатная статья PMC] [PubMed] [Google Scholar]
9. Chen Y, Fenoglio KA, Dube CM, Grigoriadis DE, Baram TZ. Клеточные и молекулярные механизмы активации гиппокампа при остром стрессе зависят от возраста. Мол Психиатрия 11:992–1002, 2006 [бесплатная статья PMC] [PubMed] [Google Scholar]
10. Chow J, Lee SM, Shen Y, Khosravi A, Mazmanian SK. Хозяин-бактериальный симбиоз в норме и болезни. Ад Иммунол 107: 243–274, 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
11. Countryman RA, Kaban NL, Colombo PJ. Гиппокампальный c-fos необходим для долговременной памяти о предпочтениях в еде, передающихся в обществе. Нейробиол Узнать Мем 84: 175–183, 2005 [PubMed] [Google Scholar]
12. Cryan JF, Dinan TG. Микроорганизмы, изменяющие сознание: влияние микробиоты кишечника на мозг и поведение. Нат Рев Нейроски
13: 701–712, 2012 [PubMed] [Google Scholar]
Нат Рев Нейроски
13: 701–712, 2012 [PubMed] [Google Scholar]
13. De Kloet ER, Derijk R. Сигнальные пути в головном мозге, участвующие в предрасположенности и патогенезе заболеваний, связанных со стрессом: генетические и кинетические факторы, влияющие на баланс MR/GR. Энн NY Acad Sci 1032: 14–34, 2004 [PubMed] [Google Scholar]
14. De Palma G, Collins SM, Bercik P, Verdu EF. Ось микробиота-кишечник-мозг при желудочно-кишечных расстройствах: стрессовые микроорганизмы, стресс головного мозга или и то, и другое? Дж Физиол 2014 [бесплатная статья PMC] [PubMed] [Google Scholar]
15. Deltheil T, Guiard BP, Cerdan J, David DJ, Tanaka KF, Reperant C, Guilloux JP, Coudore F, Hen R, Gardier AM. Поведенческие и серотонинергические последствия снижения или повышения уровня белка нейротрофического фактора головного мозга гиппокампа у мышей. нейрофармакология 55: 1006–1014, 2008 [PubMed] [Google Scholar]
16. Demaude J, Leveque M, Chaumaz G, Eutamene H, Fioramonti J, Bueno L, Ferrier L. Острый стресс увеличивает парацеллюлярную проницаемость толстой кишки у мышей через независимый от тучных клеток механизм: участие панкреатического трипсина. наука о жизни
84: 847–852, 2009 [PubMed] [Google Scholar]
Острый стресс увеличивает парацеллюлярную проницаемость толстой кишки у мышей через независимый от тучных клеток механизм: участие панкреатического трипсина. наука о жизни
84: 847–852, 2009 [PubMed] [Google Scholar]
17. Ennaceur A, Delacour J. Новый однократный тест для нейробиологических исследований памяти у крыс. 1: Поведенческие данные. Поведение Мозг Res 31: 47–59, 1988 [PubMed] [Google Scholar]
18. Estienne M, Claustre J, Clain-Gardechaux G, Paquet A, Tache Y, Fioramonti J, Plaisancie P. Материнская депривация изменяет клоны эпителиальных секреторных клеток у крыс. двенадцатиперстная кишка: роль пептидов, связанных с CRF. кишки 59: 744–751, 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
19. Eutamene H, Lamine F, Chabo C, Theodorou V, Rochat F, Bergonzelli GE, Corthesy-Theulaz I, Fioramonti J, Bueno L Синергизм между Lactobacillus paracasei и его бактериальными продуктами противодействует вызванной стрессом проницаемости кишечника и повышению чувствительности у крыс. Джей Нутр
137: 1901–1907, 2007 [PubMed] [Google Scholar]
Джей Нутр
137: 1901–1907, 2007 [PubMed] [Google Scholar]
20. Floch MH, Walker WA, Madsen K, Sanders ME, Macfarlane GT, Flint HJ, Dieleman LA, Ringel Y, Guandalini S, Kelly CP, Brandt LJ . Рекомендации по использованию пробиотиков — обновление 2011 г. J Clin Гастроэнтерол 45 Приложение: S168–S171, 2011 [PubMed] [Google Scholar]
21. Фуэнтес С., Эгерт М., Хименес-Валера М., Монтеолива-Санчес М., Руис-Браво А., Смидт Х. Штамм Lactobacillus plantarum поражает сегментированные нитчатые бактерии в кишечнике мышей с ослабленным иммунитетом. FEMS Microbiol Ecol 63: 65–72, 2008 [PubMed] [Google Scholar]
22. Gareau MG, Jury J, MacQueen G, Sherman PM, Perdue MH. Лечение крысят пробиотиками нормализует высвобождение кортикостерона и улучшает дисфункцию толстой кишки, вызванную разлучением с матерью. кишки 56: 1522–1528, 2007 [бесплатная статья PMC] [PubMed] [Google Scholar]
23. Gareau MG, Jury J, Yang PC, MacQueen G, Perdue MH. Отделение новорожденных от матери вызывает дисфункцию толстой кишки у крысят, включая нарушение сопротивляемости хозяина. Педиатр Рез
59: 83–88, 2006 [PubMed] [Google Scholar]
Педиатр Рез
59: 83–88, 2006 [PubMed] [Google Scholar]
24. Gareau MG, Sherman PM, Walker WA. Пробиотики и кишечная микробиота при здоровье и заболеваниях кишечника. Нат Рев Гастроэнтерол Гепатол 7: 503–514, 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
25. Gareau MG, Silva MA, Perdue MH. Патофизиологические механизмы стресс-индуцированного повреждения кишечника. Курр Мол Мед 8: 274–281, 2008 [PubMed] [Google Scholar]
26. Гаро М.Г., Вайн Э., Рирдон С., Шерман П.М. Пробиотики предотвращают гибель новорожденных мышей, вызванную инфекцией Citrobacter rodentium . J заразить Dis 201: 81–91, 2010 [PubMed] [Google Scholar]
27. Gareau MG, Wine E, Rodrigues DM, Cho JH, Whary MT, Philpott DJ, Macqueen G, Sherman PM. Бактериальная инфекция вызывает вызванную стрессом дисфункцию памяти у мышей. кишки 60: 307–317, 2011 [PubMed] [Google Scholar]
28. Hooper LV, Macpherson AJ. Иммунные адаптации, поддерживающие гомеостаз с микробиотой кишечника. Нат Рев Иммунол
10: 159–169, 2010 [PubMed] [Google Scholar]
Нат Рев Иммунол
10: 159–169, 2010 [PubMed] [Google Scholar]
29. Jarchum I, Pamer EG. Регуляция врожденного и адаптивного иммунитета комменсальной микробиотой. Курр Опин Иммунол 23: 353–360, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
30. Johnson-Henry KC, Nadjafi M, Avitzur Y, Mitchell DJ, Ngan BY, Galindo-Mata E, Jones NL, Sherman PM . Улучшение последствий инфекции Citrobacter rodentium у мышей путем предварительной обработки пробиотиками. J заразить Dis 191: 2106–2117, 2005 [PubMed] [Google Scholar]
31. Kipnis J, Cohen H, Cardon M, Ziv Y, Schwartz M. Дефицит Т-клеток приводит к когнитивной дисфункции: последствия терапевтической вакцинации при шизофрении и других психических состояниях. Proc Natl Acad Sci USA 101: 8180–8185, 2004 [бесплатная статья PMC] [PubMed] [Google Scholar]
32. Kipnis J, Derecki NC, Yang C, Scrable H. Иммунитет и познание: что такое возрастная деменция, ВИЧ-деменция и общего у «химиомозга»? Тренды Иммунол 29: 455–463, 2008 [PubMed] [Google Scholar]
33. Konturek PC, Brzozowski T, Konturek SJ. Стресс и кишечник: патофизиология, клинические последствия, диагностический подход и варианты лечения. J Физиол Фармакол
62: 591–599, 2011 [PubMed] [Google Scholar]
Konturek PC, Brzozowski T, Konturek SJ. Стресс и кишечник: патофизиология, клинические последствия, диагностический подход и варианты лечения. J Физиол Фармакол
62: 591–599, 2011 [PubMed] [Google Scholar]
34. Lupien SJ, Fiocco A, Wan N, Maheu F, Lord C, Schramek T, Tu MT. Гормоны стресса и человеческая память функционируют на протяжении всей жизни. Психонейроэндокринология 30: 225–242, 2005 [PubMed] [Google Scholar]
35. Martinez-Medina M, Aldeguer X, Gonzalez-Huix F, Acero D, Garcia-Gil LJ. Аномальный состав микробиоты слизистой оболочки подвздошно-ободочной кишки у пациентов с болезнью Крона, выявленный методом полимеразной цепной реакции с денатурирующим градиентным гель-электрофорезом. Воспаление кишечника Dis 12: 1136–1145, 2006 [PubMed] [Google Scholar]
36. Mombaerts P, Iacomini J, Johnson RS, Herrup K, Tonegawa S, Papaioannou VE. У мышей с дефицитом RAG-1 отсутствуют зрелые В- и Т-лимфоциты. Клетка 68: 869–877, 1992 [PubMed] [Google Scholar]
37. Ohland CL, Kish L, Bell H, Thiesen A, Hotte N, Pankiv E, Madsen KL. Влияние Lactobacillus helveticus на поведение мышей зависит от диеты и генотипа и коррелирует с изменениями в микробиоме кишечника. Психонейроэндокринология
2013 [PubMed] [Google Scholar]
Ohland CL, Kish L, Bell H, Thiesen A, Hotte N, Pankiv E, Madsen KL. Влияние Lactobacillus helveticus на поведение мышей зависит от диеты и генотипа и коррелирует с изменениями в микробиоме кишечника. Психонейроэндокринология
2013 [PubMed] [Google Scholar]
38. Olano-Martin E, Mountzouris KC, Gibson GR, Rastall RA. Ферментируемость in vitro декстрана, олигодекстрана и мальтодекстрина кишечными бактериями человека. Бр Дж Нутр 83: 247–255, 2000 [PubMed] [Google Scholar]
39. Schaaf MJ, Sibug RM, Duurland R, Fluttert MF, Oitzl MS, De Kloet ER, Vreugdenhil E. Влияние кортикостерона на экспрессию мРНК BDNF в гиппокампе крыс во время тренировки в водном лабиринте Морриса. стресс 3: 173–183, 1999 [PubMed] [Google Scholar]
40. Schnupf P, Gaboriau-Routhiau V, Cerf-Bensussan N. Взаимодействие хозяина с сегментированными нитчатыми бактериями: необычный компромисс, который стимулирует постнатальное созревание иммунная система кишечника. Семин Иммунол 25: 342–351, 2013 [PubMed] [Google Scholar]
41. Schwartz M, Shechter R. Защитные аутоиммунные функции с помощью внутричерепного иммунного надзора для поддержки разума: недостающее звено между здоровьем и болезнью. Мол Психиатрия
15: 342–354, 2010 [PubMed] [Google Scholar]
Schwartz M, Shechter R. Защитные аутоиммунные функции с помощью внутричерепного иммунного надзора для поддержки разума: недостающее звено между здоровьем и болезнью. Мол Психиатрия
15: 342–354, 2010 [PubMed] [Google Scholar]
42. Шерман П.М., Осса Дж. К., Джонсон-Генри К. Раскрытие механизмов действия пробиотиков. Нутр Клин Практ 24: 10–14, 2009 [PubMed] [Google Scholar]
43. Stasi C, Orlandelli E. Роль оси мозг-кишка в патофизиологии болезни Крона. Копать Дис 26: 156–166, 2008 [PubMed] [Google Scholar]
44. Suzuki K, Meek B, Doi Y, Muramatsu M, Chiba T, Honjo T, Fagarasan S. Аберрантное распространение сегментированных нитчатых бактерий в кишечнике с дефицитом IgA. Proc Natl Acad Sci USA 101: 1981–1986, 2004 [бесплатная статья PMC] [PubMed] [Google Scholar]
45. Wood SK, Woods JH. Рецептор рилизинг-фактора кортикотропина-1: терапевтическая мишень при сердечных вегетативных нарушениях. Экспертное мнение по целям 11: 1401–1413, 2007 [PubMed] [Google Scholar]
46. Zareie M, Johnson-Henry K, Jury J, Yang PC, Ngan BY, McKay DM, Soderholm JD, Perdue MH, Sherman PM. Пробиотики предотвращают транслокацию бактерий и улучшают барьерную функцию кишечника у крыс после хронического психологического стресса. кишки
55: 1553–1560, 2006 [бесплатная статья PMC] [PubMed] [Google Scholar]
Zareie M, Johnson-Henry K, Jury J, Yang PC, Ngan BY, McKay DM, Soderholm JD, Perdue MH, Sherman PM. Пробиотики предотвращают транслокацию бактерий и улучшают барьерную функцию кишечника у крыс после хронического психологического стресса. кишки
55: 1553–1560, 2006 [бесплатная статья PMC] [PubMed] [Google Scholar]
47. Ziv Y, Ron N, Butovsky O, Landa G, Sudai E, Greenberg N, Cohen H, Kipnis J, Schwartz M. Иммунные клетки способствуют поддержанию нейрогенеза и способности к пространственному обучению во взрослом возрасте. Нат Нейроски 9: 268–275, 2006 [PubMed] [Google Scholar]
Влияние способа родоразрешения на микробиоту кишечника младенцев — полный текст — Annals of Nutrition and Metabolism 2021, Vol. 77, Доп. 3
Микробная колонизация новорожденных является важным признаком нормальных родов. Микробиота кишечника играет центральную роль в программировании метаболизма и иммунной функции хозяина, что имеет как немедленные, так и долгосрочные последствия для здоровья. Во время вагинальных родов младенец подвергается воздействию различных материнских микробов, из которых специфические фекальные микробы колонизируют кишечник младенца. Кесарево сечение исключает контакт младенца с материнскими микробами, предотвращая вертикальную передачу кишечных микробов. Следовательно, младенцы колонизируются бактериями из окружающей среды, в том числе потенциальными патогенами из больничной среды. Недавние исследования показали, что воздействие антибиотиков во время родов оказывает эффект, подобный кесареву сечению, на микробиоту кишечника младенцев. В то время как состав кишечной микробиоты в основном нормализуется в течение первого года жизни, эпидемиологические исследования показывают, что аберрантное раннее микробное воздействие имеет долгосрочные иммунологические и метаболические последствия. Из-за высокой распространенности процедур, препятствующих нормальному развитию кишечной микробиоты, срочно необходимы эффективные методы нормализации кишечной микробиоты новорожденных.
Во время вагинальных родов младенец подвергается воздействию различных материнских микробов, из которых специфические фекальные микробы колонизируют кишечник младенца. Кесарево сечение исключает контакт младенца с материнскими микробами, предотвращая вертикальную передачу кишечных микробов. Следовательно, младенцы колонизируются бактериями из окружающей среды, в том числе потенциальными патогенами из больничной среды. Недавние исследования показали, что воздействие антибиотиков во время родов оказывает эффект, подобный кесареву сечению, на микробиоту кишечника младенцев. В то время как состав кишечной микробиоты в основном нормализуется в течение первого года жизни, эпидемиологические исследования показывают, что аберрантное раннее микробное воздействие имеет долгосрочные иммунологические и метаболические последствия. Из-за высокой распространенности процедур, препятствующих нормальному развитию кишечной микробиоты, срочно необходимы эффективные методы нормализации кишечной микробиоты новорожденных. Что еще более важно, в клинической практике следует уделять внимание дисбалансу микробиоты у новорожденных, рожденных с помощью кесарева сечения, и новорожденных, подвергшихся воздействию антибиотиков. Грудное вскармливание и пробиотики особенно важны для младенцев с нарушенной колонизацией кишечника.
Что еще более важно, в клинической практике следует уделять внимание дисбалансу микробиоты у новорожденных, рожденных с помощью кесарева сечения, и новорожденных, подвергшихся воздействию антибиотиков. Грудное вскармливание и пробиотики особенно важны для младенцев с нарушенной колонизацией кишечника.
Основные положения
Развитие микробиоты кишечника является частью физиологического развития младенцев и должно учитываться в клинической практике.
Значительная часть младенцев подвергается воздействию антибиотиков при кесаревом сечении или интранатальном введении антибиотиков, которые исключают нормальную передачу полезных микробов от матери ребенку, изменяя развитие кишечной микробиоты и, следовательно, иммунное и метаболическое развитие.
Грудное вскармливание и пробиотики особенно важны для младенцев с нарушенной колонизацией микробиоты кишечника.
Было показано, что трансплантация фекальной микробиоты от матери новорожденному восстанавливает нормальную микробиоту кишечника у детей, рожденных с помощью кесарева сечения, но требует тщательного скрининга матери.

Колонизация и раннее развитие микробиоты кишечника младенцев
Хотя представление о том, что дети рождаются стерильными, оспаривается в связи с обнаружением как бактерий, так и бактериальной ДНК в плаценте, амниотической жидкости и меконии, выделяемых в течение нескольких часов после рождения, в настоящее время консенсус экспертов заключается в том, что микробная колонизация младенца, то есть создание репликирующих микробных клеток, обычно не происходит при здоровой беременности [1, 2]. В любом случае все младенцы колонизируются микробами при рождении. Микробы, которые наблюдались внутриутробно, не включают нормальные кишечные микробы младенцев, которые должны быть приобретены во время рождения.
Во время рождения младенцы подвергаются воздействию вагинальных, фекальных и кожных бактерий матери, которые колонизируют участки тела младенца, обеспечивающие подходящую среду обитания и питательные вещества. Каждый вид бактерий имеет определенные требования к среде обитания и не может постоянно колонизировать негостеприимные участки тела. Кишечник младенца при рождении колонизируется кишечными микробами матери [3-8], в то время как вагинальные микробы матери не колонизируют кишечник младенца [7, 9, 10]. Не все материнские кишечные бактерии способны колонизировать младенцев, и важно отметить, что кишечная микробиота не передается как целое сообщество, а только отдельные члены способны образовывать устойчивые популяции. Доминирующими колонизаторами кишечника младенцев материнского происхождения являются бифидобактерии и Bacteroides [6, 7]. Некоторые виды Bifidobacterium и Bacteroides обладают способностью ферментировать олигосахариды грудного молока (HMO) [11], что, вероятно, объясняет их успех в колонизации кишечника младенцев [5]. В то время как некоторые адаптированные к кишечнику младенцев штаммы Bifidobacterium , такие как B . лонгум подвид. инфантис , Б . bifidum и B. breve, специализируются на использовании ОПЗ [12], Bacteroides spp.
Кишечник младенца при рождении колонизируется кишечными микробами матери [3-8], в то время как вагинальные микробы матери не колонизируют кишечник младенца [7, 9, 10]. Не все материнские кишечные бактерии способны колонизировать младенцев, и важно отметить, что кишечная микробиота не передается как целое сообщество, а только отдельные члены способны образовывать устойчивые популяции. Доминирующими колонизаторами кишечника младенцев материнского происхождения являются бифидобактерии и Bacteroides [6, 7]. Некоторые виды Bifidobacterium и Bacteroides обладают способностью ферментировать олигосахариды грудного молока (HMO) [11], что, вероятно, объясняет их успех в колонизации кишечника младенцев [5]. В то время как некоторые адаптированные к кишечнику младенцев штаммы Bifidobacterium , такие как B . лонгум подвид. инфантис , Б . bifidum и B. breve, специализируются на использовании ОПЗ [12], Bacteroides spp. являются субстратными универсалами. Bacteroides fragilis , thetaiotaomicron и vulgatus являются эффективными утилизаторами HMO [11]. Они используют одни и те же пути для деградации слизи хозяина и HMO и способны разрушать широкий спектр HMO [13]. Напротив, Firmicutes и Proteobacteria обычно не разрушают HMO, за исключением некоторых штаммов Lactobacillus , Streptococcus, и Enterococcus с узким спектром использования HMO [11].
являются субстратными универсалами. Bacteroides fragilis , thetaiotaomicron и vulgatus являются эффективными утилизаторами HMO [11]. Они используют одни и те же пути для деградации слизи хозяина и HMO и способны разрушать широкий спектр HMO [13]. Напротив, Firmicutes и Proteobacteria обычно не разрушают HMO, за исключением некоторых штаммов Lactobacillus , Streptococcus, и Enterococcus с узким спектром использования HMO [11].
Важность ранней материнской колонизации подтверждается тем фактом, что микробы материнского происхождения колонизируют младенца практически постоянно, в то время как нематеринские микробы более преходящи [6]. Это наводит на мысль об особой совместимости между детскими и материнскими микробами, потенциально связанной с частично генетически детерминированными факторами, такими как состав олигосахаридов грудного молока, состав слизи кишечника и иммунная система.
В то время как микробиота кишечника обычно характеризуется огромными межиндивидуальными вариациями, развитие микробиоты в младенчестве следует довольно четкой и единообразной схеме, зависящей от способа рождения (рис. 1). В течение первого года жизни в кишечнике младенцев происходит экологическая сукцессия с постоянным временным паттерном в разных культурах [14]. Первые испражнения содержат очень разнообразную микробиоту, в основном случайных прохожих [7]. После первых нескольких дней разнообразие уменьшается, так как одни микробы расцветают, а другие исчезают [7]. К исходно доминирующим видам относятся аэротолерантные таксоны, такие как стафилококки, энтерококки и стрептококки, а также энтеробактерии [12, 14]. В течение нескольких недель состав грудного молока меняется по мере того, как вырастают бифидобактерии, разлагающие олигосахариды грудного молока. Бифидобактерии обычно являются доминирующей группой до отъема, после чего таксоны, утилизирующие растительные углеводы, в основном относятся к семействам клостридий Lachnospiraceae и Ruminococcaceae начинают постепенно увеличиваться в относительной численности [14]. Численность Bacteroides может быть высокой уже очень рано и остается достаточно стабильной на протяжении всего раннего развития [14].
1). В течение первого года жизни в кишечнике младенцев происходит экологическая сукцессия с постоянным временным паттерном в разных культурах [14]. Первые испражнения содержат очень разнообразную микробиоту, в основном случайных прохожих [7]. После первых нескольких дней разнообразие уменьшается, так как одни микробы расцветают, а другие исчезают [7]. К исходно доминирующим видам относятся аэротолерантные таксоны, такие как стафилококки, энтерококки и стрептококки, а также энтеробактерии [12, 14]. В течение нескольких недель состав грудного молока меняется по мере того, как вырастают бифидобактерии, разлагающие олигосахариды грудного молока. Бифидобактерии обычно являются доминирующей группой до отъема, после чего таксоны, утилизирующие растительные углеводы, в основном относятся к семействам клостридий Lachnospiraceae и Ruminococcaceae начинают постепенно увеличиваться в относительной численности [14]. Численность Bacteroides может быть высокой уже очень рано и остается достаточно стабильной на протяжении всего раннего развития [14]. Это, вероятно, отражает универсальную природу видов Bacteroides с точки зрения потенциала использования субстрата, включая использование как разнообразных диетических полисахаридов, так и гликанов хозяина [13]. Существуют некоторые географические различия в среднем составе микробиоты кишечника младенцев. Африканские младенцы демонстрируют повышенное относительное количество Bacilli, в то время как североамериканские младенцы имеют больше Bacteroidetes и меньше Actinobacteria, чем младенцы на других континентах [14]. Вызваны ли эти различия техническими или биологическими причинами, неизвестно.
Это, вероятно, отражает универсальную природу видов Bacteroides с точки зрения потенциала использования субстрата, включая использование как разнообразных диетических полисахаридов, так и гликанов хозяина [13]. Существуют некоторые географические различия в среднем составе микробиоты кишечника младенцев. Африканские младенцы демонстрируют повышенное относительное количество Bacilli, в то время как североамериканские младенцы имеют больше Bacteroidetes и меньше Actinobacteria, чем младенцы на других континентах [14]. Вызваны ли эти различия техническими или биологическими причинами, неизвестно.
Рис. 1.
Временное развитие относительной численности доминирующих классов бактерий в кишечнике младенцев у младенцев, рожденных естественным путем, на грудном вскармливании ( a ) и младенцев, родившихся после КС ( b ). КС, кесарево сечение.
Воздействие кесарева сечения на микробиоту кишечника
Естественная передача микробиоты от матери к ребенку нарушается при родах с помощью кесарева сечения (КС) [6], что приводит к отклонению в развитии микробиоты, особенно в первые 6–6 месяцев жизни. 12 месяцев жизни [14]. Фактически, рождение CS, возможно, является фактором с наиболее однородным воздействием на микробиоту кишечника у отдельных людей и исследований. Большое исследование с участием почти 600 младенцев показало, что способ родоразрешения является наиболее важным фактором, влияющим на состав микробиоты кишечника младенцев, с более сильным эффектом, чем постнатальное лечение антибиотиками [15]. Особенно заметной и повсеместной особенностью кишечной микробиоты новорожденных с КС является низкая относительная численность бифидобактерий и почти полное отсутствие Bacteroides [14], то есть таксоны, которые обычно получают от матери при рождении и которые в значительной степени ответственны за ферментацию олигосахаридов грудного молока в кишечнике младенца. Эти закономерности наблюдаются практически во всех исследованиях, изучающих влияние CS на микробиоту кишечника младенцев (таблица 1), включая несколько крупных когортных исследований с участием 600–1000 младенцев в каждом [15–18].
12 месяцев жизни [14]. Фактически, рождение CS, возможно, является фактором с наиболее однородным воздействием на микробиоту кишечника у отдельных людей и исследований. Большое исследование с участием почти 600 младенцев показало, что способ родоразрешения является наиболее важным фактором, влияющим на состав микробиоты кишечника младенцев, с более сильным эффектом, чем постнатальное лечение антибиотиками [15]. Особенно заметной и повсеместной особенностью кишечной микробиоты новорожденных с КС является низкая относительная численность бифидобактерий и почти полное отсутствие Bacteroides [14], то есть таксоны, которые обычно получают от матери при рождении и которые в значительной степени ответственны за ферментацию олигосахаридов грудного молока в кишечнике младенца. Эти закономерности наблюдаются практически во всех исследованиях, изучающих влияние CS на микробиоту кишечника младенцев (таблица 1), включая несколько крупных когортных исследований с участием 600–1000 младенцев в каждом [15–18]. Кроме того, относительное обилие патогенных бактерий часто повышено у новорожденных с КС. Эти таксоны распространены в больницах и передаются с больничных поверхностей новорожденным [19].].
Кроме того, относительное обилие патогенных бактерий часто повышено у новорожденных с КС. Эти таксоны распространены в больницах и передаются с больничных поверхностей новорожденным [19].].
Таблица 1.
Постоянные образцы кишечной микробиоты, наблюдаемые у детей, рожденных с помощью КС, по сравнению с детьми, рожденными естественным путем при котором младенец не контактирует с микробиотой родовых путей матери. В то время как воздействие родового процесса на мать и ребенка, несомненно, оказывает физиологическое воздействие, нет оснований ожидать большой пользы для микробной колонизации родов, даже при разрыве плодных оболочек, поскольку присутствие материнских фекальных микробов в родовых путях маловероятно. здоровых матерей. Действительно, гипотеза не получила большой поддержки в научной литературе. Лишь в нескольких исследованиях сравнивали влияние различных типов КС на микробиоту кишечника младенцев. Экстренное КС, по-видимому, приводит к более резким и длительным изменениям микробиоты кишечника младенцев [18, 20], возможно, из-за различий в состоянии здоровья. В заключение, в настоящее время нет доказательств, свидетельствующих о положительном влиянии разрыва плодных оболочек или КС во время родов по сравнению с КС до родов на микробиоту кишечника младенцев.
В заключение, в настоящее время нет доказательств, свидетельствующих о положительном влиянии разрыва плодных оболочек или КС во время родов по сравнению с КС до родов на микробиоту кишечника младенцев.
До сих пор лишь в нескольких исследованиях изучался вирусный компонент кишечной микробиоты, так называемый кишечный виром, в раннем младенчестве. Недавние результаты показывают, что большинство вирусов в кишечнике новорожденных являются фагами, то есть бактериями, заражающими вирусы [21]. Имеются данные о том, что фаги передаются от матери при рождении вместе с бактериями-хозяевами [5, 22]. Следовательно, было показано, что общее разнообразие вирусов и фагов снижается у детей, рожденных с КС в возрасте 1 года, с особенно низким содержанием Anelloviridae и Caudovirales у детей, рожденных с КС [23]. Фактически, влияние способа рождения на виром кишечника было гораздо более заметным в возрасте 1 года, чем влияние на бактериом [23]. Это указывает на то, что рождение имеет решающее значение для приобретения кишечного фагома, а возможность постнатальной колонизации, например, через грудное молоко или окружающую среду, ограничена.
Метаанализ доминирующих классов бактерий показал, что различия между способами рождения постепенно выравниваются и в основном исчезают к 12-месячному возрасту [14]. Однако лишь в нескольких исследованиях изучалась связь между способом рождения и развитием кишечной микробиоты после младенчества. Снижение разнообразия Bacteroides spp. сообщается в возрасте до 2 лет [24]. Другое исследование показало снижение относительной численности нескольких представителей Lachnospiraceae 9.0130 и Ruminococcaceae у детей с КС в возрасте 4 лет [25]. Для сравнения, исследование с использованием флуоресцентной гибридизации in situ показало снижение численности клостридий у 7-летних детей, рожденных CS, по сравнению с 7-летними детьми, рожденными естественным путем [26]. Исследование с использованием количественной ПЦР выявило значительные различия в составе кишечной микробиоты между молодыми людьми, рожденными CS, и молодыми людьми, родившимися вагинально [27]. В частности, родственники Bacteroides fragilis и Lactobacillus samei были снижены у детей, родившихся с КС. Результаты показывают, что влияние способа рождения на микробиоту кишечника может в некоторых случаях сохраняться даже во взрослом возрасте. Примечательно, что в последних двух исследованиях использовались количественные измерения (FISH и qPCR соответственно), которые могут оценить абсолютную численность бактерий, в отличие от секвенирования, которое выявляет только относительную численность. Ясно, что в будущих исследованиях необходимо использовать методы, позволяющие оценить абсолютную численность [28].
Результаты показывают, что влияние способа рождения на микробиоту кишечника может в некоторых случаях сохраняться даже во взрослом возрасте. Примечательно, что в последних двух исследованиях использовались количественные измерения (FISH и qPCR соответственно), которые могут оценить абсолютную численность бактерий, в отличие от секвенирования, которое выявляет только относительную численность. Ясно, что в будущих исследованиях необходимо использовать методы, позволяющие оценить абсолютную численность [28].
Воздействие антибиотиков во время родов на микробиоту кишечника новорожденного
В большинстве больниц антибиотикотерапия, назначаемая матери, является неотъемлемой частью родоразрешения КС. Таким образом, была некоторая неясность в отношении того, является ли эффект родов CS исключительно следствием отсутствия контакта с материнскими фекальными микробами или частично из-за лечения антибиотиками. Учитывая, что независимо от состава материнской микробиоты, CS устраняет контакт между фекальными микробами матери и младенцем, тем самым предотвращая колонизацию, любые дополнительные методы лечения, влияющие на микробиоту, кажутся тривиальными.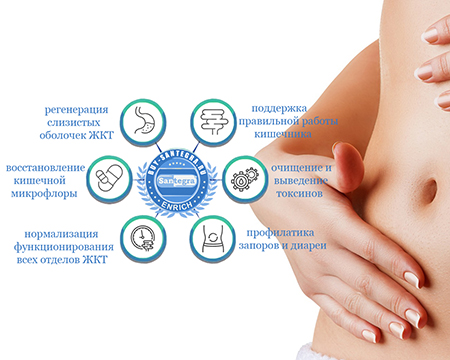 Если микроб не имеет контакта с младенцем, он не может колонизировать младенца, независимо от воздействия антибиотиков. Эта точка зрения была недавно подтверждена в исследовании, сравнивающем влияние антибиотикопрофилактики до и после КС на состав микробиоты кишечника младенцев [29].]. Не было обнаружено существенных различий в составе кишечной микробиоты между младенцами, подвергшимися и не подвергшимися материнской антибиотикопрофилактике, что свидетельствует о том, что воздействие антибиотиков не является причиной дисбаланса микробиоты, вызванного CS. Аналогичным образом, при анализе 700 младенцев стратификация по интранатальному воздействию антибиотиков не изменила результаты, касающиеся влияния КС при рождении на микробиоту кишечника младенцев [18].
Если микроб не имеет контакта с младенцем, он не может колонизировать младенца, независимо от воздействия антибиотиков. Эта точка зрения была недавно подтверждена в исследовании, сравнивающем влияние антибиотикопрофилактики до и после КС на состав микробиоты кишечника младенцев [29].]. Не было обнаружено существенных различий в составе кишечной микробиоты между младенцами, подвергшимися и не подвергшимися материнской антибиотикопрофилактике, что свидетельствует о том, что воздействие антибиотиков не является причиной дисбаланса микробиоты, вызванного CS. Аналогичным образом, при анализе 700 младенцев стратификация по интранатальному воздействию антибиотиков не изменила результаты, касающиеся влияния КС при рождении на микробиоту кишечника младенцев [18].
Эффект от лечения антибиотиками во время вагинальных родов сам по себе является важным вопросом, поскольку большая часть младенцев подвергается воздействию антибиотиков во время родов либо для профилактики, либо для лечения материнской инфекции. В некоторых странах все матери-носители группы B Streptococcus получают антибиотикопрофилактику во время родов. Целью интранатальной антибиотикопрофилактики является предотвращение передачи патогенных бактерий от матери к ребенку. Антибиотики не являются селективными между патогенными и непатогенными микроорганизмами, поэтому, если предотвращена передача патогенных микроорганизмов, то должна быть предотвращена и передача непатогенных бактерий с аналогичным профилем чувствительности к антибиотикам.
В некоторых странах все матери-носители группы B Streptococcus получают антибиотикопрофилактику во время родов. Целью интранатальной антибиотикопрофилактики является предотвращение передачи патогенных бактерий от матери к ребенку. Антибиотики не являются селективными между патогенными и непатогенными микроорганизмами, поэтому, если предотвращена передача патогенных микроорганизмов, то должна быть предотвращена и передача непатогенных бактерий с аналогичным профилем чувствительности к антибиотикам.
В исследованиях, изучающих влияние антибиотиков во время родов на младенцев, рожденных естественным путем, бифидобактерии, по-видимому, испытывают особенно сильное негативное воздействие при воздействии антибиотиков (таблица 2). Существуют расхождения в отношении влияния интранатального воздействия антибиотиков на Bacteroides с эффектами, варьирующимися от отрицательных [17, 20, 30] до нейтральных [20, 31-33] и положительных [30]. Важно отметить, что влияние воздействия антибиотиков изменяется в зависимости от практики кормления, при этом дети, находящиеся на искусственном вскармливании, страдают более серьезно [34-36]. В целом, новые данные свидетельствуют о том, что воздействие антибиотиков во время родов можно сравнить с химическим КС с микробной точки зрения, устраняя естественную передачу кишечной микробиоты, особенно бифидобактерий, от матери к ребенку.
В целом, новые данные свидетельствуют о том, что воздействие антибиотиков во время родов можно сравнить с химическим КС с микробной точки зрения, устраняя естественную передачу кишечной микробиоты, особенно бифидобактерий, от матери к ребенку.
Таблица 2.
Постоянные характеристики кишечной микробиоты, наблюдаемые у младенцев, рожденных естественным путем, подвергшихся интранатальному воздействию антибиотиков, по сравнению с детьми, не подвергавшимися воздействию антибиотиков
Последствия нарушения вертикального переноса микробов сигналы в определенных возрастных окнах (рис. 1). Если эти сигналы изменены или отсутствуют из-за аномального развития микробиоты, это может повлиять на иммунное и метаболическое развитие хозяина. Отклонения от нормальной последовательности микробиоты у младенцев и детей раннего возраста обычно протекают без явных симптомов, но могут повышать восприимчивость к более поздним проблемам со здоровьем, таким как аллергические заболевания [37-39].
 ], аутоиммунные заболевания [40] и избыточный вес [41].
], аутоиммунные заболевания [40] и избыточный вес [41].Бифидобактерии обычно образуют доминирующий таксон у здоровых вагинально рожденных детей, находящихся на грудном вскармливании, составляя до 90% общей кишечной микробиоты. Благодаря своему изобилию и метаболическим возможностям они оказывают важное влияние на состав и функцию кишечной микробиоты, а также на здоровье хозяина (рис. 2). К сожалению, бифидобактерии, возможно, являются наиболее уязвимой бактериальной группой у младенцев, на которую негативно воздействуют все неестественные методы, такие как роды с помощью КС, антибиотики, искусственное вскармливание, раннее отнятие от груди и даже материнский стресс. Бифидобактерии являются доминирующей группой, использующей HMO в кишечнике младенцев.
Рис. 2.
Последствия низкой численности бифидобактерий у младенцев.
Как следствие уменьшенного содержания доминирующих ферментеров HMO и более низкой активности брожения, у детей, рожденных с КС, наблюдается повышенный рН кишечника и сниженный уровень пропионата короткоцепочечной жирной кислоты [42]. Поскольку НМО составляют примерно 20% всех углеводов в грудном молоке [43] и большинство из них расщепляются кишечными бактериями до короткоцепочечных жирных кислот [44], ферментация НМО представляет собой значительный источник энергии для младенцев. Это указывает на то, что дети, рожденные с КС, не получают полной питательной ценности грудного молока. Кроме того, было показано, что измененный рН кишечника способствует колонизации патогенами [42], и действительно, в нескольких исследованиях наблюдалось увеличение количества патогенов у детей, рожденных с КС (таблица 1). Бифидобактерии обладают антистрептококковой активностью, что указывает на то, что низкое содержание бифидобактерий в кишечнике может увеличить рост патогенных стрептококков [31]. В дополнение к увеличению числа патогенных микробов есть данные о том, что микробиота со сниженной способностью к утилизации олигосахаридов разрушает кишечную слизь, что может привести к ослаблению кишечного барьера [45]. Это вместе с увеличением патогенных микробов, вероятно, будет стимулировать воспаление как системно, так и локально.
Поскольку НМО составляют примерно 20% всех углеводов в грудном молоке [43] и большинство из них расщепляются кишечными бактериями до короткоцепочечных жирных кислот [44], ферментация НМО представляет собой значительный источник энергии для младенцев. Это указывает на то, что дети, рожденные с КС, не получают полной питательной ценности грудного молока. Кроме того, было показано, что измененный рН кишечника способствует колонизации патогенами [42], и действительно, в нескольких исследованиях наблюдалось увеличение количества патогенов у детей, рожденных с КС (таблица 1). Бифидобактерии обладают антистрептококковой активностью, что указывает на то, что низкое содержание бифидобактерий в кишечнике может увеличить рост патогенных стрептококков [31]. В дополнение к увеличению числа патогенных микробов есть данные о том, что микробиота со сниженной способностью к утилизации олигосахаридов разрушает кишечную слизь, что может привести к ослаблению кишечного барьера [45]. Это вместе с увеличением патогенных микробов, вероятно, будет стимулировать воспаление как системно, так и локально. Действительно, признаки боли и дистресса у младенцев коррелируют с низким содержанием бифидобактерий [46, 47].
Действительно, признаки боли и дистресса у младенцев коррелируют с низким содержанием бифидобактерий [46, 47].
Бифидобактерии не только важны для здоровья кишечника в раннем возрасте, но и обладают широким иммунологическим действием, что особенно важно во время развития иммунной системы. Действительно, многочисленные исследования показали, что низкая численность бифидобактерий, особенно B . longum , а высокая численность Proteobacteria в младенчестве связана с повышенным риском аллергических заболеваний в более позднем детстве [48-51]. Несколько исследований показали, что низкая ранняя численность бифидобактерий также является предиктором более позднего ожирения [41, 52, 53].
В качестве демонстрации клинических последствий нарушения микробной колонизации несколько крупных когортных исследований и метаанализов показали, что рождение с помощью КС связано с долгосрочными последствиями для здоровья, включая повышенный риск хронических иммунных заболеваний и ожирения [54- 56], причем некоторые негативные ассоциации со здоровьем проявляются во взрослом возрасте [54]. Хотя некоторые ассоциации могут быть вызваны смешивающими эффектами, явные изменения микробиоты кишечника и важность микробиоты кишечника для физиологического развития хозяина подтверждают причинную атрибуцию.
Хотя некоторые ассоциации могут быть вызваны смешивающими эффектами, явные изменения микробиоты кишечника и важность микробиоты кишечника для физиологического развития хозяина подтверждают причинную атрибуцию.
Коррекция микробиоты младенцев после нарушенной колонизации
Число родов КС растет во всем мире, затрагивая более 50% младенцев в определенных регионах [57]. Кроме того, более 30% младенцев подвергаются воздействию антибиотиков во время вагинальных родов в развитых странах [58, 59]. Эти цифры тревожно высоки, предполагая, что естественная микробная колонизация при рождении в настоящее время нарушена почти у половины младенцев даже в регионах с низкой частотой КС и хорошим управлением антибиотиками. Таким образом, существует острая необходимость в восстановлении нормального состава кишечной микробиоты у детей, рожденных от КС и подвергшихся воздействию антибиотиков. Лишь несколько различных методов были изучены с точки зрения их эффективности в восстановлении нормальной микробиоты кишечника у новорожденных с КС (рис. 3).
3).
Рис. 3.
Изучены методы нормализации микробиоты у детей, родившихся с КС. КС, кесарево сечение; ТФМ, трансплантация фекальной микробиоты.
Исследование, сравнивающее микробиоту, обнаруженную на различных участках тела младенца в течение нескольких минут после рождения, и образцы мекония, взятые в течение первых 24 часов, с образцами кожи матери и вагинальными образцами, неудивительно, показало, что младенцы, рожденные естественным путем, все еще покрытые вагинальными выделениями во время отбор образцов содержал вагинальные микробы, а дети, рожденные с КС, содержали кожные микробы [60]. Эти результаты были интерпретированы как означающие, что кишечник младенца колонизируется вагинальными микробами матери при рождении, хотя пробы фекальной микробиоты в исследовании не брались. Однако пробы были взяты слишком рано, чтобы отличить колонизаторов от случайных прохожих. На самом деле его показывали уже в 1990, вагинальные лактобациллы не колонизируют кишечник младенцев [9], и более поздние исследования подтвердили это [7, 10]. Влагалище взрослого человека представляет собой совершенно другую среду по сравнению с участками тела младенца, и, следовательно, микробы, адаптированные к среде влагалища, преимущественно специфические виды Lactobacillus , вряд ли найдут подходящую среду обитания на теле младенца. Вагинальные лактобациллы человека хорошо приспособлены к этой среде и редко обнаруживаются в других участках тела [61]. Следовательно, вагинальные микробы бесполезны с точки зрения восстановления микробиоты кишечника младенцев [8]. Кишечник младенцев действительно содержит небольшое количество лактобацилл, но они адаптированы к кишечнику или получены из пищи, а не вагинального происхождения [61]. В настоящее время неизвестно, играет ли кратковременное воздействие вагинальных микробов во время родов роль, например, в иммунной стимуляции.
Влагалище взрослого человека представляет собой совершенно другую среду по сравнению с участками тела младенца, и, следовательно, микробы, адаптированные к среде влагалища, преимущественно специфические виды Lactobacillus , вряд ли найдут подходящую среду обитания на теле младенца. Вагинальные лактобациллы человека хорошо приспособлены к этой среде и редко обнаруживаются в других участках тела [61]. Следовательно, вагинальные микробы бесполезны с точки зрения восстановления микробиоты кишечника младенцев [8]. Кишечник младенцев действительно содержит небольшое количество лактобацилл, но они адаптированы к кишечнику или получены из пищи, а не вагинального происхождения [61]. В настоящее время неизвестно, играет ли кратковременное воздействие вагинальных микробов во время родов роль, например, в иммунной стимуляции.
В нескольких исследованиях была проверена эффективность пробиотиков как средства восстановления микробиоты у детей, родившихся с КС. Было показано, что 6-месячный ежедневный прием пробиотического продукта, содержащего несколько штаммов Lactobacillus и Bifidobacterium , облегчает нарушения микробиоты, связанные с КС и антибиотиками, у младенцев, находящихся на грудном вскармливании [62]. Важно отметить, что лечение снизило частоту аллергических заболеваний у детей, рожденных с КС, продемонстрировав, что вмешательства, направленные на кишечную микробиоту, оказывают благотворное влияние на здоровье [63]. Однако эффект пробиотического вмешательства на микробиоту кишечника зависел от грудного вскармливания и не увеличивал количество бифидобактерий у детей, находящихся на исключительно искусственном вскармливании [62]. В другом испытании 9Смесь, содержащую 0129 Lactobacillus reuteri , кормили младенцев, рожденных естественным путем, и детей, рожденных с помощью КС, в течение 6 месяцев, что оказало благотворное влияние на обилие бифидобактерий и лактобактерий в группе, рожденной с помощью КС [64]. Эти результаты очень многообещающи, демонстрируя эффективность таких простых, безопасных и экономичных вмешательств. Однако пробиотики представляют собой небольшую долю общего микробного разнообразия, которое обычно колонизирует младенцев, и не могут полностью восстановить нормальную микробиоту кишечника.
Важно отметить, что лечение снизило частоту аллергических заболеваний у детей, рожденных с КС, продемонстрировав, что вмешательства, направленные на кишечную микробиоту, оказывают благотворное влияние на здоровье [63]. Однако эффект пробиотического вмешательства на микробиоту кишечника зависел от грудного вскармливания и не увеличивал количество бифидобактерий у детей, находящихся на исключительно искусственном вскармливании [62]. В другом испытании 9Смесь, содержащую 0129 Lactobacillus reuteri , кормили младенцев, рожденных естественным путем, и детей, рожденных с помощью КС, в течение 6 месяцев, что оказало благотворное влияние на обилие бифидобактерий и лактобактерий в группе, рожденной с помощью КС [64]. Эти результаты очень многообещающи, демонстрируя эффективность таких простых, безопасных и экономичных вмешательств. Однако пробиотики представляют собой небольшую долю общего микробного разнообразия, которое обычно колонизирует младенцев, и не могут полностью восстановить нормальную микробиоту кишечника. Важно отметить, что пробиотики не являются материнскими. Вполне вероятно, что материнские штаммы адаптированы к конкретной паре мать-младенец и были предварительно отобраны материнской иммунной системой и выделениями кишечника, чтобы соответствовать ее ребенку и составу ее грудного молока.
Важно отметить, что пробиотики не являются материнскими. Вполне вероятно, что материнские штаммы адаптированы к конкретной паре мать-младенец и были предварительно отобраны материнской иммунной системой и выделениями кишечника, чтобы соответствовать ее ребенку и составу ее грудного молока.
Грудное молоко обладает высокой бифидогенностью, поэтому можно ожидать, что грудное вскармливание восстановит низкую численность бифидобактерий у детей, родившихся с КС. Было обнаружено, что исключительно грудное вскармливание оказывает благотворное влияние на микробиоту кишечника новорожденных с КС, особенно в отношении бифидобактерий [65, 66]. Однако эффект грудного вскармливания зависит от состава олигосахаридов грудного молока [67]. Олигосахарид 2′-фукозиллактоза в грудном молоке смягчает влияние родов с КС на микробиоту кишечника, но не все матери выделяют 2′-фукозиллактозу [67]. Наличие фукозилированных олигосахаридов в грудном молоке, так называемый секреторный статус, определяется генотипом FUT2 матери. Результаты показывают, что дети несекреторных матерей и младенцы, находящиеся на искусственном вскармливании, подвергаются особому риску дисбиоза кишечника, если они рождаются с КС. В целом результаты показывают, что грудное вскармливание следует считать необходимым для младенцев с нарушенной колонизацией кишечника.
Результаты показывают, что дети несекреторных матерей и младенцы, находящиеся на искусственном вскармливании, подвергаются особому риску дисбиоза кишечника, если они рождаются с КС. В целом результаты показывают, что грудное вскармливание следует считать необходимым для младенцев с нарушенной колонизацией кишечника.
В связи с тем, что младенцы обычно колонизируются фекальными микробами матери во время родов, роды можно рассматривать как трансплантацию фекальной микробиоты (ТФМ) от матери к ребенку. В недавнем пилотном исследовании детям, родившимся с КС, в течение нескольких часов после родов давали перорально ТФМ, несколько граммов фекальных масс, смешанных с грудным молоком, от их собственных матерей [8]. Лечение полностью восстановило нормальный состав кишечной микробиоты, подтвердив, что материнские фекальные микробы являются естественными колонизаторами кишечника младенцев. В то время как все процедуры передачи сообщества микробов от одного человека к другому по своей сути рискованны из-за потенциальной передачи патогенов, было показано, что ТФМ от тщательно проверенных здоровых матерей безопасна [8].
Заключение
Поскольку КС устраняет контакт между фекальными микробами младенца и матери, предотвращается естественный вертикальный перенос кишечной микробиоты от матери к ребенку. Это приводит к аберрантному составу кишечной микробиоты со сниженным количеством ферментаторов грудного молока и повышенным количеством патогенов в течение первого года жизни, возможно, дольше. Интранатальное воздействие антибиотиков во время вагинальных родов оказывает такое же, но несколько более слабое влияние на микробиоту кишечника младенца, как КС. Накопленные данные указывают на то, что нарушение колонизации кишечника в раннем возрасте несет долгосрочные риски для здоровья, включая повышенный риск хронических иммунных заболеваний и избыточного веса. Из-за высокой распространенности как КС, так и применения антибиотиков во время родов необходимы методы коррекции микробиоты кишечника младенцев. Грудное вскармливание вместе с пробиотиками, особенно содержащими бифидобактерии, может быть использовано для облегчения дисбаланса микробиоты и настоятельно рекомендуется для всех детей, родившихся после КС и подвергшихся воздействию антибиотиков. Недавно была продемонстрирована эффективность FMT от матери к ребенку в коррекции микробиоты кишечника младенца.
Недавно была продемонстрирована эффективность FMT от матери к ребенку в коррекции микробиоты кишечника младенца.
Заявление о конфликте интересов
Написание этой статьи было поддержано Институтом питания Нестле, и автор заявляет об отсутствии других конфликтов интересов.
Источники финансирования
Написание этой статьи финансировалось Хельсинкским университетом.
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений.
