Как пробиотики влияют на воспалительные процессы при диабете 1 типа. Могут ли полезные бактерии нормализовать микрофлору кишечника и снизить риск развития заболевания. Какие механизмы лежат в основе противовоспалительного действия пробиотиков при аутоиммунном диабете.
Сахарный диабет 1 типа (СД1) — это аутоиммунное заболевание, при котором иммунная система атакует и разрушает инсулин-продуцирующие бета-клетки поджелудочной железы. В последние десятилетия наблюдается рост заболеваемости СД1 во всем мире, что нельзя объяснить только генетическими факторами. Все больше данных указывает на важную роль факторов окружающей среды, в частности, изменений в составе микрофлоры кишечника, в развитии этого заболевания.
Роль микрофлоры кишечника в развитии СД1
В желудочно-кишечном тракте человека обитают триллионы микроорганизмов, которые играют важную роль в поддержании здоровья. Нормальная микрофлора кишечника:
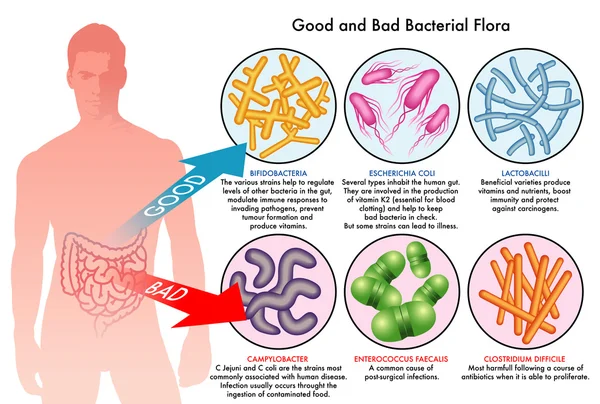
- Подавляет рост патогенных микроорганизмов
- Участвует в метаболизме питательных веществ
- Синтезирует витамины и другие полезные метаболиты
- Влияет на развитие и функционирование иммунной системы
- Поддерживает целостность кишечного барьера
Однако современный образ жизни, включая изменения в питании, чрезмерное использование антибиотиков и антисептиков, может приводить к нарушению нормального состава микрофлоры кишечника — дисбиозу. Исследования показывают, что у пациентов с СД1 и людей с высоким риском развития этого заболевания наблюдаются изменения в составе кишечной микрофлоры по сравнению со здоровыми людьми.
Как дисбиоз способствует развитию СД1?
Существует несколько механизмов, через которые нарушение микрофлоры кишечника может повышать риск развития СД1:
- Повышение проницаемости кишечного барьера — при дисбиозе нарушается целостность слизистой оболочки кишечника, что позволяет бактериям и их компонентам проникать в кровоток, вызывая системное воспаление.
- Изменение иммунного ответа — нарушение баланса микрофлоры может приводить к снижению количества регуляторных Т-клеток и повышению активности провоспалительных Т-хелперов 17 типа (Th17).
- Молекулярная мимикрия — некоторые бактериальные белки имеют сходство с аутоантигенами бета-клеток, что может провоцировать аутоиммунную реакцию.
- Изменение метаболизма — нарушение продукции короткоцепочечных жирных кислот и других метаболитов может влиять на функцию иммунных клеток и бета-клеток.
Пробиотики как способ нормализации микрофлоры при СД1
Учитывая важную роль микрофлоры кишечника в развитии СД1, все больше исследований посвящено изучению возможности использования пробиотиков для профилактики и лечения этого заболевания. Пробиотики — это живые микроорганизмы, которые при применении в адекватных количествах оказывают положительное влияние на здоровье организма-хозяина.

Механизмы действия пробиотиков при СД1:
- Восстановление нормального состава микрофлоры кишечника
- Укрепление кишечного барьера
- Модуляция иммунного ответа в сторону противовоспалительного
- Снижение системного воспаления
- Улучшение метаболизма глюкозы
Результаты исследований пробиотиков при СД1
Хотя исследования в этой области все еще продолжаются, уже получены некоторые обнадеживающие результаты:
- Исследования на животных моделях — применение пробиотиков у крыс линии NOD (модель СД1) приводило к снижению частоты развития диабета и замедлению прогрессирования заболевания.
- Клинические исследования
- Исследования механизмов — показано, что некоторые штаммы пробиотиков способны повышать количество регуляторных Т-клеток и снижать уровень провоспалительных цитокинов.
Перспективные направления исследований
Несмотря на многообещающие результаты, необходимы дальнейшие исследования для определения наиболее эффективных штаммов пробиотиков, оптимальных доз и схем применения при СД1. Некоторые перспективные направления включают:
- Изучение комбинаций различных штаммов пробиотиков
- Исследование пребиотиков и синбиотиков (комбинаций про- и пребиотиков)
- Персонализированный подбор пробиотиков на основе индивидуального состава микрофлоры
- Изучение долгосрочных эффектов применения пробиотиков
- Разработка новых методов доставки пробиотиков в кишечник
Заключение
Нормализация микрофлоры кишечника с помощью пробиотиков представляет собой перспективный подход к профилактике и лечению СД1. Хотя необходимы дальнейшие исследования, уже имеющиеся данные указывают на потенциальную эффективность этого метода в снижении риска развития заболевания и замедлении его прогрессирования. Применение пробиотиков может стать важным дополнением к существующим методам лечения СД1, помогая снизить воспаление и улучшить контроль гликемии у пациентов с этим заболеванием.
Нормализация микрофлоры кишечника способствует улучшению работы мозга
Резюме. С помощью диеты, направленной на нормализацию качественного и количественного состава микрофлоры кишечника, можно корригировать неврологические и психиатрические расстройства
Состояние желудочно-кишечного тракта частично определяет психическое состояние человека и играет главную роль в развитии некоторых соматических заболеваний. Ранее мы писали о том, что кишечная микрофлора способна оказывать влияние на метаболизм нейромедиаторов, в частности серотонина, тем самым изменяя психическое состояние человека. Специалисты из Великобритании предположили, что если рацион питания может изменить состав микрофлоры кишечника, значит, с помощью диеты можно корригировать неврологические и психиатрические расстройства.
Термин «микрофлора кишечника» охватывает все разнообразие микроорганизмов, которые присутствуют в кишечнике человека. У новорожденных просвет кишечника стерилен, однако уже к концу 1-го дня жизни он колонизируется огромным количеством бактерий, грибов и архей. В организме человека содержится ≈100 трлн микробных клеток. Влияние этой многочисленной экосистемы на состояние здоровья хозяина настолько велико, что некоторые специалисты склонны рассматривать кишечную микрофлору как отдельный «орган», приобретенный после рождения.
В организме человека содержится ≈100 трлн микробных клеток. Влияние этой многочисленной экосистемы на состояние здоровья хозяина настолько велико, что некоторые специалисты склонны рассматривать кишечную микрофлору как отдельный «орган», приобретенный после рождения.
Изучая физиологию желудочно-кишечного тракта, ученые с удивлением выявили крупные нейронные сети, содержащие ≈100 млн нервных клеток. Оказалось, что основным нейромедиатором в рамках этой энтеральной нервной системы является серотонин. Причем 80% всего серотонина, находящегося в организме, сосредоточено в кишечнике. Посредством блуждающего нерва, выходящего из продолговатого мозга и пролегающего в различных отделах грудной и брюшной полости, нервные импульсы (вместе с серотонином) поступают от кишечника в головной мозг. С уровнем именно этого биогенного амина в головном мозгу психиатры уже долгое время связывают окраску эмоционального состояния человека, а для модуляции настроения используют селективные ингибиторы обратного захвата серотонина — препараты, блокирующие реабсорбцию нейромедиатора в головном мозгу.
В настоящее время не подлежит сомнению наличие взаимосвязи между головным мозгом и кишечником. Сегодня многие исследования направлены на изучение и идентифицирование отдельных составляющих микрофлоры кишечника. Однако даже без наличия такой информации некоторые ученые полагают, что диета, способная изменить состав кишечного микробиома, оказывает влияние и на поведение человека. На этом предположении основана диета GAPS (Gut and Psychology Syndrome), предложенная доктором Наташей Кемпбелл-МакБрайд (Natasha Campbell-McBride), в основу разработки которой легло изучение влияния состояния кишечника на психологический статус.
После длительной работы с детьми и взрослыми с неврологическими и психиатрическими расстройствами, включая аутизм, синдром дефицита внимания и гиперактивности и депрессию, Н. Кемпбелл-МакБрайд создала портрет ее типичного пациента. Это индивид с частым расстройством пищеварения, плохим аппетитом, аллергическими заболеваниями, хроническим циститом и нарушениями пищевого поведения. У таких людей наблюдаются нарушения качественного и количественного состава микрофлоры кишечника, дефицит отдельных витаминов, макро- и микроэлементов, незаменимых аминокислот и других нутриентов, необходимых в том числе для нормального развития и функционирования головного мозга. Кроме того, нарушения в работе пищеварительной системы ведут к накоплению токсических веществ, что, в свою очередь, способствует развитию психических нарушений.
У таких людей наблюдаются нарушения качественного и количественного состава микрофлоры кишечника, дефицит отдельных витаминов, макро- и микроэлементов, незаменимых аминокислот и других нутриентов, необходимых в том числе для нормального развития и функционирования головного мозга. Кроме того, нарушения в работе пищеварительной системы ведут к накоплению токсических веществ, что, в свою очередь, способствует развитию психических нарушений.
В ходе нового исследования, результаты которого опубликованы в журнале «Antonie van Leeuwenhoek», ученые из Норвежского университета естественных наук (Norwegian University of Life Sciences), Осло, изучая физиологические эффекты качественного состава кишечной микрофлоры, также отметили, что для усиления роста некоторых видов бактерий, населяющих кишечник, целесообразно использовать диетологические приемы, например повышение уровня потребляемости кисломолочных продуктов.
Диета GAPS состоит из этапов, предусматривающих восстановление нормальной микрофлоры кишечника с помощью определенного набора продуктов и пробиотиков. В отличие от других диет, при этом не делается акцент на употребление сырых или специальным образом приготовленных продуктов. Продукты растительного происхождения (фрукты, овощи, зерновые, бобовые, орехи и семечки) способствуют детоксикации организма, а животного (мясо, рыба, молочные продукты и яйца) — поставляют в организм питательные вещества, необходимые для нормального функционирования органов и систем.
В отличие от других диет, при этом не делается акцент на употребление сырых или специальным образом приготовленных продуктов. Продукты растительного происхождения (фрукты, овощи, зерновые, бобовые, орехи и семечки) способствуют детоксикации организма, а животного (мясо, рыба, молочные продукты и яйца) — поставляют в организм питательные вещества, необходимые для нормального функционирования органов и систем.
Автор диеты подчеркивает, что каждый отдельный случай нарушения качественного и количественного состава кишечной микрофлоры приводит к развитию различных неврологических и психиатрических симптомов. При этом еда вместо источника полезных нутриентов становится основной причиной развития заболеваний. Лицам, планирующим перейти на этот тип питания, в любом случае следует проконсультироваться с врачом.
Scutti S. (2013) GAPS Diet: Can Mental Illness Be Cured By Eating To Correct Intestinal Imbalances? Medicaldaily, Sep. 2 (http://www.medicaldaily.com/gaps-diet-can-mental-illness-be-cured-eating-correct-intestinal-imbalances-255309).
Umu O.C., Oostindjer M., Pope P.B. et al. (2013) Potential applications of gut microbiota to control human physiology. Antonie Van Leeuwenhoek, Aug. 23 [Epub ahead of print].
Юлия Котикович
Как восстановить микрофлору кишечника у детей?
Микрофлора кишечника у детей
Когда говорят, что пищеварение и иммунитет у детей несовершенны, имеют в виду, что детская микрофлора формируется постепенно, год за годом увеличивая видовое разнообразие бактерий и их численность, а значит, и возможности усвоения различных веществ, и потенциал иммунной системы.
Формирование микрофлоры у детей проходит в несколько этапов:
- Первый год жизни
- Дошкольный период
- Школьный период
Первыми бактериями, с которыми сталкивается ребенок после «стерильных условий» внутриутробного развития, являются микроорганизмы родовых путей матери. При естественном протекании родов происходит заселение пищеварительной системы, верхних дыхательных путей, кожных покровов, мочеполовой системы малыша. Таким образом микрофлора здоровой женщины поддерживает несовершенные защитные силы новорожденного и препятствует проникновению патогенной флоры в его организм. Дети, родившиеся при помощи кесарева сечения, больше подвержены инфекциям, поскольку колонизация кишечника и других систем полезными бактериями у них происходит позже, и они чаще страдают от аллергических реакций.
При естественном протекании родов происходит заселение пищеварительной системы, верхних дыхательных путей, кожных покровов, мочеполовой системы малыша. Таким образом микрофлора здоровой женщины поддерживает несовершенные защитные силы новорожденного и препятствует проникновению патогенной флоры в его организм. Дети, родившиеся при помощи кесарева сечения, больше подвержены инфекциям, поскольку колонизация кишечника и других систем полезными бактериями у них происходит позже, и они чаще страдают от аллергических реакций.
Не менее важным этапом формирования микрофлоры ребенка является период грудного вскармливания. В молоке матери содержатся лактоза, лизоцим, иммуноглобулины, а также бифидогенные компоненты, способствующие росту и развитию полезных бактерий кишечника. Ранний отказ от грудного вскармливания, введение прикорма, не соответствующего возрасту ребенка, может спровоцировать проблемы с пищеварением и дисбиоз. Дети на искусственном вскармливании чаще имеют проблемы со стулом, поскольку неразвитая микрофлора не справляется с искусственными смесями и другими продуктами питания.
Микрофлора кишечника у детей в дошкольный период
Начиная со второго года жизни состав микрофлоры кишечника ребенка по количественному и качественному составу постепенно расширяется: малыш уже ходит сам, и теперь ограничить его контакт с предметами, на которых живут разные микроорганизмы, довольно сложно. Домашние животные, вещи других детей и взрослых, оборудование детских площадок, почва и растения, – всё это источники микроорганизмов. Кроме того, существенно расширяется рацион ребенка. Что, с одной стороны, дает толчок для развития пищеварительной системы, а с другой – часто становится
После трех лет у детей значительно расширяется круг общения, ведь большинство из них посещает детский сад. Вместе с этим увеличивается нагрузка на иммунную систему. Прибавьте к этому стресс от изменения режима и образа жизни, смену рациона, отсутствие четких гигиенических навыков, – всё это серьезно испытывает кишечную микрофлору и иммунитет на прочность.
Микрофлора кишечника у детей в школьный период
Этот этап жизни ребенка характеризуется не меньшими рисками для состояния микрофлоры кишечника, чем дошкольный. Увеличивается количество ежедневных ситуаций, провоцирующих стрессы, нервная система пытается адаптироваться к многочисленным эмоциональным нагрузкам. Питание в столовых часто оставляет желать лучшего, да и отследить, чем в течение дня питается ребенок, предоставленный сам себе в течение дня, становится все сложнее.
Между тем, именно сбалансированное питание – залог нормального состояния микрофлоры, а значит здорового обмена веществ, роста и развития, состояния иммунитета.
Сладости и выпечка, столь любимые детьми, являются источником сахара и крахмалов, которые провоцируют рост патогенных микробов и грибков, затрудняют пищеварение, становятся причиной лишнего веса. Дефицит витаминов и периодических компонентов в рационе (овощей, фруктов, зелени, круп, ферментированных продуктов) сказывается на качестве жизнедеятельности кишечных бактерий, ведь именно
 Кроме того, пребиотики контролируют липидный и углеводный обмен, а значит, вес ребенка, двигательная активность которого с началом школьного года значительно снижается.
Кроме того, пребиотики контролируют липидный и углеводный обмен, а значит, вес ребенка, двигательная активность которого с началом школьного года значительно снижается.
Как восстановить микрофлору кишечника у детей?
Помочь пищеварению и снизить восприимчивость организма к инфекциям при адаптации ребенка к детскому саду или школе помогут пробиотические комплексы, такие, как «Панбиолакт Кидс». Это безмолочные пребиотики, о преимуществе которых речь пойдёт дальше.
Сегодня тема непереносимости молочных продуктов (молочного сахара или белков) активно обсуждается потребителями и исследуется в научных кругах.
Аллергическая реакция на молочные продукты часто возникает после инфекционных заболеваний кишечника (ротавирусных инфекций, энтеритов) или воспалений его слизистой оболочки, которые влияют на выработку и активность лактазы – фермента, расщепляющего молочный сахар лактозу. Может быть спровоцирована присутствием в организме паразитов, нарушениями в работе желудка, печени и желчного пузыря, дисбиозом.
Может быть спровоцирована присутствием в организме паразитов, нарушениями в работе желудка, печени и желчного пузыря, дисбиозом.
Дети могут проявлять чувствительность к молочным белкам вследствие незрелости пищеварительной системы, не имеющей необходимого набора ферментов, повышенной реакции неокрепшего иммунитета. Иммунная система может ошибочно воспринимать белковые компоненты молока как вредоносные и начинает их атаку, провоцируя выработку гистамина (вещества, вызывающего симптомы аллергической реакции).
Изучением микробиоты человека занимается биотехнологическое направление Артлайф. Бактерии в составе продуктов Артлайф выращены на гипоаллергенных (безмолочных) средах. Это минимизирует проявления чувствительности со стороны ослабленной пищеварительной системы и иммунитета, ускоряет улучшение состояния кишечника и его микрофлоры. Пробиотики Артлайф безопасны для потребителей с непереносимостью лактозы и молочного белка.
Нормализация микробиоты у пациентов после лечения поражений толстой кишки
1. Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2016. CA: Cancer J Clin. 2016;66:7–30. [PubMed] [Google Scholar]
Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2016. CA: Cancer J Clin. 2016;66:7–30. [PubMed] [Google Scholar]
2. Haggar FA, Boushey RP. Эпидемиология колоректального рака: заболеваемость, смертность, выживаемость и факторы риска. Clin Colon Rectal Surg. 2009;22:191–7. doi: 10.1055/s-0029-1242458. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Hellinger MD, Сантьяго, Калифорния. Повторная операция по поводу рецидива колоректального рака. Clin Colon Rectal Surg. 2006;19: 228–36. doi: 10.1055/s-2006-956445. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Ryuk JP, Choi GS, Park JS, Kim HJ, Park SY, Yoon GS, Jun SH, Kwon YC. Прогностические факторы и прогноз рецидива колоректального рака в течение 2 лет после радикальной резекции. Энн Сург Трит Рез. 2014; 86: 143–51. doi: 10.4174/астр.2014.86.3.143. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Howlader N, Noone AM, Krapcho M, Miller D, Bishop K, Kosary CL, Yu M, Ruhl J, Tatalovich Z, Mariotto A, Lewis Д. Р., Чен Х.С., Фейер Э.Дж., Кронин К.А., (ред.). Обзор статистики рака SEER, 19.75-2014, Национальный институт рака. Бетесда, Мэриленд. https://seer.cancer.gov/csr/1975_2014/.
Р., Чен Х.С., Фейер Э.Дж., Кронин К.А., (ред.). Обзор статистики рака SEER, 19.75-2014, Национальный институт рака. Бетесда, Мэриленд. https://seer.cancer.gov/csr/1975_2014/.
6. Goodwin AC, Destefano Shields CE, Wu S, Huso DL, Wu X, Murray-Stewart TR, Hacker-Prietz A, Rabizadeh S, Woster PM, Sears CL, Casero RA. Катаболизм полиаминов способствует индуцированному энтеротоксигенными Bacteroides fragilis онкогенезу толстой кишки. Proc Natl Acad Sci USA. 2011; 108:15354–9. doi: 10.1073/pnas.1010203108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Abed J, Emgård JEM, Zamir G, Faroja M, Almogy G, Grenov A, Sol A, Naor R, Pikarsky E, Atlan KA, Mellul A, Chaushu S, Manson AL, Earl AM, Ou N, Brennan CA, Garrett WS, Bachrach G. Fap2 опосредует обогащение колоректальной аденокарциномы Fusobacterium nucleatum путем связывания с Gal-GalNAc, экспрессируемым опухолью. Клеточный микроб-хозяин. 2016;20:215–25. doi: 10.1016/j.chom.2016.07.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Arthur JC, Gharaibeh RZ, Mühlbauer M, Perez-Chanona E, Uronis JM, McCafferty J, Fodor AA, Jobin C. Анализ микробного генома показывает существенную роль воспаления в бактериально-индуцированном колоректальном раке. Община природы. 2014;5:4724. doi: 10.1038/ncomms5724. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Arthur JC, Gharaibeh RZ, Mühlbauer M, Perez-Chanona E, Uronis JM, McCafferty J, Fodor AA, Jobin C. Анализ микробного генома показывает существенную роль воспаления в бактериально-индуцированном колоректальном раке. Община природы. 2014;5:4724. doi: 10.1038/ncomms5724. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Костич А.Д., Чун Э., Робертсон Л., Гликман Дж.Н., Галлини К.А., Мишо М., Клэнси Т.Е., Чанг Д.К., Лоххед П., Холд Г.Л., Эл -Омар Э.М., Бреннер Д., Фукс К.С., Мейерсон М., Гарретт В.С. Fusobacterium nucleatum потенцирует онкогенез кишечника и модулирует иммунное к опухоли микроокружение. Клеточный микроб-хозяин. 2013;14:207–15. doi: 10.1016/j.chom.2013.07.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Ву С., Ри К.Дж., Альбезиано Э., Рабизадех С., Ву Х., Йен Х.Р., Хусо Д.Л., Бранкати Ф.Л., Вик Э., Макаллистер Ф., Хуссо Ф., Пардолл Д.М., Сирс С.Л. Комменсал толстой кишки человека способствует онкогенезу толстой кишки посредством активации Т-клеточных ответов Т-хелперного типа 17. Природа Мед. 2009;15:1016–22. doi: 10.1038/nm.2015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Природа Мед. 2009;15:1016–22. doi: 10.1038/nm.2015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Zackular JP, Baxter NT, Chen GY, Schloss PD. Манипуляции с микробиотой кишечника выявляют роль в онкогенезе толстой кишки. мсфера. 2016; 1:1–12. doi: 10.1128/mSphere.00001-15. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Zackular JP, Baxter NT, Iverson KD, Sadler WD, Petrosino JF, Chen GY, Schloss PD. Микробиом кишечника модулирует онкогенез толстой кишки. мБио. 2013;4:e00692—00613. doi: 10.1128/mBio.00692-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Baxter NT, Zackular JP, Chen GY, Schloss PD. Структура кишечного микробиома после колонизации человеческими фекалиями определяет бремя опухоли толстой кишки. Микробиом. 2014;2:20. doi: 10.1186/2049-2618-2-20. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Флинн К.Дж., Бакстер Н.Т., Шлосс П.Д. Метаболический и общественный синергизм оральных бактерий при колоректальном раке. мсфера. 2016; 1:1–6. doi: 10.1128/mSphere.00102-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
мсфера. 2016; 1:1–6. doi: 10.1128/mSphere.00102-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Wang T, Cai G, Qiu Y, Fei N, Zhang M, Pang X, Jia W, Cai S, Zhao L. Структурная сегрегация кишечника микробиоты между больными колоректальным раком и здоровыми добровольцами. ISME J. 2012; 6: 320–9. doi: 10.1038/ismej.2011.109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Chen H-M, Yu Y-N, Wang J-L, Lin Y-W, Kong X, Yang C-Q, Yang L, Liu Z-J, Yuan Y-Z, Liu F, Wu J-X, Zhong L, Fang DC, Zou W, Fang J-Y. Снижение потребления пищевых волокон и структурное изменение микробиоты кишечника у пациентов с прогрессирующей колоректальной аденомой. Am J Clin Nutr. 2013;97:1044–52. doi: 10.3945/ajcn.112.046607. [PubMed] [CrossRef] [Google Scholar]
17. Chen W, Liu F, Ling Z, Tong X, Xiang C. Просвет кишечника человека и связанная со слизистой оболочкой микробиота у пациентов с колоректальным раком. PloS Один. 2012;е39743:7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Shen XJ, Rawls JF, Randall T, Burcal L, Mpande CN, Jenkins N, Jovov B, Abdo Z, Sandler RS, Keku TO. Молекулярная характеристика бактерий, прикрепляющихся к слизистой оболочке, и ассоциации с колоректальными аденомами. Кишечные микробы. 2010;1:138–47. doi: 10.4161/gmic.1.3.12360. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Shen XJ, Rawls JF, Randall T, Burcal L, Mpande CN, Jenkins N, Jovov B, Abdo Z, Sandler RS, Keku TO. Молекулярная характеристика бактерий, прикрепляющихся к слизистой оболочке, и ассоциации с колоректальными аденомами. Кишечные микробы. 2010;1:138–47. doi: 10.4161/gmic.1.3.12360. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Костич А.Д., Геверс Д., Педамаллу К.С., Мишо М., Герцог Ф., Эрл А.М., Ожесина А.И., Юнг Дж., Басс А.Дж., Табернеро Дж., Басельга J, Liu C, Shivdasani RA, Ogino S, Birren BW, Huttenhower C, Garrett WS, Meyerson M. Геномный анализ выявляет связь Fusobacterium с колоректальной карциномой. Геном Res. 2012;22:292–8. doi: 10.1101/gr.126573.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Feng Q, Liang S, Jia H, Stadlmayr A, Tang L, Lan Z, Zhang D, Xia H, Xu X, Jie Z, Su L, Li X, Li X, Li J, Xiao L, Huber-Schönauer U, Niederseer D, Xu X, Al-Aama JY, Yang H, Wang J, Kristiansen K, Arumugam M, Tilg H, Datz C, Wang J , Развитие кишечного микробиома вдоль последовательности колоректальной аденомы-карциномы. Нац коммун. 2015;6:6528. doi: 10.1038/ncomms7528. [PubMed] [CrossRef] [Академия Google]
Нац коммун. 2015;6:6528. doi: 10.1038/ncomms7528. [PubMed] [CrossRef] [Академия Google]
21. Дехеа К.М., Вик Э.К., Хехенблейкнер Э.М., Уайт Дж.Р., Марк Уэлч Д.Л., Россетти Б.Дж., Петерсон С.Н., Снесруд Э.К., Борисый Г.Г., Лазарев М., Штейн Э., Вадивелу Дж., Рослани А.С., Малик А.А., Ваньири Д.В., Го К.Л., Тевамбига И., Фу К., Ван Ф., Льоса Н., Хуссо Ф., Романс К., Ву Х, Макаллистер Ф.М., Ву С., Фогельштейн Б., Кинзлер К.В., Пардолл Д.М., Сирс С.Л. Организация микробиоты является отличительной чертой проксимального колоректального рака. Proc Natl Acad Sci USA. 2014; 111:18321–6. doi: 10.1073/pnas.1406199111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Мима К., Сукава Ю., Нишихара Р., Цянь З.Р., Ямаути М., Инамура К., Ким С.А., Масуда А., Новак Дж.А., Ношо К., Костич А.Д., Яннакис М., Ватанабэ Х., Буллман С., Милнер Д.А., Харрис CC, Giovannucci E, Garraway LA, Freeman GJ, Dranoff G, Chan AT, Garrett WS, Huttenhower C, Fuchs CS, Ogino S. Fusobacterium nucleatum и Т-клетки при колоректальной карциноме. JAMA Онкол. 2015; 1: 653–61. doi: 10.1001/jamaoncol.2015.1377. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
JAMA Онкол. 2015; 1: 653–61. doi: 10.1001/jamaoncol.2015.1377. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Arthur JC, Perez-Chanona E, Mühlbauer M, Tomkovich S, Uronis JM, Fan T-J, Campbell BJ, Abujamel T, Dogan B, Rogers AB , Rhodes JM, Stintzi A, Simpson KW, Hansen JJ, Keku TO, Fodor AA, Jobin C. Воспаление кишечника нацелено на канцерогенную активность микробиоты. Наука (Нью-Йорк) 2012; 338:120–3. doi: 10.1126/science.1224820. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Baxter NT, Ruffin MT, Rogers MAM, Schloss PD. Модель на основе микробиоты повышает чувствительность фекального иммунохимического теста для выявления поражений толстой кишки. Геном Мед. 2016;8:37. doi: 10.1186/s13073-016-0290-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Zeller G, Tap J, Voigt AY, Sunagawa S, Kultima JR, Costea PI, Amiot A, Böhm J, Brunetti F, Habermann N, Hercog Р., Кох М., Лучани А., Менде Д.Р., Шнайдер М.А., Шротц-Кинг П. , Турниганд С., Тран Ван Нье Дж., Ямада Т., Циммерманн Дж., Бенеш В., Клоор М., Ульрих С.М., Кнебель Дебериц Мвон, Собхани И., Борк P. Возможности фекальной микробиоты для раннего выявления колоректального рака. Мол Сист Биол. 2014;10:766. doi: 10.15252/msb.20145645. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Турниганд С., Тран Ван Нье Дж., Ямада Т., Циммерманн Дж., Бенеш В., Клоор М., Ульрих С.М., Кнебель Дебериц Мвон, Собхани И., Борк P. Возможности фекальной микробиоты для раннего выявления колоректального рака. Мол Сист Биол. 2014;10:766. doi: 10.15252/msb.20145645. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Zackular JP, Rogers MAM, Ruffin MT, Schloss PD. Микробиом кишечника человека как инструмент скрининга колоректального рака. Cancer Prev Res (Филадельфия) 2014; 7: 1112–21. doi: 10.1158/1940-6207.CAPR-14-0129. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
27. O’Brien CL, Allison GE, Grimpen F, Pavli P. Влияние подготовки кишечника для колоноскопии на микробиоту кишечника. ПЛОС ОДИН. 2013;e62815:8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Kozich JJ, Westcott SL, Baxter NT, Highlander SK, Schloss PD. Разработка стратегии секвенирования с двойным индексом и конвейера курирования для анализа данных последовательности ампликона на платформе секвенирования MiSeq Illumina. Appl Environ Microbiol. 2013;79: 5112–20. doi: 10.1128/AEM.01043-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Appl Environ Microbiol. 2013;79: 5112–20. doi: 10.1128/AEM.01043-13. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Pruesse E, Quast C, Knittel K, Fuchs BM, Ludwig W, Peplies J, Glöckner FO, SILV A. Комплексный онлайн-ресурс для проверки качества и данные выровненной последовательности рибосомной РНК, совместимые с ARB. Нуклеиновые Кислоты Res. 2007; 35: 7188–96. doi: 10.1093/nar/gkm864. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Edgar RC, Haas BJ, Clemente JC, Quince C, Knight R. UCHIME повышает чувствительность и скорость обнаружения химер. Биоинформатика. (Оксфорд, Англия) 2011; 27:2194–200. doi: 10.1093/биоинформатика/btr381. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Wang Q, Garrity GM, Tiedje JM, Cole JR. Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой таксономии бактерий. Appl Environ Microbiol. 2007; 73: 5261–7. doi: 10.1128/AEM.00062-07. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Schloss PD, Westcott SL. Оценка и улучшение методов, используемых в операционных подходах на основе таксономических единиц для анализа последовательности гена 16S рРНК. Appl Environ Microbiol. 2011;77:3219–26. doi: 10.1128/AEM.02810-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Schloss PD, Westcott SL. Оценка и улучшение методов, используемых в операционных подходах на основе таксономических единиц для анализа последовательности гена 16S рРНК. Appl Environ Microbiol. 2011;77:3219–26. doi: 10.1128/AEM.02810-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Брейман Л. Случайные леса. Мах Учиться. 2001;45:5–32. doi: 10.1023/A:1010933404324. [CrossRef] [Google Scholar]
34. Anderson MJ, Walsh DCI. PERMANOVA, ANOSIM и тест Мантеля перед лицом неоднородных дисперсий: какую нулевую гипотезу вы проверяете? Эколь моногр. 2013; 83: 557–74. дои: 10.1890/12-2010.1. [CrossRef] [Google Scholar]
35. Benjamini Y, Hochberg Y. Управление частотой ложных открытий: практичный и мощный подход к множественному тестированию. J Royal Stat Soc Ser B Methodol. 1995;57:289–300. [Google Scholar]
Нормализация врожденного воспаления пробиотиками при СД1
- Логин
- Регистр
- Забыли пароль
Название проекта: Пробиотическая нормализация врожденного воспаления при СД1
Тип гранта: Инновационная клиническая или трансляционная наука
Тип диабета: Диабет 1 типа
Дата начала проекта: 1 января 2019 г.
Дата окончания проекта: 31 декабря, 2022
Фокус: иммунология, педиатрические Статус: Активный
Терапевтическая цель: Лечение диабета
Описание исследования
В желудочно-кишечном тракте человека обитают миллиарды бактерий, что представляет собой значительный контакт с окружающей средой. Эти полезные организмы подавляют рост патогенов и влияют на развитие и функцию иммунной системы. Имеющиеся данные свидетельствуют о том, что современный образ жизни может способствовать росту измененной субоптимальной кишечной флоры. Хотя развитие диабета 1 типа (СД1) имеет сильную генетическую основу, этот потенциально модулируемый фактор окружающей среды может лежать в основе роста заболеваемости СД1, наблюдаемого за последние полвека. Действительно, дисбактериоз и измененная барьерная функция кишечника связаны с прогрессированием СД1 у людей, а также в моделях диабета на грызунах. Этот проект расширяет исследования повышенного врожденного воспалительного состояния, которое присутствует у пациентов с СД1, а также у здоровых членов их семей. Это воспалительное состояние согласуется с реакцией на молекулы микробного происхождения. Аналогичное воспалительное состояние наблюдается в модели диабета 1 типа у крыс BioBreeding; в этой модели протоколы диеты или антибиотиков, которые способствуют росту противовоспалительных бактерий (например, лактобацилл) в кишечном тракте, нормализуют воспалительное состояние и отсрочивают/предотвращают СД1. Кроме того, неонатальное использование пробиотиков было связано со сниженным риском развития островковых специфических аутоантител у детей с высоким генетическим риском. Эти результаты подтверждают возможность того, что добавление пробиотиков с «противовоспалительными» бактериями может уменьшить семейное воспалительное состояние и продлить функцию бета-клеток (период медового месяца) у пациентов с впервые выявленным СД1. В предлагаемых исследованиях будут рассмотрены эти вопросы, поскольку выявление безопасных, широко применимых модификаторов окружающей среды, влияющих на прогрессирование СД1, имеет решающее значение для разработки профилактических и терапевтических подходов.
Этот проект расширяет исследования повышенного врожденного воспалительного состояния, которое присутствует у пациентов с СД1, а также у здоровых членов их семей. Это воспалительное состояние согласуется с реакцией на молекулы микробного происхождения. Аналогичное воспалительное состояние наблюдается в модели диабета 1 типа у крыс BioBreeding; в этой модели протоколы диеты или антибиотиков, которые способствуют росту противовоспалительных бактерий (например, лактобацилл) в кишечном тракте, нормализуют воспалительное состояние и отсрочивают/предотвращают СД1. Кроме того, неонатальное использование пробиотиков было связано со сниженным риском развития островковых специфических аутоантител у детей с высоким генетическим риском. Эти результаты подтверждают возможность того, что добавление пробиотиков с «противовоспалительными» бактериями может уменьшить семейное воспалительное состояние и продлить функцию бета-клеток (период медового месяца) у пациентов с впервые выявленным СД1. В предлагаемых исследованиях будут рассмотрены эти вопросы, поскольку выявление безопасных, широко применимых модификаторов окружающей среды, влияющих на прогрессирование СД1, имеет решающее значение для разработки профилактических и терапевтических подходов.
Профиль исследования
Какую область исследования диабета охватывает ваш проект? Какую роль этот конкретный проект будет играть в профилактике, лечении и/или лечении диабета?
Рост заболеваемости СД1 за последние несколько десятилетий совпадает с увеличением использования антибиотиков и внедрением западной диеты. Эти изменения окружающей среды, вероятно, изменили кишечную микробиоту. Дисбиоз и гиперпроницаемость кишечника были связаны с СД1 в моделях грызунов и людей. Примечательно, что модулирование кишечной микробиоты путем изменения диеты, лечения антибиотиками или пробиотическими добавками может нормализовать системное воспаление и отсрочить/предотвратить диабет в моделях на грызунах. Недавно применение пробиотиков у новорожденных было связано со снижением риска аутоиммунитета островков у детей с высоким генетическим риском. Этот проект направлен на определение того, снижает ли прием пробиотиков в период непосредственно после начала заболевания системное воспаление и скорость снижения функции бета-клеток. Полученные знания будут непосредственно применимы к профилактическим стратегиям у лиц с высоким генетическим риском развития СД1.
Полученные знания будут непосредственно применимы к профилактическим стратегиям у лиц с высоким генетическим риском развития СД1.
Если бы человек с диабетом спросил вас, как ваш проект поможет ему в будущем, что бы вы ответили?
При СД1 сохранение даже номинальной функции β-клеток связано с уменьшением частоты ретинопатии, нефропатии и тяжелой гипогликемии. Этот проект направлен на определение того, снижает ли прием пробиотиков в период непосредственно после начала заболевания системное воспаление и скорость снижения функции бета-клеток. Если это исследование покажет пользу, оно поддержит предпосылку для дополнительных исследований, которые изучают потенциал пробиотических добавок для 1) снижения вероятности возникновения заболевания у субъектов из группы риска; и 2) снизить риск вторичных/микрососудистых осложнений у пациентов с установленным заболеванием.
Почему лично для вас важно участвовать в исследованиях диабета? Какую роль эта награда сыграет в ваших исследованиях?
Моя страсть к иммунологии и диабету 1 типа проистекает из личного интереса к аутоиммунитету.