Как правильно осуществлять кормление тяжелобольных пациентов через назогастральный зонд и гастростому. Какие существуют показания для установки гастростомы. Какие правила ухода за гастростомой необходимо соблюдать. Какие осложнения могут возникнуть при энтеральном питании.
Особенности кормления тяжелобольных пациентов
Правильное питание играет crucial роль в лечении и реабилитации тяжелобольных пациентов. Когда пациент не может принимать пищу через рот, используются альтернативные методы кормления — через назогастральный зонд или гастростому.
Кормление через назогастральный зонд
Назогастральный зонд — это тонкая трубка, которая вводится через нос в желудок пациента. Через нее можно вводить жидкое питание и лекарства. Этот метод обычно используется в течение короткого периода времени (до 4-6 недель).
Основные правила кормления через назогастральный зонд:
- Перед каждым кормлением необходимо проверять правильность расположения зонда
- Пациент должен находиться в полусидячем положении во время и 30-60 минут после кормления
- Питательную смесь нужно вводить медленно, небольшими порциями
- После кормления зонд необходимо промывать водой
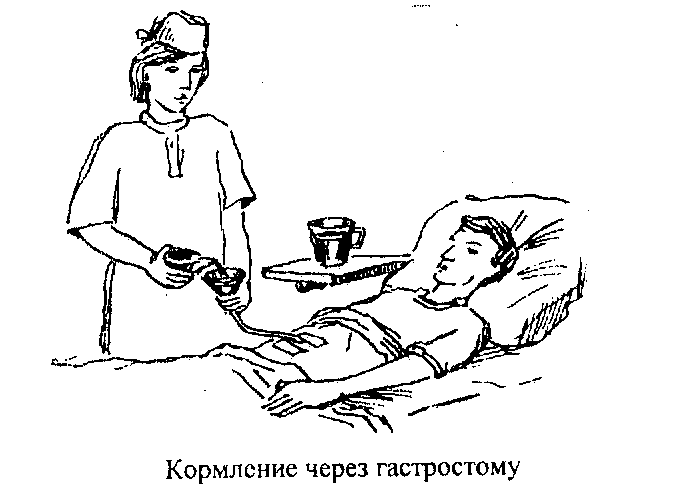
Кормление через гастростому
Гастростома — это искусственное отверстие, наложенное хирургическим путем на переднюю брюшную стенку, соединяющее желудок с внешней средой. Она используется для длительного энтерального питания.

Основные преимущества гастростомы перед назогастральным зондом:
- Более комфортна для пациента
- Позволяет осуществлять питание в течение длительного времени
- Снижает риск развития пролежней в носоглотке
- Облегчает уход за полостью рта
Показания для установки гастростомы
Основными показаниями для наложения гастростомы являются:
- Необходимость в длительном энтеральном питании (более 4-6 недель)
- Нарушение глотания различной этиологии
- Опухоли головы, шеи, пищевода
- Травмы лицевого скелета
- Длительное бессознательное состояние
- Тяжелые неврологические заболевания
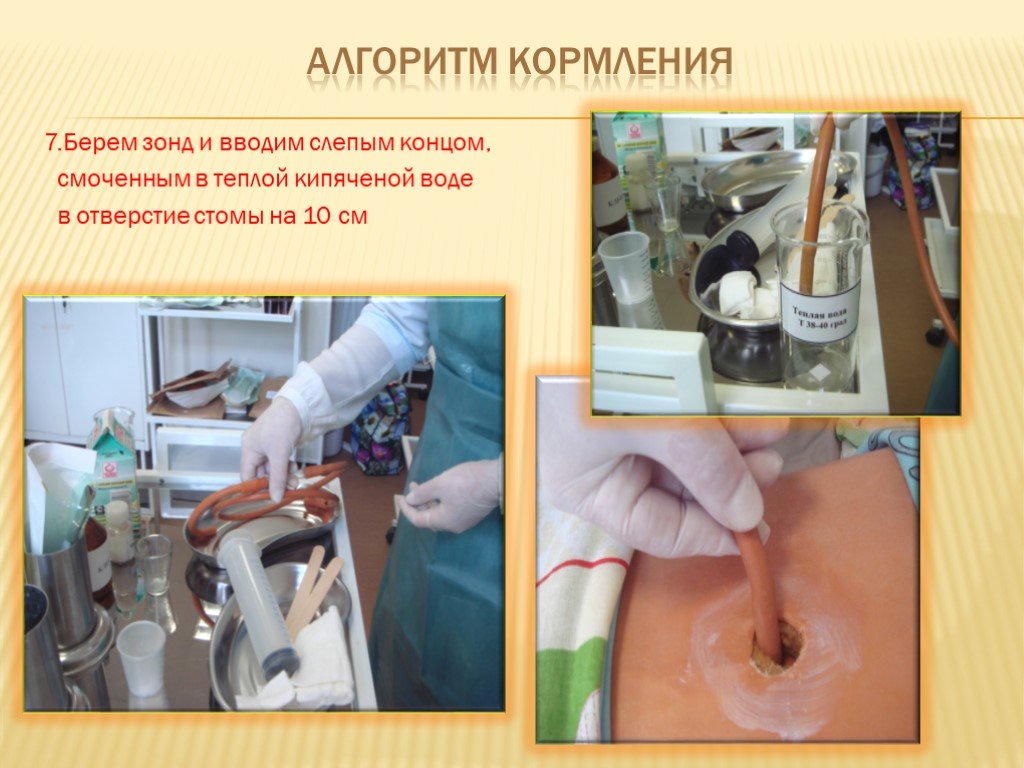
Алгоритм кормления через гастростому
Правильная техника кормления через гастростому включает следующие этапы:
- Придать пациенту полусидячее положение
- Промыть гастростомическую трубку теплой кипяченой водой
- Подготовить необходимое количество питательной смеси комнатной температуры
- Медленно вводить смесь небольшими порциями (по 20-30 мл)
- После введения смеси снова промыть трубку водой
- Оставить пациента в полусидячем положении на 30-60 минут
Правила ухода за гастростомой
Для профилактики осложнений необходимо соблюдать следующие правила ухода за гастростомой:

- Ежедневно осматривать кожу вокруг стомы
- Обрабатывать кожу антисептиком и накладывать стерильную повязку
- Менять фиксирующую пластину каждые 5-7 дней
- Промывать гастростомическую трубку после каждого кормления
- Менять трубку каждые 2-3 месяца
- При покраснении или отделяемом из стомы обращаться к врачу
Возможные осложнения при энтеральном питании
При кормлении через зонд или гастростому могут возникать следующие осложнения:
- Аспирационная пневмония
- Диарея или запор
- Тошнота и рвота
- Метаболические нарушения
- Инфицирование стомы
- Подтекание содержимого желудка
Для профилактики осложнений необходимо строго соблюдать правила кормления и ухода за питательными зондами и стомами, а также регулярно контролировать состояние пациента.
Преимущества энтерального питания
Несмотря на возможные осложнения, энтеральное питание имеет ряд важных преимуществ по сравнению с парентеральным:
- Более физиологично и безопасно
- Поддерживает функцию желудочно-кишечного тракта
- Снижает риск инфекционных осложнений
- Предотвращает атрофию слизистой кишечника
- Экономически более выгодно
Поэтому при наличии функционирующего ЖКТ энтеральное питание является методом выбора для нутритивной поддержки тяжелобольных пациентов.
Выбор питательных смесей
Для энтерального питания используются специальные жидкие питательные смеси, которые подбираются индивидуально с учетом состояния пациента. Основные виды смесей:
- Полимерные — содержат цельные белки, углеводы и жиры
- Полуэлементные — содержат частично гидролизованные нутриенты
- Специализированные — для пациентов с особыми потребностями
Выбор оптимальной смеси осуществляется врачом-диетологом на основании диагноза, нутритивного статуса и функции ЖКТ пациента.
Мониторинг состояния пациента
При проведении энтерального питания необходим регулярный контроль следующих показателей:
- Масса тела
- Водный баланс
- Биохимические показатели крови
- Толерантность к питанию
- Функция ЖКТ
- Состояние кожи вокруг стомы
Это позволяет своевременно выявлять и корректировать возможные осложнения энтерального питания.
Заключение
Энтеральное питание через назогастральный зонд или гастростому является важнейшим компонентом лечения тяжелобольных пациентов. При правильном выполнении оно позволяет обеспечить адекватную нутритивную поддержку и улучшить результаты лечения. Ключевыми факторами успеха являются соблюдение техники кормления, тщательный уход и регулярный мониторинг состояния пациента.
Кормление пациента через гастростому: показания и особенности
Когда пациенты не получают питательные вещества в достаточном количестве, их переводят на специализированное питание. Оно помогает не допустить истощения организма.
Если у пациента нет противопоказаний, врач выбирает пероральный приём готовых питьевых смесей или в ряде случаев энтеральное зондовое питание, при котором питательные смеси вводят через зонд или гастростому.
Наиль Егофаров
Директор по научно-медицинской работе и выводу продуктов на рынок Nutricia
В этой статье расскажем, как правильно питаться пациентам с гастростомой, или гастростомической трубкой, которую устанавливают через брюшную стенку в желудок путём хирургической манипуляции.
Гастростома — небольшая трубка, которая соединяет стенки желудка и брюшной полости
Зондовое питание пациентов Питание смесями для сипинга
Когда устанавливают гастростому
Гастростому устанавливают в двух случаях: когда зондовое питание продолжается более 30 дней4, или если пациенту противопоказана установка желудочного или кишечного зонда.
При длительном зондовом питании предпочтение отдают гастростоме, потому что она приносит меньше дискомфорта, чем зонд, который вводят через носовой проход. Преимущество гастростомы в том, что её приходится менять не так часто. После заживления послеоперационной раны пациент может находиться дома и заниматься привычными делами.
Бывают ситуации, когда установить назогастральный зонд невозможно: например, если у пациента опухоль головы, шеи или пищевода, травма лицевого скелета или мягких тканей лица или пациент перенёс операцию на костях лицевого скелета. В этих и некоторых других случаях врач может посоветовать установить гастростому.
Как правильно кормить пациента через гастростому
Пациентов с гастростомой выписывают из стационара, и они могут находиться дома. Вот что нужно, чтобы организовать питание в домашних условиях.
Для кормления через гастростому понадобятся тёплая кипячёная вода, питательная смесь и пара шприцев — для воды и смеси.
Пациентов с гастростомой можно кормить специализированной смесью и жидкой домашней едой. Что и в каких количествах давать пациенту, определяет врач. Единственное требование к питательной смеси — она должна быть жидкой и без комочков, иначе зонд может засориться. Если гастростомическую трубку не получится промыть водой, пациенту понадобится помощь врача.
Перед кормлением и после него рекомендуют промывать трубку зонда тёплой кипячёной водой. Это нужно для профилактики бактериальных осложнений, ведь смесь — отличная среда для развития бактерий.
Питательные смеси вводят в зонд с помощью шприца, специальных насосов или гравитационных систем для кормления. Подойдёт любое приспособление, которым удобнее пользоваться.
Главное в кормлении — вводить смесь медленно. Если делать это быстро, у пациента возникнут побочные реакции — рвота или отрыжка. На кормление может уходить до одного часа.
На кормление может уходить до одного часа.
Важно следить за гигиеной полости рта пациента, даже если он не ест через рот. Манипуляции простые — чистка зубов дважды в день и полоскание рта специальной жидкостью или искусственной слюной при необходимости.
Соблюдать гигиену важно, потому что на зубах быстро образуется налёт, даже если пациент через рот питается редко или не питается совсем. Если не удалять его и не предотвращать его появление, могут возникнуть болезненные ощущения. Кроме этого, плохая гигиена повышает риски развития воспалительных процессов в носоглотке и верхних дыхательных путях.
Жидкая гомогенная еда, гигиена зонда и полости рта — основа комфортного питания дома без осложнений.
20 минутминимальное время кормления1
Уход за гастростомой
Гастростома требует ухода. Вот основные правила, которые нужно соблюдать, чтобы избежать осложнений2:
- ежедневно промывать тёплой водой с мылом кожу вокруг стомы и под устройством внешней фиксации;
- регулярно менять повязки и следить, чтобы кожа вокруг стомы была сухой, пока послеоперационная рана не заживёт.
 Такой уход снижает вероятность инфицирования;
Такой уход снижает вероятность инфицирования; - после полного формирования стомы ежедневно поворачивать гастростомическую трубку на 360O, чтобы вокруг стомы не нарастала грануляционная ткань;
- промывать зонд после каждого кормления или каждые восемь часов, даже если через него ничего не вводили. Это профилактика бактериальных осложнений;
- немедленно обратиться к врачу, если зонд выпал или засорился, а очистить его не получилось.
Питание через гастростому рассчитано на длительный срок. Пациенты с гастростомой питаются жидкой однородной едой или готовыми специализированными смесями, которые подбирает врач.
Все манипуляции можно совершать дома, но для этого нужно проконсультироваться с врачом. Он подберёт смесь, рассчитает объём питания и воды для пациента, а после покажет, как ухаживать за гастростомой.
Источники
- Медицинский информационный ресурс www.
 hippocratic.ru, URL: http://www.hippocratic.ru/medtext1/medtext_19382.htm (Дата обращения: 13.08.2021)
hippocratic.ru, URL: http://www.hippocratic.ru/medtext1/medtext_19382.htm (Дата обращения: 13.08.2021) - Электронный фонд правовых и нормативно-технических документов, URL: https://docs.cntd.ru/document/1200119181 (Дата обращения: 13.08.2021)
- Электронный фонд правовых и нормативно-технических документов, URL: https://docs.cntd.ru/document/901871304 (Дата обращения: 13.08.2021)
- Чуприна С. Е. и соавт. Нутритивная поддержка у пациентов с острым нарушением мозгового кровообращения. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018; 118(1): 110–114.
Получите бесплатную консультацию по питанию от специалистов СберЗдоровья
Получить консультациюЧто ещё почитать
Общая информация
28.01.22Общая информация
26.10.22Общая информация
Паллиатив
20. 10.22
10.22Общая информация
Онкология
28.01.22Общая информация
28.10.22Общая информация
Онкология
28.01.22Новейший справочник медицинской сестры / Библиотека / Медицинский справочник
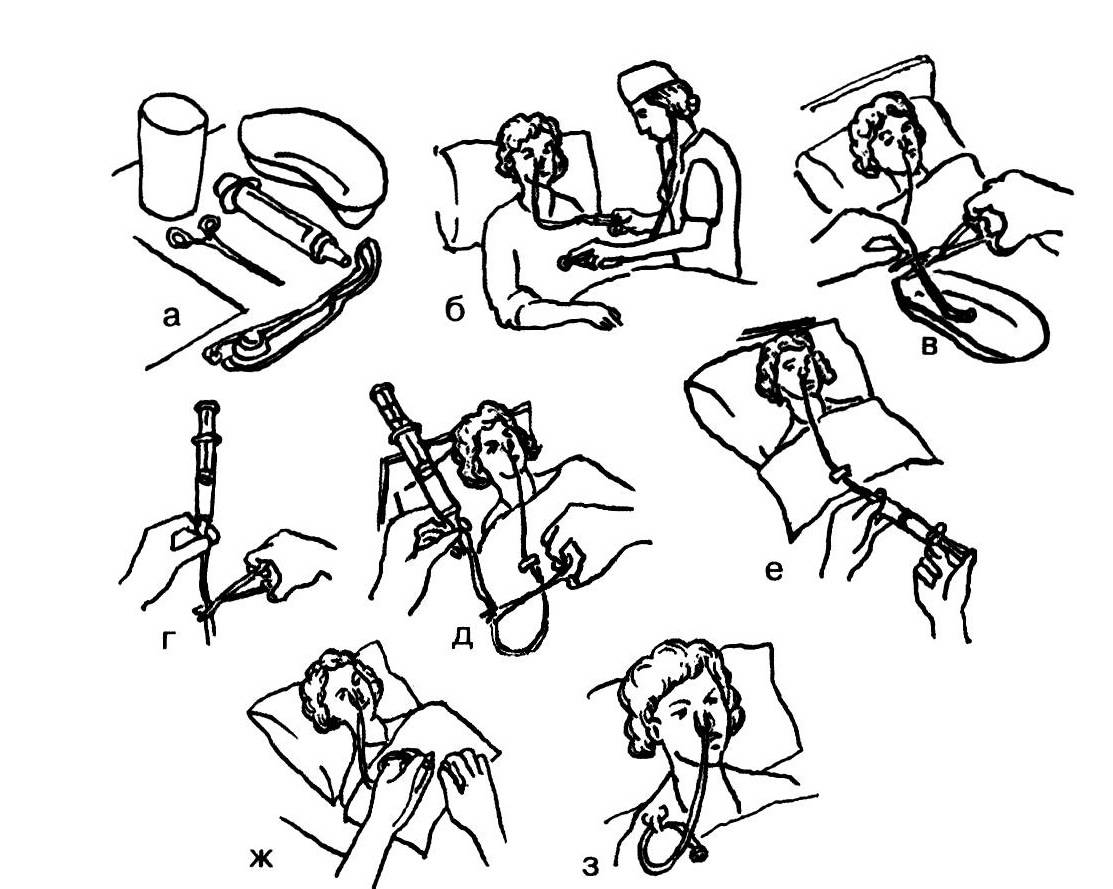
Кормление тяжелобольного через рот и назогастральный зонд
Материалы и инструменты
— AD —
Фонендоскоп, система для непрерывного режима зондового кормления, шприц (20–50 мл), зажим, изотонический раствор хлорида натрия, салфетка, лейкопластырь, перчатки нестерильные, воронка, комплект столовой посуд, часы.
Алгоритм кормления
Подготовительный этап
Если при зондовом питании используются инфузионные насосы, настройка и порядок работы определяются инструкцией к ним.
Используемый инвентарь, посуда и ортопедические протезные приспособления могут варьироваться в зависимости от назначений специалиста по восстановительной медицине.
Недоношенным детям, выхаживаемым в кювезе, а также травмированным вертикальное положение не придается.
До и после проведения процедуры провести гигиеническую обработку рук.
Во время процедуры необходимо использовать перчатки.
Следует идентифицировать пациента, представиться, если он находится в сознании.
Проинформировать о кормлении, составе и объеме пищи, методе кормления.
Должно быть добровольное информированное согласие.
Письменного подтверждения согласия не требуется.
Необходимо гигиеническим способом обработать руки, осушить, надеть перчатки, если кормление будет осуществляться через назогастральный зонд.
Подготовить питательный раствор; подогреть его до температуры 30–35° С.
Ход выполнения
1. При кормлении через рот
Следует помочь пациенту занять в постели полусидячее положение, положение с опущенными ногами, или помочь пересесть на стул.
Необходимо помочь ему вымыть руки, расчесаться. Если у него съемные зубные протезы, помочь установить их, закрыв грудь салфеткой.
Если у него съемные зубные протезы, помочь установить их, закрыв грудь салфеткой.
Придвинув прикроватный столик к кровати, сервировать его.
В соответствии с пожеланиями пациента разместить тарелки с едой. Если у него нарушена моторика, подложить нескользящие салфетки.
Если нарушена координация, следует предложить посуду с бортиком или другую, которую рекомендуют специалисты.
Затем предложить пациенту столовые приборы.
2. Если пациент может есть самостоятельно
В случае необходимости использовать приспособления для предплечья, облегчающие подъем руки до уровня рта (подвижные подставки, поддерживающие ремни, которые одеваются через голову), а также протезы и ортопедические приспособления.
При этом следует обязательно наблюдать за процессом пережевывания и глотания.
При необходимости менять тарелки.
После окончания приема пищи помочь пациенту прополоскать рот, занять в постели удобное положение.
3. Если пациент нуждается в активном кормлении
Следует немного приподнять головной конец кровати.
Убедиться, что пища имеет гомогенную консистенцию.
Затем придвинуть прикроватный столик к кровати, сервировать стол.
Одной рукой следует несколько приподнять голову пациента, другой поднести к его рту ложку, придерживая его голову во время жевания и глотания.
При гемипарезе пищу подносят с той стороны, которая является здоровой.
Следует поить пациента по требованию или после того, как он съест 3–5 ложек пищи.
Жидкость необходимо давать при помощи ложки или поильника.
После окончания кормления необходимо помочь пациенту прополоскать рот или обработать его в соответствии с протоколом 14.07.002 «Уход за полостью рта тяжелобольного».
После окончания еды на 30 минут следует придать пациенту полусидячее положение.
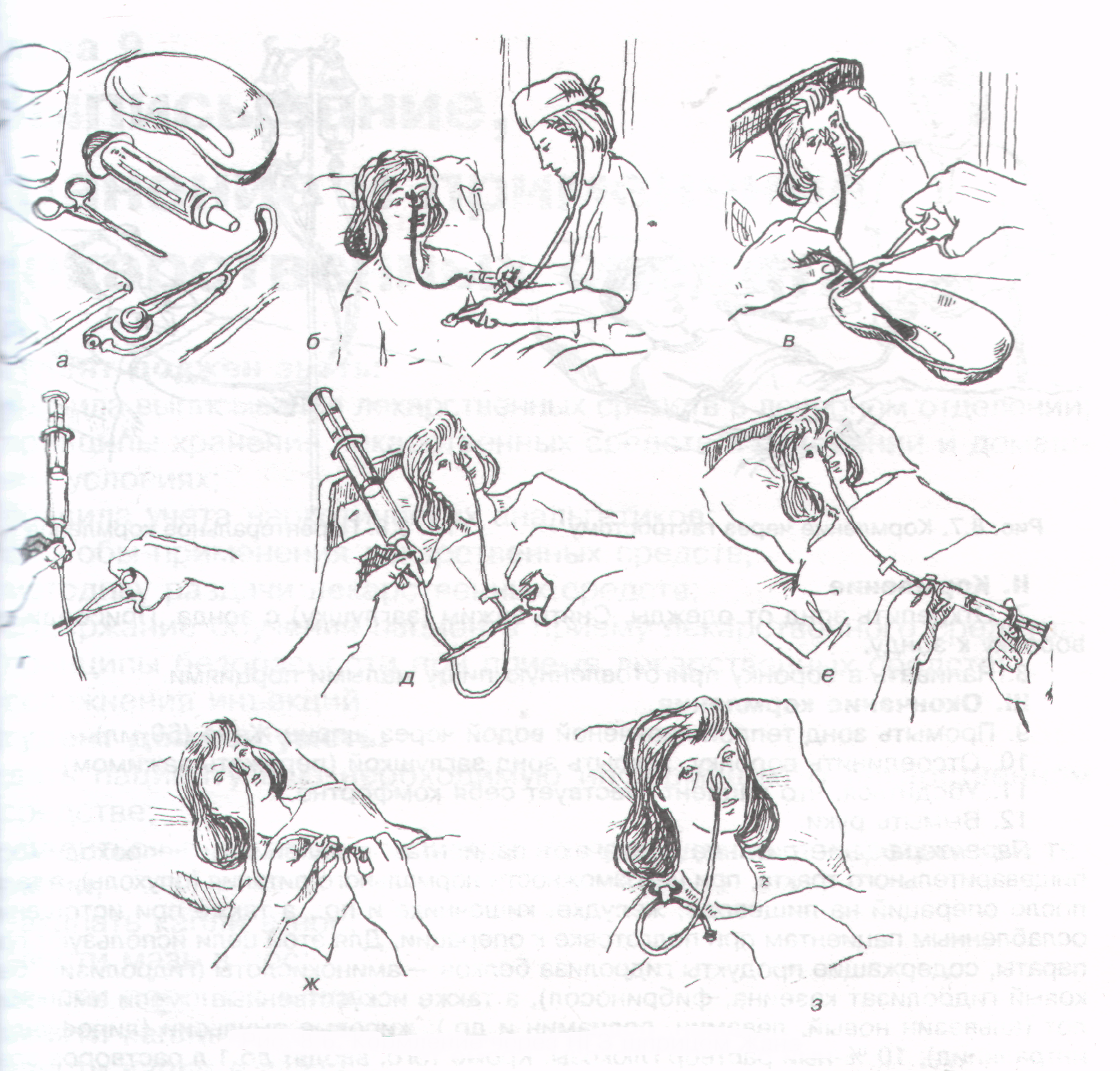
4. При кормлении через назогастральный зонд
Следует уточнить предписанный пациенту непрерывный или перемежающийся (фракционный) режим кормления.
Необходимо вымыть и осушить руки, используя при этом мыло или антисептик.
Головной конец кровати следует приподнять на 30–45 градусов.
При этом следует обязательно проверить правильность положения зонда.
К дистальному участку зонда необходимо присоединить шприц (20 см3) и аспирировать содержимое желудка, оценив его характер.
При появлении кровотечения и признаков нарушения эвакуации желудочного содержимого кормление следует прекратить.
Затем к дистальному участку зонда следует присоединить шприц, заполненный 20 см3 воздуха и ввести воздух внутрь, одновременно аускультируя область эпигастрия.
Осмотреть кожу и слизистые носа, исключив инфицирование и трофические нарушения, связанные с процессом постановки назогастрального зонда.
Проверить фиксацию зонда, при необходимости следует заменить пластырную повязку.
5. При непрерывном режиме зондового кормления
Сначала следует промыть емкость для питательной смеси и соединительную канюлю.
Затем заполнить емкость назначенной питательной смесью.
К дистальному участку назогастрального зонда или приемному штуцеру инфузионного насоса следует присоединить канюлю.
При этом необходимо установить необходимую скорость введения раствора при помощи дозатора канюли или блока управления.
Через каждый 1 ч следует обязательно контролировать скорость введения раствора и объем смеси, которая вводится, а также аускультировать перистальтические шумы во всех квадрантах живота.
Каждые 3 ч необходимо проверять остаточный объем желудочного содержимого.
Если объем показателя, который указан в назначении врача, превышен, необходимо прекратить кормление.
После окончания процедуры следует промыть зонд физиологическим или другим раствором (20–30 мл) в соответствии с назначенной схемой.
6. При перемежающимся (фракционном) режиме зондового кормления
Следует подготовить объем питательной смеси, который назначен, перелив его в чистую посуду.
Заполнив питательным раствором шприц (20–50 мл) или воронку вести активно медленно (с помощью шприца) или пассивно (с помощью воронки) объем питательной смеси в желудок пациента.
Введение следует производить дробно по 20–30 мл с интервалом между порциями 1–3 мин.
После введения очередной порции пережимать дистальный участок зонда, препятствуя его опустошению.
После окончания процедуры ввести назначенный пациенту объем воды.
Если не предусмотрено введение жидкости, промыть зонд физиологическим раствором (30 мл).
Завершающий этап
В завершении необходимо во всех квадрантах живота аускультировать перистальтические шумы.
Следует обработать ротовую полость, вытереть лицо пациента.
Затем необходимо продезинфицировать использованный материал.
Сняв перчатки, гигиеническим способом обработать руки и осушить их.
Справиться у пациента о его самочувствии.
В медицинской документации сделать запись о процедуре.
Поддержание энтерального питания у тяжелобольных с использованием недавно разработанного назоеюнального питательного зонда с функцией декомпрессии желудка
Intern Med. 2016 15 октября; 55 (20): 2945–2950.
doi: 10.2169/internalmedicine.55.6915
, 1 , 1 и 1
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности 90 003
Для нутритивной поддержки тяжелобольных пациентов энтеральный путь предпочтительнее, чем парентеральный путь. Хотя назоеюнальное питание может быть лучше желудочного при возникновении гастроинтестинальных симптомов, оно не обязательно решает проблему больших остаточных объемов желудка. Мы сообщаем об успешном использовании недавно разработанного назоеюнального питательного зонда с функцией декомпрессии желудка у 84-летнего мужчины с тяжелой пневмонией. После того, как желудочное питание было сочтено плохо переносимым, использование этой трубки улучшило доставку питания до тех пор, пока состояние пациента не стало достаточно стабильным для выполнения чрескожной эндоскопической гастростомии.
Ключевые слова: энтеральное питание, назоеюнальный зонд, декомпрессия желудка, аспирационная пневмония, тяжелобольные
С 2011 года пневмония обогнала цереброваскулярные нарушения и стала третьей по значимости причиной смерти в Японии.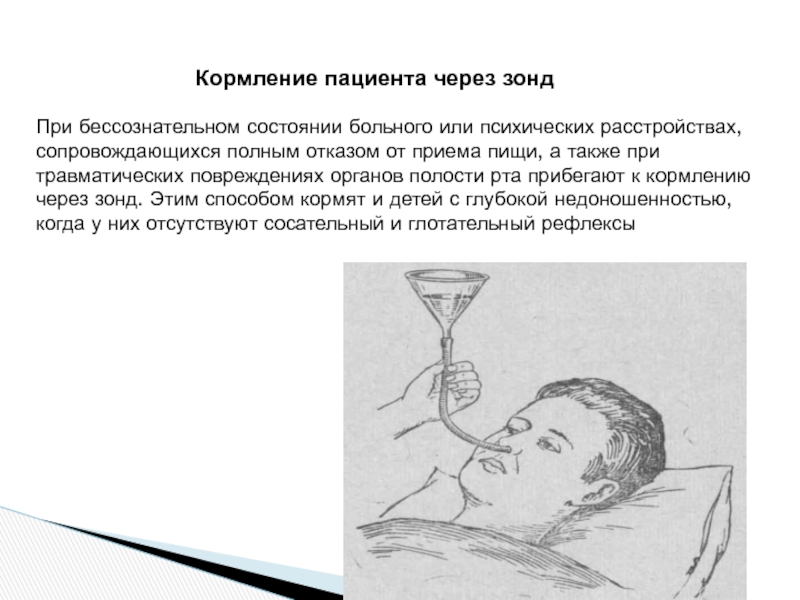 Пожилые люди особенно склонны к развитию тяжелой пневмонии из-за различных сопутствующих заболеваний (1). Нутритивная поддержка играет неотъемлемую роль в лечении пациентов в критическом состоянии, и энтеральный путь всегда предпочтительнее парентерального (2-4). Энтеральное питание обычно начинается с желудочного питания через назогастральный зонд, потому что его легче достичь, но пищевая непереносимость, обычно определяемая как большой остаточный объем желудка (назогастральный аспират> 350-400 мл) вместе с желудочно-кишечными симптомами, может достигать 40%. у тяжелобольных (5). Обычным решением при непереносимости желудочного питания является использование постпилорического (дуоденального или тощекишечного) питания. Однако замедленное опорожнение желудка и сохраняющиеся большие остаточные объемы желудка могут по-прежнему приводить к микроаспирации и пневмонии. Здесь мы сообщаем об успешном использовании недавно разработанного назоеюнального зонда с функцией декомпрессии желудка у пациента с септическим шоком из-за тяжелой пневмонии.
Пожилые люди особенно склонны к развитию тяжелой пневмонии из-за различных сопутствующих заболеваний (1). Нутритивная поддержка играет неотъемлемую роль в лечении пациентов в критическом состоянии, и энтеральный путь всегда предпочтительнее парентерального (2-4). Энтеральное питание обычно начинается с желудочного питания через назогастральный зонд, потому что его легче достичь, но пищевая непереносимость, обычно определяемая как большой остаточный объем желудка (назогастральный аспират> 350-400 мл) вместе с желудочно-кишечными симптомами, может достигать 40%. у тяжелобольных (5). Обычным решением при непереносимости желудочного питания является использование постпилорического (дуоденального или тощекишечного) питания. Однако замедленное опорожнение желудка и сохраняющиеся большие остаточные объемы желудка могут по-прежнему приводить к микроаспирации и пневмонии. Здесь мы сообщаем об успешном использовании недавно разработанного назоеюнального зонда с функцией декомпрессии желудка у пациента с септическим шоком из-за тяжелой пневмонии.
У 84-летнего японца с деменцией в доме престарелых поднялась температура, и он получил лечение от инфекции верхних дыхательных путей в ближайшей клинике. Однако лихорадка сохранялась, и через два дня он был направлен в нашу больницу в связи со снижением артериального давления, снижением SpO 2 (сатурация периферического кислорода) и потерей сознания.
При поступлении у больного дыхательная недостаточность и шок. Артериальное давление 77/48 мм рт.ст., пульс 107 ударов в минуту (регулярный), SpO 2 составляла 84% даже при подаче кислорода со скоростью 10 л/мин через резервуарную маску и частоте дыхания 32 вдоха в минуту. Температура тела 38,3℃, слышны грубые хрипы в легочных полях с обеих сторон (справа > слева). Его уровень сознания был изменен по Японской шкале комы (JCS) III-200 или по шкале комы Глазго 3 (E1V1M1). Рентгенограмма грудной клетки и компьютерная томография показали диффузную консолидацию в обоих легких, соответствующую острой пневмонии.
Открыть в отдельном окне
Рентгенограмма грудной клетки и КТ при поступлении выявляют диффузное уплотнение в обоих легких (справа>слева).
Лабораторные данные () при поступлении продемонстрировали лейкоцитоз (27 180 мкл) с нейтрофилией (98%) и высокий уровень С-реактивного белка (19,30 мг/дл), что убедительно свидетельствует о наличии воспаления. Также наблюдалось небольшое повышение уровня ферментов печени и желчевыводящих путей, гипопротеинемия и почечная дисфункция с высоким уровнем креатинкиназы. Нарушения параметров свертывания крови, такие как тромбоцитопения, удлинение протромбинового времени и повышение уровня продуктов деградации фибрина, также указывали на возможность развития диссеминированной внутрисосудистой коагулопатии (ДВС-синдром).
Таблица.
Лабораторные данные при поступлении.
| Лейкоциты | 27 180 | /мкл | TP | 5,2 | г/дл 900 47 |
| ・Нейтрофилы | 98 | % | Alb | 2,7 | г/дл |
| ・Лимфоцит | 1,1 | % | T-Bil | 2,1 | мг/дл |
| 0,2 | % | АСТ | 120 | ЕД/л | |
| ・Эозинофил | 0,0 | % | 9 0046 ALT64 | Е/л | |
| ・Моноцит | 0,7 | % | ЛДГ | 542 | Е/л |
| Эритроциты | 331 | ×10 4 /мкл | ЩФ | 197 | ЕД/л |
| Hb | 10,2 | г/дл | γ-GTP | 9 | Е/л |
| Ht | 30,4 | % | ЭМИ | 17 | U/L |
| Plt | 8 | ×10 4 / мкл | СК | 2,706 | ЕД/л |
| СРБ | 19,30 | мг/дл | АМК | 53,9 | мг/дл |
| Cr | 1,38 | мг /дл | |||
| ABGA (O 2 10 л/мин маска резервуара): | Na | 140 | мэкв/л | ||
| pH | 7,50 | г/дл | K | 4,0 | мэкв/л |
| PaCO 2 | 27,0 | мм рт. ст. ст. | Cl | 105 | мэкв/ L |
| PaO 2 | 58,0 | мм рт.ст. | Глюкоза | 100 | мг/дл |
| HCO 3 — | 20,7 | ммоль/л | HbAlc 9004 7 | 5.0 | % |
| SaO 2 | 92,5 | % | PT -INR | 1,49 | |
| APTT | 47,5 | s | |||
| Фибриноген | 476 | мг/дл | |||
| Д-димер | 8,4 | мкг/мл | |||
| ФДП | 15,7 | мкг/мл | |||
Открыть в отдельном окне
Лейкоциты: лейкоциты, эритроциты : эритроцит, Hb: гемоглобин, Ht: гематокрит, Plt: тромбоциты, CRP: С-реактивный белок, ABGA: анализ газов артериальной крови, TP: общий белок, Alb: альбумин, T-Bil: общий билирубин, AMY: амилаза , CK: креатинкиназа, BUN: азот мочевины крови, Cr: креатинин, PT-INR: международное нормализованное отношение протромбинового времени, APTT: активированное частичное тромбопластиновое время, FDP: продукты деградации фибриногена.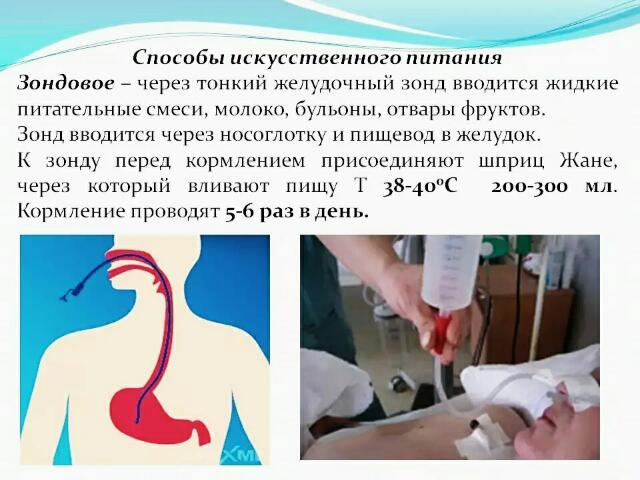
У пациента был диагностирован септический шок вследствие тяжелой аспирационной пневмонии, и он лечился в нашем отделении интенсивной терапии. Его оценка по шкале APACHEII составила 30, а по шкале оценки последовательной органной недостаточности (SOFA) — 15, что отражало тяжесть заболевания и полиорганную дисфункцию. Терапия была начата с гидрата меропенема (1,5 г/день), гидрохлорида дофамина (3 мкг/кг/мин) и мезилата нафамостата (0,07 мг/кг/ч). По мере стабилизации состояния на 2-й день был установлен назогастральный зонд размером 12 Fr, а на следующий день начато энтеральное питание с использованием стандартной полимерной смеси (5 ккал/кг/сут, 30 мл/ч). Используемая полимерная формула имела плотность калорий 1 ккал/мл, при этом 58% калорий приходились на углеводы, 25% — на липиды, и обеспечивала 4 грамма белка на каждые 100 вводимых ккал. Дозу и скорость инфузии постепенно увеличивали до 900 ккал/сут (15 ккал/кг/сут при 80 мл/ч) на 9-й день, когда у него развилась лихорадка 39,5℃ с постоянным снижением SpO 2 (<90%). Количество лейкоцитов в его крови увеличилось до 39 020 мкл, а рентгенограмма грудной клетки выявила свежие инфильтраты в правом нижнем поле. Заподозрена аспирация из-за желудочного рефлюкса (непереносимость желудочного питания), и энтеральное питание было прекращено.
Количество лейкоцитов в его крови увеличилось до 39 020 мкл, а рентгенограмма грудной клетки выявила свежие инфильтраты в правом нижнем поле. Заподозрена аспирация из-за желудочного рефлюкса (непереносимость желудочного питания), и энтеральное питание было прекращено.
Введение назоеюнального зонда
На 10-й день в просвет тощей кишки под рентгеноскопическим контролем был введен недавно разработанный назоеюнальный зонд для кормления размером 16Fr с функцией декомпрессии желудка (NJT/GD, ). Небольшое количество контрастного вещества (Гастрографин Ⓡ 10 мл) вводили в просвет желудка перед удалением назогастрального питательного зонда, чтобы установить ориентацию желудка и двенадцатиперстной кишки. Затем был введен NJT/GD таким образом, чтобы кончик располагался за связкой Трейтца с рентгеноконтрастным маркером, расположенным перед привратником (слева). После процедуры установка трубки была снова подтверждена с помощью контрастного вещества (справа).
Открыть в отдельном окне
Недавно разработанный назоеюнальный зонд для питания с функцией декомпрессии желудка (NJT/GD).
Открыть в отдельном окне
Постановка НЙТ/ГД с использованием рентгеноскопии. Слева: расположение рентгеноконтрастного маркера (острие стрелки) перед привратником. Справа: подтверждение контрастным веществом.
Энтеральное питание было возобновлено в день установки зонда в дозе 800 ккал/сут (13 ккал/кг/сут при 60 мл/ч) с одновременным дренированием остаточного желудочного содержимого (). Дозу кормления постепенно увеличивали до 1500 ккал/сут (25 ккал/кг/сут без помпы) с 15-го дня. В ходе тощекишечного питания с НЮТ/ГД объем желудочного дренажа колебался от 50 до 450 мл/сут. Дренажа энтерального питания не наблюдалось, рецидива лихорадки высокой степени или стойкого снижения SpO 9 не наблюдалось.0025 2 во время использования NJT/GD, что означает хорошую переносимость энтерального питания.
Открыть в отдельном окне
Одновременная декомпрессия (дренаж) желудка с тощекишечным питанием.
Хотя состояние пациента улучшилось, оценка, проведенная нашей командой по лечению дисфагии, показала, что пероральный прием еще не был безопасным, и было показано долгосрочное энтеральное питание чрескожным путем. К 22 дню он был достаточно здоров, чтобы провести чрескожную эндоскопическую гастростомию (ЧЭГ) с использованием метода интродьюсера. Эндоскопия верхних отделов желудочно-кишечного тракта, проведенная до процедуры, не выявила каких-либо аномалий (таких как грыжа пищеводного отверстия диафрагмы и т. д.), которые могли бы препятствовать энтеральному питанию. Послеоперационный период протекал гладко, на 30-е сутки он был переведен в наше реабилитационное отделение. Глотательная терапия позволила ему быть выписанным из нашей больницы на 43-й день с некоторым пероральным приемом пищи. Клиническое течение и обеспечение энтерального питания больного обобщены в . Прием допамина гидрохлорида был прекращен с 3-го дня, а нафамостата мезилат — с 5-го дня. При поступлении из аспирированной мокроты пациента был выделен пенициллин-чувствительный Streptococcus pneumoniae (PSSP). Гидрат меропенема применяли до 14-го дня, после чего применяли сульфаметоксазол (вводимый через NJT/GD).
К 22 дню он был достаточно здоров, чтобы провести чрескожную эндоскопическую гастростомию (ЧЭГ) с использованием метода интродьюсера. Эндоскопия верхних отделов желудочно-кишечного тракта, проведенная до процедуры, не выявила каких-либо аномалий (таких как грыжа пищеводного отверстия диафрагмы и т. д.), которые могли бы препятствовать энтеральному питанию. Послеоперационный период протекал гладко, на 30-е сутки он был переведен в наше реабилитационное отделение. Глотательная терапия позволила ему быть выписанным из нашей больницы на 43-й день с некоторым пероральным приемом пищи. Клиническое течение и обеспечение энтерального питания больного обобщены в . Прием допамина гидрохлорида был прекращен с 3-го дня, а нафамостата мезилат — с 5-го дня. При поступлении из аспирированной мокроты пациента был выделен пенициллин-чувствительный Streptococcus pneumoniae (PSSP). Гидрат меропенема применяли до 14-го дня, после чего применяли сульфаметоксазол (вводимый через NJT/GD).
Открыто в отдельном окне
Слева: чрескожная эндоскопическая гастростомия (ЧЭГ), выполненная на 22-й день. В центре: эндоскопический вид (сделанный до введения трубки ЧЭГ) NJT/GD с рентгеноконтрастным маркером (стрелка), правильно расположенным перед привратником . Справа: отверстия для декомпрессии желудка при NJT/GD (указатели стрелок).
В центре: эндоскопический вид (сделанный до введения трубки ЧЭГ) NJT/GD с рентгеноконтрастным маркером (стрелка), правильно расположенным перед привратником . Справа: отверстия для декомпрессии желудка при NJT/GD (указатели стрелок).
Открыть в отдельном окне
Клиническое течение и обеспечение энтерального питания (НГТ: назогастральный зонд, НЙТ/ГД: назоеюнальный зонд с функцией декомпрессии желудка, ЧЭГ: чрескожная эндоскопическая гастростомия, ПЕРЕВОД: перевод в реабилитационное отделение).
Этот случай иллюстрирует успешное обеспечение энтерального питания, которое является неотъемлемой частью основной терапии, у тяжелобольного пациента. Поскольку пневмония у пациента была классифицирована как тяжелая, наша основная терапия включала использование меропенема, антибактериального препарата широкого спектра действия, который продемонстрировал высокую эффективность и переносимость у пожилых пациентов с потенциально фатальной аспирационной пневмонией (6).
Энтеральное питание (через зонд) считается предпочтительным способом питания пациентов в критическом состоянии и часто связано с благоприятными исходами (2–4). Мало того, что это более физиологично, энтеральное питание может также сохранить структуру слизистой оболочки и иммунную функцию, уменьшая воспалительную реакцию (7). Было продемонстрировано, что начало энтерального питания возможно и безопасно даже в течение 6 часов после поступления в отделение интенсивной терапии (8). Хотя некоторые более ранние исследования пришли к выводу, что постпилорическое питание не имеет явных преимуществ перед желудочным питанием с точки зрения общего получаемого питания и осложнений (9).,10), на это могут влиять различия в тяжести заболевания (11). Недавние системные обзоры и мета-анализы показывают, что постпилорическое кормление может снижать заболеваемость пневмонией, связанной с кормлением, но не обязательно улучшает клинически важные исходы, такие как смертность или продолжительность пребывания в стационаре (12–15). Кроме того, процедурные сложности введения постпилорической трубки затрудняют рекомендацию рутинной установки у всех пациентов в критическом состоянии.
Мало того, что это более физиологично, энтеральное питание может также сохранить структуру слизистой оболочки и иммунную функцию, уменьшая воспалительную реакцию (7). Было продемонстрировано, что начало энтерального питания возможно и безопасно даже в течение 6 часов после поступления в отделение интенсивной терапии (8). Хотя некоторые более ранние исследования пришли к выводу, что постпилорическое питание не имеет явных преимуществ перед желудочным питанием с точки зрения общего получаемого питания и осложнений (9).,10), на это могут влиять различия в тяжести заболевания (11). Недавние системные обзоры и мета-анализы показывают, что постпилорическое кормление может снижать заболеваемость пневмонией, связанной с кормлением, но не обязательно улучшает клинически важные исходы, такие как смертность или продолжительность пребывания в стационаре (12–15). Кроме того, процедурные сложности введения постпилорической трубки затрудняют рекомендацию рутинной установки у всех пациентов в критическом состоянии. Текущий консенсус по-прежнему заключается в том, чтобы начинать энтеральное питание назогастральным путем, как в этом случае, а затем переходить на постпилорическое питание только при возникновении непереносимости желудочного питания (16).
Текущий консенсус по-прежнему заключается в том, чтобы начинать энтеральное питание назогастральным путем, как в этом случае, а затем переходить на постпилорическое питание только при возникновении непереносимости желудочного питания (16).
Однако постпилорическое кормление на самом деле не решает проблему замедленного опорожнения желудка, а большие остаточные объемы желудка, которые могут сохраняться, все же могут привести к микроаспирации или пневмонии. Идеальным решением для тяжелобольных пациентов с непереносимостью желудочного питания было бы постпилорическое питание с одновременной декомпрессией желудка. Хотя концепция и конструкция назогастроеюнального зонда двойного назначения с декомпрессионной способностью желудка были описаны недавно (17,18), нам не известно о каком-либо клиническом применении такого зонда в литературе. NJT/GD, используемый в данном случае, был разработан Create Medic (Иокогама, Япония) с некоторым вкладом в дизайн от соответствующего автора. Насколько нам известно, это первое сообщение об использовании назоеюнального питательного зонда с функцией декомпрессии желудка у пациента.
Использование NJT/GD позволило обеспечить почти непрерывное (перерыв менее 24 часов) энтеральное питание пациента до тех пор, пока он не поправится достаточно, чтобы пройти ПЭГ. Это также позволило постепенно увеличить дозу энтерального питания на 67% больше, чем при использовании назогастрального зонда. Вопрос, на который следует обратить внимание, заключается в том, можно ли было достичь подобного результата при использовании обычного назоеюнального зонда (без какой-либо функции декомпрессии желудка) в данном случае. Хотя однозначного ответа нет, видя, что объем желудочного дренажа достигал 450 мл/день на протяжении всего курса тощекишечного питания, мы считаем, что NJT/GD был лучшим временным вариантом для эффективного энтерального питания.
В заключение мы сообщили об успешном использовании недавно разработанного назоеюнального зонда для кормления с функцией декомпрессии желудка у тяжелобольного пациента. Использование этой трубки улучшило доставку энтерального питания при плохой переносимости желудочного питания. Мы считаем, что NJT/GD играет важную роль в клинической практике, поскольку мы стремимся удовлетворить пищевые и терапевтические потребности отдельных пациентов.
Мы считаем, что NJT/GD играет важную роль в клинической практике, поскольку мы стремимся удовлетворить пищевые и терапевтические потребности отдельных пациентов.
NJT/GD был впервые предложен доктором Мохаммадом Шукри Джахитом из больницы Sungai Buloh, который также является нынешним президентом Общества парентерального и энтерального питания Малайзии.
1. Янссенс Дж.П. Пневмония у пожилого (гериатрического) населения. Карр Опин Пульм Мед 11: 226-230, 2005. [PubMed] [Google Scholar]
2. Kreymann KG, Berger MM, Deutz NE, et al.. Руководство ESPEN по энтеральному питанию: Интенсивная терапия. Клин Нутр 25: 210-223, 2006. [PubMed] [Google Scholar]
3. McClave SA, Martindale RG, Vanek VW, et al..
Руководство по предоставлению и оценке поддерживающей нутритивной терапии у взрослых пациентов в критическом состоянии: Общество медицины критических состояний (SCCM) и Американское общество парентерального и энтерального питания (A.S.P.E.N.). JPEN J Parenter Enteral Nutr
33: 277-316, 2009 г. . [PubMed] [Google Scholar]
. [PubMed] [Google Scholar]
4. Elke G, Kuhnt E, Ragaller M, et al.. Энтеральное питание связано с улучшением исхода у пациентов с тяжелым сепсисом. Вторичный анализ исследования VISEP. Мед Клин Интенсивмед Нотфмед 108: 223-233, 2013. [PubMed] [Google Scholar]
5. Blaser AR, Starkopf J, Kirsimägi Ü, Deane AM. Определение, распространенность и исход пищевой непереносимости в интенсивной терапии: систематический обзор и метаанализ. Acta Anaesthesiol Scand 58: 914-922, 2014. [PubMed] [Google Scholar]
6. Токуясу Х., Харада Т., Ватанабэ Э. и др.. Эффективность меропенема при лечении аспирационной пневмонии у пожилых пациентов. Интерн Мед 48: 129-135, 2009. [PubMed] [Google Scholar]
7. Seres DS, Valcarcel M, Guillaume A. Преимущества энтерального питания перед парентеральным. Therap Adv Гастроэнтерол 6: 157-167, 2013. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Шанкар Б., Дафни Д.К., Рамакришнан Н., Венкатараман Р.
Осуществимость, безопасность и исход очень раннего энтерального питания у пациентов в критическом состоянии: результаты обсервационного исследования. Джей Крит Уход
30: 473–475, 2015. [PubMed] [Google Scholar]
Джей Крит Уход
30: 473–475, 2015. [PubMed] [Google Scholar]
9. Хо К.М., Добб Г.Дж., Уэбб С.А. Сравнение раннего желудочного и постпилорического питания у пациентов в критическом состоянии: метаанализ. Интенсивная терапия 32: 639-649, 2006. [PubMed] [Google Scholar]
10. White H, Sosnowski K, Tran K, Reeves A, Jones M. Рандомизированное контролируемое сравнение раннего постпилорического и раннего желудочного кормления для достижения целей в области питания у пациентов интенсивной терапии на ИВЛ. Критический уход 13: R187, 2009. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Хуан Х.Х., Чанг С.Дж., Хсу К.В., Чанг Т.М., Кан С.П., Лю М.Ю. Тяжесть заболевания влияет на эффективность энтерального питания на клинические исходы у пациентов в критическом состоянии. Дж Акад Нутр Диета 112: 1138-1146, 2012. [PubMed] [Google Scholar]
12. Jiyong J, Tiancha H, Huiqin W, Jingfen J.
Влияние желудочного и постпилорического питания на заболеваемость пневмонией у пациентов в критическом состоянии: наблюдения из традиционного и байесовского метаанализа случайных эффектов. Клин Нутр
32: 8–15, 2013. [PubMed] [Google Scholar]
Клин Нутр
32: 8–15, 2013. [PubMed] [Google Scholar]
13. Чжан З., Сюй С., Дин Дж., Ни Х. Сравнение кормления через пилорический зонд и кормление через желудочный зонд у пациентов отделения интенсивной терапии: метаанализ. Нутр Клин Практ 28: 371-380, 2013. [PubMed] [Google Scholar]
14. Alhazzani W, Almasoud A, Jaeschke R, et al.. Кормление тонкой кишки и риск пневмонии у взрослых пациентов в критическом состоянии: систематический обзор и метаанализ рандомизированных исследований. Критический уход 17: R127, 2013. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Alkhawaja S, Martin C, Butler RJ, Gwadry-Sridhar F. Постпилорическое кормление по сравнению с желудочным зондом для профилактики пневмонии и улучшения исходов питания у взрослых в критическом состоянии. Системная версия базы данных Cochrane 8: CD008875, 2015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Бергер М.М., Согель Л.
Кормите пациента в отделении интенсивной терапии сначала «желудочно», а постпилорически только в случае неудачи. Критический уход
14: 123, 2010. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Критический уход
14: 123, 2010. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Silk DB. Развивающаяся роль назоеюнального питания Trietz после связки в энтеральном питании и потребность в улучшении конструкции зонда для кормления и методов размещения. JPEN J Parenter Enteral Nutr 35: 303-307, 2011. [PubMed] [Google Scholar]
18. Silk DB, Quinn DG. Обоснование и конструкция новых назогастральных и назогастроеюнальных зондов для декомпрессии желудка двойного назначения и зондов для энтерального питания. JPEN J Parenter Enteral Nutr 39: 531-543, 2015. [PubMed] [Google Scholar]
Кормление через назогастральный зонд у пожилых пациентов: обзор текущей практики и проблем, с которыми пришлось столкнуться
1. Mundi M.S., Patel J., McClave S.A., Hurt R.T. Зондовое питание пожилых людей: от выявления недостаточности питания к обеспечению энтерального питания. Клинические вмешательства в старение . 2018;13:1353–1364. doi: 10.2147/cia.s134919. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2. Смукалла С. М., Димитрова И., Фейнтух Ю. М., Хан А. Дисфагия у пожилых. Современные методы лечения в гастроэнтерологии . 2017;15(3):382–396. doi: 10.1007/s11938-017-0144-0. [PubMed] [CrossRef] [Google Scholar]
Смукалла С. М., Димитрова И., Фейнтух Ю. М., Хан А. Дисфагия у пожилых. Современные методы лечения в гастроэнтерологии . 2017;15(3):382–396. doi: 10.1007/s11938-017-0144-0. [PubMed] [CrossRef] [Google Scholar]
3. Сура Л., Мадхаван А., Карнаби Г., Крари М. А. Дисфагия у пожилых людей: лечение и вопросы питания. Клинические вмешательства в старение . 2012;7:287–298. doi: 10.2147/CIA.S23404. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Улучшение NHS, Предупреждение о безопасности пациентов, 2016 г., https://improvement.nhs.uk/documents/177/Patient_Safety_Alert_Stage_2_-_Deterioration_resources_July_2016_v2.pdf.
5. Черчворд-Венн Т. А., Брин Л., Филлипс С. М. Изменения метаболизма мышечных белков человека при старении: белок и физические упражнения как контрмеры для компенсации саркопении. Биофакторы . 2014;40:199–205. [PubMed] [Google Scholar]
6. Брауни С. Почему пожилые люди подвержены риску дефицита питательных веществ? Международный журнал сестринской практики .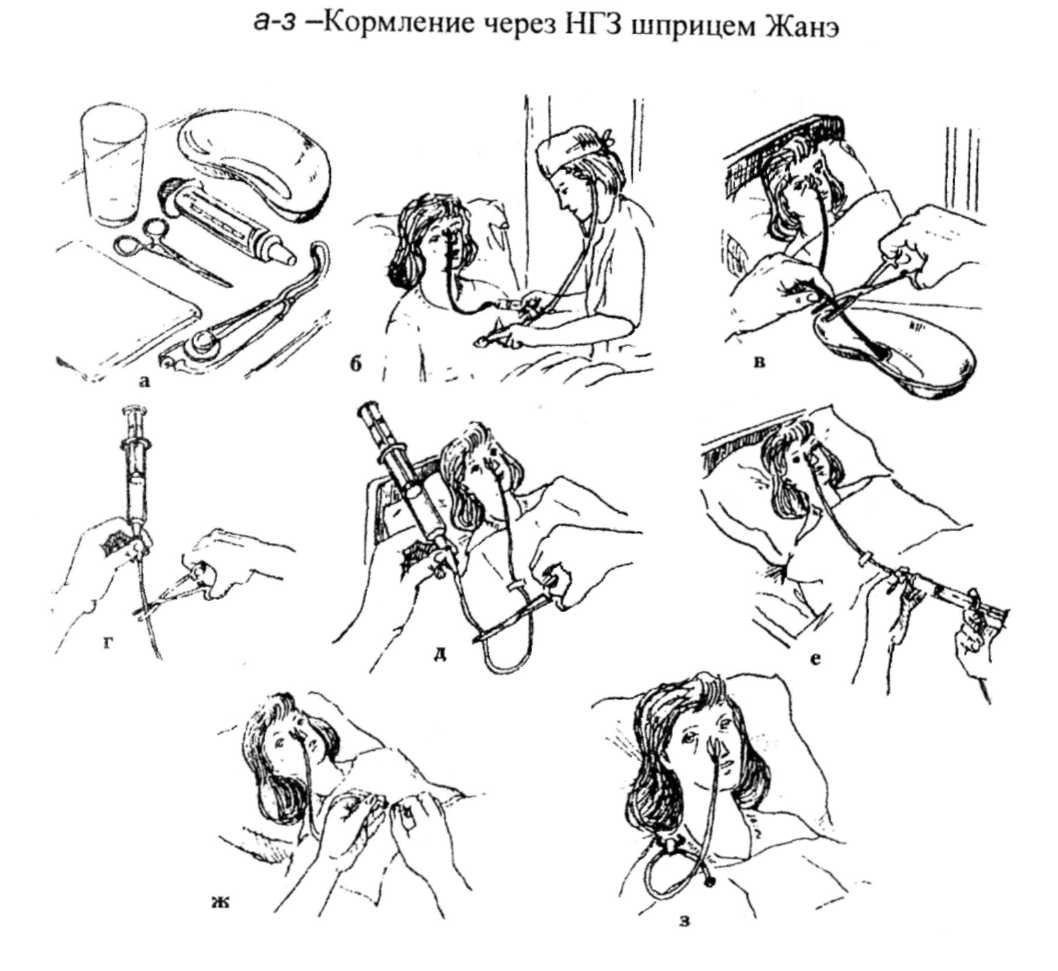 2006;12(2):110–118. doi: 10.1111/j.1440-172x.2006.00557.x. [PubMed] [CrossRef] [Академия Google]
2006;12(2):110–118. doi: 10.1111/j.1440-172x.2006.00557.x. [PubMed] [CrossRef] [Академия Google]
7. Веллас Б., Лаук С., Андриё С. и соавт. Оценка питания пожилых людей. Текущее мнение о клиническом питании и метаболической помощи . 2001;4(1):5–8. doi: 10.1097/00075197-200101000-00002. [PubMed] [CrossRef] [Google Scholar]
8. Хиксон М. Недоедание и старение. Медицинский журнал последипломного образования . 2006;82(963):2–8. doi: 10.1136/pgmj.2005.037564. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
9. Рид Р. Л., Йочум К., Перлмуттер Л., Мередит К. Э., Мурадян А. Д. Взаимосвязь между физическими упражнениями, мышечной силой и ожирением тела у здорового пожилого человека Население. Журнал Американского гериатрического общества . 1991;39(12):1189–1193. doi: 10.1111/j.1532-5415.1991.tb03573.x. [PubMed] [CrossRef] [Google Scholar]
10. Wanten G., Calder P.C., Forbes A. Ведение взрослых пациентов, нуждающихся в домашнем парентеральном питании.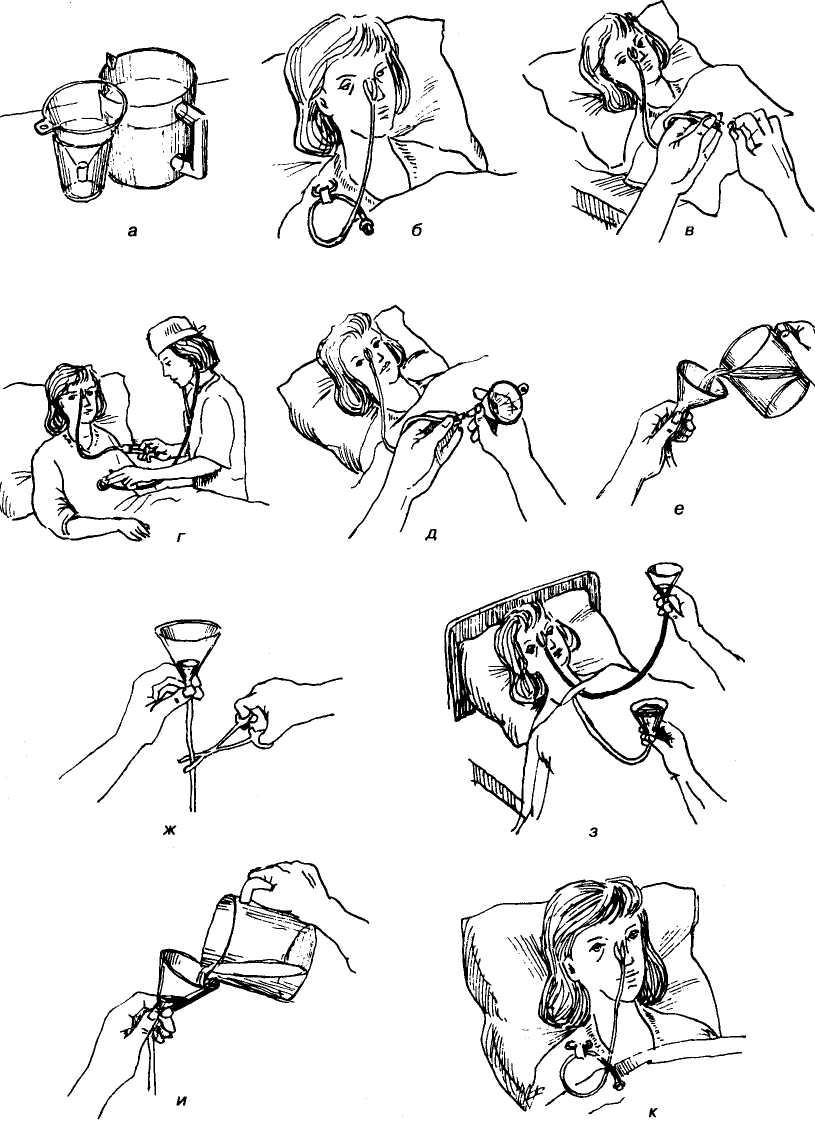 БМЖ . 2011; 342 doi: 10.1136/bmj.d1447.d1447 [PubMed] [CrossRef] [Google Scholar]
БМЖ . 2011; 342 doi: 10.1136/bmj.d1447.d1447 [PubMed] [CrossRef] [Google Scholar]
11. Масаки С., Кавамото Т. Сравнение долгосрочных результатов между энтеральным питанием через гастростому и полным парентеральным питанием у пожилых людей. лица с дисфагией: когортное исследование с сопоставимой предрасположенностью. PLoS One . 2019; 14 doi: 10.1371/journal.pone.0217120.e0217120 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Herbert G., Perry R., Andersen H.K., et al. Раннее энтеральное питание в течение 24 часов после операции на нижних отделах желудочно-кишечного тракта по сравнению с более поздним началом в связи с продолжительностью пребывания в стационаре и послеоперационными осложнениями. Кокрановская база данных систематических обзоров . 2018; 22 doi: 10.1002/14651858.CD004080.pub3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Schroeder D., Gillanders L., Mahr K., Hill G.L. Влияние немедленного послеоперационного энтерального питания на состав тела, функцию мышц и заживление ран. Журнал парентерального и энтерального питания . 1991;15(4):376–383. doi: 10.1177/0148607191015004376. [PubMed] [CrossRef] [Google Scholar]
Журнал парентерального и энтерального питания . 1991;15(4):376–383. doi: 10.1177/0148607191015004376. [PubMed] [CrossRef] [Google Scholar]
14. Dennis M., Lewis S., Cranswick G., et al. FOOD: многоцентровое рандомизированное исследование, оценивающее политику питания у пациентов, поступивших в больницу с недавним инсультом. Оценка медицинских технологий . 2006; 10:1–120. doi: 10.3310/hta10020. [PubMed] [CrossRef] [Google Scholar]
15. Stratton R.J., Ek A.-C., Engfer M., et al. Энтеральная пищевая поддержка в профилактике и лечении пролежней: систематический обзор и метаанализ. Обзоры исследований старения . 2005;4(3):422–450. doi: 10.1016/j.arr.2005.03.005. [PubMed] [CrossRef] [Google Scholar]
16. Оджо О., Брук Дж. Использование энтерального питания при лечении инсульта. Питательные вещества . 2016;8(12):с. 827. doi: 10.3390/nu8120827. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
17. Ciocon J. O.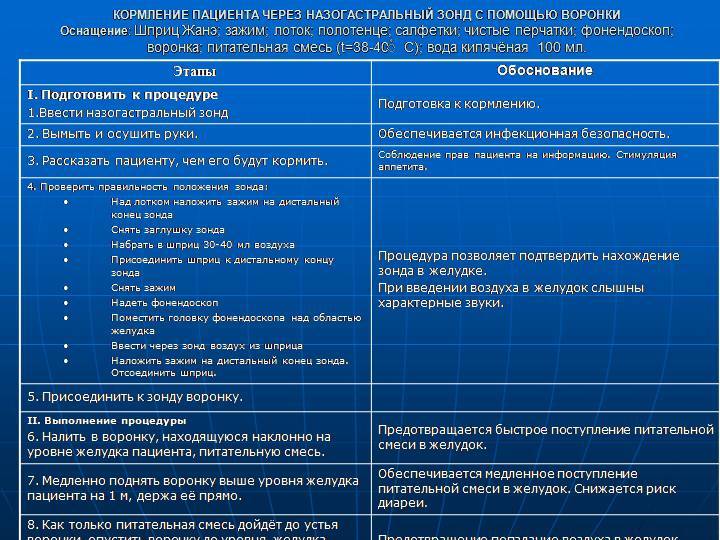 , Silverstone F. A., Graver L. M., et al. Зондовое питание у пожилых пациентов. Архив внутренних болезней . 1988;148(2):429–433. doi: 10.1001/archinte.1988.00380020173022. [PubMed] [CrossRef] [Google Scholar]
, Silverstone F. A., Graver L. M., et al. Зондовое питание у пожилых пациентов. Архив внутренних болезней . 1988;148(2):429–433. doi: 10.1001/archinte.1988.00380020173022. [PubMed] [CrossRef] [Google Scholar]
18. Nesemeier R., Dunlap N., McClave S.A., et al. Доказательная поддержка диетотерапии при раке головы и шеи. Текущие отчеты о хирургии . 2017;5:с. 18. doi: 10.1007/s40137-017-0179-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Wang T.-G., Wu M.-C., Chang Y.-C., Hsiao T.-Y., Lien I. -Н. Влияние назогастральных зондов на функцию глотания у лиц с дисфагией после инсульта. Архив физической медицины и реабилитации . 2006;87(9):1270–1273. doi: 10.1016/j.apmr.2006.05.019. [PubMed] [CrossRef] [Google Scholar]
20. Wang Z.-Y., Chen J.-M., Ni G.-X. Влияние постоянного назогастрального зонда на функцию глотания у пожилых пациентов с постинсультной дисфагией при длительном кормлении через нос. ВМС Нейрол . 2019;19:с. 83. doi: 10.1186/s12883-019-1314-6. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
2019;19:с. 83. doi: 10.1186/s12883-019-1314-6. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
21. Dziewas R., Warnecke T., Hamacher C., et al. Усугубляет ли назогастральный зонд дисфагию у пациентов с острым инсультом? BMC Неврология . 2008;8:с. 28. doi: 10.1186/1471-2377-8-28. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
22. Джаафар М. Х., Махадева С., Морган К., Тан М. П. Чрескожная эндоскопическая гастростомия по сравнению с назогастральным питанием у пожилых людей с неинсультной дисфагией: систематический обзор . Журнал питания, здоровья и старения . 2015;19(2):190–197. doi: 10.1007/s12603-014-0527-z. [PubMed] [CrossRef] [Google Scholar]
23. Рудберг М. А., Эглестон Б. Л., Грант М. Д., Броди Дж. А. Эффективность зондового питания у жителей домов престарелых с нарушениями глотания. Журнал парентерального и энтерального питания . 2000;24(2):97–102. doi: 10.1177/014860710002400297. [PubMed] [CrossRef] [Google Scholar]
24. Ayman A.R., Khoury T., Cohen J., et al. Введение ПЭГ у пациентов с деменцией не улучшает нутритивный статус и имеет худшие результаты по сравнению с введением ПЭГ по другим показаниям. Журнал клинической гастроэнтерологии . 2017;51(5):417–420. doi: 10.1097/мкг.00000000000000624. [PubMed] [CrossRef] [Google Scholar]
Ayman A.R., Khoury T., Cohen J., et al. Введение ПЭГ у пациентов с деменцией не улучшает нутритивный статус и имеет худшие результаты по сравнению с введением ПЭГ по другим показаниям. Журнал клинической гастроэнтерологии . 2017;51(5):417–420. doi: 10.1097/мкг.00000000000000624. [PubMed] [CrossRef] [Google Scholar]
25. Gomes G.F., Pisani J.C., Macedo E.D., Campos A.C. Назогастральный зонд как фактор риска аспирации и аспирационной пневмонии. Текущее мнение о клиническом питании и метаболической помощи . 2003;6(3):327–333. doi: 10.1097/01.mco.0000068970.34812.8b. [PubMed] [CrossRef] [Google Scholar]
26. Chou H.-H., Tsou M.-T., Hwang L.-C. Кормление через назогастральный зонд в сравнении с кормлением с рук в домашних условиях для пожилых людей с тяжелой деменцией на Тайване: сравнение прогнозов. BMC Гериатрия . 2020;20:с. 60. doi: 10.1186/s12877-020-1464-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Нейман М. Дж., Мейер С. Т., Даттон Дж. Л., Смит Р. Держите этот рентген. Журнал клинической гастроэнтерологии . 1995;20(4):293–295. doi: 10.1097/00004836-199506000-00007. [PubMed] [CrossRef] [Google Scholar]
Дж., Мейер С. Т., Даттон Дж. Л., Смит Р. Держите этот рентген. Журнал клинической гастроэнтерологии . 1995;20(4):293–295. doi: 10.1097/00004836-199506000-00007. [PubMed] [CrossRef] [Google Scholar]
28. Улучшение NHS. Предупреждение о безопасности пациента: неправильное размещение назогастрального зонда: постоянный риск смерти и серьезного вреда. NHS Улучшение . 2016;17 [Google Scholar]
29. Метени Н. А., Титлер М. Г. Оценка размещения зондов для кормления. Американский журнал медсестер . 2001;101(5):36–45. doi: 10.1097/00000446-200105000-00017. [PubMed] [CrossRef] [Google Scholar]
30. Metheny N.A., Stewart B.J., Smith L., Yan H., Diebold M., Clouse R.E. pH и концентрация билирубина в аспиратах через зонд для питания как предикторы размещения зонда. Исследования в области сестринского дела . 1999;48(4):189–197. дои: 10.1097/00006199-199907000-00001. [PubMed] [CrossRef] [Google Scholar]
31. Ni M.Z., Huddy J.R. , Priest O.H., et al. Выбор пороговых значений pH для безопасной проверки размещения назогастрального зонда: подход к аналитическому моделированию решений. BMJ Открытый . 2017; 7 doi: 10.1136/bmjopen-2017-018128.e018128 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Priest O.H., et al. Выбор пороговых значений pH для безопасной проверки размещения назогастрального зонда: подход к аналитическому моделированию решений. BMJ Открытый . 2017; 7 doi: 10.1136/bmjopen-2017-018128.e018128 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Fernandez R. S., Chau JP-C., Thompson D. R., Griffiths R., Lo Х.-С. Точность биохимических маркеров для прогнозирования размещения назогастрального зонда у взрослых — систематический обзор диагностических исследований. Международный журнал сестринских исследований . 2010;47(8):1037–1046. doi: 10.1016/j.ijnurstu.2010.03.015. [PubMed] [CrossRef] [Google Scholar]
33. Taylor S.J., McWilliam H., Allan K., Hocking P. Эффективность зондового питания: подтверждение и потеря. Британский журнал медсестер . 2015;24(7):371–375. doi: 10.12968/bjon.2015.24.7.371. [PubMed] [CrossRef] [Google Scholar]
34. Borsci S., Buckle P., Huddy J., et al. Исследование пригодности рН-полосок для установки назогастрального зонда. PLoS One . 2017; 12 doi: 10.1371/journal.pone.0189013.e0189013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS One . 2017; 12 doi: 10.1371/journal.pone.0189013.e0189013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Роват А. М., Грэм С., Деннис М. Исследование для определения вероятной точности рН-тестирование для подтверждения установки назогастрального зонда. BMJ Открытый Гастроэнтерол . 2018;5 doi: 10.1136/bmjgast-2018-000211.e000211 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Валлерстедт С. М., Фастбом Дж., Линке Дж., Витолс С. Долгосрочные использование ингибиторов протонной помпы и распространенность причин гастропротекции, связанных с заболеваниями и лекарственными препаратами, — поперечное популяционное исследование. Фармакоэпидемиология и безопасность лекарственных средств . 2017;26(1):9–16. doi: 10.1002/pds.4135. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Ротман С. Р., Бишоп Т. Ф. Применение ингибиторов протонной помпы в амбулаторных условиях США, 2002–2009 гг.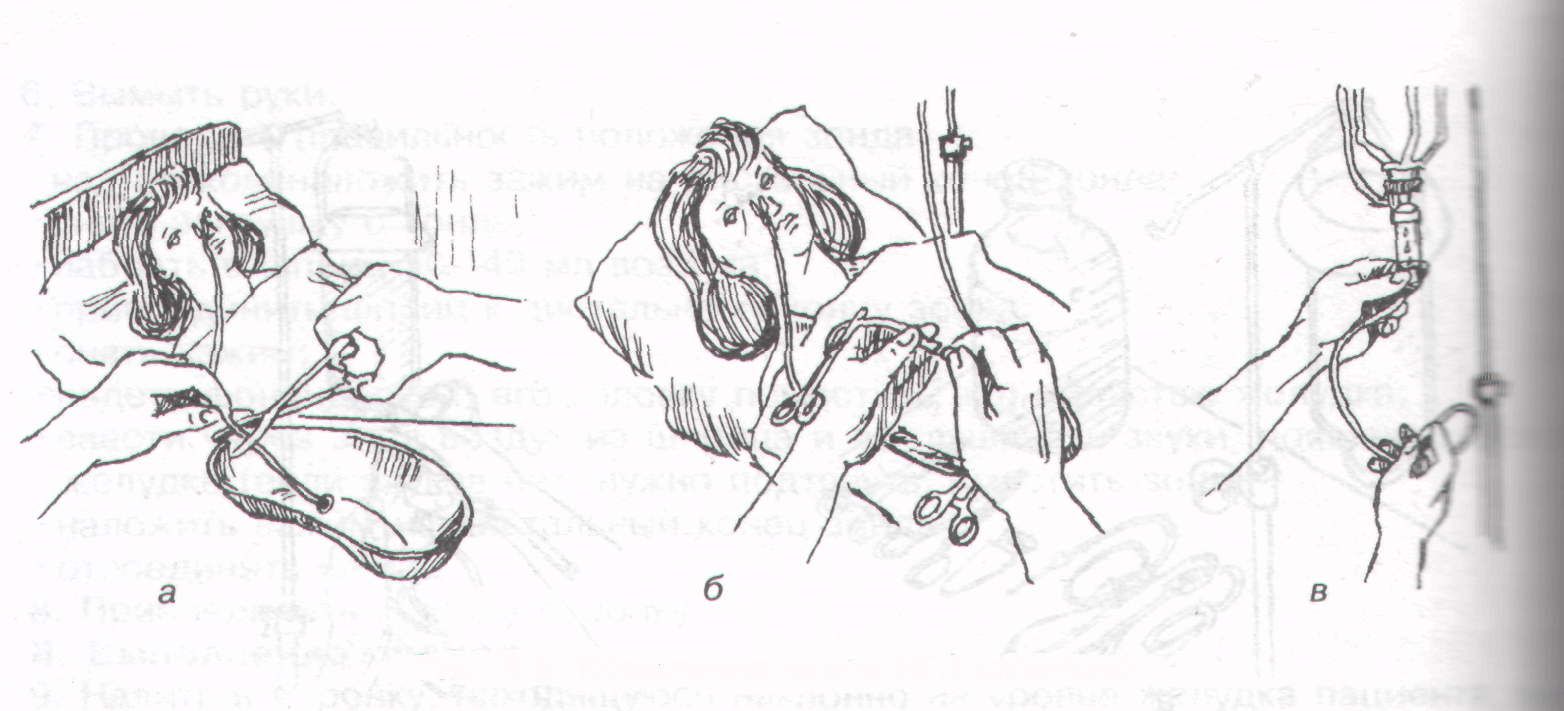 PLoS Один . 2013; 8 doi: 10.1371/journal.pone.0056060.e56060 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS Один . 2013; 8 doi: 10.1371/journal.pone.0056060.e56060 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Брейзер С., Тейлор С. Дж., Аллан К., Клементе Р., Тоэр Д. Инсульт: неэффективное крепление трубки снижает питание и медикаментозное лечение. Британский журнал медсестер . 2017;26(12):656–663. doi: 10.12968/bjon.2017.26.12.656. [PubMed] [CrossRef] [Google Scholar]
39. McFarland A. Анализ эффективности затрат клинического алгоритма подтверждения установки назогастрального зонда у взрослых пациентов больницы. Журнал передового сестринского дела . 2017;73(1):201–216. doi: 10.1111/янв.13103. [PubMed] [CrossRef] [Google Scholar]
40. Де Агилар-Насименто Дж. Э., Кудск К. А. Клинические затраты на установку зонда для кормления. Журнал парентерального и энтерального питания . 2007;31(4):269–273. doi: 10.1177/0148607107031004269. [PubMed] [CrossRef] [Google Scholar]
41. Stroud M., Duncan H., Nightingale J. , et al. Рекомендации по энтеральному питанию взрослых пациентов стационара. Кишка . 2003; 52 (Приложение 7) doi: 10.1136/gut.52.suppl_7.vii1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, et al. Рекомендации по энтеральному питанию взрослых пациентов стационара. Кишка . 2003; 52 (Приложение 7) doi: 10.1136/gut.52.suppl_7.vii1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Wang W. W., Moyle W. Использование физических ограничений для людей с деменцией: обзор литературы. Австралийский журнал продвинутого сестринского дела: ежеквартальное издание Королевской австралийской федерации медсестер . 2005;22(4):46–52. [PubMed] [Google Scholar]
43. Комиссия по качеству обслуживания. Краткое руководство: ограничения (физические и механические) 2015. https://www.cqc.org.uk/sites/default/files/20180322_
44. Национальный институт здравоохранения и передового опыта. Деменция: оценка, ведение и поддержка людей, живущих с деменцией, и тех, кто за ними ухаживает. Реестр грантов . 2018;2019:с. 540. [Google Scholar]
45. Taylor S.J., Allan K., Clemente R., Marsh A., Toher D. Крепление зонда для кормления при критических состояниях: последствия для безопасности. Британский журнал медсестер . 2018;27(18):1036–1041. doi: 10.12968/bjon.2018.27.18.1036. [PubMed] [CrossRef] [Google Scholar]
Taylor S.J., Allan K., Clemente R., Marsh A., Toher D. Крепление зонда для кормления при критических состояниях: последствия для безопасности. Британский журнал медсестер . 2018;27(18):1036–1041. doi: 10.12968/bjon.2018.27.18.1036. [PubMed] [CrossRef] [Google Scholar]
46. Seder C.W., Stockdale W., Hale L., Janczyk R.J. Назальная уздечка уменьшает смещение питательной трубки и может увеличить потребление калорий в хирургическом отделении интенсивной терапии: рандомизированное контролируемое исследование . Медицина интенсивной терапии . 2010;38(3):797–801. doi: 10.1097/ccm.0b013e3181c311f8. [PubMed] [CrossRef] [Google Scholar]
47. Brugnolli A., Ambrosi E., Canzan F., Saiani L. Закрепление назогастральных зондов у взрослых пациентов: обзор. Международный журнал сестринских исследований . 2014;51(6):943–950. doi: 10.1016/j.ijnurstu.2013.12.002. [PubMed] [CrossRef] [Google Scholar]
48. Martin G., Koizia L., Kooner A., et al. Использование гарнитуры смешанной реальности HoloLens2 для защиты медицинских работников во время COVID-19пандемия: проспективная, наблюдательная оценка. Журнал медицинских интернет-исследований . 2020;22 doi: 10.2196/21486.e21486 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Журнал медицинских интернет-исследований . 2020;22 doi: 10.2196/21486.e21486 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Утилита для улучшения предсказания положения зонда для кормления. Исследования в области сестринского дела . 2000;49:302–309. [PubMed] [Google Scholar]
50. Metheny N.A., Stewart B.J., Smith L., Yan H., Diebold M., Clouse R.E. pH и концентрации пепсина и трипсина в аспиратах через зонд для питания как предикторы размещения зонда. ЯПЕН. Журнал парентерального и энтерального питания . 1997;21(5):279–285. doi: 10.1177/0148607197021005279. [PubMed] [CrossRef] [Google Scholar]
51. Гейзельман Д. Э., Видович Р. Р., Милькович Г., Блэк Л. Д. Установка назоинтестинального зонда с зондом для кормления с датчиком рН. Журнал парентерального и энтерального питания . 1993;17(6):562–565. doi: 10.1177/0148607193017006562. [PubMed] [CrossRef] [Google Scholar]
52. Smithard D., Barrett N.A., Hargroves D. , Elliot S. Системы энтерального доступа с электромагнитным датчиком: обзор литературы. Дисфагия . 2015;30(3):275–285. doi: 10.1007/s00455-015-9607-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Elliot S. Системы энтерального доступа с электромагнитным датчиком: обзор литературы. Дисфагия . 2015;30(3):275–285. doi: 10.1007/s00455-015-9607-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Meyer P., Henry M., Maury E., Baudel J.-L., Guidet B., Offenstadt G. Колориметрическая капнография для обеспечения правильной положение назогастрального зонда. Журнал интенсивной терапии . 2009;24(2):231–235. doi: 10.1016/j.jcrc.2008.06.003. [PubMed] [CrossRef] [Google Scholar]
54. Brun P.-M., Chenaitia H., Lablanche C., et al. Двухточечное ультразвуковое исследование для подтверждения правильного положения желудочного зонда на догоспитальном этапе. Военная медицина . 2014;179(9):959–963. doi: 10.7205/milmed-d-14-00044. [PubMed] [CrossRef] [Google Scholar]
55. Tsujimoto H., Tsujimoto Y., Nakata Y., Akazawa M., Kataoka Y. УЗИ для подтверждения установки желудочного зонда. Кокрановская база данных систематических обзоров . 2017; 28 doi: 10.1002/14651858.CD012083.pub2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2017; 28 doi: 10.1002/14651858.CD012083.pub2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Taylor S., Allan K., McWilliam H., et al. Подтверждение положения назогастрального зонда с помощью электромагнитного отслеживания в сравнении с pH или рентгеновским излучением и рентгеноконтрастностью зонда. Британский журнал медсестер . 2014;23(7):352–358. doi: 10.12968/bjon.2014.23.7.352. [PubMed] [CrossRef] [Google Scholar]
57. Powers J., Luebbehusen M., Spitzer T., et al. Проверка электромагнитного установочного устройства по сравнению с рентгенограммой брюшной полости для прогнозирования точности размещения питательной трубки. Журнал парентерального и энтерального питания . 2011;35(4):535–539. doi: 10.1177/0148607110387436. [PubMed] [CrossRef] [Google Scholar]
58. Мицци А., Коцци С., Беретта Л., Греко М., Брага М. Установка назогастрального зонда под визуальным контролем в реальном времени: серия случаев с использованием кенгуру с Технология IRIS в отделении интенсивной терапии.
