Что такое адсорбция и как она происходит. Какие бывают виды адсорбции. Чем отличается физическая адсорбция от хемосорбции. Как описать адсорбцию математически. Где применяется адсорбция в промышленности и быту.
Что такое адсорбция
Адсорбция — это процесс концентрирования вещества на поверхности раздела фаз. При этом вещество, которое концентрируется на поверхности, называется адсорбатом, а поверхность, на которой происходит концентрирование — адсорбентом.
Адсорбция является самопроизвольным процессом, при котором происходит уменьшение свободной энергии Гиббса системы. При адсорбции выделяется тепло, то есть это экзотермический процесс.
Виды адсорбции
Выделяют два основных вида адсорбции:
- Физическая адсорбция
- Химическая адсорбция (хемосорбция)
Физическая адсорбция
При физической адсорбции взаимодействие между адсорбентом и адсорбатом осуществляется за счет слабых межмолекулярных сил Ван-дер-Ваальса. Основные особенности физической адсорбции:

- Обратимость процесса
- Низкая теплота адсорбции (10-40 кДж/моль)
- Возможность образования полимолекулярных слоев адсорбата
- Высокая скорость установления адсорбционного равновесия
Химическая адсорбция
При хемосорбции между адсорбентом и адсорбатом образуется химическая связь. Ключевые характеристики хемосорбции:
- Необратимость или трудная обратимость процесса
- Высокая теплота адсорбции (40-400 кДж/моль)
- Образование только мономолекулярного слоя адсорбата
- Более низкая скорость по сравнению с физической адсорбцией
Факторы, влияющие на адсорбцию
На процесс адсорбции оказывают влияние следующие факторы:
- Природа адсорбента и адсорбата
- Удельная поверхность адсорбента
- Температура
- Концентрация адсорбата
- Давление (для газов)
Как влияет температура на адсорбцию
С повышением температуры физическая адсорбция уменьшается, так как усиливается тепловое движение молекул адсорбата. Для хемосорбции зависимость от температуры более сложная — сначала с ростом температуры адсорбция увеличивается, а затем начинает уменьшаться.

Зависимость адсорбции от концентрации и давления
С увеличением концентрации адсорбата в растворе или давления газа адсорбция возрастает. При этом зависимость не является линейной — при высоких концентрациях наступает насыщение поверхности адсорбента.
Изотермы адсорбции
Зависимость величины адсорбции от концентрации (или давления) при постоянной температуре называется изотермой адсорбции. Существует несколько типов изотерм адсорбции:
- Изотерма Ленгмюра
- Изотерма Фрейндлиха
- Изотерма БЭТ
Изотерма Ленгмюра
Теория Ленгмюра описывает мономолекулярную адсорбцию на однородной поверхности. Основные положения теории Ленгмюра:
- Адсорбция локализована на отдельных адсорбционных центрах
- Каждый центр взаимодействует только с одной молекулой адсорбата
- Адсорбционные центры энергетически эквивалентны
- Адсорбированные молекулы не взаимодействуют друг с другом
Уравнение изотермы Ленгмюра имеет вид:
[TEX]a = a_\infty \frac{K c}{1 + K c}[/TEX]
где a — величина адсорбции, a∞ — емкость адсорбционного монослоя, K — константа адсорбционного равновесия, c — равновесная концентрация адсорбата.

Изотерма Фрейндлиха
Эмпирическое уравнение Фрейндлиха хорошо описывает адсорбцию на неоднородной поверхности:
[TEX]a = K c^{1/n}[/TEX]
где K и n — эмпирические константы.
Изотерма БЭТ
Теория БЭТ (Брунауэр, Эммет, Теллер) описывает полимолекулярную адсорбцию. Основные положения теории БЭТ:
- Образуются полимолекулярные адсорбционные слои
- Теплота адсорбции в первом слое отличается от теплоты конденсации
- Теплота адсорбции во всех последующих слоях равна теплоте конденсации
Уравнение изотермы БЭТ:
[TEX]a = \frac{a_m C p}{(p_s — p)[1 + (C-1)\frac{p}{p_s}]}[/TEX]
где am — емкость монослоя, C — константа, p — давление газа, ps — давление насыщенного пара.
Применение адсорбции
Адсорбция широко используется в различных областях:
- Очистка газов и жидкостей
- Осушка газов
- Разделение газовых и жидких смесей
- Улавливание и рекуперация паров растворителей
- Очистка сточных вод
- Извлечение ценных компонентов из растворов
- Катализ гетерогенных реакций
Адсорбенты в промышленности
Наиболее распространенные промышленные адсорбенты:
- Активированный уголь
- Силикагель
- Цеолиты
- Оксид алюминия
- Ионообменные смолы
Адсорбция в быту
В повседневной жизни мы часто сталкиваемся с адсорбцией:
- Поглощение запахов активированным углем в холодильниках
- Использование силикагеля для осушки воздуха
- Применение адсорбентов в фильтрах для воды
- Использование активированного угля в медицине при отравлениях
Десорбция
Десорбция — это процесс, обратный адсорбции, при котором происходит удаление адсорбированного вещества с поверхности адсорбента. Десорбцию можно осуществить следующими способами:
- Повышением температуры
- Понижением давления
- Промывкой растворителем
- Вытеснением другим веществом
Десорбция используется для регенерации отработанных адсорбентов и извлечения поглощенных веществ.
Аналитическая и физколлоидная химияТема 9 Адсорбционные процессы на границе раздела фаз Конспект лекции
- Понятие об адсорбции
- Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- Полимолекулярная адсорбция. Уравнение БЭТ
- Энергетические параметры адсорбции на однородной поверхности
- Взаимодействие частиц в адсорбционном слое и классификация изотерм адсорбции
Ключові терміни:
адсорбат, адсорбент, адсорбционное равновесие, адсорбция, изотерма адсорбции, полимолекулярная адсорбция, теория Ленгмюра, уравнение ФрейндлихаПонятие об адсорбции
Любые гетерогенные процессы, например, разложение или образование химического соединения, растворение твердых тел, газов или жидкостей, испарение, возгонка и т.п., а также многие другие процессы проходят в присутствии поверхностей раздела фаз (твердое тело — газ, твердое тело — жидкость, газ – жидкость). Состояние вещества у поверхности раздела соприкасающихся фаз отличается от его состояния внутри этих фаз вследствие различия молекулярных взаимодействий в разных фазах. Это различие вызывает особые поверхностные явления на границе раздела фаз.
Это различие вызывает особые поверхностные явления на границе раздела фаз.
Представим себе поверхность твердого тела на границе с газом. Внутри твердого тела частицы (атомы, ионы или молекулы), образующие его решетку, правильно чередуются в соответствии с кристаллической структурой, причем их взаимодействия уравновешены. Состояние же частицы, находящейся на поверхности, иное — взаимодействия таких частиц не уравновешены, и поэтому поверхность твердого тела притягивает молекулы вещества из соседней газовой фазы. В результате концентрация этого вещества на поверхности становится больше, чем в объеме газа, газ адсорбируется поверхностью твердого тела.
Таким образом, адсорбция представляет собой концентрирование вещества на поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция ‒ адсорбент, а поглощаемое из объемной фазы вещество — адсорбат.
Адсорбент поглощает из объемной фазы тем больше вещества, чем больше развита его поверхность. Поверхность, приходящаяся на 1 г адсорбента, называют удельной поверхностью. Величина удельной поверхности у различных адсорбентов может быть весьма различной. Непористые тела имеют удельную поверхность от нескольких м2/г до сотен м2/г. Большое увеличение поверхности связано обычно с наличием в твердом теле узких пор. Примерами таких высокодисперсных пористых тел с удельной поверхностью до нескольких тысяч м2/г являются активированный уголь и силикагель.
Поверхность, приходящаяся на 1 г адсорбента, называют удельной поверхностью. Величина удельной поверхности у различных адсорбентов может быть весьма различной. Непористые тела имеют удельную поверхность от нескольких м2/г до сотен м2/г. Большое увеличение поверхности связано обычно с наличием в твердом теле узких пор. Примерами таких высокодисперсных пористых тел с удельной поверхностью до нескольких тысяч м2/г являются активированный уголь и силикагель.
Количественно адсорбция может быть выражена с помощью нескольких величин:
- величиною а, представляющей собой количество адсорбата, находящегося в объеме адсорбционного слоя, отвечающего единице массы адсорбента (моль/г).
- величиною Г, представляющей собой избыток числа молей адсорбата в объеме поверхностного слоя площадью 1 см2 по сравнению с числом его молей в том же объеме, если бы у межфазной границы не происходило изменение концентрации адсорбата (Г>0 — адсорбция, Г<0 – десорбция).

Различают физическую и химическую адсорбцию. В первом случае адсорбционные силы имеют ту же природу, что и межмолекулярные силы. Физическая адсорбция всегда обратима. При химической адсорбции адсорбционные силы имеют химическую природу. Хемосорбция обычно необратима. При химической адсорбции молекулы адсорбата, связанные с адсорбентом прочными химическими связями, не могут перемещаться по поверхности адсорбента. Это случай
Физическая адсорбция протекает самопроизвольно с выделением энергии. Адсорбат стремится занять всю поверхность адсорбента, но этому препятствует процесс, противоположный адсорбции — десорбция, вызванный стремлением к равномерному распределению вещества. Для каждой концентрации адсорбата в окружающей среде существует состояние адсорбционного равновесия, аналогичное равновесию между испарением и конденсацией. Адсорбционное равновесие — это динимическое равновесие которое наступает тогда, когда скорость процесса адсорбции равна скорости обратного процесса десорбции. Понятно, что чем выше концентрация адсорбата, тем больше адсорбция. Также ясно, что чем выше температура, тем меньше физическая адсорбция. Для каждой температуры существует свое адсорбционное равновесие.
Адсорбат стремится занять всю поверхность адсорбента, но этому препятствует процесс, противоположный адсорбции — десорбция, вызванный стремлением к равномерному распределению вещества. Для каждой концентрации адсорбата в окружающей среде существует состояние адсорбционного равновесия, аналогичное равновесию между испарением и конденсацией. Адсорбционное равновесие — это динимическое равновесие которое наступает тогда, когда скорость процесса адсорбции равна скорости обратного процесса десорбции. Понятно, что чем выше концентрация адсорбата, тем больше адсорбция. Также ясно, что чем выше температура, тем меньше физическая адсорбция. Для каждой температуры существует свое адсорбционное равновесие.
Адсорбцию принято характеризовать зависимостью количества адсорбированного вещества а от концентрации (или равновесного давления). Графики а=f(c) или а=f(р) при Т=const называют изотермами адсорбции. Вид обычной изотермы показан на рис. 9.1.
9.1.
Рисунок 9.1 ‒ Типичный вид изотермы адсорбции
Как можно видеть, изотерма имеет три характерных участка. Начальный круто поднимающийся вверх почти прямолинейный участок кривой показывает, что при малых концентрациях адсорбция пропорциональна концентрации. Это область, в которой выполняется закон Генри:[TEX]а=К\cdot{с}[/TEX], где К – константа Генри, не зависящая от концентрации с. В области I поверхность адсорбента в значительной степени свободна.
Почти горизонтальный участок III соответствует большим концентрациям и отвечает поверхности адсорбента, полностью насыщенной адсорбатом. В. этих условиях, если на поверхности может образоваться лишь мономолекулярный слой адсорбата, количество его практически перестает зависеть от концентрации. Средний участок II кривой соответствует промежуточным степеням заполнения поверхности.
Важной задачей теории адсорбции является вывод уравнения изотермы адсорбции. В настоящее время эта задача еще далека от разрешения. Для описания изотермы адсорбции предложен ряд эмпирических формул. {1/n}}}[/TEX](9.1)
{1/n}}}[/TEX](9.1)
где X — количество адсорбированного вещества, моль; m — масса адсорбента; с — равновесная концентрация, b и 1/n – константы.
Константы b и 1/n уравнения Фрейндлиха легко найти графически по изотерме, построенной в логарифмических координатах:
- [TEX]\ln{a}=\ln{\beta}+1/n\ln{C}[/TEX](9.2)
Это уравнение прямой. Тангенс угла наклона этой прямой равен 1/n, а отрезок, отсекаемый прямой на оси ординат, равен lnb. Константа b обычно колеблется в широких пределах. Физический смысл ее становится ясным, если принять с=1, тогда b представляет собой величину адсорбции при равновесной концентрации адсорбата 1 моль/л. Показатель 1/n принимается постоянным, лежащим в пределах 0,2 -1,0 для адсорбции из газовой среды и 0,1 — 0,5 для адсорбции из растворов. Поэтому уравнение Фрейндлиха пригодно лишь для концентраций, меньших 0,5 моль/л.2.
Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
Фундаментальным вкладом в учение об адсорбции явилась теория Ленгмюра.
- адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата. На поверхности адсорбента образуется поэтому мономолекулярный слой адсорбата;
- адсорбционные центры энергетически эквивалентны;
- адсорбированные молекулы не взаимодействуют друг с другом.
Для вывода изотермы адсорбции Ленгмюра учтем, что при установлении в системе адсорбционного равновесия скорость адсорбции ([TEX]V\downarrow [/TEX])должна равняться скорости десорбции([TEX]V\uparrow [/TEX]). Для того, чтобы молекула адсорбировалась, она должна удариться о поверхность и попасть на незанятое место. Учитывая, что число ударов пропорционально концентрации С, а вероятность попасть на незанятое место пропорционально их числу, имеем
Учитывая, что число ударов пропорционально концентрации С, а вероятность попасть на незанятое место пропорционально их числу, имеем
- [TEX]V\downarrow=k_1c(1-\Theta),[/TEX](9.3)
где[TEX]\Theta[/TEX]- доля занятых мест,[TEX]k_1[/TEX]- константа скорости адсорбции. Скорость десорбции прямо пропорциональна числу адсорбированных молекул:
- [TEX]V\uparrow=k_2\Theta, [/TEX](9.4)
где[TEX]k_2[/TEX]- константа скорости десорбции.
При равновесии[TEX]V\uparrow=V\downarrow[/TEX]и
- [TEX]k_1c(1-\Theta)=k_2\Theta[/TEX]
Отсюда
- [TEX]\Theta=\frac{Kc}{1+Kc} [/TEX](9.5)
где[TEX] K=k_1/k_2[/TEX]- константа адсорбционного равновесия.
Обозначим символом[TEX]a_\infty[/TEX]максимальную адсорбцию или емкость адсорбционного монослоя. Тогда
- [TEX]\Theta=a/a_\infty[/TEX](9.6)
Следовательно,
- [TEX]a=a_\infty \frac{K\cdot{c}}{1+K\cdot{c}}.[/TEX](9.7)
Это уравнение носит название изотермы адсорбции Ленгмюра. Для газов и паров концентрацию можно заменить пропорциональным ей значением давления и изотерма адсорбции примет вид
Для газов и паров концентрацию можно заменить пропорциональным ей значением давления и изотерма адсорбции примет вид
- [TEX]a=a_\infty{\frac{K_p{\cdot{P}}}{1+K_p{\cdot{P}}}} [/TEX](9.8)
Константы адсорбционного равновесия К и[TEX]K_p[/TEX]характеризуют энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше значение константы адсорбционного равновесия.
Важны экстраполяционные следствия уравнения изотермы Ленгмюра. При[TEX]C\rightarrow{0}[/TEX]имеем[TEX]a=a_\infty{\cdot}K\cdot{c}[/TEX]и[TEX]\Theta=K\cdot{c}[/TEX].
Эти выражения соответствуют закону Генри: величина адсорбции линейно растет с увеличением концентрации. Таким образом уравнение Ленгмюра является более общим соотношением, включающим и уравнение Генри.
При больших концентрациях, когда[TEX] K_c\gg1[/TEX]
- [TEX]a=a_\infty и \Theta=1[/TEX]
Эти соотношения отвечают насыщению, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата. Экспериментальные результаты по определению изотермы адсорбции обычно обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме:
Экспериментальные результаты по определению изотермы адсорбции обычно обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме:
- [TEX]\frac{c}{a}=\frac{1}{a_\infty{K}}+\frac{c}{a_\infty}.[/TEX](9.9)
Методика нахождения коэффициентов уравнения Ленгмюра показана на рис. 9.2.
Рисунок 9.2 ‒ К нахождению констант уравнения Ленгмюра
Полимолекулярная адсорбция. Уравнение БЭТ
Опыт показывает, что наряду с изотермами адсорбции, которые описываются уравнением Ленгмюра и о которых мы говорили, часто встречаются изотермы, не имеющие участка, параллельного оси давлений и отвечающего насыщению поверхности адсорбента молекулами адсорбата. Такая изотерма — показана на рис 9.3. Это связано с явлением, при котором на активных центрах поверхности адсорбента образуются несколько слоев молекул или ионов адсорбата — полимолекулярная адсорбция.
Наиболее удачная теория (из многочисленных), описывающая подобные процессы была создана в 1935-1940 гг. Брунауэром, Эмметом, Теллером применительно к адсорбции паров. Их теория получила название теории БЭТ. Ее основные положения:
Брунауэром, Эмметом, Теллером применительно к адсорбции паров. Их теория получила название теории БЭТ. Ее основные положения:
- Адсорбционные слои полимолекулярны, причем их толщина на разных участках поверхности различна.
- Адсорбционные силы тождественны силам, вызывающим конденсацию.
Рисунок 9.3 ‒ Изотерма полимолекулярной адсорбции
Последнее положение может быть обосновано следующим образом: лишь первый слой молекул адсорбата находится в непосредственной близости к поверхности твердого тела. Второй, и особенно последующие слои, прилегают к молекулам, подобным им, и их образование напоминает обычную конденсацию пара на поверхности жидкости.
На основании этих представлений Брунауэр, Эммет и Теллер вывели следующее уравнение изотермы адсорбции паров:
- [TEX]a=\frac{a_\infty{\cdot{K_П\cdot{p/p_s}}}}{(1-p/p_s)[1+(K_П-1)p/p_s]}[/TEX](9.10)
где[TEX]K_П[/TEX]- константа равновесия полимолекулярной адсорбции, Р — давление пара,[TEX]P_s[/TEX]- давление насыщенного пара при данной температуре,[TEX]a_\infty[/TEX]- емкость монослоя.
При низких давлениях, когда[TEX]p/p_s\ll 1[/TEX], учитывая, что[TEX]K_p=K_П\cdot{1/p_s}[/TEX], получаем уравнение Ленгмюра:
- [TEX]\frac{a_\infty{K_p}p_sp/p_s}{1+K_pp_sp/p_s}=a_\infty{\frac{K_pp}{1+K_pp}}.[/TEX](9.11)
Уравнение изотермы полимолекулярной адсорбции БЭТ легко привести к линейной форме:
- [TEX]\frac{p/p_s}{a(1-p/p_s)}=\frac{1}{a_\infty{K_П}}+\frac{K_П-1}{a_\infty{K_П}}p/p_s.[/TEX](9.12)
По наклону этой прямой и отсекаемому ею отрезку на оси ординат можно найти значения констант[TEX]a_\infty[/TEX]и[TEX]K_П[/TEX].
Теория БЭТ, так же как и теория Ленгмюра, указывает путь для определения удельной поверхности адсорбента (любого твердого вещества). Для этого находят емкость монослоя[TEX]a_\infty[/TEX]для паров простых веществ ([TEX]N_2[/TEX], Ar, Kr) при низких температурах. Затем, зная площадь[TEX]S_0[/TEX], занимаемую одной молекулой простого вещества, вычисляют удельную поверхность адсорбента:
- [TEX]S_{уд}=a_\infty{\cdot{N_a}\cdot{S_0}}[/TEX](9.
 13)
13)
где[TEX]N_a[/TEX]- число Авогадро. Это метод определения удельной поверхности по БЭТ.
Энергетические параметры адсорбции на однородной поверхности
Между энергией Гиббса, энтальпией и энтропией адсорбции существует известное соотношение:
- [TEX]\Delta{G}=\Delta{H}-T\Delta{S}.[/TEX]
Адсорбция — самопроизвольный процесс, а всякому самопроизвольному процессу при P,T=const отвечает условие[TEX]\Delta{G}<0[/TEX]. Энтропия также уменьшается ([TEX]\Delta{S}<0[/TEX]), т.к. при адсорбции ограничивается свобода движения молекул: в объемной фазе они движутся в трех направлениях, а на поверхности — в двух. Из приведенного уравнения следует, что энтальпия адсорбции должна иметь тот же знак, т.е.[TEX]\Delta{H}<0[/TEX]. Таким образом, адсорбция — экзотермический процесс.
Если адсорбция подчиняется уравнениям Генри и Ленгмюра, т.е. константа равновесия адсорбции в этих уравнениях не зависят от степени заполнения поверхности, то стандартная энергия Гиббса адсорбции может быть рассчитана по уравнению, справедливому для химических реакций:
- [TEX]\Delta{G^0}=-RT\ln{K}.
 0}+RT\ln{K}}{T}. [/TEX]
0}+RT\ln{K}}{T}. [/TEX]
Данные соотношения для расчета энергетических параметров адсорбции получены, исходя из предположения, что поверхность адсорбента однородна (эквипотенциальна) и на ней образуется мономолекулярный слой адсорбата.
Если адсорбция происходит на неоднородной поверхности, то наиболее реакционноспособные адсорбционные центры будут заняты уже при малых равновесных концентрациях. Таким образом, энергетические параметры адсорбции зависят от степени заполнения поверхности адсорбатом. Например, дифференциальная теплота адсорбции будет уменьшаться по мере заполнения поверхности.
Взаимодействие частиц в адсорбционном слое и классификация изотерм адсорбции
Одним из опорных пунктов теории Ленгмюра является константа отсутствия взаимодействия частиц адсорбата в адсорбционном слое, Однако ленгмюровская адсорбция является лишь частным случаем в многообразном мире адсорбционных процессов. На рис. 9.4 показаны различные формы изотерм адсорбции из разбавленных растворов.
Рисунок 9.4 ‒ Формы изотерм адсорбции
Исходя из формы начального участка были выделены четыре характерных класса изотерм (S, L, H, C). Деление изотерм на отдельные типы внутри каждого класса связано с последующим изменением их формы при наиболее высоких концентрациях. Класс L (класс Ленгмюра) является наиболее общим. Изотермы типа L2 достигают насыщения, дальнейшая адсорбция выше этого уровня дает изотерму типа L3. Если достигается второе плато, то имеем дело с изотермой L4. Для изотерм типа L5 характерно наличие максимума. Максимум отражает изменение состояния вещества в растворе — например, ассоциацию молекул при определенной концентрации. Сходный, хотя и не столь полный, набор типов изотерм получен и для других классов.
Начальный участок изотерм S — класса выгнут относительно оси концентраций, однако далее часто следует точка перегиба, что и придает изотерме характерную S -обратную форму.
Изотермы класса Н (высокое сродство – higf) наблюдается при чрезвычайно сильной адсорбции при очень низких концентрациях; они пересекаются с осью ординат. Изотермы класса С (constant) имеют начальный линейный участок, что указывает на постоянное распределение растворенного вещества между раствором и адсорбентом (постоянная скорость адсорбции).
Изотермы класса С (constant) имеют начальный линейный участок, что указывает на постоянное распределение растворенного вещества между раствором и адсорбентом (постоянная скорость адсорбции).
Теоретический анализ различных типов изотерм адсорбции позволяет получить много полезной информации о механизме адсорбции. При этом следует принимать во внимание величину энергии активации процесса удаления молекул адсорбата с поверхности адсорбента. Если взаимодействие между адсорбированными молекулами пренебрежимо мало, энергия активации не зависит от степени заполнения поверхностиf a это приведет к изотерме типа L или Н.
Если сила взаимодействия между адсорбированными молекулами больше силы взаимодействия между растворенным веществом и адсорбентом, энергия активации возрастает и адсорбция описывается изотермой типа S. В этом случае молекулы растворенного вещества стремятся расположиться на поверхности в виде цепей.
Изотермы типа Н наблюдаются в тех случаях, когда имеет место хемосорбция.
Изотерма типа С характерна для адсорбции на микропористых адсорбентах и соответствует таким условиям, при которых число адсорбционных центров остается постоянным в широкой области концентраций. По мере заполнения одних центров появляются новые, и доступная для адсорбции поверхность увеличивается пропорционально количеству адсорбированного вещества.
Раздел 4 Поверхностные явления, Коллоидные системыТема 9 Адсорбционные процессы на границе раздела фаз Краткий конспект
Адсорбция представляет собой концентрирование вещества на поверхности раздела фаз.
Адсорбция — самопроизвольный процесс, а всякому самопроизвольному процессу при P,T=const отвечает условие ∆G<0. Энтропия также уменьшается (∆S<0), т.к. при адсорбции ограничивается свобода движения молекул: в объемной фазе они движутся в трех направлениях, а на поверхности — в двух. Из приведенного уравнения следует, что энтальпия адсорбции должна иметь тот же знак, т.е. ∆Н<0. Таким образом, адсорбция — экзотермический процесс.
Вещество, на поверхности которого происходит адсорбция ‒ адсорбент, а поглощаемое из объемной фазы вещество — адсорбат.
Адсорбент поглощает из объемной фазы тем больше вещества, чем больше развита его поверхность. Поверхность, приходящаяся на 1 г адсорбента, называют удельной поверхностью. Величина удельной поверхности у различных адсорбентов может быть весьма различной. Непористые тела имеют удельную поверхность от нескольких м2/г до сотен м2/г. Большое увеличение поверхности связано обычно с наличием в твердом теле узких пор. Примерами таких высокодисперсных пористых тел с удельной поверхностью до нескольких тысяч м2/г являются активированный уголь и силикагель. Для каждой концентрации адсорбата в окружающей среде существует состояние адсорбционного равновесия, аналогичное равновесию между испарением и конденсацией. Адсорбционное равновесие — это динимическое равновесие которое наступает тогда, когда скорость процесса адсорбции равна скорости обратного процесса десорбции.
Количественно адсорбция может быть выражена величиною а, представляющей собой количество адсорбата, находящегося в объеме адсорбционного слоя, отвечающего единице массы адсорбента (моль/г).
Различают физическую и химическую адсорбцию. В первом случае адсорбционные силы имеют ту же природу, что и межмолекулярные силы. Физическая адсорбция всегда обратима. При химической адсорбции адсорбционные силы имеют химическую природу. Хемосорбция обычно необратима. При химической адсорбции молекулы адсорбата, связанные с адсорбентом прочными химическими связями, не могут перемещаться по поверхности адсорбента. Это случай локализованной адсорбции. В отличие от этого при физической адсорбции могут иметь место как нелокализованная адсорбция, когда молекулы адсорбата способны передвигаться по поверхности адсорбента, так и локализованная. Локализованная физическая адсорбция объясняется тем, что поверхность адсорбента состоит из различных атомов, ионов или молекул, по-разному взаимодействующих с молекулами адсорбата. {1/n}}}[/TEX]
{1/n}}}[/TEX]
где X — количество адсорбированного вещества, моль; m — масса адсорбента; с — равновесная концентрация, b и 1/n – константы. Уравнение Фрейндлиха пригодно лишь для концентраций, меньших 0,5 моль/л.
Фундаментальным вкладом в учение об адсорбции явилась теория Ленгмюра. Эта теория позволяет учесть наиболее сильные отклонения от закона Генри, связанные с ограниченностью поверхности адсорбента. Это обстоятельство приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации адсорбируемого вещества. Это положение является основным в теории Ленгмюра и уточняется следующими допущениями:
- адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата. На поверхности адсорбента образуется поэтому мономолекулярный слой адсорбата;
- адсорбционные центры энергетически эквивалентны;
- адсорбированные молекулы не взаимодействуют друг с другом.
Уравнение изотермы адсорбции Ленгмюра имеет такой вид:
- [TEX]a=a_\infty{\frac{K\cdot{c}}{1+K\cdot{c}}}.
 [/TEX]
[/TEX]
Для газов и паров концентрацию можно заменить пропорциональным ей значеним давления и изотерма адсорбции приобретёт вид
- [TEX]a=a_\infty{\frac{K_p\cdot{P}}{1+K_p\cdot{P}}} [/TEX]
Константы адсорбционного равновесия К и Кр характеризуют энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше значение константы адсорбционного равновесия.
Опыт показывает, что наряду с изотермами адсорбции, которые описываются уравнением Ленгмюра и о которых мы говорили, часто встречаются изотермы, не имеющие участка, параллельного оси давлений и отвечающего насыщению поверхности адсорбента молекулами адсорбата. Такое явление называется полимолекулярной адсорбцией и связано с адсорбцией активными центрами адсорбента нескольких слоев молекул адсорбата.
Наиболее удачная теория (из многочисленных), описывающая подобные процессы была создана в 1935-1940 гг. Брунауэром, Эмметом, Теллером применительно к адсорбции паров. Их теория получила название теории БЭТ. Ее основные положения:
Их теория получила название теории БЭТ. Ее основные положения:
- Адсорбционные слои полимолекулярны, причем их толщина на разных участках поверхности различна.
- Адсорбционные силы тождественны силам, вызывающим конденсацию.
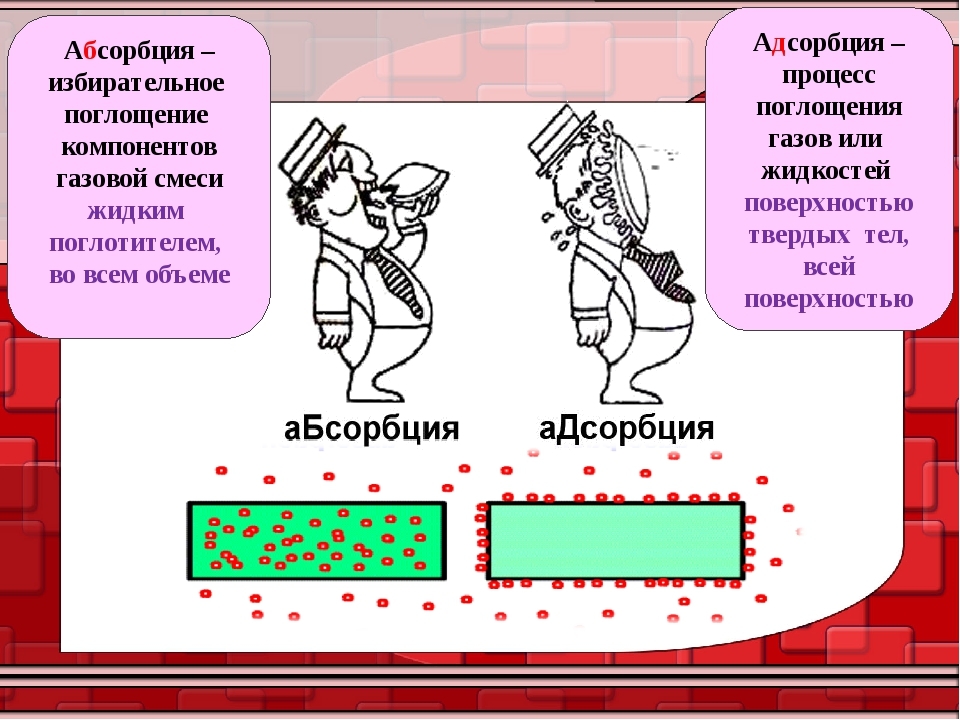
Разница между абсорбцией и адсорбцией
Адсорбция и абсорбция
В адсорбции вещество, молекулы которого адсорбируются на поверхности, называется адсорбатом. Вещество, на поверхности которого происходит процесс, называется адсорбентом. Это поверхностное явление.
Абсорбция — это отдельный от адсорбции механизм, поскольку молекулы, подвергающиеся абсорбции, всасываются по длине, а не по воздуху. Адсорбция основана на поверхности, где на поверхности развита пленка адсорбата, и абсорбция включает в себя полный объем абсорбирующего агента.
Содержание
- Определения
- Важная разница между абсорбцией и адсорбцией
- Примеры адсорбентов
- Механизм адсорбции
- Часто задаваемые вопросы – Часто задаваемые вопросы
Определения адсорбции и абсорбции
Что такое адсорбция?
Адсорбция – это прилипание молекул (или ионов и атомов) к поверхности твердого тела или жидкости. Молекулы накапливаются только на поверхности и не проникают в объем адсорбирующего материала.
Молекулы накапливаются только на поверхности и не проникают в объем адсорбирующего материала.
- Вещество, молекулы которого адсорбируются на поверхности, называется адсорбатом .
- Вещество, на поверхности которого происходит процесс, называется адсорбентом .
- Это поверхностное явление.
Что такое абсорбция?
Абсорбция – это физическое или химическое действие или механизм, при котором электроны, молекулы или ионы присоединяются к некоторой объемной фазе – твердому или жидкому веществу.
Разница между адсорбцией и абсорбцией
Критерии | Поглощение | Адсорбция |
| Определение | Ассимиляция молекулярной системы в объеме твердой или жидкой среды. | Накопление молекулярных частиц на дне вместо жидкости или твердого тела. |
| Феномен | Массовое явление. | Поверхностное явление. |
| Теплообменник | Эндотермический процесс | Экзотермический процесс |
| Температура | Температура не влияет. | Воздействие низкой температуры |
| Скорость реакции | Происходит с одинаковой частотой. | Неуклонно увеличивается и достигает равновесия. |
| Концентрация | Постоянна во всей среде. | Концентрация адсорбента на дне отличается от концентрации в массе. |
Примеры адсорбентов
- Некоторые примеры хороших адсорбентов включают:
Гель оксида алюминия - Силикагель
- Цеолиты
- Активированный уголь
- Графит
Что такое десорбция?
Десорбция – обратный процесс, при котором адсорбированное вещество удаляется с поверхности адсорбента.
Механизм адсорбции
Процесс адсорбции возникает из-за того, что силы, действующие на поверхностные частицы вещества, не такие, как силы, действующие на объем материала. В отличие от частиц внутри объема, на открытой поверхности частицы не окружены атомами со всех сторон.
Следовательно, внутренние силы уравновешивают друг друга, а силы на поверхности неуравновешены. Неуравновешенные остаточные силы на поверхности имеют тенденцию притягивать частицы адсорбата. Это приводит к процессу адсорбции.
Здесь следует отметить, что при данных температуре и давлении, чем больше площадь поверхности адсорбента, тем выше степень адсорбции.
Часто задаваемые вопросы – Часто задаваемые вопросы
Q1
В чем разница между адсорбцией и абсорбцией?
Адсорбирующие соединения прилипают к поверхности молекулы, тогда как абсорбирующие вещества входят в объемную фазу жидкости или твердого тела.
Q2
Что является примером адсорбции?
Осаждение молекулярных частиц на поверхность известно как адсорбция. Адсорбат относится к молекулярным частицам, которые адсорбируются на поверхности, тогда как адсорбент относится к поверхности, на которой происходит адсорбция. Типичными примерами являются глина, силикагель, коллоиды, металлы и другие адсорбенты.
Адсорбат относится к молекулярным частицам, которые адсорбируются на поверхности, тогда как адсорбент относится к поверхности, на которой происходит адсорбция. Типичными примерами являются глина, силикагель, коллоиды, металлы и другие адсорбенты.
Q3
Какие существуют типы абсорбции?
Физическая абсорбция и химическая абсорбция представляют собой два типа процессов абсорбции, в зависимости от того, происходит ли химическая реакция между растворенным веществом и растворителем.
Q4
Что такое процесс абсорбции?
Абсорбция – это химический процесс, при котором материал в одном состоянии переходит в другое вещество в другом состоянии.
Q5
Каковы основные типы абсорбционной спектроскопии?
Инфракрасные, атомные, видимые, ультрафиолетовые (УФ) и рентгеновские волны являются наиболее распространенными типами волн, регистрируемых с помощью абсорбционной спектроскопии. Методы, используемые каждым спектрофотометром, одинаковы.
Чтобы узнать больше об адсорбции и абсорбции, зарегистрируйтесь в BYJU’S и загрузите наше приложение.
Разница между абсорбентом и адсорбентом (со сравнительной таблицей)
Оставить комментарий / Микробиология / Автор Суприя Н
Разница между абсорбентом и абсорбентом в основном обусловлена следующими факторами, такими как их механизм и явления, за которыми они следуют:
Механизм : Механизм абсорбента и абсорбента заключается в удержании частиц или молекул, в котором формирователь поглощает частицы в матрица, а последняя адсорбирует частицы на твердой матрице.
Явления : Абсорбция и адсорбция — это явления, которые делают использование абсорбента и адсорбата соответственно. Оба процесса принципиально различаются тем, по какому механизму они пропускают частицы.
Содержимое: Абсорбент и Адсорбент
- Сравнительная таблица
- Определение
- Примеры
- Ключевые отличия
- Заключение
Сравнительная таблица
| Свойства | Абсорбент | Адсорбент |
|---|---|---|
| Значение | Абсорбент представляет собой разновидность матрицы, которая пропускает твердые, жидкие и газообразные частицы на поверхность матрицы | Сорбентную матрицу можно определить как матрицу, которая удерживает частицы жидкой и газообразной среды над поверхностью матрицы |
| Разделение частиц | Абсорбирующая среда поглощает частицы абсорбата, которые способны поглощаться средой | Адсорбирующая матрица поглощает частицы, называемые адсорбатом, которые способны адсорбироваться на поверхности матрицы |
| Рабочий | Абсорбент работает по принципу растворения, диффузии или осмоса, что позволяет определенным частицам проникать в матрицу | Адсорбент работает по принципу адгезии, что позволяет частицам прилипать к поверхности матрицы |
| Явления | Работает на явлениях абсорбции | Работает на явлениях абсорбции |
| Теплообмен | Силы взаимодействия между абсорбирующей матрицей и молекулами абсорбата проявляют эндотермическую тепловую энергию | Силы взаимодействия между абсорбирующей матрицей и молекулами адсорбата проявляют экзотермическую энергию |
| Влияние температуры | Температура не влияет на процесс абсорбции | Адсорбция зависит от температуры |
| Отделение частиц | Частицы поглощаются абсорбирующей матрицей | Отделяют частицы на абсорбирующей матрице |
| Взаимодействие между частицами и матрицей | Абсорбированные материалы попадают в абсорбент через различные фазы вещества или какую-либо химическую реакцию | Адсорбированные материалы прилипают к адсорбенту за счет сил Ван-дер-Валя или взаимодействия ковалентной связи |
| Примеры | Вата, бумажные полотенца и т. д. д. | Активированный оксид алюминия, силикагель, активированный уголь, глина и т. д. |
Определение абсорбента
Абсорбент можно определить как материал, который поглощает частицы или позволяет частицам проникать через его поверхность, и этот процесс обычно называют 0030 поглощение . Частицы, которые поглощаются абсорбирующей матрицей, называются абсорбирующими материалами.
В процессе абсорбции многие твердые, жидкие и газообразные частицы могут попадать в абсорбент посредством растворения, диффузии или осмоса. Следовательно, абсорбенту требуется физическая энергия извне для разделения частиц внутри матрицы.
Процесс абсорбции можно понять на примере абсорбата сок и абсорбент в виде папиросной бумаги . Папиросная бумага сразу же впитывает жидкое вещество, поэтому сок впитывается в поры папиросной бумаги, и он становится неопознаваемым , чтобы отделить его.
Здесь взаимодействие между частицами абсорбента и абсорбата является стойким , но не связано с каким-либо физическим или химическим взаимодействием. Скорость поглощения составляет однородных , а теплообмен между поверхностью и окружающей средой составляет эндотермический , т.е. требует энергии извне.
Типы
Химическая абсорбция : Это химически реактивный процесс, который происходит между частицами абсорбата и абсорбирующей матрицей. Например, водный гидроксид натрия (абсорбент) растворяет кислый газ .
Физическое поглощение : Это химически нереактивный и процесс происходит между двумя фазами материи. Например, жидкость поглощает газ, как в вода , есть определенное количество растворенного кислорода . Это зависит от фаз и физических свойств абсорбата, таких как растворимость, и других факторов, таких как давление и температура.
Определение адсорбента
Адсорбент можно определить как матрицу, которая разделяет или удерживает частицы на своей поверхности посредством явлений, обычно называемых адсорбцией . Частицы, которые отделяются матрицей адсорбента, называются адсорбат материалы.
В процессе адсорбции многие растворенные твердые, жидкие и газообразные частицы могут отделяться на поверхности абсорбента за счет адгезии частиц. Следовательно, абсорбенту не нужна физическая энергия для отделения частиц, прилипших к поверхности матрицы.
Процесс адсорбции можно понять на примере адсорбента активированного угля и адсорбата аммиак газообразный . Активированный уголь имеет мельчайшие поры, которые позволяют газообразному аммиаку застревать в этих порах, что позволяет легко отделить адсорбат.
Здесь взаимодействие между частицами абсорбента и абсорбата является непостоянным , так как частицы слабо прилипают к поверхности матрицы адсорбента. Абсорбат прилипает к адсорбенту за счет некоторой физической силы взаимодействия или химической связи, такой как межмолекулярные силы Ван-дер-Ваальса или ковалентные связи, соответственно.
Абсорбат прилипает к адсорбенту за счет некоторой физической силы взаимодействия или химической связи, такой как межмолекулярные силы Ван-дер-Ваальса или ковалентные связи, соответственно.
Скорость адсорбции неравномерна , которая постепенно увеличивается, пока не достигнет равновесного состояния. Теплообмен между поверхностью и окружающей средой экзотермический , т.е. выделяется энергия.
Типы
Физическая адсорбция : Также называется Физисорбция , при которой абсорбирующая матрица и частицы абсорбата связываются посредством слабых сил Ван-дер-Ваальса.
Химическая адсорбция : Также обозначается как Хемосорбция , при которой абсорбирующая матрица и частицы абсорбата связываются химической связью, особенно ковалентной связью.
Примеры абсорбента
Основная роль абсорбента заключается в растворении или абсорбции взаимодействующих с ним частиц. Некоторые из примеров приведены ниже:
Некоторые из примеров приведены ниже:
- Некоторые примеры абсорбентов из повседневной жизни включают предметы домашнего обихода, такие как полотенца, бумажные салфетки, бумажные полотенца и т. д.
- Биологические процессы типа абсорбция через кожу и абсорбция из кишечника являются типичными примерами, в которых первый поглощает физическую энергию, такую как солнечный свет и некоторые химические вещества, а второй поглощает питательные вещества и воду.
- Жидкий хладагент также является примером абсорбента, который поглощает тепло из холодильника.
Примеры адсорбента
Функция адсорбента заключается в разделении взаимодействующих с ним частиц. Некоторые из примеров включают в себя:
- Некоторые распространенные примеры адсорбентов включают силикагель, активированный оксид алюминия, активированный уголь, цеолиты, активированный уголь и т.
 д.
д. - Адсорбция вирусов – это биологический процесс, при котором вирус прикрепляется к поверхности клетки-хозяина.
- Адсорбционная хроматография представляет собой молекулярную методику, с помощью которой можно разделить частицы жидкости или газа, прилипшие к неподвижной фазе или матрице адсорбента.
Ключевые различия между абсорбентом и адсорбентом
- Абсорбирующая матрица позволяет твердым, жидким и газообразным частицам проникать на поверхность матрицы. Напротив, адсорбентная матрица удерживает частицы растворенной твердой, жидкой и газообразной среды над поверхностью матрицы.
- Абсорбирующая среда поглощает частицы абсорбата (способные впитываться в среду). Напротив, матрица адсорбента отделяет частиц адсорбата (способных адсорбироваться на поверхности среды).
- Абсорбент работает по принципу диффузии или осмоса , что позволяет определенным частицам проникать в матрицу.

