Что такое микрофлора кишечника. Как нарушается баланс микрофлоры. Какие симптомы указывают на дисбактериоз. Какие методы помогают восстановить микрофлору. Какие препараты эффективны для нормализации микрофлоры кишечника.
Что такое микрофлора кишечника и почему она важна
Микрофлора кишечника — это совокупность микроорганизмов, населяющих желудочно-кишечный тракт человека. Она играет важнейшую роль в поддержании здоровья организма:
- Участвует в процессах пищеварения и усвоения питательных веществ
- Синтезирует витамины и другие полезные вещества
- Поддерживает иммунитет
- Защищает от патогенных микробов
- Влияет на обмен веществ
Нарушение баланса микрофлоры может привести к различным проблемам со здоровьем, поэтому так важно поддерживать ее в нормальном состоянии.
Причины нарушения микрофлоры кишечника
Основные факторы, которые могут нарушить баланс микрофлоры:
- Прием антибиотиков
- Неправильное питание
- Стрессы
- Инфекционные заболевания ЖКТ
- Снижение иммунитета
- Гормональные нарушения
- Возрастные изменения
Симптомы дисбактериоза кишечника
На нарушение микрофлоры могут указывать следующие симптомы:

- Расстройства стула (диарея, запоры)
- Вздутие живота, повышенное газообразование
- Боли и дискомфорт в животе
- Снижение аппетита
- Общая слабость, утомляемость
- Аллергические реакции
- Частые простудные заболевания
Методы восстановления микрофлоры кишечника
Диета и питание
Правильное питание — основа здоровой микрофлоры. Рекомендуется:
- Употреблять пробиотические продукты (кефир, йогурт, квашеная капуста)
- Есть больше клетчатки (овощи, фрукты, цельнозерновые продукты)
- Ограничить сахар и рафинированные продукты
- Пить достаточно воды
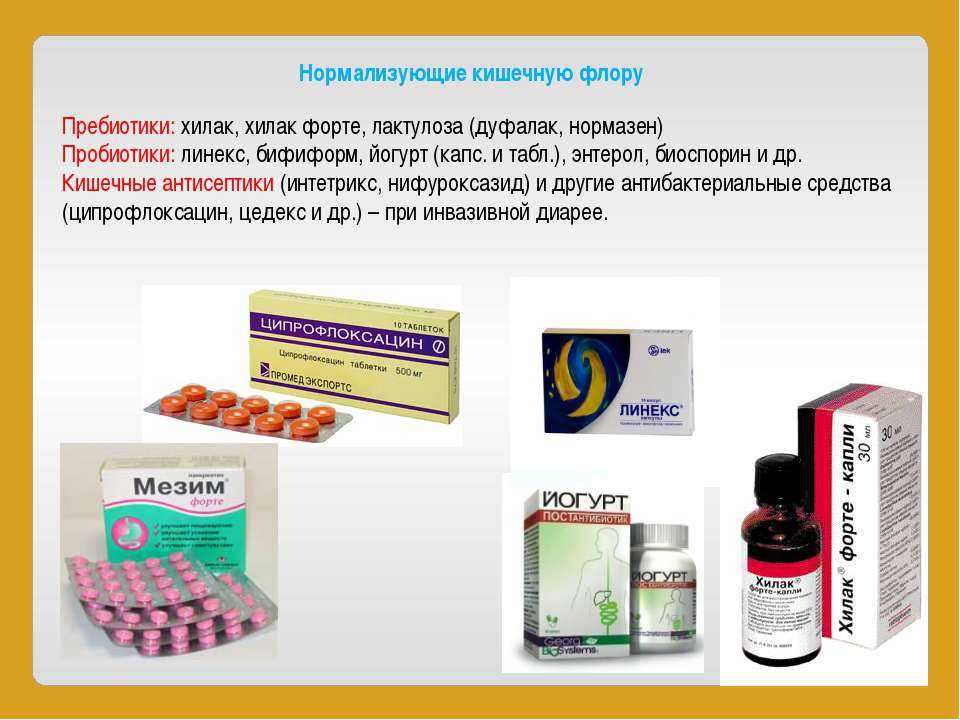
Пробиотики
Препараты с живыми полезными бактериями помогают восстановить нормальную микрофлору. Наиболее эффективны штаммы Lactobacillus и Bifidobacterium.
Пребиотики
Пищевые волокна, которые служат питательной средой для полезных бактерий. К ним относятся инулин, пектин, фруктоолигосахариды.
Фаготерапия
Использование бактериофагов — вирусов, избирательно уничтожающих патогенные бактерии. Помогает нормализовать баланс микрофлоры.
Трансплантация фекальной микробиоты
Пересадка здоровой микрофлоры от донора пациенту с тяжелыми нарушениями. Эффективна при рецидивирующих инфекциях C. difficile.

Эффективные препараты для восстановления микрофлоры
Наиболее популярные средства:
- Линекс — комплекс лиофилизированных бактерий
- Бифиформ — содержит бифидо- и энтерококки
- Аципол — лактобактерии и кефирные грибки
- Хилак форте — продукты метаболизма нормальной кишечной флоры
- Бактисубтил — споры Bacillus cereus
Важно помнить, что любые препараты нужно принимать только после консультации с врачом.
Профилактика нарушений микрофлоры
Чтобы поддерживать здоровый баланс кишечной микрофлоры:
- Питайтесь правильно и разнообразно
- Ограничьте употребление алкоголя
- Откажитесь от курения
- Ведите активный образ жизни
- Избегайте стрессов
- Не злоупотребляйте антибиотиками
Регулярная забота о здоровье кишечника поможет сохранить нормальный баланс микрофлоры и избежать многих проблем со здоровьем.
Современные исследования микробиома кишечника
В последние годы ученые уделяют большое внимание изучению микробиома человека и его влиянию на здоровье. Некоторые интересные открытия:
- Состав микрофлоры может влиять на риск развития ожирения, диабета, сердечно-сосудистых и аутоиммунных заболеваний
- Кишечные бактерии способны синтезировать нейромедиаторы и влиять на работу мозга
- Нарушения микрофлоры могут быть связаны с развитием депрессии и тревожных расстройств
- Микробиом играет важную роль в формировании иммунитета с рождения
Эти открытия открывают новые перспективы в лечении и профилактике различных заболеваний через модуляцию кишечной микрофлоры.
Заключение
Здоровая микрофлора кишечника — залог хорошего самочувствия и крепкого иммунитета. При появлении симптомов дисбактериоза важно своевременно обратиться к врачу. Комплексный подход, включающий правильное питание, пробиотики и другие методы, поможет восстановить нормальный баланс микроорганизмов и улучшить состояние здоровья.
Восстановление микрофлоры кишечника современное и безопасное средство — СПА ЭФФЕРЕНС
Восстановление микрофлоры кишечника современное и безопасное средство — СПА ЭФФЕРЕНС- Главная
- Наш блог
- Восстановление микрофлоры кишечника
С чем связано понятие «дырявый» кишечник?
Нарушение проницаемости кишечной мембраны ведёт к нарушению барьерной функции кишечника. Образующие мембрану белки представляют собой плотно связанную платформу, которые регулируют целостность эпителиального барьера и поддерживают иммунную активность слизистой оболочки в приемлемых физиологических пределах.
В случае её повреждения возникает большое количество «эпителиальных пробелов» слизистой кишечника. Через эти «пробелы» во внутреннюю среду организма устремляются различные чужеродные антигены, продукты метаболизма бактерий, вирусы, промежуточные и остаточные химические вещества, обладающие токсическими свойствами. Суммарное воздействие этих факторов приводит к аутоинтоксикации и развитию ряда болезней, на первый взгляд, не связанных с патологией кишечника – ревматоидный артрит, сахарный диабет 1 типа, псориаз, системные аллергические реакции и многие другие.
Изменение проницаемости кишечного барьера обусловлено целым рядом факторов:
- СТРЕСС — приводит к нарушениям микроциркуляции, нарушается питание эпителиоцитов, образующих барьерный слой. Эти воздействия осуществляются посредством секреции в просвет кишки растворимых факторов иммунной клеткой или апикальной частью эпителиальной клетки, разрушающих целостность эпителиального барьера. Поэтому провоспалительные цитокины (усиливающие воспаление), такие как IFN-γ, TNF-α, IL-4, IL-12, и IL-1 и IL-β, играют важную роль в нарушении плотного контакта белков слизистого барьера.

- Персистирующие МИКРОВОСПАЛЕНИЯ, ведущие к функциональным расстройствам желудочно-кишечного тракта (синдром раздражённого кишечника, функциональный запор, функциональная диарея и др.). Выявлена статистически значимая связь между инфильтрацией слизистой оболочки и количеством тучных клеток, которые в организме человека тесно связаны с заживлением ран и защиты от патогенов. Кроме этого показано наличие избыточного обсеменения микробами тонкого кишечника.
- Патогенное воздействие нормальной микрофлоры (по современной терминологии микробиоты), способной автономно нарушать проницаемость эпителиального барьера. Считается, что именно разнообразный, но стабильный СОСТАВ МИКРОФЛОРЫ кишечника является определяющим для здорового функционирования. В условиях нарушенной проницаемости обнаруживают различных представителей тонкокишечной и фекальной флоры, и изменения её состава.
- Ятрогенные факторы (АНТИБИОТИКИ + кортикоиды, иммунодепрессанты, противозачаточные, лучевая терапия).
Одной из относительно новой концепций нарушений кишечного барьера является изменение в нейроэндокринной системе. Ось «головной мозг – кишечник» включает в себя несколько отделов центральной и периферической нервных систем: периферическая нейроэндокринная система, вегетативная нервная система, гипоталамо-гипофизарно – надпочечниковая. Под контролем этой всеобъемлющей оси протекают все основные процессы, происходящие в кишечнике: моторика, секреция, всасывание, микроциркуляция и местная иммунная защита.
При сокращении числа полезных для человека бифидо- и лактобактерий и возрастании уровня вредных микроорганизмов наблюдается нарушение микрофлоры кишечника. Причинами данного явления, как мы выяснили, могут быть неправильное питание, прием лекарственных препаратов, инфекции, психологические стрессы, заболевания ЖКТ, иммунные или гормональные нарушения и ряд других факторов.
Для восстановления микрофлоры кишечника требуется правильно диагностировать проблему. Дисбактериоз обычно определяется по следующим симптомам:
- Диарея (нередко чередуется с запорами), повышенное газообразование, отрыжка, вздутие живота.
- Не свойственные раннее аллергические реакции на продукты питания.
- Общая слабость, плохой аппетит, головные боли.
- Снижение иммунитета, что приводит к частым случаям возникновения ОРЗ, ОРВИ, появлению грибковых заболеваний.
После выявления дисбактериоза назначаются препараты для восстановления микрофлоры кишечника. К ним относятся невсасывающиеся антибактериальные средства, специальные антисептики, иммуномодуляторы. Также для устранения дисбактериоза рекомендуется принимать пробиотики (препараты с живыми культурами полезных микроорганизмов), пребиотики (помогают флоре кишечника размножаться), синбиотики (вещества, объединяющие свойства двух предыдущих видов средств). Сегодня, помимо апробированного эффективного метода кишечный лаваж СПА-ЭФФЕРЕНС, врачи нашего центра применяют уникальную методику лечения запоров и восстановления микрофлоры кишечника — многокомпонентную пребиотическую смесь LIFEPRO.
Методы СПА-ЭФФЕРЕНС и LIFEPRO как вместе, так и по отдельности — мягко воздействуют на ЖКТ, избавляют от симптомов дисбактериоза и способствуют развитию полезных микроорганизмов. Чтобы заказать курс процедур, необходимо заполнить онлайн-анкету на сайте, указав свои физические параметры и симптомы. Специалисты свяжутся с Вами и проконсультируют по всем вопросам.
Cтоимость курса процедур
Для получения консультации и назначений по прохождению курса профилактики/лечения необходимо ЗАПОЛНИТЬ АНКЕТУ.
Поделиться
Как восстановить микрофлору кишечника у детей?
Микрофлора кишечника у детей
Когда говорят, что пищеварение и иммунитет у детей несовершенны, имеют в виду, что детская микрофлора формируется постепенно, год за годом увеличивая видовое разнообразие бактерий и их численность, а значит, и возможности усвоения различных веществ, и потенциал иммунной системы.
Формирование микрофлоры у детей проходит в несколько этапов:
- Первый год жизни
- Дошкольный период
- Школьный период
Микрофлора кишечника у детей в первый год жизни
Первыми бактериями, с которыми сталкивается ребенок после «стерильных условий» внутриутробного развития, являются микроорганизмы родовых путей матери. При естественном протекании родов происходит заселение пищеварительной системы, верхних дыхательных путей, кожных покровов, мочеполовой системы малыша. Таким образом микрофлора здоровой женщины поддерживает несовершенные защитные силы новорожденного и препятствует проникновению патогенной флоры в его организм. Дети, родившиеся при помощи кесарева сечения, больше подвержены инфекциям, поскольку колонизация кишечника и других систем полезными бактериями у них происходит позже, и они чаще страдают от аллергических реакций.
При естественном протекании родов происходит заселение пищеварительной системы, верхних дыхательных путей, кожных покровов, мочеполовой системы малыша. Таким образом микрофлора здоровой женщины поддерживает несовершенные защитные силы новорожденного и препятствует проникновению патогенной флоры в его организм. Дети, родившиеся при помощи кесарева сечения, больше подвержены инфекциям, поскольку колонизация кишечника и других систем полезными бактериями у них происходит позже, и они чаще страдают от аллергических реакций.
Не менее важным этапом формирования микрофлоры ребенка является период грудного вскармливания. В молоке матери содержатся лактоза, лизоцим, иммуноглобулины, а также бифидогенные компоненты, способствующие росту и развитию полезных бактерий кишечника. Ранний отказ от грудного вскармливания, введение прикорма, не соответствующего возрасту ребенка, может спровоцировать проблемы с пищеварением и дисбиоз. Дети на искусственном вскармливании чаще имеют проблемы со стулом, поскольку неразвитая микрофлора не справляется с искусственными смесями и другими продуктами питания.
Микрофлора кишечника у детей в дошкольный период
Начиная со второго года жизни состав микрофлоры кишечника ребенка по количественному и качественному составу постепенно расширяется: малыш уже ходит сам, и теперь ограничить его контакт с предметами, на которых живут разные микроорганизмы, довольно сложно. Домашние животные, вещи других детей и взрослых, оборудование детских площадок, почва и растения, – всё это источники микроорганизмов. Кроме того, существенно расширяется рацион ребенка. Что, с одной стороны, дает толчок для развития пищеварительной системы, а с другой – часто становится причиной возникновения проблем с животом.
После трех лет у детей значительно расширяется круг общения, ведь большинство из них посещает детский сад. Вместе с этим увеличивается нагрузка на иммунную систему. Прибавьте к этому стресс от изменения режима и образа жизни, смену рациона, отсутствие четких гигиенических навыков, – всё это серьезно испытывает кишечную микрофлору и иммунитет на прочность.
Микрофлора кишечника у детей в школьный период
Этот этап жизни ребенка характеризуется не меньшими рисками для состояния микрофлоры кишечника, чем дошкольный. Увеличивается количество ежедневных ситуаций, провоцирующих стрессы, нервная система пытается адаптироваться к многочисленным эмоциональным нагрузкам. Питание в столовых часто оставляет желать лучшего, да и отследить, чем в течение дня питается ребенок, предоставленный сам себе в течение дня, становится все сложнее.
Между тем, именно сбалансированное питание – залог нормального состояния микрофлоры, а значит здорового обмена веществ, роста и развития, состояния иммунитета.
Сладости и выпечка, столь любимые детьми, являются источником сахара и крахмалов, которые провоцируют рост патогенных микробов и грибков, затрудняют пищеварение, становятся причиной лишнего веса. Дефицит витаминов и периодических компонентов в рационе (овощей, фруктов, зелени, круп, ферментированных продуктов) сказывается на качестве жизнедеятельности кишечных бактерий, ведь именно клетчатка является для них питательной средой и фактором активного размножения. Кроме того, пребиотики контролируют липидный и углеводный обмен, а значит, вес ребенка, двигательная активность которого с началом школьного года значительно снижается.
Кроме того, пребиотики контролируют липидный и углеводный обмен, а значит, вес ребенка, двигательная активность которого с началом школьного года значительно снижается.
Как восстановить микрофлору кишечника у детей?
Помочь пищеварению и снизить восприимчивость организма к инфекциям при адаптации ребенка к детскому саду или школе помогут пробиотические комплексы, такие, как «Панбиолакт Кидс». Это безмолочные пребиотики, о преимуществе которых речь пойдёт дальше.
Сегодня тема непереносимости молочных продуктов (молочного сахара или белков) активно обсуждается потребителями и исследуется в научных кругах.
Аллергическая реакция на молочные продукты часто возникает после инфекционных заболеваний кишечника (ротавирусных инфекций, энтеритов) или воспалений его слизистой оболочки, которые влияют на выработку и активность лактазы – фермента, расщепляющего молочный сахар лактозу. Может быть спровоцирована присутствием в организме паразитов, нарушениями в работе желудка, печени и желчного пузыря, дисбиозом.
Может быть спровоцирована присутствием в организме паразитов, нарушениями в работе желудка, печени и желчного пузыря, дисбиозом.
Дети могут проявлять чувствительность к молочным белкам вследствие незрелости пищеварительной системы, не имеющей необходимого набора ферментов, повышенной реакции неокрепшего иммунитета. Иммунная система может ошибочно воспринимать белковые компоненты молока как вредоносные и начинает их атаку, провоцируя выработку гистамина (вещества, вызывающего симптомы аллергической реакции).
Изучением микробиоты человека занимается биотехнологическое направление Артлайф. Бактерии в составе продуктов Артлайф выращены на гипоаллергенных (безмолочных) средах. Это минимизирует проявления чувствительности со стороны ослабленной пищеварительной системы и иммунитета, ускоряет улучшение состояния кишечника и его микрофлоры. Пробиотики Артлайф безопасны для потребителей с непереносимостью лактозы и молочного белка.
Восстановим разнообразие микробиоты | Кровь
Пропустить пункт назначения
Трансплантация|
18 марта 2021 г.
Флоран Малар,
Мохамад Мохти
Кровь (2021) 137 (11): 1442–1444.
https://doi.org/10.1182/blood.2020009963
Подключенный контент
Соответствующая статья была опубликована: Нарушение разнообразия фекальной микробиоты и клинические исходы после ауто-ТГСК: многоцентровое обсервационное исследование
Цитата
Флоран Малар, Мохамад Мохти; Давайте восстановим разнообразие микробиоты. Кровь 2021; 137 (11): 1442–1444. doi: https://doi.org/10.1182/blood.2020009963
Скачать файл цитирования:
- Рис (Зотеро)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- КонецПримечание
- РефВоркс
- Бибтекс
Темы:
Бесплатные исследовательские статьи
Темы:
микробиом
снижение разнообразия фекальной микробиоты и то, что пациенты с большей степенью повреждения микробиома (ниже среднего фекального кишечного разнообразия) при приживлении нейтрофилов имели худшую выживаемость без прогрессирования, чем пациенты с меньшим повреждением микробиома.
Открыть большойСкачать PPT
Модуляция микробиоты: потенциальные механизмы и восстановление гомеостаза и кишечного барьера. Увеличение разнообразия микробиоты может способствовать восстановлению защитного эффекта кишечного барьера, а также сдерживанию воспаления. FMT, перенос фекальной микробиоты; MDRB, бактерии с множественной лекарственной устойчивостью. Профессиональная иллюстрация Патрика Лейна, ScEYEnce Studios.
Открыть большойСкачать PPT
Модуляция микробиоты: потенциальные механизмы и восстановление гомеостаза и кишечного барьера. Увеличение разнообразия микробиоты может способствовать восстановлению защитного эффекта кишечного барьера, а также сдерживанию воспаления. FMT, перенос фекальной микробиоты; MDRB, бактерии с множественной лекарственной устойчивостью. Профессиональная иллюстрация Патрика Лейна, ScEYEnce Studios.
Close modal
За последнее десятилетие с развитием метагеномного анализа стал возможным всесторонний анализ микробиома кишечника человека, который показал важную роль, которую микробиота играет в здоровье и заболевании. 2 Таким образом, нарушение микробиоты кишечника, именуемое в дальнейшем дисбиозом, связано с множеством различных заболеваний, включая инфекции, рак, воспалительные и метаболические заболевания, неврологические заболевания и психические заболевания. 2 В области гематологических злокачественных новообразований исследования микробиоты в основном были сосредоточены на аллогенной HCT, где дисбактериоз фекальной микробиоты был связан с инфекциями кровотока, реакцией «трансплантат против хозяина» и более короткой общей выживаемостью. 3 Кроме того, более высокая численность бактериальной группы, состоящей в основном из Eubacterium limosum , была связана со сниженным риском рецидива/прогрессирования гематологического злокачественного новообразования после алло-HCT. 4 Важно отметить, что использование антибиотиков широкого спектра действия во время алло-ТГСК является важным фактором дисбиоза кишечной микробиоты и отрицательно влияет на результаты лечения пациентов.
2 Таким образом, нарушение микробиоты кишечника, именуемое в дальнейшем дисбиозом, связано с множеством различных заболеваний, включая инфекции, рак, воспалительные и метаболические заболевания, неврологические заболевания и психические заболевания. 2 В области гематологических злокачественных новообразований исследования микробиоты в основном были сосредоточены на аллогенной HCT, где дисбактериоз фекальной микробиоты был связан с инфекциями кровотока, реакцией «трансплантат против хозяина» и более короткой общей выживаемостью. 3 Кроме того, более высокая численность бактериальной группы, состоящей в основном из Eubacterium limosum , была связана со сниженным риском рецидива/прогрессирования гематологического злокачественного новообразования после алло-HCT. 4 Важно отметить, что использование антибиотиков широкого спектра действия во время алло-ТГСК является важным фактором дисбиоза кишечной микробиоты и отрицательно влияет на результаты лечения пациентов. 5
5
Теперь возникает вопрос, существует ли подобная корреляция между повреждением кишечной микробиоты и исходом для пациента с другими терапевтическими стратегиями, используемыми у пациентов с гематологическими злокачественными новообразованиями. Этот вопрос особенно актуален для ауто-HCT, учитывая воздействие высоких доз химиотерапии, антибиотиков широкого спектра действия, мукозита и нарушения нутритивного статуса, которые могут вызвать дисбактериоз кишечной микробиоты. Khan и соавт. провели крупнейшее и первое многоцентровое исследование с участием 534 взрослых пациентов, перенесших ауто-ТГСК по поводу миеломы или лимфомы. Они обнаружили, что, как и при алло-HCT, разнообразие фекальной микробиоты на исходном уровне (т.е. до ауто-HCT) снижено по сравнению со здоровыми добровольцами. Кроме того, у пациентов наблюдалось дальнейшее снижение разнообразия микробиоты в период нейтропении с надиром вокруг приживления. Затем большее разнообразие фекальной микробиоты при приживлении было связано со сниженным риском прогрессирования или смерти даже после поправки на тип заболевания и статус заболевания (отношение рисков [HR] 0,6; 95% доверительный интервал [ДИ], от 0,42 до 0,83, P = 0,006). Однако, хотя большее разнообразие фекальной микробиоты при приживлении также было связано с улучшением общей выживаемости, эта ассоциация не была статистически значимой после поправки на тип заболевания и статус.
Однако, хотя большее разнообразие фекальной микробиоты при приживлении также было связано с улучшением общей выживаемости, эта ассоциация не была статистически значимой после поправки на тип заболевания и статус.
Это исследование включало миелому и различные подтипы лимфомы, и мы можем подвергнуть сомнению влияние этой важной неоднородности на результаты. В попытке преодолеть эту неоднородность авторы проанализировали более однородную группу из 9 человек.9 пациентов с миеломой, перенесших ауто-ТГСК в течение 12 месяцев после индукционной химиотерапии. Более высокое разнообразие фекальной микробиоты при приживлении снова было связано со сниженным риском прогрессирования или смерти даже после поправки на цитогенетический риск (HR, 0,53; 95% ДИ, 0,29–0,96; P = 0,037). Тем не менее, в этот ретроспективный анализ были включены только 99 пациентов, и для подтверждения их результатов необходимы дальнейшие исследования.
В целом, результаты Khan et al. подтвердили, что, как предполагалось, микробиота связана с исходом пациента после ауто-HCT, аналогично тому, что было сообщено после алло-HCT. Однако остается установить направленность этой взаимосвязи, например, является ли снижение разнообразия микробиоты кишечника ответственным за повышенный риск прогрессирования или смерти, или является ли снижение разнообразия микробиоты кишечника суррогатным маркером других параметров, влияющих на исход заболевания. Предыдущие исследования могут подсказать некоторые ответы. В мышиной модели миеломы манипуляции с кишечной микробиотой стимулируют клетки, продуцирующие интерлейкин-17, и эозинофилы, которые синергически ускоряют прогрессирование миеломы. 6 Кроме того, в группе из 34 пациентов с миеломой, получавших лечение первой линии, сообщалось о корреляции между составом микробиоты (более высокая относительная численность Eubacterium hallii ) и достижением минимального остаточного негативного заболевания, 7 , что еще раз подтверждает роль микробиоты при прогрессировании множественной миеломы. Тем не менее, не было обнаружено корреляции между бактериями, связанными с прогрессированием миеломы в этих исследованиях, и риском смерти или прогрессирования в текущем исследовании Khan et al.
Однако остается установить направленность этой взаимосвязи, например, является ли снижение разнообразия микробиоты кишечника ответственным за повышенный риск прогрессирования или смерти, или является ли снижение разнообразия микробиоты кишечника суррогатным маркером других параметров, влияющих на исход заболевания. Предыдущие исследования могут подсказать некоторые ответы. В мышиной модели миеломы манипуляции с кишечной микробиотой стимулируют клетки, продуцирующие интерлейкин-17, и эозинофилы, которые синергически ускоряют прогрессирование миеломы. 6 Кроме того, в группе из 34 пациентов с миеломой, получавших лечение первой линии, сообщалось о корреляции между составом микробиоты (более высокая относительная численность Eubacterium hallii ) и достижением минимального остаточного негативного заболевания, 7 , что еще раз подтверждает роль микробиоты при прогрессировании множественной миеломы. Тем не менее, не было обнаружено корреляции между бактериями, связанными с прогрессированием миеломы в этих исследованиях, и риском смерти или прогрессирования в текущем исследовании Khan et al.
Наконец, это исследование поднимает вопрос о роли терапевтических стратегий для предотвращения или восстановления кишечного дисбиоза у этих пациентов. Можно использовать и даже комбинировать несколько подходов, в том числе стратегии сбережения антибиотиков и введение пребиотиков (таких как неперевариваемые углеводы), постбиотиков (таких как короткоцепочечные жирные кислоты) или пробиотиков. Что касается пробиотиков, может быть сложно идентифицировать соответствующие штаммы для переноса, потому что, как показано здесь, бактерии, выявленные в одном исследовании, часто не подтверждаются в последующем исследовании. Напротив, уже было продемонстрировано, что перенос фекальной микробиоты в условиях алло-HCT 8 и терапии болезни «трансплантат против хозяина», 9 и после индукционной химиотерапии острого миелоидного лейкоза безопасны и эффективны для восстановления разнообразия микробиоты кишечника. 10 Увеличение разнообразия микробиоты может помочь восстановить защитный эффект кишечного барьера и сдержать воспаление (см. рисунок). Таким образом, перенос фекальной микробиоты можно рассматривать как адъювантную терапию во время ауто-ТГСК, направленную на восстановление разнообразия микробиоты кишечника от исходного уровня до полного выздоровления пациентов.
рисунок). Таким образом, перенос фекальной микробиоты можно рассматривать как адъювантную терапию во время ауто-ТГСК, направленную на восстановление разнообразия микробиоты кишечника от исходного уровня до полного выздоровления пациентов.
Таким образом, разнообразие микробиоты все чаще признается в качестве ключевого прогностического фактора стратификации при гематологических злокачественных новообразованиях. Измененное состояние перекрестных помех хозяин-микроб с аутоусугубляющими сигналами с обеих сторон может ухудшить исход для пациентов. Следовательно, модуляцию микробиоты следует рассматривать как цель персонализированного питания и терапии. Работа Хана и др. прокладывает путь для таких вмешательств.
Раскрытие информации о конфликте интересов: F.M. сообщает о гонорарах за лекции от Therakos/Mallinckrodt, Biocodex, Janssen, Keocyt, Sanofi, Jazz Pharmaceuticals и Astellas. М.М. сообщает о грантах и/или гонорарах за лекции от Janssen, Sanofi, MaaT Pharma, JAZZ Pharmaceuticals, Celgene, Amgen, BMS, Takeda, Pfizer и Roche.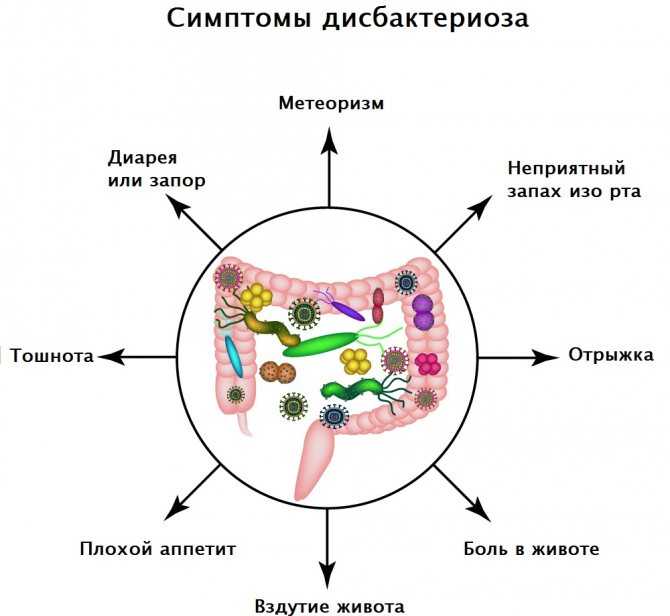
1.
Хан
N
,
Линднер
S
,
Гомес
АЛК
и др.
Нарушение разнообразия фекальной микробиоты и клинические исходы после ауто-ТГСК: многоцентровое обсервационное исследование
.
Кровь
.
2021
;
137
(
11
):
1527
—
1537
.
2.
Линч
СВ
,
Педерсен
О
.
Микробиом кишечника человека в норме и при болезни
.
N Engl J Med
.
2016
;
375
(
24
):
2369
—
2379
.
3.
Шоно
Y
,
ван ден Бринк
MRM
.
Повреждение микробиоты кишечника при аллогенной трансплантации гемопоэтических стволовых клеток
.
Nat Rev Рак
.
2018
;
18
(
5
):
283
—
295
.
4.
Пелед
Ю
,
Девлин
СМ
,
Стаффас
Аи др.
Кишечная микробиота и рецидив после трансплантации гемопоэтических клеток
.
Дж Клин Онкол
.
2017
;
35
(
15
):
1650
—
1659
.
5.
Weber
D
,
Jenq
RR
,
Пелядь
JU
Нарушение микробиоты, вызванное ранним применением антибиотиков широкого спектра действия, является независимым фактором риска исхода после аллогенной трансплантации стволовых клеток
.
Трансплантация костного мозга Биол
.
2017
;
23
:
845
—
852
.
6.
Calcinotto
A
,
Brevi
A
,
Chesi
М
и др.
Управляемые микробиотой клетки, продуцирующие интерлейкин-17, и эозинофилы совместно ускоряют прогрессирование множественной миеломы
.
Нац Коммуна
.
2018
;
9
(
1
):
4832
.
7.
Пьянко
MJ
,
Девлин
СМ
,
Литтманн
ER
и др.
Минимальный отрицательный результат остаточной болезни при множественной миеломе связан с составом микробиоты кишечника
.
Blood Adv
.
2019
;
3
(
13
):
2040
—
2044
.
8.
ДеФилипп
Z
,
Пелядь
Ю
,
Ли
S
и др.
Сторонняя трансплантация фекальной микробиоты после алло-HCT восстанавливает разнообразие микробиома
.
Blood Adv
.
2018
;
2
(
7
):
745
—
753
.
9.
Малар
Ф
,
Лощи
М
,
Легран
F
и др.
Успешное и безопасное лечение кишечной реакции «трансплантат против хозяина» (БТПХ) с помощью биотерапевтических биотерапевтических средств с полной экосистемой микробиоты пула доноров: результаты лечения группы из 29 пациентов из сострадательного использования/расширенного доступа [резюме]
.
Кровь
.
2020
;
136
(
доп 1
). Реферат 422.
10.
Мохты
М
,
Малард
F
,
Вехофф
А
, и др.
Исследование Odyssee: профилактика осложнений дисбиоза с помощью аутологичного переноса фекальной микробиоты (ТФМ) у пациентов с острым миелоидным лейкозом (ОМЛ), проходящих интенсивное лечение: результаты проспективного многоцентрового исследования [аннотация]
.
Кровь
.
2018
;
132
(
доп 1
). Резюме 1444.
Резюме 1444.
Войти через ваше учреждение
Раскрыт успешный механизм трансплантации фекальной микробиоты
22 февраля 2021 г.
Восстановление функций кишечной микрофлоры свидетельствует об успешности ТФМ. Предоставлено: Сатоши Уэмацу, Городской университет Осаки
Городской университет Осаки демонстрирует успех трансплантации фекальной микробиоты (ТФМ), раскрывая скоординированные усилия бактериофагов (фагов) и бактерий-хозяев по восстановлению кишечной флоры человека.
Инфекция Clostridioides difficile (rCDI) возникает в кишечнике и вызывается грамположительной спорообразующей анаэробной бактерией C. difficile , когда ее споры прикрепляются к фекалиям и передаются с рук в рот работники здравоохранения. Пациенты, проходящие лечение антибиотиками, особенно восприимчивы, поскольку антибиотики сильно повреждают микроорганизмы, поддерживающие здоровье кишечника.
Лечение rCDI включает отмену антибиотиков, вызывающих заболевание, и начало антибактериальной терапии, хотя это может быть очень сложным. Трансплантация фекальной микробиоты (ТФМ) считается эффективной альтернативной терапией, поскольку она решает проблему с нуля, заменяя поврежденную микрофлору здоровой посредством трансплантации кала.
Трансплантация фекальной микробиоты (ТФМ) считается эффективной альтернативной терапией, поскольку она решает проблему с нуля, заменяя поврежденную микрофлору здоровой посредством трансплантации кала.
Однако в 2019 году было зарегистрировано два случая смерти, вызванных устойчивыми к антибиотикам бактериальными инфекциями после ТФМ, что позволяет предположить, что для решения проблем безопасности, связанных с лечением, требуется модификация ТФМ или альтернативы.
Исследователи из Городского университета Осаки и Института медицинских наук Токийского университета взялись за решение этой проблемы в большом исследовании, опубликованном в журнале Gastroenterology .
Используя свой первоначальный анализ, о котором сообщалось в 2020 году, исследователи получили информацию о метагеноме кишечных бактерий и вирусов из образцов фекалий девяти пациентов с rCDI из Brigham and Women’s Hospital в Бостоне, которые успешно перенесли FMT. Они выявили бактерии и фаги, участвующие в патогенезе rCDI, и важные пути восстановления функции кишечной флоры.
Выявив, как бактериом и виром в кишечнике работают вместе как орган, исследовательская группа смогла показать, что ТФМ может быть столь же безопасным, как замена плохого органа на хороший.
«Кишечная микробиота обязательно должна рассматриваться как «орган»!» По словам главного исследователя профессора Сатоши Уэмацу, «ТФМ резко изменила кишечный бактериом и виром и, несомненно, восстановит кишечные бактериальные и вирусные функции».
В пост-COVID-19
Впервые выявленный в 2019 году в Ухане, Китай, COVID-19 или Коронавирусная болезнь 2019 года (которая первоначально называлась «новый коронавирус 2019 года» или 2019-nCoV) представляет собой инфекционное заболевание, вызываемое тяжелым острым респираторным синдромом коронавирус 2 (ТОРС). -КоВ-2). Он распространился по всему миру, что привело к пандемии коронавируса 2019–2022 годов.
» data-gt-translate-attributes='[{«attribute»:»data-cmtooltip», «format»:»html»}]’>COVID-19 world, rCDI станет одной из наиболее актуальных международных болезней.
