Какое влияние оказывает трехвалентное и двухвалентное железо в воде на здоровье человека. Каковы основные источники поступления железа в воду. Как определить повышенное содержание железа в воде. Какие существуют способы очистки воды от избытка железа.
Формы железа в воде
В природных водах железо может находиться в двух основных формах:
- Двухвалентное железо Fe2+ (закисное) — хорошо растворимо в воде, не имеет цвета и запаха
- Трехвалентное железо Fe3+ (окисное) — плохо растворимо, придает воде желто-бурую окраску
При контакте с кислородом воздуха растворенное двухвалентное железо окисляется до трехвалентного и выпадает в осадок в виде ржавчины. Этот процесс называется обезжелезиванием воды.
Источники поступления железа в воду
Основными источниками поступления железа в природные воды являются:
- Растворение железосодержащих горных пород и минералов
- Подземные воды, богатые растворенным железом
- Промышленные сточные воды
- Коррозия металлических труб водопроводов
В подземных водах из-за отсутствия кислорода преобладает растворенное двухвалентное железо. В поверхностных водах больше трехвалентного железа, связанного с органическими веществами.

Влияние железа на органолептические свойства воды
Повышенное содержание железа в воде оказывает негативное влияние на ее органолептические свойства:
- Вода приобретает желтовато-бурую окраску
- Появляется металлический привкус
- Образуются ржавые разводы на сантехнике
- Возникают пятна на белье при стирке
Уже при концентрации железа выше 0,3 мг/л вода может иметь неприятный вкус и цвет. При содержании более 1 мг/л вода становится мутной с выраженным металлическим привкусом.
Влияние избытка железа на здоровье человека
Избыток железа в питьевой воде может оказывать следующее негативное влияние на организм человека:
- Нарушение работы желудочно-кишечного тракта
- Повышенная нагрузка на печень и почки
- Аллергические реакции
- Изменение состава крови
- Нарушение обмена веществ
При длительном употреблении воды с повышенным содержанием железа возможно развитие заболеваний печени, почек, риск онкологических заболеваний.
Методы очистки воды от избытка железа
Для снижения концентрации железа в воде применяются следующие методы очистки:

- Аэрация — насыщение воды кислородом воздуха
- Фильтрация через каталитические загрузки
- Ионный обмен
- Обратный осмос
- Окисление химическими реагентами
Выбор оптимального метода зависит от концентрации и форм железа в воде, ее химического состава, требуемой производительности очистки.
Нормы содержания железа в питьевой воде
Согласно санитарным нормам, предельно допустимая концентрация (ПДК) общего железа в питьевой воде составляет:
- В России — 0,3 мг/л
- В странах ЕС — 0,2 мг/л
- По рекомендациям ВОЗ — 0,3 мг/л
При превышении этих значений необходимо применять методы очистки воды от избытка железа для обеспечения ее безопасности и приемлемых органолептических свойств.
Как определить повышенное содержание железа в воде?
Определить наличие избытка железа в воде можно по следующим признакам:
- Желтоватый или бурый цвет воды
- Металлический привкус
- Ржавые подтеки на сантехнике
- Желтые пятна на белье после стирки
Для точного определения концентрации железа необходимо провести лабораторный анализ воды. Это позволит выбрать оптимальный метод очистки при превышении допустимых значений.

Железо как необходимый элемент для организма
- Входит в состав гемоглобина крови
- Участвует в процессах кроветворения
- Обеспечивает транспорт кислорода в организме
- Необходим для нормального функционирования иммунной системы
Суточная потребность взрослого человека в железе составляет 10-18 мг. При этом из воды усваивается только около 10% поступающего с ней железа.
Заключение
Таким образом, присутствие железа в питьевой воде является нормальным явлением. Однако при превышении допустимых концентраций необходимо применять методы очистки для обеспечения безопасности и приемлемых органолептических свойств воды. Правильный подбор системы очистки позволит получить качественную питьевую воду без избытка железа.
Железодефицитные анемии | uzalo48.lipetsk
Железодефицитные анемии (ЖДА) — широко распространенные болезни, при которых снижается содержание железа в сыворотке крови, костном мозге и депо. В результате этого нарушается образование гемоглобина, возникает анемия (малокровие).
Наиболее частой причиной ЖДА являются кровопотери, особенно длительные, постоянные, часто незначительные. В этих случаях организм теряет железа больше, чем может получить из пищи. Организм теряет железо с мочой, калом, потом, слущивающимся эпителием кожи и кишечника. У женщин прибавляются потери железа с месячными, во время беременности, родов, кормлении грудью. В связи с этим у женщин очень часто потребности в железе превышают всасывание железа из пищи, что и становится наиболее частой причиной ЖДА.
Значительное место в развитии ЖДА занимают кровопотери из желудочно-кишечного тракта. Они являются самой частой причиной дефицита железа у мужчин и второй по частоте причиной у женщин. Такие кровопотери могут быть следствием язвенной болезни желудка и двенадцатиперстной кишки, опухолей желудка или кишечника, дивертикулов различной локализации, глистных инвазий, эрозий слизистой оболочки, кровоточащего геморроя. Реже причиной могут быть почечные кровопотери, кровопотери в замкнутые полости, при эндометриозе.
Реже причиной могут быть почечные кровопотери, кровопотери в замкнутые полости, при эндометриозе.
ЖДА часто встречается у детей. Она может развиться вследствие дефицита железа у матери, при многоплодной беременности.
Клинические проявления ЖДА разнообразны. Чаще всего это слабость, головокружения, сердцебиения, одышка, обмороки. Характерны изменения кожи, ногтей, волос, извращения вкуса. Часто наблюдается сухость и трещины кожи на руках, трещины в углах рта. Ногти становятся уплощенными и даже вогнутыми, истончаются, ломаются. Характерна выраженная мышечная слабость. При дефиците железа как у взрослых, так и у подростков, бывает извращение вкуса. Больные часто едят мел, уголь, глину, песок, сырые крупы. Бывает пристрастие к запаху бензина, ацетона, выхлопных газов. Наиболее важный лабораторный признак — гипохромная анемия, снижение гемоглобина. Все остальные лабораторные проявления уточняются врачом при необходимости.
Распространена ЖДА очень широко. В нашей полосе железодефицитны около 20% женщин.
В нашей полосе железодефицитны около 20% женщин.
Следует особенно отметить, что в состав гемоглобина входит трехвалентное железо, которое содержится в пище животного происхождения. Двухвалентное железо, которое входит в состав пищи растительного происхождения, существенного значения в обмене железа человеческом организме не играет. Анемия беременных в 99% случаев – это ЖДА.
Лечение ЖДА — обычно простая и благодарная задача. К сожалению, далеко не всегда ЖДА лечаттак, как положено.
Современные принципы лечения следующие:
1. Невозможно устранить ЖДА без препаратов железа, лишь диетой. Из препаратов железа его всасывается в 15-20 раз больше. Тем не менее пища должна быть полноценной, содержать достаточное количество белка и витаминов в виде овощей и фруктов. Рекомендуются мясные продукты, печень, только не сырая, рыба. Нельзя считать оправданным назначение большого количества пищи растительного происхождения, так как содержащееся в ней железо не дает должного эффекта.
2. При ЖДА нельзя прибегать к переливаниям крови без жизненных показаний, так как кроме осложнений это ничего не дает.
3. ЖДА надо лечить препаратами железа, а не витаминами, не глюкозой, не препаратами печени. Сочетать прием препаратов железа с другими препаратами не имеет смысла.
4. ЖДА следует лечить в основном препаратами для приема внутрь. Все другие пути введения должен определять гематолог. В настоящее время выбор препаратов широк: сорбифер, мальтофер, тотема — их десятки.
Необходимо следить, чтобы 1 таблетка или доза имели в своем составе не менее 100 мг железа и не забывать, что все эти препараты дают черный кал.
5. Обычно для нормализации анализа крови необходим месячный прием препаратов железа. Но будет ошибкой на этом остановиться. После нормализации гемоглобина, необходимо восполнить депо железа в организме, то есть при нормальном гемоглобине продолжить прием препаратов железа еще в течение 2 месяцев. Только после этого можно говорить о излечении от ЖДА.
Лечение ЖДА — задача терапевтов, а тяжелыми и сложными случаями занимаются врачи-гематологи.
Врач-гематолог
ГУЗ «ЛГБ №3 «Свободный Сокол»
Александр Соболев
Железистая вода Подмосковья | Филиал ФБУЗ «Центр гигиены и эпидемиологии в городе Москве» в ЗАО г. Москвы
Железистая вода Подмосковья
Присутствие железа в водах связано с широким распространением этого элемента в природе. Железо составляет 4,6 % массы земной коры, занимая четвертое место среди 107 элементов.
Железо попадает в воду при растворении горных пород, с которыми вода контактирует в процессе миграции. К их числу относятся песчано-гравийные и глинистые материалы, содержащие большое количество железистых соединений. Значительное количество железа попадает в воду со сточными водами промышленных предприятий. Кроме того, в природной воде содержится много минеральных и органических веществ, которые могут взаимодействовать с железом, и вследствие этих реакций образуются сложный комплекс соединений, находящихся в воде в растворенном, коллоидном и взвешенном состоянии.
В подземных водах из-за низкого содержания растворенного кислорода железо присутствует в основном в растворенном двухвалентном виде. При контакте с кислородом воздуха происходит процесс окисления железа (двухвалентное железо переходит в трехвалентное), которое, гидролизуясь, выпадает в осадок в виде гидроксида железа Fe(OH)3
В поверхностных водах железо в основном находится в виде трехвалентных комплексных соединений с растворенными неорганическими и органическими гумусовыми соединениями.
Повышенное содержание железа наблюдается в болотных водах, в которых оно находится в виде комплексов с солями гуминовых кислот, так называемое, органическое железо.
Питьевое водоснабжение Московской области на 90% обеспечивается подземными водами. В связи с этим одной из наиболее актуальных проблем является повышенная концентрация железа в источниках Подмосковья. Для РФ предельно допустимая концентрация железа в питьевой воде и воде источников хозяйственно-питьевого водоснабжения в соответствии с СанПиН 2. 1.4.1074-01 составляет 0,3 миллиграмма на литр. Нормой Евросоюза является 0.2 миллиграмма на литр.
1.4.1074-01 составляет 0,3 миллиграмма на литр. Нормой Евросоюза является 0.2 миллиграмма на литр.
По районам Подмосковья наблюдается различная степень загрязненности подземных вод железом, концентрация которого в некоторых источниках может достигать 10 мг/л. Особенно много железа в водоносных источниках Егорьевского, Клинского, Солнечногорского, Павлово-Посадского, Шатурского, Истринского и Волоколамского районов.
Влияние железа на качество водыПовышенная концентрация железа в питьевой воде влияет на органолептические показатели качества воды, такие как запах (особенно при нагревании воды), цветность и мутность.
Содержащая железо вода сначала прозрачна и чиста на вид. Однако даже при непродолжительном контакте с кислородом воздуха железо окисляется, придавая воде желтовато-бурую окраску. Уже при концентрациях железа выше 0.3 мг/л такая вода способна вызвать появление ржавых потеков на сантехнике и пятен на белье при стирке. При содержании железа выше 1 мг/л вода становится мутной, окрашивается в желто-бурый цвет, ощущается характерный металлический привкус.
При содержании железа выше 1 мг/л вода становится мутной, окрашивается в желто-бурый цвет, ощущается характерный металлический привкус.
Может изменяться вкус и внешний вид напитков и еды, приготовленных с использованием такой воды.
Повышенное содержание железа вызывает развитие железобактерий, отложение осадка в трубах и их засорение, в результате чего снижается срок службы сантехнического оборудования.
Влияние железа на организм человекаВсемирная Организация Здравоохранения не считает, что повышенного содержание железа в воде оказывает вредное влияние на здоровье человека.
Однако, наши врачи придерживаются другого мнения. Они считают, что длительное употребления воды с повышенным содержанием железа отрицательно сказывается на состоянии кожных покровов человека, почек, печени и пищеварительной системы и может приводить к серьёзным проблемам со здоровьем, например, способствовать развитию аллергических реакций, изменять морфологический состав крови.
Способов устранения железа много, каждый из них применим в определенных пределах, имеет свои преимущества и недостатки.
Аэрация представляет собой процесс насыщения воды атмосферным воздухом. Эффективность такого насыщения невысока, а потому аэрация может использоваться только в том случае, если концентрация железа в воде не превышает10 мг/л.
Применение окислителей. Хлорирование либо озонирование воды не только решает проблему двухвалентного железа, но и успешно борется с микроорганизмами. Что касается бытовых систем очистки воды, то в них чаще всего используется перманганат калия.
Каталитическое окисление – наиболее распространенный в быту способ удаления двухвалентного железа. В качестве окислителей в таких установках используется катализатор Birm, а также составы созданные на основе доломита, глауконита и цеолита. Выбор конкретного реактива определяется концентрацией железа в воде.
Ионный обмен. Методика ионного обмена стоит особняком от других способов обезжелезивания воды, поскольку реакция обмена ионами не является чистой окислительно-восстановительной реакцией. Впрочем, возможности катионитных материалов в качестве обезжелезивателя весьма ограничены, поскольку трехвалентное железо легко «забивает» смолу, снижая ее эффективность, а так называемое органическое железо образует на поверхности смолы пленку, представляющую собой отличную среду для развития бактерий.
Методика ионного обмена стоит особняком от других способов обезжелезивания воды, поскольку реакция обмена ионами не является чистой окислительно-восстановительной реакцией. Впрочем, возможности катионитных материалов в качестве обезжелезивателя весьма ограничены, поскольку трехвалентное железо легко «забивает» смолу, снижая ее эффективность, а так называемое органическое железо образует на поверхности смолы пленку, представляющую собой отличную среду для развития бактерий.
Мембранные фильтры способны удалить из воды практически все примеси, в том числе и железо. При этом, однако, следует принять во внимание, что эффективное удаление железа в любом виде возможно только при использовании фильтров обратного осмоса. Недостатком очистки воды методом обратного осмоса является получение практически дистиллированной воды, которую организм практически не способен использовать для процессов жизнедеятельности.
Выбор метода обезжелезивания зависит от множества различных факторов, таких, например как:
- требуемый объем чистой воды
- содержание железа, марганца, сероводорода в исходной воде
- pH (водородный показатель) воды
- перманганатная окисляемость
- другие загрязнения воды
Провести анализ воды на содержание железа и других показателей состава и свойств воды можно в Испытательном лабораторном центре ФФБУЗ «Центр гигиены и эпидемиологии в городе Москве» в ЗАО г. Москвы
Москвы
Контактный телефон: (495)-443-78-18
Электронная структура трехвалентного железа, октаэдрически координированная с кислородом
- Опубликовано:
- J. A. TOSSELL 1 ,
- D. J. VAUGHAN 1 и
- K. H. JOHNSON 2
253 доступа
23 Цитаты
Сведения о показателях
Abstract
Ион FERRIC, координированный с октаэдром оксидных ионов, может считаться основной полиэдрической единицей Fe 2 O 3 (гематит) и важной единицей Ca 3 Fe 2 Si 3 O 12 (андрадитовый гранат), Fe 3 O 4 (магнетит) и другие силикатные и оксидные минералы. Знание электронной структуры этого элемента представляет значительный интерес для минералогии и науки о твердом теле. В последние годы большой объем информации об электронном строении минералов получен при изучении их спектральных свойств. Мы сообщаем здесь результаты молекулярных квантово-механических расчетов на FeO 6 9- единиц и сравнить их с экспериментальными данными рентгеновской эмиссионной, рентгеновской фотоэлектронной и оптической спектроскопии. Обнаруженное совпадение экспериментальных и расчетных энергий спектральных переходов подтверждает правильность расчета и, кроме того, уточняет интерпретацию спектральных данных.
Знание электронной структуры этого элемента представляет значительный интерес для минералогии и науки о твердом теле. В последние годы большой объем информации об электронном строении минералов получен при изучении их спектральных свойств. Мы сообщаем здесь результаты молекулярных квантово-механических расчетов на FeO 6 9- единиц и сравнить их с экспериментальными данными рентгеновской эмиссионной, рентгеновской фотоэлектронной и оптической спектроскопии. Обнаруженное совпадение экспериментальных и расчетных энергий спектральных переходов подтверждает правильность расчета и, кроме того, уточняет интерпретацию спектральных данных.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Соответствующие статьи
Статьи открытого доступа со ссылками на эту статью.
Электронные структуры грейгита (Fe3S4): гибридное функциональное исследование и предсказание перехода Вервея
- Мин Ву
- , Джон С.
 Це
Це - и Юаньмин Пан
Научные отчеты Открытый доступ 12 февраля 2016 г.
Варианты доступа
Подписаться на этот журнал
К сожалению, для вашей страны недоступна возможность персональной подписки.
Дополнительная информация
Арендуйте или купите этот товар
Получите только этот товар столько, сколько вам нужно
$39,95
Узнать больше
Цены могут облагаться местными налогами, которые рассчитываются при оформлении заказа
Ссылки
901 10Джонсон, K.H., and Smith, jun., F.C., Phys. , В, 5 , 831 (1972).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Слейтер, Дж. К., и Джонсон, К. Х., Физ. , В, 5 , 844 (1972).
К., и Джонсон, К. Х., Физ. , В, 5 , 844 (1972).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Джонсон, К. Х., и Смит, Ф. К., Междунар. J. Квантовая хим. , 55 , 429 (1971).
Google Scholar
Джонсон, К. Х., Adv. Квант. хим. , 7 (в печати).
Костер А.С. и Мендель Х., J. Phys. хим. Твердые тела , 31 , 2511 (1970).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Bonnelle, C., Аннал. физ. , 14 , 1 (1966).
Google Scholar
Fischer, D.W., in Adv. Рентгенофазовый анализ , 13 (Пленум, 1970).
Google Scholar
O’Nions, R. K., and Smith, O.G., Amer. Минерал , 56 , 1452 (1971).
K., and Smith, O.G., Amer. Минерал , 56 , 1452 (1971).
Google Scholar
O’Nions, R.K., and Smith, D.G.W., Nature Physical Science , 231 , 130 (1971).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Koster, A.S., and Rieck, G.D., J. Phys. хим. Сол. , 31 , 2505 (1970).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Fischer, D.W., Phys. Rev. , B, 5 , 4219 (1972).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Tandon, S.P. и Gupta, J.P., Spectr. лат. , 3 , 297 (1970).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Мур Р. К. и Уайт В.Б., Канада. Минеральная. , 11 , 791 (1972).
К. и Уайт В.Б., Канада. Минеральная. , 11 , 791 (1972).
Google Scholar
Мессмер Р.П., Уолгрен У. и Джонсон К.Х., Chem. физ. лат. , 18 , 7 (1973).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Slichter, C.P., and Drickamer, H.G., J. Chem. физ. , 56 , 2142 (1972).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Ссылки для скачивания
Информация об авторе
Авторы и организации
Департамент наук о Земле и планетах, Массачусетский технологический институт, Кембридж, Массачусетс, 02139
J. A. TOSSELL & D. J. VAUGHAN
Департамент металлургии и материаловедение, Массачусетский технологический институт, Кембридж, Массачусетс, 02139
K. H. JOHNSON
- J.
 A. TOSSELL
A. TOSSELLПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- D. J. VAUGHAN
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- K. H. JOHNSON
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Электронные структуры грейгита (Fe3S4): гибридное функциональное исследование и предсказание перехода Вервея
- Мин Ву
- Джон С Цзе
- Юаньмин Пан
Научные отчеты (2016)
Электронные структуры координационных центров Fe3+ в оксидах железа: приложения к спектрам, связи и магнетизму
- Дэвид М.
 Шерман
Шерман
Физика и химия минералов (1985)
- Дэвид М.
Дефектная структура MgO, содержащих растворенные вещества трехвалентных катионов: окислительно-восстановительное поведение железа
- В. Х. Гурден
- В. Д. Кингери
- Дж. Дриер
Журнал материаловедения (1979)
Мягкая рентгеновская спектроскопия силикатов железа
- Чарльз Г.
 Додд
Додд - Пол Х. Риббе
Физика и химия минералов (1978)
- Чарльз Г.
Измерение поляризованных спектров поглощения синтетических силикатных микрокристаллов, содержащих переходные металлы, в спектральном диапазоне 44000-4000 см?1
- К. Лангер
- Р. М. Абу-Эйд
Физика и химия минералов (1977)
Трехвалентные ионы — катионы и анионы
Теории, предложенные до сих пор, объясняют физические и химические свойства различных найденных элементов. Исследования разных ученых способствовали расширению периодической таблицы и описали различных других участников атомной химии. Например, молекулы, изотопы, ионы, радикалы, соединения и т. д.
Исследования разных ученых способствовали расширению периодической таблицы и описали различных других участников атомной химии. Например, молекулы, изотопы, ионы, радикалы, соединения и т. д.
Атомы известны как крошечные частицы элементов, которые участвуют в химической реакции. Молекулы представляют собой группу из двух или более атомов, образующих наименьшую единицу.
Атомы различных элементов имеют свою собственную природу, некоторые из них стабильны, а некоторые достигают стабильности, делясь своим валентным электроном с другими атомами. В то время как молекулы связаны между собой химическими связями. Схема молекулы была опубликована Джоном Дальтоном. Некоторыми примерами молекул являются газообразный азот, вода, поваренная соль и т. д.
Что такое ионы?
Ионы представляют собой атомы или группы атомов, которые электрически заряжены и несут положительный или отрицательный заряд. Образование ионов происходит за счет потери или совместного использования электронов.
Анионы и катионы
Анион представляет собой ион, несущий отрицательный заряд. Анионы образуются путем получения электронов от других атомов, из-за чего они приобретают отрицательный заряд. Проще говоря, это означает, что в атоме больше электронов, чем протонов. Существует четыре типа анионов. Они перечислены ниже,
- Одновалентные анионы
- Двухвалентные анионы
- Трехвалентные анионы
- Четырехвалентные анионы
Катион представляет собой ион, несущий положительный заряд. Катионы образуются за счет потери электронов, из-за чего они приобретают положительный заряд. Это означает, что в атоме больше протонов, чем электронов. Существует четыре типа катионов. Они перечислены ниже:
- Одновалентные катионы
- Двухвалентные катионы
- Трехвалентные катионы
- Четырехвалентные катионы
Что такое трехвалентные катионы (+3)?
Трехвалентные катионы – это положительно заряженные ионы, имеющие валентность (3+).
Это означает, что двухвалентные ионы образуются, теряя три валентных электрона и приобретая положительный заряд.
Катион обозначается верхним индексом 3+ над символом атома или группы атомов. Некоторыми примерами трехвалентных катионов являются алюминий (Al 3+ ), хром (Cr 3+ ) и т. д.
Список тревалентных катионов
Название | Формула |
|---|---|
13037777777777777777777777777777777777777777777777777777777777777777777777NINIINIIN | |
Хром | CR 3+ |
Железо [III] | Fe 3+ |
| 90 030 Золото | Золото 3+ |
Некоторые металлы, такие как медь, ртуть и железо, образуют два вида ионов с разными зарядами или валентностями. Например:
Например:
- Металлическая медь (Cu) образует два иона Cu + и Cu 2+ : Ион Cu+ с единичным положительным зарядом называется ионом меди (I), где ( I) указывает на то, что ион имеет валентность 1+. Ион меди — это другое название иона меди (I) Cu + 9.0011 . Второй ион меди, Cu 2+ , содержит две единицы положительного заряда и называется ионом меди(II), где (II) означает, что ион имеет валентность 2+. Ион меди – другое название иона меди (II) Cu 2+ .
- Металлическая ртуть (Hg) также производит два иона, Hg + и Hg 2+ : Ртуть — это название, данное иону Hg + . Это ион ртути (I) или ион ртути с валентностью 1+. С другой стороны, ион Hg +2 также известен как ион ртути (II) или ион ртути и имеет валентность 2+.
- Металлическое железо (Fe) образует два иона, Fe 2+ и Fe 3+ : Ион Fe 2+ также известен как ион железа (II) или ион железа имеет 2+ валентность.
 Ион Fe 3+ также известен как ион железа (III) или ион трехвалентного железа и имеет валентность 3+.
Ион Fe 3+ также известен как ион железа (III) или ион трехвалентного железа и имеет валентность 3+.
Что такое трехвалентные анионы (3-)?
Трехвалентные анионы представляют собой отрицательно заряженные ионы, имеющие свою валентность (3-). Это означает, что трехвалентные анионы образуются путем приобретения трех валентных электронов и получения отрицательного заряда.
Анион обозначается верхним индексом 3- над символом атома или группы атомов. Некоторыми примерами трехвалентных анионов являются нитрид (N 3-), фосфат (PO 4 3-) и т. д.
Список трехвалентных анионов
Наименование | Формула |
|---|---|
Нитрид | N 3- |
Фосфат | PO 3- |
Феррицианид | Fe(CN) 900 45 6 3- |
Фосфид | P 3- |
Примеры вопросов
Вопрос 1: Какой заряд несет катион?
Ответ:
Анион является электроположительным и несет положительный заряд из-за потери электронов.

 Це
Це A. TOSSELL
A. TOSSELL Шерман
Шерман Додд
Додд
 Это означает, что двухвалентные ионы образуются, теряя три валентных электрона и приобретая положительный заряд.
Это означает, что двухвалентные ионы образуются, теряя три валентных электрона и приобретая положительный заряд.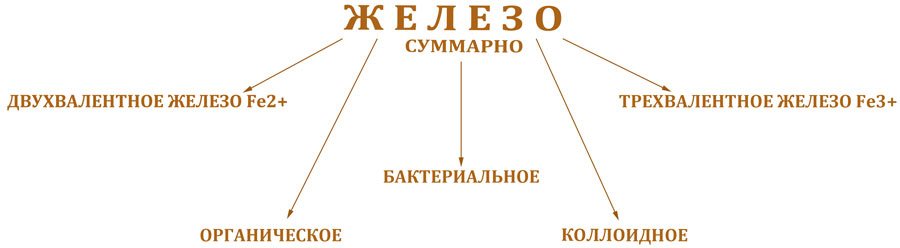 Ион Fe 3+ также известен как ион железа (III) или ион трехвалентного железа и имеет валентность 3+.
Ион Fe 3+ также известен как ион железа (III) или ион трехвалентного железа и имеет валентность 3+.