Каковы основные причины развития анемии при беременности. Какие препараты железа наиболее эффективны и безопасны для лечения железодефицитной анемии у беременных. Как правильно диагностировать и лечить анемию во время беременности. Какие осложнения могут возникнуть при нелеченой анемии у беременных.
Распространенность и причины анемии при беременности
Железодефицитная анемия (ЖДА) является одной из наиболее распространенных проблем во время беременности. По данным исследований, анемия наблюдается у 90-100% беременных женщин. Основные причины развития ЖДА при беременности:
- Повышенная потребность в железе для роста плода и плаценты (увеличивается почти в 9 раз к концу беременности)
- Физиологическая гемодилюция во время беременности
- Недостаточное поступление железа с пищей
- Нарушение всасывания железа в кишечнике при токсикозе беременных
- Наличие хронических воспалительных заболеваний
- Дефицит железа еще до наступления беременности
Диагностика анемии у беременных

- Снижение уровня гемоглобина ниже 110 г/л
- Снижение содержания сывороточного железа
- Снижение уровня ферритина
- Повышение общей железосвязывающей способности сыворотки
Важно проводить дифференциальную диагностику истинной ЖДА с анемией хронических заболеваний, для которой характерно повышение уровня ферритина.
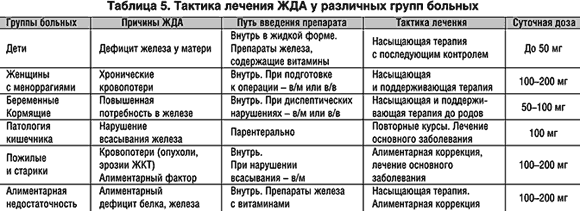
Современные препараты железа для лечения анемии у беременных
Основные требования к препаратам железа для применения во время беременности:
- Высокая биодоступность и эффективность
- Хорошая переносимость и безопасность
- Быстрая коррекция дефицита железа
- Продолжительный лечебный эффект
- Эффективность при нарушении всасывания железа
Наиболее часто применяются следующие препараты железа:
Пероральные препараты железа:
- Препараты двухвалентного железа (сульфат железа) — высокая биодоступность, быстрый эффект, но хуже переносятся
- Препараты трехвалентного железа — лучше переносятся, но действуют медленнее
Внутривенные препараты железа:
- Железа карбоксимальтозат (Феринжект) — позволяет быстро восполнить дефицит железа, хорошо переносится
- Железа сахарат (Венофер) — возможно применение во II и III триместрах беременности
Эффективность применения препаратов железа при беременности
Исследования показывают высокую эффективность современных препаратов железа при лечении ЖДА у беременных:
- Прирост уровня гемоглобина на 10-30 г/л за 1 месяц лечения
- Нормализация показателей обмена железа (ферритин, сывороточное железо)
- Уменьшение симптомов анемии (слабость, утомляемость)
- Снижение риска осложнений беременности, связанных с анемией
Безопасность применения препаратов железа при беременности
Современные препараты железа при правильном применении безопасны для беременных:
- Побочные эффекты при приеме пероральных препаратов в основном связаны с ЖКТ (тошнота, запоры) и редко требуют отмены лечения
- Внутривенные препараты железа имеют хороший профиль безопасности при применении во II-III триместрах
- Важно соблюдать дозировки и длительность курса лечения согласно рекомендациям
Осложнения нелеченой анемии при беременности
Анемия во время беременности может приводить к следующим осложнениям:
- Преэклампсия
- Преждевременные роды
- Задержка внутриутробного развития плода
- Гипоксия плода
- Слабость родовой деятельности
- Повышенный риск послеродовых кровотечений и инфекций
- Гипогалактия
Рекомендации по профилактике и лечению анемии у беременных
Основные рекомендации включают:
- Скрининг на анемию у всех беременных женщин
- Профилактический прием препаратов железа с ранних сроков беременности
- Своевременное выявление и лечение ЖДА
- Применение адекватных доз препаратов железа (100-200 мг элементарного железа в сутки)
- Длительность лечения не менее 3 месяцев
- Контроль эффективности терапии (уровень гемоглобина, ферритина)
- При неэффективности пероральных препаратов — переход на внутривенные формы
Таким образом, современные препараты железа позволяют эффективно и безопасно лечить анемию у беременных женщин, снижая риск осложнений для матери и плода. Важно своевременно выявлять и корректировать дефицит железа на протяжении всей беременности.
Современные подходы к лечению железодефицитной анемии » Акушерство и Гинекология
У подавляющего большинства женщин репродуктивного возраста сегодня наблюдается дефицит железа, нередко приводящий к развитию анемии. Должен ли гинеколог, к которому приходят на прием эти пациентки, знать основные принципы диагностики и лечения анемии – об этом размышляли специалисты на секционном заседании «Iros status в акушерстве и гинекологии. Патогенетические варианты железодефицитных анемий», состоявшемся в рамках Общероссийского семинара «Репродуктивный потенциал России: версии и контрверсии. Московские чтения».
Открывая заседание, профессор Виктор Евсеевич Радзинский, заведующий кафедрой акушерства и гинекологии с курсом перинатологии медицинского факультета РУДН, подчеркнул, что повышенный интерес к анемии связан в первую очередь с тем, что это заболевание негативно влияет не только на здоровье самой женщины и течение ее беременности, но и на здоровье будущего ребенка. Дети, которые родились у женщины с анемией, отстают в развитии от здоровых сверстников, чаще страдают различными хроническими и инфекционными заболеваниями. Именно поэтому, несмотря на то что лечением анемий должны заниматься гематологи, практическим врачам-гинекологам чрезвычайно важно ориентироваться в современных подходах к профилактике и лечению этого заболевания.
Дети, которые родились у женщины с анемией, отстают в развитии от здоровых сверстников, чаще страдают различными хроническими и инфекционными заболеваниями. Именно поэтому, несмотря на то что лечением анемий должны заниматься гематологи, практическим врачам-гинекологам чрезвычайно важно ориентироваться в современных подходах к профилактике и лечению этого заболевания.
Оптимальный выбор препаратов железа
Профессор Николай Игоревич Стуклов, руководитель курса гематологии кафедры госпитальной терапии РУДН, представил интересный доклад «Валентность препаратов железа. Есть ли оптимальное решение?». Он рассказал, что ему как гематологу постоянно приходится сталкиваться с пациентками, которые наряду с гинекологическими заболеваниями имеют железодефицитную анемию (ЖДА). Важнейшей причиной ее развития у женщин репродуктивного возраста является наличие регулярной менструальной кровопотери, которая при присоединении какого-либо патологического фактора (инфекции, заболевания женской репродуктивной системы, недостаток белковой пищи и т.
По мнению профессора Стуклова, врачам-гинекологам важно четко знать критерии диагноза ЖДА (снижение уровня гемоглобина у женщины ниже 120 г/л, а у беременной – ниже 110 г/л), при которых требуется назначение препаратов железа. Помимо этого чрезвычайно важно правильно установить причины анемии (нарушения поступления, всасывания, кровопотеря, повышенное потребление и т.д.) и по возможности устранить их. При успешности лечения наблюдается обязательный отклик на терапию препаратами железа – прирост гемоглобина на 10–20 г/л за месяц.
Большое внимание в докладе профессор Стуклов уделил наиболее подходящим по составу и методу введения препаратам железа, которые сегодня применяются для профилактики дефицита железа и лечения ЖДА. Он напомнил, что пероральные препараты железа разделяются на две группы: двухвалентного и трехвалентного железа. У каждой из этих групп есть свои преимущества и недостатки. Так, биодоступность солей двухвалентного железа выше (до 30–40%), поэтому они оказывают быстрый эффект и нормализуют уровень гемоглобина и ферритина (сроки лечения – 2–4 месяца, в зависимости от тяжести анемии). Препараты трехвалентного железа действуют медленнее (их биодоступность – до 10%) и требуют длительного применения: нормализация гемоглобина наступает только спустя 3–4 месяца, а нормализация показателей депо железа – ферритина – через 6–8 месяцев от начала терапии.
Профессор Стуклов рассказал об опыте применения препарата двухвалентного железа (Сорбифер Дурулес, 100 мг 2 раза в день) у пациенток с гинекологическими невоспалительными заболеваниями. Через месяц приема у всех пациенток медиана прироста гемоглобина составила 30 г/л/месяц. При этом были достоверно установлены различия эффективности препарата в зависимости от количества этиологических факторов развития анемии. В частности, сочетание заболеваний репродуктивной системы и ЖКТ снижало эффективность терапии, что требовало для данной категории больных более длительного курса лечения.
Также Николай Игоревич говорил о переносимости препаратов двухвалентного железа, подчеркнув, что при острых заболеваниях верхних отделов ЖКТ (особенно воспалительных) эти средства назначать не следует. В других случаях преимуществами обладают препараты пролонгированного действия, которые имеют меньшую частоту приема и лучше переносятся больными. Расчет суточной и курсовой дозы препарата производится индивидуально с учетом степени тяжести анемического синдрома и основного заболевания. В частности, у гинекологических больных он рекомендовал трапециевидную схему назначения препарата: 3–5 дней пациентка принимает профилактическую дозу (100 мг/сутки), затем при хорошей переносимости переходит на лечебную дозу (100 мг 2 раза в сутки) до нормализации гемоглобина, после этого опять на сниженную дозу (100 мг/сутки) до нормализации ферритина.
Расчет суточной и курсовой дозы препарата производится индивидуально с учетом степени тяжести анемического синдрома и основного заболевания. В частности, у гинекологических больных он рекомендовал трапециевидную схему назначения препарата: 3–5 дней пациентка принимает профилактическую дозу (100 мг/сутки), затем при хорошей переносимости переходит на лечебную дозу (100 мг 2 раза в сутки) до нормализации гемоглобина, после этого опять на сниженную дозу (100 мг/сутки) до нормализации ферритина.
В заключение Н.И. Стуклов представил конкурентный анализ препаратов железа, отметив высокую эффективность, хорошую переносимость и удачные фармакоэкономические характеристики препарата пролонгированного действия Сорбифер Дурулес, содержащего сульфат железа и аскорбиновую кислоту.
Анемия беременных и анемия у беременных
О лечении ЖДА у беременных рассказала в своем докладе профессор Лидия Сергеевна Логутова, заместитель директора по научной работе МОНИИАГ. Она отметила, что в период гестации самым распространенным гематологическим заболеванием является анемия – клинико-гематологический синдром, обусловленный снижением концентрации гемоглобина и эритроцитов, а также морфологическими изменениями эритроцитов. При этом важно отличать истинную анемию от гидремии (снижения показателей «красной крови» при отсутствии морфологических изменений эритроцитов), которая протекает бессимптомно и особого лечения не требует, поскольку с окончанием беременности показатели крови достаточно быстро нормализуются.
При этом важно отличать истинную анемию от гидремии (снижения показателей «красной крови» при отсутствии морфологических изменений эритроцитов), которая протекает бессимптомно и особого лечения не требует, поскольку с окончанием беременности показатели крови достаточно быстро нормализуются.
По мнению Лидии Сергеевны, анемии у беременных бывают догестационные и гестационные, диагностируемые соответственно в I или во II триместре беременности. В связи с этим некоторые клиницисты подразделяют их на «анемию у беременных» и «анемию беременных», подразумевая в первом случае заболевание, существовавшее еще до беременности, а во втором – развившееся в гестационный период.
В подавляющем числе случаев во время беременности развивается ЖДА, характеризующаяся снижением содержания железа в сыворотке крови, костном мозге и депо; нарушением синтеза гема и белков, содержащих железо (миоглобин), железосодержащих тканевых ферментов. Развитие ЖДА связано с гормональными изменениями, происходящими в организме беременной женщины, а также с развитием ранних токсикозов, препятствующих всасыванию в ЖКТ железа, магния, фосфора, которые необходимы для кроветворения.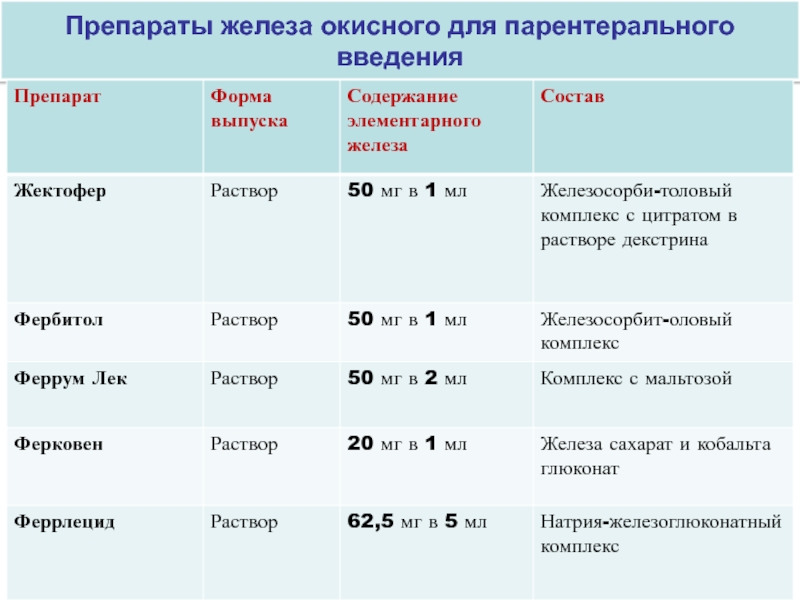 Причиной анемии также может стать дефицит железа, связанный с его повышенной утилизацией для функционирования фетоплацентарного комплекса, или нарушение перекисного окисления липидов. При этом суточная потребность в железе во время беременности возрастает прямо пропорционально срокам: в I триместре она не превышает 0,6–0,8 мг/сутки, во II триместре увеличивается до 2–4 мг/сутки, а в III триместре – до 10–12 мг/сутки. Таким образом, к концу беременности неизбежно возникает обеднение железом организма женщины.
Причиной анемии также может стать дефицит железа, связанный с его повышенной утилизацией для функционирования фетоплацентарного комплекса, или нарушение перекисного окисления липидов. При этом суточная потребность в железе во время беременности возрастает прямо пропорционально срокам: в I триместре она не превышает 0,6–0,8 мг/сутки, во II триместре увеличивается до 2–4 мг/сутки, а в III триместре – до 10–12 мг/сутки. Таким образом, к концу беременности неизбежно возникает обеднение железом организма женщины.
Профессор Логутова призвала врачей-гинекологов с большим вниманием относиться к женщинам с ЖДА во время беременности, поскольку это заболевание сказывается на здоровье не только матери, но и ребенка, провоцируя преэкслампсию, гипоксию или гипотрофию плода, гипогалактию, невынашивание беременности, снижение моторной функции матки (слабость родовой деятельности), гнойно-септические инфекции в послеродовом периоде. Также она подчеркнула, что недостаточное депонирование железа в антенатальном периоде является одной из причин дефицита железа и анемии у грудных детей. Особенную настороженность надо проявлять к женщинам из группы риска по развитию ЖДА.
Особенную настороженность надо проявлять к женщинам из группы риска по развитию ЖДА.
«Каково же должно быть лечение анемии? – задалась вопросом Л.С. Логутова. – Беременные женщины с ЖДА нуждаются в медикаментозном лечении и диетическом питании. Однако восполнить дефицит железа только продуктами питания невозможно, обязательно нужно принимать лекарственные препараты железа, из которых организмом усваивается в 15–20 раз больше этого элемента, чем из пищи». По мнению Лидии Сергеевны, идеальный железосодержащий препарат должен обладать минимальным количеством побочных эффектов, иметь простую схему применения и наилучшее соотношение эффективности и цены, содержать достаточное количество железа, а также компоненты, усиливающие его всасывание и стимулирующие гемопоэз. И такие препараты сегодня, к счастью, имеются в арсенале врачей.
Профессор Логутова представила анализ результатов применения у женщин во время беременности препарата Сорбифер Дурулес, который назначался с лечебной и профилактической целью после постановки терапевтом диагноза ЖДА. Этот препарат содержит оптимальную дозировку железа в доступной форме (в 1 таблетке – 320 мг сульфата железа, что соответствует 100 мг двухвалентного железа) и аскорбиновую кислоту, которая способствует улучшению всасывания и усвоению железа, а также оказывает антиоксидантное действие. По словам Л.С. Логутовой, прием Сорбифер Дурулес в течение 2 месяцев показал хорошую клиническую эффективность этого препарата. У женщин на фоне проводимой терапии наблюдалось достоверное повышение уровня гемоглобина в сравнении с исходными значениями, причем этот показатель оставался в пределах нормативных значений и до родов, и в послеродовой период. Такая же тенденция наблюдалась и в динамике показателей количества эритроцитов и цветного показателя. Каких-либо побочных отрицательных эффектов, требующих отмены препарата, отмечено не было. Все это позволяет рекомендовать Сорбифер Дурулес для лечения ЖДА, а также для профилактики ее развития. «Сорбифер Дурулес при достаточно высокой эффективности является одним из самых доступных препаратов на нашем рынке, что имеет огромное значение для многих наших пациенток», – добавила Лидия Сергеевна.
Этот препарат содержит оптимальную дозировку железа в доступной форме (в 1 таблетке – 320 мг сульфата железа, что соответствует 100 мг двухвалентного железа) и аскорбиновую кислоту, которая способствует улучшению всасывания и усвоению железа, а также оказывает антиоксидантное действие. По словам Л.С. Логутовой, прием Сорбифер Дурулес в течение 2 месяцев показал хорошую клиническую эффективность этого препарата. У женщин на фоне проводимой терапии наблюдалось достоверное повышение уровня гемоглобина в сравнении с исходными значениями, причем этот показатель оставался в пределах нормативных значений и до родов, и в послеродовой период. Такая же тенденция наблюдалась и в динамике показателей количества эритроцитов и цветного показателя. Каких-либо побочных отрицательных эффектов, требующих отмены препарата, отмечено не было. Все это позволяет рекомендовать Сорбифер Дурулес для лечения ЖДА, а также для профилактики ее развития. «Сорбифер Дурулес при достаточно высокой эффективности является одним из самых доступных препаратов на нашем рынке, что имеет огромное значение для многих наших пациенток», – добавила Лидия Сергеевна.
Лечебная тактика зависит от причины заболевания
Важную тему подняла в своем докладе «Анемия воспаления. Мнимый дефицит железного фонда» профессор Елизавета Юрьевна Лебеденко, д.м.н., доцент кафедры акушерства и гинекологии Ростовского государственного медицинского университета. Она напомнила, что врач для назначения адекватной терапии должен хорошо понимать, с какими именно причинами связана анемия у конкретной пациентки. «Лечим ли мы истинный дефицит железа, восполняем ли мы запасы железа или мы должны направить свои действия на купирование тех процессов, которые способствовали снижению запасов железа, ухудшению его транспорта и циркуляции в организме? Это крайне важные моменты, которые лежат в основе выбора лечебной тактики», – подчеркнула Елизавета Юрьевна. По ее словам, существенное влияние на различные звенья метаболизма железа оказывает наличие хронического воспаления (так называемая анемия хронического заболевания). При использовании стандартного подхода к лечению анемии у больных с хроническими воспалительными заболеваниями можно столкнуться с существенными трудностями.
Серьезнейшей проблемой назвала профессор Лебеденко анемию у беременных женщин, распространенность которой составляет 90–100%. «Железодефицит в конце беременности – естественный процесс расхода запасенного железа на построение большого объема новых тканей, – заметила она. – При этом потребности в железе увеличиваются почти в 9 раз (с 2 мг Fe до 18 мг Fe). Безусловно, тот фон, та «железная» база, которую женщина имеет во время беременности, крайне важна».
По мнению Е.Ю. Лебеденко, анемию беременных следует рассматривать не как простой железодефицит, а как комбинированное нарушение эритропоэза и гомеостаза железа, имеющее признаки анемии хронических болезней. Это связано с тем, что плацента в условиях гипоксии способна в больших количествах продуцировать провоспалительные цитокины, а латентно текущие урогенитальные инфекции у беременных способны угнетать продукцию эндогенного ЭПО избыточной продукцией провоспалительных цитокинов. В связи с этим необходимо проводить дифференциальную диагностику истинной ЖДА с анемией хронических воспалительных заболеваний.
В качестве примера, который демонстрирует необходимость направленного подхода к лечению анемий, Елизавета Юрьевна привела конкретный клинический случай, который, к сожалению, закончился трагически. Погибшая пациентка с анемией получала препараты железа практически в течение всего срока беременности, но эффекта от лечения не было. В данном случае имела место функциональная анемия воспаления, поэтому лечение должно было быть другим. И если бы провели дальнейшие исследования этой пациентки и выявили бы то патологическое состояние, которое определяло развитие у нее дефицита железа, исход был бы иным.
В качестве дискуссионных вопросов профессор Лебеденко предложила обсудить возможность использования таких дифференцированных маркеров генеза анемии, как гепсидин, сывороточный ферритин и растворимый трансферриновый рецептор. Для разных форм анемии характерны определенные сдвиги этих показателей: например, при функциональной анемии уровень ферритина повышен, а при истинном дефиците железа понижен и уровень ферритина, и растворимый трансферриновый рецептор. По мнению Елизаветы Юрьевны, анализ этих показателей помогает установить происхождение анемии.
По мнению Елизаветы Юрьевны, анализ этих показателей помогает установить происхождение анемии.
Говоря о лечении истинной – железодефицитной – анемии у беременных, Е.Ю. Лебеденко отметила, что наиболее широко используются препараты железа. Для достижения необходимого результата лечения они должны соответствовать определенным требованиям: обладать высокой биодоступностью и эффективностью, хорошей переносимостью и безопасностью; оказывать продолжительный лечебный эффект и быстро корректировать железодефицитное состояние. Также эти препараты должны обладать эффективностью при нарушении всасывания железа из ЖКТ. Как правило, в стандартных схемах терапии используются препараты, содержащие 100 мг «чистого», т.е. двухвалентного железа, назначаемые 2 раза в сутки. Следует также иметь в виду, что биодоступность железа повышается при наличии в препарате акселераторов всасывания (например, аскорбиновой кислоты), а также матрицы, замедляющей всасывание активной субстанции (соли железа). Немаловажным критерием при выборе препарата железа наряду с основными требованиями является финансовый аспект.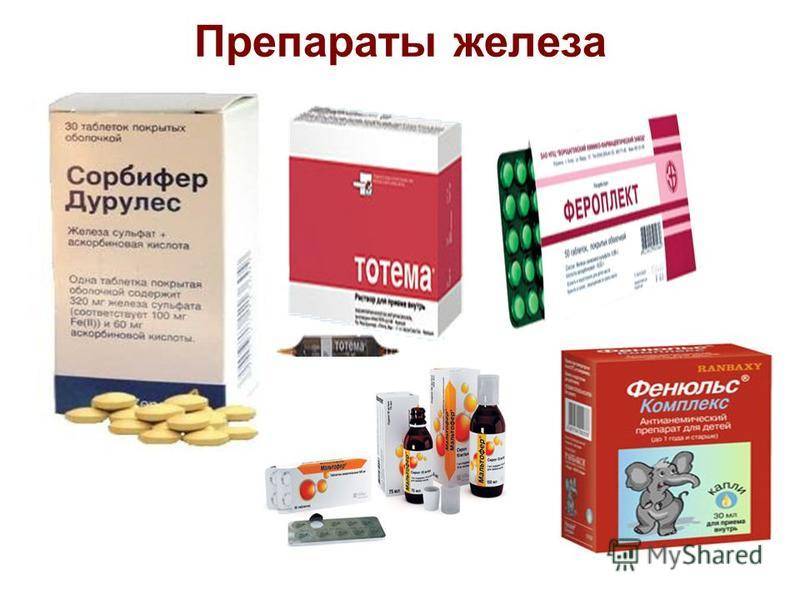 Учитывая все эти факторы, оптимальным представляется препарат Сорбифер Дурулес (№ 30 и № 50), который, обладая высокой эффективностью и хорошей переносимостью, выгодно отличается по стоимости от аналогичных средств.
Учитывая все эти факторы, оптимальным представляется препарат Сорбифер Дурулес (№ 30 и № 50), который, обладая высокой эффективностью и хорошей переносимостью, выгодно отличается по стоимости от аналогичных средств.
В качестве заключения
Секционное заседание завершилось активной дискуссией, в ходе которой эксперты отвечали на вопросы слушателей, связанные с диагностикой и лечением анемии и железодефицитных состояний. По мнению большинства собравшихся врачей, состоявшееся мероприятие имело огромное практическое значение. Своевременное выявление пациентов из группы риска ЖДА, адекватная врачебная тактика, в том числе в рамках предгравидарной подготовки, применение современных железосодержащих препаратов с учетом их особенностей и преимуществ помогает скорректировать гематологические показатели прежде, чем возникнут неминуемые осложнения. Это чрезвычайно важно для сохранения здоровья наших пациенток.
СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ ЛЕЧЕНИЯ АНЕМИИ У БЕРЕМЕННЫХ ЖЕНЩИН (ЛЕКЦИЯ) | Чернов
1. Хух Р., Брейман К. Анемия во время беременности и в послеродовом периоде. Пер. с англ. М.: Триада; 2007. 73 с.
Хух Р., Брейман К. Анемия во время беременности и в послеродовом периоде. Пер. с англ. М.: Триада; 2007. 73 с.
2. World Health Organization. The prevalence of anemia in women: a tabulation of available information. Geneva: WHO; 1992 (WHO/MCH/MSM/92.2). Available at: http://apps.who.int/iris/bitstream/10665/58994/1/WHO_MCH_MSM_92.2.pdf.
3. Воронцов И.М. Железо и смежные проблемы микронутриентного обеспечения в предконцепционной, антенатальной и постнатальной педиатрии. В кн.: Дефицит железа и железодефицитная анемия у детей. М.: Славянский диалог, 2001: 36-58.
4. Recommendations to prevent and control iron deficiency in the United States. Centers for Disease Control and Prevention. MMW Recomm Rep, 1998, 47(RR-3): 1-29.
5. Венофер. Монография по препарату. 2-е изд. М.: МегаПро, 2001. 115 с.
6. Крайтон Р., Даниельсон Б.Д., Гайссер П. Лечение препаратами железа: особый акцент на внутривенной терапии. Пер. с англ. Тверь: Триада, 2007. 87 с.
7. Burns DL, Mascioli EA, Bistrian BR. Parenteral iron dextran therapy: a review. Nutrition, 1995, 11(2): 163-8.
Parenteral iron dextran therapy: a review. Nutrition, 1995, 11(2): 163-8.
8. Vaage-Nilsen O. Acute, severe and anaphylactoid reactions are very rare with low-molecular-weight iron dextran, CosmoFer. Nephrol Dial Transplant, 2008, 23(10): 3372. author reply 3372.
9. Феринжект. Монография по препарату. Издание компании Такеда, 2009. 88 с.
10. Friedrisch JR, Cançado RD. Intravenous ferric carbo xymaltose for the treatment of iron deficiency anemia. Rev Bras Hematol Hemoter, 2015, 37(6): 400-5.
11. Sobrado CW, Cançado RD, Sobrado LF, Frugis MO, Sobrado MF. Treatment of anemia and improvement of quality of life among patients with Crohn’s disease: experience using ferric carboxymaltose. Arq Gastroenterol, 2015, 52(4): 255-9.
12. Koduru P, Abraham BP. The role of ferric carboxymaltose in the treatment of iron deficiency anemia in patients with gastrointestinal disease. Therap Adv Gastroenterol, 2016, 9(1): 76-85.
13. Vikrant S, Parashar A. The safety and efficacy of high dose ferric carboxymaltose in patients with chronic kidney disease: a single center study. Indian J Nephrol, 2015, 25(4): 213-21.
Indian J Nephrol, 2015, 25(4): 213-21.
14. Hedenus M, Karlsson T, Ludwig H, Rzychon B, Felder M, Roubert B, et al. Intravenous iron alone resolves anemia in patients with functional iron deficiency and lymphoid malignancies undergoing chemotherapy. Med Oncol, 2014, 31(12): 302.
15. Pels A, Ganzevoort W. Safety and efficacy of ferric carboxymaltose in anemic pregnant women: a retrospective case control study. Obstet Gynecol Int, 2015, 2015: 728952.
16. Rathod S, Samal SK, Mahapatra PC, Samal S. Ferric carboxymaltose: a revolution in the treatment of postpartum anemia in Indian women. Int J Appl Basic Med Res, 2015, 5(1): 25-30.
17. Mahey R, Kriplani A, Mogili KD, Bhatla N, Kachhawa G, Saxena R. Randomized controlled trial comparing ferric carboxymaltose and iron sucrose for treatment of iron deficiency anemia due to abnormal uterine bleeding. Int J Gynaecol Obstet, 2015. pii: S0020-7292(15)00723-7.
18. Comín-Colet J, Rubio-Rodríguez D, RubioTerrés C, Enjuanes-Grau C, Gutzwiller FS, Anker SD, et al.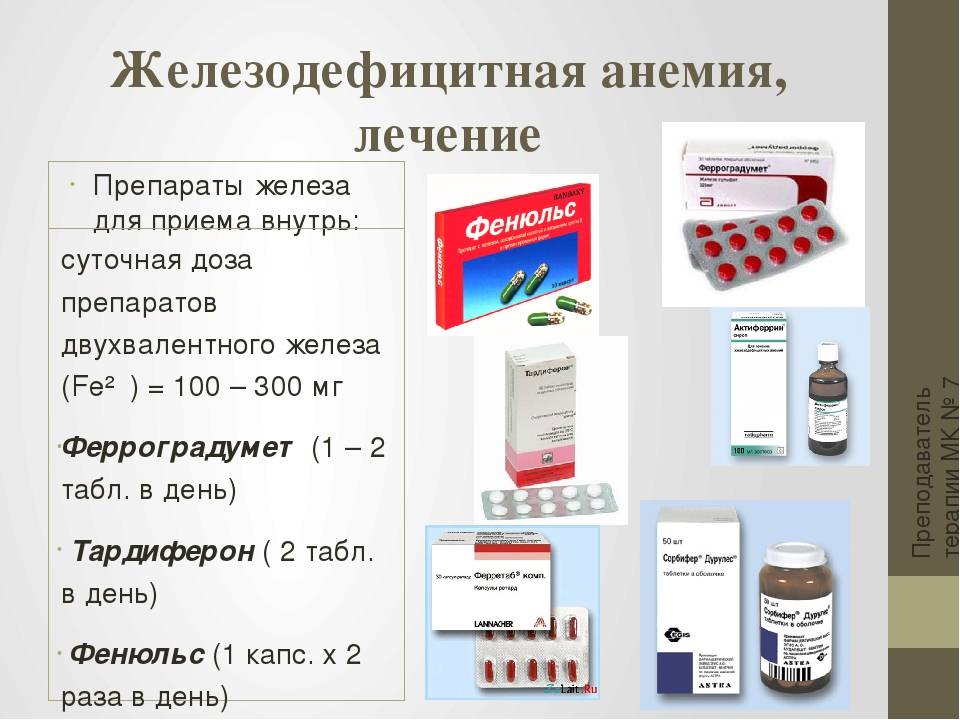 A cost-effectiveness analysis of ferric carboxymaltose in patients with iron deficiency and chronic heart failure in Spain. Rev Esp Cardiol (Engl Ed), 2015, 68(10): 846-51.
A cost-effectiveness analysis of ferric carboxymaltose in patients with iron deficiency and chronic heart failure in Spain. Rev Esp Cardiol (Engl Ed), 2015, 68(10): 846-51.
19. Moore RA, Gaskell H, Rose P, Allan J. Metaanalysis of efficacy and safety of intravenous ferric carboxymaltose (Ferinject) from clinical trial reports and published trial data. BMC Blood Disord, 2011, 11: 4.
20. Evstatiev R, Marteau P, Iqbal T, Khalif IL, Stein J, Bokemeyer B, et al. FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease. Gastroenterology, 2011, 141(3): 846-53.
Современная заместительная терапия железом: клинические и патофизиологические данные
Обзор
. 2018 Январь; 107(1):16-30.
doi: 10.1007/s12185-017-2373-3. Epub 2017 1 декабря.
Доменико Джирелли 1 , Сара Уголини 2 , Фабиана Бусти 2 , Джакомо Марчи 2 , Аннализа Кастанья 2
Принадлежности
- 1 Медицинский факультет, Отделение внутренних болезней, Регион Венето Справочный центр нарушений метаболизма железа, Передовой центр редких гематологических заболеваний «EuroBloodNet», Университет Вероны, Поликлиника Г.
 Б. Росси, 37134, Верона, Италия. [email protected].
Б. Росси, 37134, Верона, Италия. [email protected]. - 2 Медицинский факультет, Отделение внутренних болезней, Регион Венето Справочный центр нарушений метаболизма железа, Передовой центр редких гематологических заболеваний «EuroBloodNet», Веронский университет, поликлиника G.B. Росси, 37134, Верона, Италия.
- PMID: 29196967
- DOI: 10.1007/с12185-017-2373-3
Обзор
Domenico Girelli et al. Int J Гематол. 2018 Январь
. 2018 Январь; 107(1):16-30.
doi: 10. 1007/s12185-017-2373-3.
Epub 2017 1 декабря.
1007/s12185-017-2373-3.
Epub 2017 1 декабря.
Авторы
Доменико Джирелли 1 , Сара Уголини 2 , Фабиана Бусти 2 , Джакомо Марчи 2 , Аннализа Кастанья 2
Принадлежности
- 1 Медицинский факультет, Отделение внутренних болезней, Регион Венето Справочный центр нарушений метаболизма железа, Центр передового опыта в области редких гематологических заболеваний «EuroBloodNet», Университет Вероны, Поликлиника G.B. Росси, 37134, Верона, Италия. [email protected].
- 2 Медицинский факультет, Отделение внутренних болезней, Регион Венето Реферальный центр нарушений метаболизма железа, Передовой центр редких гематологических заболеваний «EuroBloodNet», Университет Вероны, поликлиника G.
 B. Росси, 37134, Верона, Италия.
B. Росси, 37134, Верона, Италия.
- PMID: 29196967
- DOI: 10.1007/с12185-017-2373-3
Абстрактный
Дефицит железа с анемией или без нее чрезвычайно распространен во всем мире и представляет собой серьезную проблему для общественного здравоохранения. Заместительная терапия железом восходит к семнадцатому веку и до недавнего времени развивалась относительно медленно. Как пероральные, так и внутривенные традиционные препараты железа, как известно, далеки от идеальных, в основном из-за проблем с переносимостью и безопасностью соответственно. В начале этого века открытие оси гепсидин/ферропортин стало поворотным моментом в знании патофизиологии нарушений метаболизма железа, открыв новую эру. Тем временем достижения в области фармацевтических технологий позволяют производить новые препараты железа, направленные на минимизацию проблем, присущих традиционным подходам. Фармакокинетика железа для перорального и парентерального введения существенно различается, и различия становятся еще более очевидными в свете основной роли гепсидина в регуляции системного гомеостаза железа. Здесь мы рассмотрим, как меняется терапия препаратами железа благодаря таким важным достижениям как в патофизиологии, так и в фармакологии.
Тем временем достижения в области фармацевтических технологий позволяют производить новые препараты железа, направленные на минимизацию проблем, присущих традиционным подходам. Фармакокинетика железа для перорального и парентерального введения существенно различается, и различия становятся еще более очевидными в свете основной роли гепсидина в регуляции системного гомеостаза железа. Здесь мы рассмотрим, как меняется терапия препаратами железа благодаря таким важным достижениям как в патофизиологии, так и в фармакологии.
Ключевые слова: анемия; Сердечная недостаточность; гепсидин; Дефицит железа; Железотерапия.
Похожие статьи
[Терапия железом: показания, ограничения и модальность].
Арлет Дж. Б., Пушо Дж., Ласоцкий С., Бомонт С., Эрмин О. Арлет Дж.
 Б. и соавт.
Преподобный Мед Интерне. 2013 Январь; 34 (1): 26-31. doi: 10.1016/j.revmed.2012.04.007. Epub 2012 21 мая.
Преподобный Мед Интерне. 2013.
PMID: 22621856
Обзор.
Французский.
Б. и соавт.
Преподобный Мед Интерне. 2013 Январь; 34 (1): 26-31. doi: 10.1016/j.revmed.2012.04.007. Epub 2012 21 мая.
Преподобный Мед Интерне. 2013.
PMID: 22621856
Обзор.
Французский.Молекулярные аспекты и лечение дефицита железа у пожилых людей.
Романо А.Д., Палья А., Белланти Ф., Виллани Р., Санджинето М., Вендемиале Г., Сервиддио Г. Романо А.Д. и др. Int J Mol Sci. 2020 28 мая; 21 (11): 3821. дои: 10.3390/ijms21113821. Int J Mol Sci. 2020. PMID: 32481481 Бесплатная статья ЧВК. Обзор.
Уровни гепсидина в сыворотке у детей, инфицированных Helicobacter pylori, с железодефицитной анемией: исследование случай-контроль.
Азаб С.Ф., Эш А.М. Азаб С.
 Ф. и др.
Энн Хематол. 2013 ноябрь;92(11):1477-83. doi: 10.1007/s00277-013-1813-2. Epub 2013 13 июня.
Энн Хематол. 2013.
PMID: 23760782
Ф. и др.
Энн Хематол. 2013 ноябрь;92(11):1477-83. doi: 10.1007/s00277-013-1813-2. Epub 2013 13 июня.
Энн Хематол. 2013.
PMID: 23760782Роли оси гепсидин-ферропортин и железа при раке.
Wu XN, Su D, Wang L, Yu FL. Wu XN и соавт. Eur J Рак Prev. 2014 март; 23(2):122-33. doi: 10.1097/CEJ.0b013e3283627f14. Eur J Рак Prev. 2014. PMID: 23676854 Обзор.
Лечение препаратами железа больных сердечной недостаточностью с анемией и без нее.
Джелани К.У., Аттанасио П., Кац С.Д., Анкер С.Д. Джелани Ку и др. Клиника сердечной недостаточности. 2010 июль; 6 (3): 305-12. doi: 10.1016/j.hfc.2010.02.002. Клиника сердечной недостаточности. 2010. PMID: 20630405 Обзор.

Посмотреть все похожие статьи
Цитируется
Эпигаллокатехин-3-галлат облегчает окислительное повреждение печени, вызванное перегрузкой железом у мышей, путем ингибирования ферроптоза.
Ян С, Ву А, Тан Л, Тан Д, Чен В, Лай С, Гу К, Чен Дж, Чен Д, Тан Ц. Ян С и др. Питательные вещества. 2023 21 апреля; 15 (8): 1993. дои: 10.3390/nu15081993. Питательные вещества. 2023. PMID: 37111212 Бесплатная статья ЧВК.
Безопасность и эффективность внутривенной терапии карбоксимальтозой железа у детей с хронической болезнью почек.
Гарсия-Ортега П., Хименес-Лозано И., Крус А., Поло А.Ф., Лопес М., Арисета Г. Гарсия-Ортега П.
 и др.
Фронт Педиатр. 2022 6 октября; 10:967233. doi: 10.3389/fped.2022.967233. Электронная коллекция 2022.
Фронт Педиатр. 2022.
PMID: 36275063
Бесплатная статья ЧВК.
и др.
Фронт Педиатр. 2022 6 октября; 10:967233. doi: 10.3389/fped.2022.967233. Электронная коллекция 2022.
Фронт Педиатр. 2022.
PMID: 36275063
Бесплатная статья ЧВК.Дефицит питательных микроэлементов, проявляющийся отеком диска зрительного нерва, связанным с внутричерепной гипертензией или без нее: систематический обзор.
Рейнольдс Г., Эппс С., Хантли А., Атан Д. Рейнольдс Г. и соавт. Питательные вещества. 2022 26 июля; 14 (15): 3068. дои: 10.3390/nu14153068. Питательные вещества. 2022. PMID: 35893919 Бесплатная статья ЧВК. Обзор.
Эффективность и безопасность карбоксимальтозы железа при лечении железодефицитной анемии: многоцентровое исследование в реальном мире из Индии.
Чармила А.
 , Натараджан С., Читра Т.В., Павар Н., Кинджавадекар С., Фирке Й., Муругасан У., Ядав П., Охри Н., Модгил В., Родж А., Свами О.К.
Чармила А. и др.
Дж. Кровь Мед. 2022 8 июня; 13:303-313. DOI: 10.2147/JBM.S361210. Электронная коллекция 2022.
Дж. Кровь Мед. 2022.
PMID: 35706850
Бесплатная статья ЧВК.
, Натараджан С., Читра Т.В., Павар Н., Кинджавадекар С., Фирке Й., Муругасан У., Ядав П., Охри Н., Модгил В., Родж А., Свами О.К.
Чармила А. и др.
Дж. Кровь Мед. 2022 8 июня; 13:303-313. DOI: 10.2147/JBM.S361210. Электронная коллекция 2022.
Дж. Кровь Мед. 2022.
PMID: 35706850
Бесплатная статья ЧВК.Лапароскопическая хирургия не снижает потребность в переливании эритроцитарной массы после резекции колоректальной опухоли: исследование сопоставления показателей предрасположенности у 728 пациентов.
Турри Г., Малерба Г., Геккеле Г., Конти К., Рэндон Ф., Пикколи П., Гандини Г., Джирелли Д., Гульельми А., Педраццани К. Турри Г. и др. BMC Surg. 2022 31 марта; 22 (1): 123. doi: 10.1186/s12893-022-01569-0. BMC Surg. 2022. PMID: 35361179Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Рекомендации
- Хум Мутат.
 2014 ноябрь;35(11):1321-9
—
пабмед
2014 ноябрь;35(11):1321-9
—
пабмед
- Хум Мутат.
- Мол Фарм. 2012 4 июня; 9 (6): 1628-37 — пабмед
- J Гепатол. 2016 июль; 65 (1): 226-227 — пабмед
- Ревмирующий артрит. 2011 декабрь; 63 (12): 3672-80 — пабмед
- Клеточный метаб.
 2015 3 ноября; 22(5):777-87
—
пабмед
2015 3 ноября; 22(5):777-87
—
пабмед
- Клеточный метаб.
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- 2014.0851/Fondazione Cassa di Risparmio di Verona Vicenza Belluno e Ancona
- ПРИХТА н. 2014-00000451/регион Венето
категорий перорального железа | Iron Corner
Резюме Существует большой интерес к разработке соединений, переносимых лучше, чем соли железа; было предложено множество соединений (например, сахаросомное железо, полипептид гемового железа, железосодержащие наночастицы), но исследования ограничены. Сукросомальное железо было протестировано у пациентов с ХБП, но механизм всасывания и реальная польза неясны. В тех же условиях цитрат железа и железа, связывающий фосфаты, одновременно корректирует как гиперфосфатемию, так и дефицит железа; его двойной эффект проверяется в клинических испытаниях при ХБП. Испытание фазы 3 мальтола железа дало положительные результаты при железодефицитной анемии при воспалительных заболеваниях кишечника. Для подтверждения эффективности этих препаратов железа необходимы тщательно спланированные клинические испытания.
Сукросомальное железо было протестировано у пациентов с ХБП, но механизм всасывания и реальная польза неясны. В тех же условиях цитрат железа и железа, связывающий фосфаты, одновременно корректирует как гиперфосфатемию, так и дефицит железа; его двойной эффект проверяется в клинических испытаниях при ХБП. Испытание фазы 3 мальтола железа дало положительные результаты при железодефицитной анемии при воспалительных заболеваниях кишечника. Для подтверждения эффективности этих препаратов железа необходимы тщательно спланированные клинические испытания.
Сульфат железа, фумарат железа и глюконат железа являются препаратами на основе солей железа, наиболее часто назначаемыми для лечения железодефицитной анемии у здоровых в остальном пациентов, учитывая их общедоступность и низкую стоимость. Тем не менее, ожидайте, что частота прекращения или несоблюдения режима лечения достигнет 30-40% из-за побочных эффектов со стороны желудочно-кишечного тракта. У пациентов с сопутствующими заболеваниями, связанными с воспалением и повышением уровня гепсидина, сульфат железа (а также другие соли железа и, в значительной степени, пероральные препараты железа в целом) будут неэффективны. Увеличение дозы перорального железа с целью увеличения абсорбции приведет только к увеличению желудочно-кишечной токсичности.
У пациентов с сопутствующими заболеваниями, связанными с воспалением и повышением уровня гепсидина, сульфат железа (а также другие соли железа и, в значительной степени, пероральные препараты железа в целом) будут неэффективны. Увеличение дозы перорального железа с целью увеличения абсорбции приведет только к увеличению желудочно-кишечной токсичности.
Сульфат железа обычно неэффективен сразу после операции из-за послеоперационного воспаления и может способствовать пролонгации послеоперационной кишечной непроходимости.
Карбонильное железо и полисахаридно-железный комплексКарбонильное железо доступно в США как феозол с карбонильным железом. Это не соль железа, а скорее микрочастицы элементарного железа. Для растворения микрочастиц и образования гидрохлоридной соли требуется кислая среда в желудке.
По-видимому, он не имеет значительных преимуществ перед сульфатом железа, кроме меньшего потенциала отравления у детей. Ниферекс представляет собой комплекс полисахарида железа, состоящий из трехвалентного железа в комплексе с гидролизованным крахмалом. Считается, что он вызывает меньше раздражения желудочно-кишечного тракта, но это утверждение бездоказательно.
Считается, что он вызывает меньше раздражения желудочно-кишечного тракта, но это утверждение бездоказательно.
Полипептид гемового железа коммерчески доступен и продается в Соединенных Штатах как Proferrin ES или Proferrin Forte (в сочетании с 1 мг фолиевой кислоты и поэтому требует рецепта). Этот продукт изготовлен из гемоглобина, извлеченного из эритроцитов коровы.
Данные свидетельствуют о том, что гемовое железо лучше переносится и усваивается лучше, чем соли железа. Однако, как и в случае с другими пероральными добавками железа, биодоступность фрагмента железа ограничена у пациентов с воспалением и повышенным уровнем гепсидина.
Гемовое железо является отличной альтернативой сульфату железа у здоровых пациентов с дефицитом железа, которые не переносят соли железа. Он значительно дороже.
Железо-аминокислотные хелаты Эти препараты железа состоят из конъюгата двухвалентного железа с аминокислотой, обычно глицином. Продукты, продаваемые в Соединенных Штатах, включают Easy Iron, Gentle Iron, и Ferrochel (в сочетании с кальцием, витамином B12, витамином C и фолиевой кислотой).
Продукты, продаваемые в Соединенных Штатах, включают Easy Iron, Gentle Iron, и Ferrochel (в сочетании с кальцием, витамином B12, витамином C и фолиевой кислотой).
Имеются некоторые данные, свидетельствующие о более высокой биодоступности, чем у солей железа, у здоровых в других отношениях пациентов с дефицитом железа. Хелаты железа и аминокислот с меньшей вероятностью вызывают непереносимость со стороны желудочно-кишечного тракта, чем соли железа, и представляют собой еще одну (и лишь немного более дорогую) альтернативу сульфату железа.
Железопротеиновый сукцинилат (IPS) Эти продукты железа представляют собой форму трехвалентного железа, связанного с химически модифицированным белком (казеином) посредством сукцинилирования, которое стабилизирует комплекс. ИПС нерастворим при низком рН и становится растворимым в двенадцатиперстной кишке из-за гидролиза белковой части при более высоком рН в двенадцатиперстной кишке. Исследования показали значительно более низкую частоту побочных эффектов по сравнению с фумаратом железа, сульфатом железа, глюконатом железа и глицином железа. 1 Эффективность также может быть выше, чем у солей двухвалентного железа. Ряд составов доступен без рецепта в Соединенных Штатах, включая Ferrets IPS, Ironsorb и Iron Protein Plus.
1 Эффективность также может быть выше, чем у солей двухвалентного железа. Ряд составов доступен без рецепта в Соединенных Штатах, включая Ferrets IPS, Ironsorb и Iron Protein Plus.
Микрокапсулированный пирофосфат железа
Микрокапсулированный пирофосфат железа в липосомальной форме является новым достижением в лечении железодефицитной анемии. Эта соль «в целом признана безопасной (GRAS)» Кодексом федеральных правил Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (USFDA). Кроме того, Европейское управление по безопасности пищевых продуктов (EFSA) также объявило пирофосфат железа безопасной пищевой добавкой. 1,2 По сравнению с обычными пероральными солями железа, микрокапсулированное липосомальное железо обладает самой высокой биодоступностью. Это приводит к более быстрому повышению уровня гемоглобина в сыворотке крови, его вкус имеет лучшие вкусовые качества, и он не имеет нежелательных эффектов, таких как изжога, желудочно-кишечные расстройства и запоры.
Сукросомиал железа химический
Сукросомиал железа представляет собой пероральный препарат железа, состоящий из пирофосфата железа, защищенного двухслойной фосфолипидной мембраной, состоящей в основном из лецитина подсолнечника. 1 Доклинические данные показали, что сахаросомное железо удерживает железо в сахаросомах в желудочном соке, что позволяет интактным сахаросомам достигать тонкой кишки, где они всасываются. Рандомизированное открытое исследование оценивало пероральное введение сахаросомного железа у не зависимого от диализа пациента с железодефицитной анемией. 3 Пациенты были рандомизированы 2:1 для перорального введения сахаросомного железа 30 мг/сут в течение 3 месяцев или внутривенного введения глюконата железа 125 мг/нед до общей дозы 1000 мг с последующим наблюдением в течение 4 месяцев. Исследование показало, что краткосрочное пероральное введение сахаросомного железа было столь же эффективным, как и глюконат железа внутривенно, для коррекции анемии, с благоприятным профилем переносимости. Сукросомальное железо также оценивали в нескольких других клинических условиях, включая ЖДА, связанную с беременностью, воспалительным заболеванием кишечника, глютеновой болезнью, раком и кровотечением. 3,4
Сукросомальное железо также оценивали в нескольких других клинических условиях, включая ЖДА, связанную с беременностью, воспалительным заболеванием кишечника, глютеновой болезнью, раком и кровотечением. 3,4
Pergola PE, Fishbane S, Ganz T. Новые пероральные препараты железа для лечения железодефицитной анемии при хроническом заболевании почек. Adv Хроническая болезнь почек . 2019;26(4):272-291. doi:10.1053/j.ackd.2019.05.002
Гирелли Д., Уголини С., Бусти Ф. и др. Современная заместительная терапия железом: клинические и патофизиологические выводы. Int J Hematol 107, 16–30 (2018). https://doi.org/10.1007/s12185-017-2373-3
Хуссейн У., Зия К., Икбал Р., и др. (07 мая 2019 г.) Эффективность новой пищевой добавки (Ferfer®), содержащей микроинкапсулированное железо в липосомальной форме, при железодефицитной анемии у женщин. Cureus 11(5): e4603
Дополнительные ссылки- Cancelo-Hidalgo MJ, Castelo-Branco C, Palacios S, et al.

