Как развивается устойчивость гельминтов к лекарствам. Какие факторы способствуют появлению резистентности. Какие меры помогут предотвратить развитие устойчивости паразитов к антигельминтным препаратам. Почему важен комплексный подход к борьбе с гельминтозами.
Гельминтозы — глобальная проблема здравоохранения
Гельминтозы, передающиеся через почву (ГПП), остаются одной из наиболее распространенных паразитарных инфекций в мире. По оценкам, более 1,5 миллиарда человек инфицированы ГПП, преимущественно в тропических и субтропических регионах. Основными возбудителями являются:
- Анкилостомы (Necator americanus и Ancylostoma duodenale)
- Аскарида человеческая (Ascaris lumbricoides)
- Власоглав (Trichuris trichiura)
Заражение происходит при контакте с зараженной почвой — проглатывании яиц аскарид и власоглавов или проникновении личинок анкилостом через кожу. ГПП особенно распространены среди беднейших слоев населения, не имеющих доступа к чистой воде и надлежащей санитарии.

Влияние гельминтозов на здоровье
Гельминтозы оказывают серьезное негативное влияние на здоровье, особенно детей и беременных женщин:
- Анемия и дефицит железа
- Задержка физического и когнитивного развития детей
- Нарушение питания
- Снижение успеваемости и посещаемости школы
- Ухудшение репродуктивного здоровья женщин
Все это в долгосрочной перспективе приводит к снижению трудоспособности и экономической продуктивности.
Стратегии борьбы с гельминтозами
Всемирная организация здравоохранения (ВОЗ) рекомендует проводить профилактическую дегельминтизацию групп риска:
- Дети дошкольного и школьного возраста
- Женщины репродуктивного возраста, особенно беременные
- Взрослые из групп повышенного риска заражения
Основными препаратами для массовой дегельминтизации являются альбендазол и мебендазол из группы бензимидазолов. Они эффективны против большинства ГПП и имеют хороший профиль безопасности.
Эффективность массовой дегельминтизации
Программы массовой дегельминтизации позволили значительно снизить распространенность и интенсивность гельминтозов во многих эндемичных регионах. Однако для полной ликвидации передачи ГПП необходимы дополнительные меры:

- Улучшение санитарии и гигиены
- Обеспечение доступа к чистой воде
- Санитарное просвещение населения
- Борьба с промежуточными хозяевами гельминтов
Без комплексного подхода после прекращения дегельминтизации происходит быстрое повторное заражение населения.
Риск развития устойчивости к противогельминтным препаратам
Длительное массовое применение одних и тех же антигельминтных средств создает селективное давление на популяции паразитов и может привести к развитию лекарственной устойчивости. В ветеринарии это уже стало серьезной проблемой — многие гельминты сельскохозяйственных животных устойчивы к бензимидазолам.
Механизмы устойчивости
Основным механизмом устойчивости к бензимидазолам являются мутации в гене β-тубулина, кодирующем белок-мишень этих препаратов. Наиболее значимы замены в трех кодонах:
- 167 (фенилаланин на тирозин)
- 198 (глутаминовая кислота на аланин)
- 200 (фенилаланин на тирозин)
Эти мутации нарушают связывание бензимидазолов с β-тубулином, что снижает их противогельминтную активность.

Признаки снижения эффективности
Хотя клинически значимая устойчивость ГПП человека пока не доказана, есть косвенные признаки снижения эффективности антигельминтных препаратов:
- Уменьшение показателей излечения и снижения числа яиц гельминтов после лечения
- Обнаружение мутаций устойчивости в популяциях паразитов
- Сохранение передачи ГПП в регионах с длительными программами дегельминтизации
Метаанализ показал, что за 20 лет эффективность альбендазола и мебендазола против анкилостом могла снизиться на 15%, а против власоглавов — на 30%.
Мониторинг устойчивости гельминтов
Для своевременного выявления устойчивости необходим регулярный мониторинг эффективности антигельминтных препаратов и генетический скрининг популяций паразитов. Основные методы включают:
- Оценку эффективности лечения (показатели излечения и снижения числа яиц)
- Молекулярно-генетические исследования (ПЦР, секвенирование) для выявления мутаций устойчивости
- Фенотипические тесты на чувствительность изолятов гельминтов к препаратам in vitro
Важно проводить мониторинг до и после курсов массовой дегельминтизации для отслеживания динамики устойчивости.

Проблемы диагностики устойчивости
Выявление устойчивости ГПП человека сопряжено с рядом трудностей:
- Отсутствие стандартизированных методов оценки чувствительности
- Сложность получения изолятов взрослых гельминтов от людей
- Неясная связь между генотипом и фенотипом устойчивости
- Возможность развития устойчивости по неизвестным механизмам
Стратегии предотвращения развития устойчивости
Для сохранения эффективности существующих антигельминтных препаратов необходимо внедрение комплексных стратегий, направленных на замедление развития устойчивости:
Оптимизация схем дегельминтизации
- Использование препаратов с разным механизмом действия
- Ротация антигельминтных средств
- Комбинированная терапия несколькими препаратами
- Соблюдение оптимальных дозировок для предотвращения субтерапевтических концентраций
Целевой подход к лечению
- Диагностика перед лечением для выявления инфицированных
- Лечение только инфицированных лиц вместо массовой дегельминтизации
- Сохранение популяции гельминтов, чувствительных к препаратам («рефугиум»)
Комплексный контроль передачи
- Улучшение санитарии и доступа к чистой воде
- Санитарное просвещение и изменение поведения населения
- Борьба с промежуточными хозяевами гельминтов
- Вакцинация (при наличии эффективных вакцин)
Мониторинг и исследования
- Регулярный мониторинг эффективности препаратов
- Генетический скрининг популяций паразитов
- Разработка новых антигельминтных средств
- Изучение механизмов устойчивости гельминтов
Проблема зоонозных резервуаров
Многие виды ГПП способны заражать как человека, так и животных. Это создает дополнительные риски развития и распространения устойчивости:

- Обмен генами устойчивости между популяциями паразитов человека и животных
- Формирование резервуаров устойчивых гельминтов у животных
- Возможность гибридизации близкородственных видов (например, Ascaris lumbricoides и A. suum)
Необходим комплексный подход «Единое здоровье», учитывающий взаимодействие паразитов человека и животных.
Перспективы борьбы с гельминтозами
Несмотря на риск развития устойчивости, массовая дегельминтизация остается важным инструментом контроля ГПП. Однако для достижения устойчивого результата необходимы:
- Комплексный подход, сочетающий лечение, профилактику и контроль передачи
- Разработка новых антигельминтных препаратов и вакцин
- Внедрение стратегий управления устойчивостью паразитов
- Укрепление систем эпиднадзора и мониторинга
- Повышение осведомленности населения и медработников
При правильном подходе возможно значительное снижение бремени гельминтозов и предотвращение развития широкомасштабной лекарственной устойчивости.
Заключение
Устойчивость к противогельминтным препаратам представляет серьезную угрозу для программ контроля гельминтозов. Хотя клинически значимая устойчивость ГПП человека пока не доказана, есть признаки снижения эффективности существующих препаратов. Необходимо внедрение комплексных стратегий для замедления развития устойчивости и сохранения эффективности антигельминтной терапии. Ключевыми элементами являются оптимизация схем лечения, целевой подход, улучшение санитарии, мониторинг эффективности и разработка новых препаратов. Только комплексный подход позволит достичь устойчивого контроля над гельминтозами в долгосрочной перспективе.
Сегодня антигельминтики отпускаются без рецепта и…
24.06.2020, 11:22
открыть оригиналСегодня антигельминтики отпускаются без рецепта и плановые обработки оказались в наших с вами руках. Хорошо это или плохо?
Ну что может быть нового в дегельминтизации? Паразитические черви высоко адаптированы к жизни за счёт хозяев, очень консервативны в своих привычках и, как нам казалось, довольно предсказуемы. Жизненный цикл у каждого вида строго расписан, основные и промежуточные хозяева распределены. Ну, где-то раз в пять лет на фоне применения определённого препарата накапливается достаточное количество устойчивых к нему паразитов, и фармакологам приходится искать новые лекарства.
При этом сам процесс дегельминтизации стал проще. Все видовые и возрастные ограничения, как правило, указываются прямо на коробке, и уж тем более вы найдёте их в инструкции-вкладыше. В плановом порядке обработку проводят однократно, при этом не надо выдерживать животное без еды.
Вроде бы всё просто, но полностью использовать все возможности новых препаратов многим владельцам мешают устаревшие представления о дегельминтизации. В чём они заключаются?
— Вот вам первый миф: вначале найдите в анализе кала гельминтов в любой форме, а уже потом давайте лекарство. Когда-то это было логичным, так как использовались более токсичные препараты, к тому же эффективные только против одного класса гельминтов. К сожалению, выяснилось, что традиционные анализы не выявляют значительной доли инвазированных животных. Многие их них внешне здоровы, так как паразитов в них немного, но, тем не менее, паразиты эти успешно размножаются и заражают окружающую среду — а именно дом, в котором живёт животное-хозяин. А теперь подумайте: в наших квартирах обитают кошки, собаки, декоративные грызуны и даже хорьки. Для многих они уже не просто домашние любимцы, а младшие члены семьи. Такое сближение неизбежно приводит к тому, что тесно общающемуся населению легче обмениваться рядом общих болезней, в том числе и различными глистами. Последних в окружающей среде хватает. Например, прогулявшись по садику и облизав лапки, можно приобрести нахлебников. Ещё кошка охотится на многих промежуточных хозяев гельминтов. А такого паразита, как огуречный цепень, она может заполучить не выходя из дома, а просто выкусывая блох (они являются переносчиком этого гельминта).
Для многих они уже не просто домашние любимцы, а младшие члены семьи. Такое сближение неизбежно приводит к тому, что тесно общающемуся населению легче обмениваться рядом общих болезней, в том числе и различными глистами. Последних в окружающей среде хватает. Например, прогулявшись по садику и облизав лапки, можно приобрести нахлебников. Ещё кошка охотится на многих промежуточных хозяев гельминтов. А такого паразита, как огуречный цепень, она может заполучить не выходя из дома, а просто выкусывая блох (они являются переносчиком этого гельминта).
1. Не стоит ожидать, что после дачи современных противоглистных препаратов вы обнаружите в кале полуживых глистов. В лучшем случае от них останутся тонкие желеобразные прожилки. А при слабой инвазии вы не увидите и этого.
2. Появление в кале (или в рвотных массах) червячков, видимых невооружённым глазом, свидетельствует о высокой степени глистной инвазии. В этом случае нельзя проводить самолечение и необходимо срочно показать животное ветеринарному врачу, так как одновременная гибель большого числа гельминтов в результате самостоятельной дачи лекарства может вызвать у животного интоксикацию.
3. Антигельминтики выпускаются в различной форме: таблетки, пасты, суспензии, сахарки, капли на холку. У каждого из них есть существенные преимущества. Так, суспензии удобно вводить шприцом-дозатором вглубь пасти, за корень языка, чтобы животное не чувствовало непривычного вкуса А капли на холку — просто находка для владельцев строптивых кошек. Однако стоит учитывать, что не все такие препараты являются универсальными.
4. Многие врачи советуют прогнать глистов будущей матери за 10–14 дней до плановой вязки. По их мнению, во время самой беременности и лактации приём антигельминтиков нежелателен. Однако производители некоторых антигельминтиков советуют сделать обработку матери за две недели до родов.
5. Пожилой возраст не является противопоказанием для приёма антигельминтиков. Но к старости у животного могут накопиться хронические заболевания, ухудшиться работа печени, почек. Пусть врач проверит состояние здоровья вашего питомца и поможет с выбором препарата для дегельминтизации.
Чтобы обезопасить свою семью — и в первую очередь детей — от гельминтов, надо следовать правилам простейшей личной гигиены и регулярно обрабатывать своих питомцев надёжным препаратом. Всемирная ветеринарная ассоциация рекомендует проводить дегельминтизацию взрослых кошек ежеквартально: три месяца — срок, в течение которого в кишечнике накапливается «критическая масса» гельминтов и появляется опасность для здоровья животного и семьи, в которой оно живёт. Кроме того, половозрелые черви могут быть абсолютно не чувствительны к действующим веществам, губительным для их личиночной стадии, а личинки некоторых видов могут «затаиваться» в организме хозяина, образуя инкапсулированную форму. Это тоже говорит в пользу профилактики и частоты обработок с учётом жизненного цикла паразита. Существует достаточное число эффективных и, при надлежащем следовании инструкции, безопасных комплексных препаратов, которые владелец кошки может самостоятельно применять в плановом порядке. Эти средства обладают широким спектром действия, охватывающим всех «популярных» круглых и плоских гельминтов, и низким уровнем токсичности для пациента.
— Раньше владельцам кошек рекомендовали дегельминтизировать питомцев два раза в год: поздней весной (май – июнь) и осенью (сентябрь-октябрь). Сейчас рекомендации изменились, однако очень многие продолжают двукратную обработку, приурочивая её к возвращению с дачи в конце лета, а потом — к прививочной компании в начале года.
— Второй распространённый миф как раз о дегельминтизации и прививках. Распространённая установка — дегельминтизацию необходимо приурочивать к вакцинации. Это правильно в том смысле, что прививаемое животное должно быть свободно от паразитов. И если человек только что приобрёл или подобрал животное и не знает, обрабатывал ли его прежний владелец, или же уверен, что никто этим не занимался, перед первой прививкой обязательно избавляют животное от глистов. Но при регулярной дегельминтизации раз в квартал нет надобности ни приурочивать дачу препарата к прививочной компании, ни специально давать его лишний раз. Единственное, за чем надо проследить, — между дегельминтизацией и прививкой должны пройти хотя бы 1–2 недели.
Обращаю ваше внимание, что в случае каких-либо сомнений не надо стесняться консультироваться с врачом. Например, если ваша кошка ослаблена другой болезнью или беременна.
И, разумеется, в тех случаях, когда нужна не профилактическая обработка, а изгнание вполне конкретных глистов из больного животного, лучше предоставить это компетенции специалиста.
Массовое применение препаратов от гельминтов, передающихся через почву, в масштабах всего сообщества – риск лекарственной устойчивости и стратегии смягчения последствий 1, 2). ППГ непропорционально воздействуют на беднейшие и наиболее уязвимые сообщества. ППГ включают анкилостомы (
Necator americanus и Ancylostoma duodenale ), Ascaris lumbricoides и Trichuris trichiura . Заражение происходит при проглатывании яиц A. lumbricoides и T. trichiura или проникновении через кожу личинок анкилостомы, присутствующих в зараженной почве (3, 4). Анкилостомозы средней и тяжелой степени (MHI) связаны с более низкими уровнями гемоглобина и анемией, что может быть особенно вредным для беременных женщин и детей младшего возраста, которые часто имеют низкие исходные запасы железа (5–8). Дети с инфекциями ППГ также страдают от недоедания и плохого когнитивного развития, что еще больше влияет на посещаемость и успеваемость в школе, а также на экономическую продуктивность в будущем (9).–11). Текущая стратегия Всемирной организации здравоохранения (ВОЗ) направлена на ликвидацию заболеваемости за счет целенаправленной дегельминтизации противогельминтными препаратами групп риска, в том числе детей дошкольного возраста (ДШК), детей школьного возраста (ДШК) и женщин репродуктивного возраста. возраст (ВРА).
Дети с инфекциями ППГ также страдают от недоедания и плохого когнитивного развития, что еще больше влияет на посещаемость и успеваемость в школе, а также на экономическую продуктивность в будущем (9).–11). Текущая стратегия Всемирной организации здравоохранения (ВОЗ) направлена на ликвидацию заболеваемости за счет целенаправленной дегельминтизации противогельминтными препаратами групп риска, в том числе детей дошкольного возраста (ДШК), детей школьного возраста (ДШК) и женщин репродуктивного возраста. возраст (ВРА). Крупномасштабные программы дегельминтизации привели к значительному снижению распространенности, интенсивности и связанной с этим заболеваемости геогельминтозами (12). Однако до тех пор, пока не произойдет существенное экономическое развитие, включая значительное улучшение доступа к чистой воде, санитарии и гигиене (WASH), резервуары среди нелеченых взрослых будут по-прежнему приводить к заражению и сохранению в окружающей среде (от недель для анкилостомы до лет для 9). 0005 Аскариды ) (13). Это приводит к быстрому повторному заражению в группах риска, если дегельминтизация не повторяется часто с течением времени. Данные математических моделей и полевых испытаний показывают, что в некоторых географических условиях можно прервать передачу ППГ, приняв стратегию массового введения лекарственных средств (МДА) в масштабах всего сообщества, при которой лечатся все люди, включая взрослых (14–16). ). Стратегия прерывания передачи может позволить прекратить долгосрочные программы дегельминтизации и существенно снизить потребность в пожертвованиях лекарств, от которых в значительной степени зависят программы дегельминтизации (17).
0005 Аскариды ) (13). Это приводит к быстрому повторному заражению в группах риска, если дегельминтизация не повторяется часто с течением времени. Данные математических моделей и полевых испытаний показывают, что в некоторых географических условиях можно прервать передачу ППГ, приняв стратегию массового введения лекарственных средств (МДА) в масштабах всего сообщества, при которой лечатся все люди, включая взрослых (14–16). ). Стратегия прерывания передачи может позволить прекратить долгосрочные программы дегельминтизации и существенно снизить потребность в пожертвованиях лекарств, от которых в значительной степени зависят программы дегельминтизации (17).
Двумя наиболее часто используемыми препаратами в существующих программах по лечению геогельминтозов (и доступными в рамках программ пожертвований) являются альбендазол и мебендазол. Оба этих препарата относятся к одному классу бензимидазолов, действие которых основано на ингибировании полимеризации тубулина, что приводит к параличу и гибели гельминтов (18). Метаанализ 2017 года показал, что, хотя оба препарата были высокоэффективны против A. lumbricoides , альбендазол обладал более высокой эффективностью против анкилостомозов с показателем излечения (CR) 80% и коэффициентом сокращения количества яиц (ERR) 9.0%. Напротив, мебендазол оказался наиболее эффективным против T. trichiura , что привело к CR 42,1% и ERR 66% (19). Продолжающееся использование препаратов с менее чем оптимальной эффективностью предполагает, что вероятность возникновения резистентности в человеческом населении может быть высокой, и, хотя глобальные оценки продолжают показывать, что заболеваемость, вызванная ППГ, снижается, некоторые исследования в районах с длительной историей дегельминтизации предполагают снижение эффективности этих препаратов (20, 21). Фактически, обзор этого субъекта за 2018 г. показал, что эффективность как альбендазола, так и мебендазола для лечения анкилостомоза могла снизиться на целых 15% в течение двух десятилетий с 1995 до 2015 года (22).
Метаанализ 2017 года показал, что, хотя оба препарата были высокоэффективны против A. lumbricoides , альбендазол обладал более высокой эффективностью против анкилостомозов с показателем излечения (CR) 80% и коэффициентом сокращения количества яиц (ERR) 9.0%. Напротив, мебендазол оказался наиболее эффективным против T. trichiura , что привело к CR 42,1% и ERR 66% (19). Продолжающееся использование препаратов с менее чем оптимальной эффективностью предполагает, что вероятность возникновения резистентности в человеческом населении может быть высокой, и, хотя глобальные оценки продолжают показывать, что заболеваемость, вызванная ППГ, снижается, некоторые исследования в районах с длительной историей дегельминтизации предполагают снижение эффективности этих препаратов (20, 21). Фактически, обзор этого субъекта за 2018 г. показал, что эффективность как альбендазола, так и мебендазола для лечения анкилостомоза могла снизиться на целых 15% в течение двух десятилетий с 1995 до 2015 года (22). Этот же обзор предполагает, что снижение эффективности еще более выражено для лечения T. trichiura , при этом эффективность снижается примерно на 30%. Неясно, является ли это потенциальное снижение эффективности результатом появления лекарственной устойчивости (23), но такие тенденции дают косвенные доказательства в поддержку этой возможности.
Этот же обзор предполагает, что снижение эффективности еще более выражено для лечения T. trichiura , при этом эффективность снижается примерно на 30%. Неясно, является ли это потенциальное снижение эффективности результатом появления лекарственной устойчивости (23), но такие тенденции дают косвенные доказательства в поддержку этой возможности.
Устойчивость к противогельминтным препаратам
В ветеринарии рутинное массовое лечение скота привело к широко распространенной лекарственной устойчивости с хорошо задокументированными полиморфизмами одиночных нуклеотидов (SNP), которые привели к тому, что весь класс бензимидазолов оказался неэффективным. Анализы изотермической петлевой опосредованной изотермической амплификации (LAMP), ПЦР, секвенирование по Сэнгеру, пиросеквенирование и секвенирование следующего поколения (NGS) выявили SNP, связанные с устойчивостью к бензимидазолу у различных нематод человека и животных в одном из трех кодонов — 167, 198 и 200 – в гене, кодирующем β-тубулин изотипа 1 (24, 25) (более уместно назвать локус β-тубулина А, чтобы предотвратить ложные последствия ортологии) (26). (Примеры на людях подробно описаны в таблице 1). В этих исследованиях использовали нуклеиновую кислоту, полученную из различных источников, включая взрослых червей (из исследований изгнания), вскрытых или концентрированных яиц или образцов стула (таблица 2). В некоторых исследованиях регистрировалась история лечения и собирались образцы как до, так и после лечения, чтобы задокументировать временную связь между лечением и появлением предполагаемых генотипических детерминант резистентности. В дополнение к наличию или отсутствию, пиросеквенирование и NGS также позволяют оценить долю популяции червей в образце с SNP и были бы более полезны в лонгитюдных исследованиях с образцами, собранными до и после введения лечения.
(Примеры на людях подробно описаны в таблице 1). В этих исследованиях использовали нуклеиновую кислоту, полученную из различных источников, включая взрослых червей (из исследований изгнания), вскрытых или концентрированных яиц или образцов стула (таблица 2). В некоторых исследованиях регистрировалась история лечения и собирались образцы как до, так и после лечения, чтобы задокументировать временную связь между лечением и появлением предполагаемых генотипических детерминант резистентности. В дополнение к наличию или отсутствию, пиросеквенирование и NGS также позволяют оценить долю популяции червей в образце с SNP и были бы более полезны в лонгитюдных исследованиях с образцами, собранными до и после введения лечения.
Таблица 1 Однонуклеотидные полиморфизмы, описанные в локусе β-тубулина А видов STH человека.
Таблица 2 Обзор частот однонуклеотидных полиморфизмов локуса β-тубулина А, зарегистрированных в образцах ППГ человека.
Хотя мониторинг этих известных SNP, важных в ветеринарии, является логичной отправной точкой для усилий по мониторингу резистентности, сосредоточения внимания на наличии/отсутствии ветеринарных маркеров может быть недостаточно, чтобы определить, возникает ли резистентность в популяциях паразитов человека. Развитие резистентности в популяциях паразитов, заражающих человека, может развиваться в результате конвергентной эволюции сходных SNP, но также легко может происходить в результате генотипических изменений в других позициях или в других генах β-тубулина. Таким образом, требуются широкие усилия по надзору с использованием менее целенаправленных подходов, и мониторинг не должен ограничиваться теми SNP, о которых известно, что они связаны с ветеринарной резистентностью. Скорее, эффективный надзор потребует использования таких инструментов, как секвенирование РНК или секвенирование ампликонов, для широкого наблюдения за продуктами транскрипции на наличие как идентичных, так и новых SNP и местоположений SNP.
Развитие резистентности в популяциях паразитов, заражающих человека, может развиваться в результате конвергентной эволюции сходных SNP, но также легко может происходить в результате генотипических изменений в других позициях или в других генах β-тубулина. Таким образом, требуются широкие усилия по надзору с использованием менее целенаправленных подходов, и мониторинг не должен ограничиваться теми SNP, о которых известно, что они связаны с ветеринарной резистентностью. Скорее, эффективный надзор потребует использования таких инструментов, как секвенирование РНК или секвенирование ампликонов, для широкого наблюдения за продуктами транскрипции на наличие как идентичных, так и новых SNP и местоположений SNP.
Окончательные доказательства клинически значимой резистентности к бензимидазолу у людей не были задокументированы. Однако в некоторых регионах, где продолжается передача вируса человеку, несмотря на неоднократные циклы целенаправленной дегельминтизации, резистентность к бензимидазолу могла возникнуть у различных видов ППГ человека (27, 31, 41). В таких условиях обнаружение SNP, кодирующих резистентность, может свидетельствовать об устойчивости в циркулирующих популяциях червей, и если развитие резистентности отражает закономерности, наблюдаемые в ветеринарном сообществе, эти SNP могут быстро и необратимо стать доминирующими из-за давления отбора лекарств (42). Это вызывает озабоченность, поскольку длительные кампании MDA при субоптимальном охвате могут повлиять на популяции гельминтов и привести к расширению популяций червей, устойчивых к антигельминтным средствам (41). Хотя важно помнить, что SNP в вышеупомянутых локусах не были окончательно продемонстрированы как релевантные для развития резистентности у видов, заражающих человека, клинически значимая резистентность, вызванная селективным давлением, опосредованным вмешательством, может возникать с помощью множества других механизмов (43). ). Срочно необходимы дополнительные исследования с использованием подходов, основанных на секвенировании, на уровне видов с широким географическим представительством для выявления детерминант резистентности в человеческой популяции (если они существуют) или для мониторинга их развития и появления (43–45).
В таких условиях обнаружение SNP, кодирующих резистентность, может свидетельствовать об устойчивости в циркулирующих популяциях червей, и если развитие резистентности отражает закономерности, наблюдаемые в ветеринарном сообществе, эти SNP могут быстро и необратимо стать доминирующими из-за давления отбора лекарств (42). Это вызывает озабоченность, поскольку длительные кампании MDA при субоптимальном охвате могут повлиять на популяции гельминтов и привести к расширению популяций червей, устойчивых к антигельминтным средствам (41). Хотя важно помнить, что SNP в вышеупомянутых локусах не были окончательно продемонстрированы как релевантные для развития резистентности у видов, заражающих человека, клинически значимая резистентность, вызванная селективным давлением, опосредованным вмешательством, может возникать с помощью множества других механизмов (43). ). Срочно необходимы дополнительные исследования с использованием подходов, основанных на секвенировании, на уровне видов с широким географическим представительством для выявления детерминант резистентности в человеческой популяции (если они существуют) или для мониторинга их развития и появления (43–45).
Несмотря на то, что обычно наблюдается лишь ограниченная или умеренная распространенность среди видов ППГ, заражающих человека, наличие SNP, связанных с устойчивостью к бензимидазолу в ветеринарном мире, остается причиной беспокойства среди сообщества ППГ. Что касается заражения человека анкилостомозом, то большинство исследований, подтверждающих наличие маркеров ветеринарной устойчивости, относятся к N. americanus (таблица 2). SNP в кодоне 167 были идентифицированы в Гане (28), в кодоне 198 в Гане (28), Бразилии (35) и Шри-Ланке (25) и в кодоне 200 в Гане (28), Кении (27), Гаити (34). ) и Бразилии (35). Глядя на образцы, собранные до и после лечения, исследование в Гане показало очень скромное (от 1,7% до 5%), но значительное увеличение обнаружения среди образцов, собранных после лечения альбендазолом (28). Для инфекции Trichuris , где эффективность бензимидазолов изначально ниже, исследование в Панаме показало снижение резистентных SNP после лечения на кодоне 167 (27). Однако для кодонов 198 и 200 исследования на Гаити, Кении и Панаме показали увеличение доли SNP как в гетерозиготных, так и в гомозиготных популяциях (27, 31). При инфицировании человека Ascaris наиболее устойчивые SNP, о которых сообщалось, находились в кодоне 167, и они были зарегистрированы на Гаити, в Кении и Панаме (27). Хотя исследования, документирующие появление таких SNP, важны и предостерегают, в настоящее время их актуальность и связь с развитием резистентности остаются неясными.
Однако для кодонов 198 и 200 исследования на Гаити, Кении и Панаме показали увеличение доли SNP как в гетерозиготных, так и в гомозиготных популяциях (27, 31). При инфицировании человека Ascaris наиболее устойчивые SNP, о которых сообщалось, находились в кодоне 167, и они были зарегистрированы на Гаити, в Кении и Панаме (27). Хотя исследования, документирующие появление таких SNP, важны и предостерегают, в настоящее время их актуальность и связь с развитием резистентности остаются неясными.
Стратегии и соображения по смягчению последствий
Если для прерывания передачи ППГ будет принята дегельминтизация в масштабах всего сообщества, давление наркотиков на целевую популяцию резко возрастет, а доля населения, не получающего лечения (убежища), будет сведена к минимуму. Это уменьшит пул паразитов дикого типа в сообществе (42). Таким образом, потребуются стратегии для смягчения потенциального возникновения лекарственной устойчивости (44, 46). В ветеринарном сообществе исторически предполагалось, что содержание необработанной субпопуляции всего в 20% от стада (которое будет содержать популяции восприимчивых к лекарственным средствам гельминтов) может значительно отсрочить появление и распространение резистентности. Отсроченная резистентность, возникающая в результате этих относительно низких уровней нелеченых индивидуумов, была предложена в качестве возможной причины отсутствия подтвержденной резистентности в человеческой популяции, где само по себе несоблюдение режима часто обеспечивает существование такой субпопуляции нелеченных индивидуумов. 42). Однако, хотя сохранение нелеченой субпопуляции может отсрочить резистентность, это также контрпродуктивно для усилий, направленных на прерывание передачи. Уравновешивание таких проблем будет иметь решающее значение для успеха любой программы вмешательства в масштабах всего сообщества.
Отсроченная резистентность, возникающая в результате этих относительно низких уровней нелеченых индивидуумов, была предложена в качестве возможной причины отсутствия подтвержденной резистентности в человеческой популяции, где само по себе несоблюдение режима часто обеспечивает существование такой субпопуляции нелеченных индивидуумов. 42). Однако, хотя сохранение нелеченой субпопуляции может отсрочить резистентность, это также контрпродуктивно для усилий, направленных на прерывание передачи. Уравновешивание таких проблем будет иметь решающее значение для успеха любой программы вмешательства в масштабах всего сообщества.
Помимо содержания адекватных убежищ, ветеринарное сообщество может извлечь много других уроков. Потребность в чувствительных диагностических инструментах, способных выявлять маркеры резистентности в месте сбора, будет иметь решающее значение для контроля и снижения риска широко распространенного развития резистентности, особенно в условиях расширенного ландшафта лечения. Однако, несмотря на то, что такие технологии, как LAMP и амплификация рекомбиназной полимеразы, продолжают расширять возможности полевого тестирования, адекватные инструменты трудно представить до тех пор, пока не будет определено четкое определение маркеров резистентности в сообществе паразитов, заражающих человека. Изучение использования новых средств для дегельминтизации, перепрофилирование старых препаратов, использование комбинированной лекарственной терапии и акцент на недопущении недостаточной дозировки также сыграют важную роль в будущих усилиях по предотвращению развития широко распространенной резистентности в сообществе человека-паразита. Инновационные стратегии по снижению загрязнения окружающей среды также будут иметь решающее значение (23, 47), равно как и интеграция подходов, ориентированных на сообщества, и участие в изменении поведения для улучшения справедливого охвата и соблюдения режима приема МДА и ВСГ.
Однако, несмотря на то, что такие технологии, как LAMP и амплификация рекомбиназной полимеразы, продолжают расширять возможности полевого тестирования, адекватные инструменты трудно представить до тех пор, пока не будет определено четкое определение маркеров резистентности в сообществе паразитов, заражающих человека. Изучение использования новых средств для дегельминтизации, перепрофилирование старых препаратов, использование комбинированной лекарственной терапии и акцент на недопущении недостаточной дозировки также сыграют важную роль в будущих усилиях по предотвращению развития широко распространенной резистентности в сообществе человека-паразита. Инновационные стратегии по снижению загрязнения окружающей среды также будут иметь решающее значение (23, 47), равно как и интеграция подходов, ориентированных на сообщества, и участие в изменении поведения для улучшения справедливого охвата и соблюдения режима приема МДА и ВСГ.
Адекватное рассмотрение животных резервуаров инфекции и случаев гибридизации паразитов также может оказаться критически важным, если необходимо отсрочить/предотвратить развитие резистентности. Доказательства скрещивания Ascaris suum и A. lumbricoides представляют собой поучительную историю о необходимости применения подхода «Единое здоровье» к стратегиям вмешательства (48). В то время как зоонозные резервуары и/или скрещивающиеся популяции паразитов представляют значительный риск развития и латеральной передачи резистентности, также возможно, что в некоторых случаях животные-резервуары могут служить необработанной субпопуляцией, предоставляя полезные убежища. Учет таких факторов может оказаться решающим как для успеха будущих вмешательств, так и для предотвращения развития резистентности у видов ППГ, поражающих людей.
Доказательства скрещивания Ascaris suum и A. lumbricoides представляют собой поучительную историю о необходимости применения подхода «Единое здоровье» к стратегиям вмешательства (48). В то время как зоонозные резервуары и/или скрещивающиеся популяции паразитов представляют значительный риск развития и латеральной передачи резистентности, также возможно, что в некоторых случаях животные-резервуары могут служить необработанной субпопуляцией, предоставляя полезные убежища. Учет таких факторов может оказаться решающим как для успеха будущих вмешательств, так и для предотвращения развития резистентности у видов ППГ, поражающих людей.
Вклад авторов
SA, NP и JW разработали концепцию обзора, MM провел обзор литературы, SA и NP подготовили рукопись, которая была рассмотрена и доработана всеми авторами. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Финансирование исследования DeWorm3 было предоставлено Фондом Билла и Мелинды Гейтс (номер гранта: INV-022149).
Благодарности
Мы благодарим Мидхуна Сасикумара за помощь в оформлении рукописи и ссылки.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечание издателя
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций, издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Ссылки
1. де Сильва Н.Р., Брукер С., Хотез П.Дж., Монтрезор А., Энгельс Д., Савиоли Л. Гельминтные инфекции, передающиеся через почву: обновление глобальной картины. Trends Parasitol (2003) 19(12):547–51. doi: 10.1016/j.pt.2003.10.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Пуллан Р.Л., Смит Дж.Л., Ясрасария Р., Брукер С.Дж. Глобальные показатели инфицирования и бремени болезней, вызванных гельминтозами, передающимися через почву, в 2010 г. Паразиты-переносчики (2014) 7(1):37. doi: 10.1186/1756-3305-7-37
Пуллан Р.Л., Смит Дж.Л., Ясрасария Р., Брукер С.Дж. Глобальные показатели инфицирования и бремени болезней, вызванных гельминтозами, передающимися через почву, в 2010 г. Паразиты-переносчики (2014) 7(1):37. doi: 10.1186/1756-3305-7-37
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Бетони Дж., Брукер С., Альбонико М., Гейгер С.М., Лукас А., Димерт Д. и другие. Гельминтозы, передающиеся через почву: аскаридоз, трихоцефалез, анкилостомоз. Ланцет (2006) 367(9521):1521–32. doi: 10.1016/S0140-6736(06)68653-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4. Zawawi A, Else KJ. Вакцины против гельминтов, передающихся через почву: мы приближаемся? Фронт Иммунол (2020) 11:576748. doi: 10.3389/fimmu.2020.576748
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
5. Брукер С., Хотез П.Дж., Банди Д.П. Анкилостомозная анемия у беременных женщин: систематический обзор. PloS Negl Trop Dis (2008) 2(9):e291. doi: 10.1371/journal.pntd.0000291
PloS Negl Trop Dis (2008) 2(9):e291. doi: 10.1371/journal.pntd.0000291
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Смит Дж. Л., Брукер С. Влияние анкилостомоза и дегельминтизации на анемию у небеременных: систематический обзор. Trop Med Int Health (2010) 15(7):776–95. doi: 10.1111/j.1365-3156.2010.02542.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Тагипур А., Годсиан С., Джаббари М., Олфатифар М., Абдоли А., Гаффарифар Ф. Глобальная распространенность кишечных паразитарных инфекций и связанные с ними факторы риска у беременных: систематический обзор и метаанализ. Trans R Soc Trop Med Hyg (2021) 115(5):457–70. doi: 10.1093/trstmh/traa101
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
8. Мазибуко XI, Чимбари М. Влияние шистосомоза и передающихся через почву гельминтов на навыки экспрессивной речи у африканских детей дошкольного возраста. BMC Infect Dis (2022) 22(1):264. doi: 10.1186/s12879-022-07260-2
BMC Infect Dis (2022) 22(1):264. doi: 10.1186/s12879-022-07260-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Кромптон Д.У. Значение анкилостомоза для общественного здравоохранения. Паразитология (2000) 121 Приложение: S39–50. doi: 10.1017/S0031182000006454
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
10. Дегарег А., Эрко Б. Связь между кишечными гельминтозами и недостаточным весом среди школьников в начальной школе Тикур Вуха, северо-запад Эфиопии. J Infect Public Health (2013) 6(2):125–33. doi: 10.1016/j.jiph.2012.11.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Mireku MO, Boivin MJ, Davidson LL, Ouédraogo S, Koura GK, Alao MJ, et al. Влияние гельминтозов во время беременности на когнитивные и двигательные функции детей первого года жизни. PloS Negl Trop Dis (2015) 9(3):e0003463. doi: 10.1371/journal.pntd.0003463
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Кинг Ч. Эпидемиология и борьба с гельминтозами: достижение успехов и решение остающихся проблем. Adv Parasitol (2019) 103:11–30. doi: 10.1016/bs.apar.2018.08.001
Кинг Ч. Эпидемиология и борьба с гельминтозами: достижение успехов и решение остающихся проблем. Adv Parasitol (2019) 103:11–30. doi: 10.1016/bs.apar.2018.08.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Сенекал Дж., Нордин А., Виннерос Б. Судьба аскарид при различных значениях pH, температуры и влажности. J Water Health (2020) 18(3):375–82. doi: 10.2166/wh.2020.264
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Truscott JE, Turner HC, Farrell SH, Anderson RM. Передающиеся через почву гельминты: математические модели передачи, влияние массового введения лекарств и критерии исключения передачи. Adv Parasitol (2016) 94:133–98. doi: 10.1016/bs.apar.2016.08.002
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
15. Coffeng LE, Truscott JE, Farrell SH, Turner HC, Sarkar R, Kang G, et al. Сравнение и проверка двух математических моделей воздействия массового введения лекарств на аскариды и анкилостомоз. Эпидемии (2017) 18:38–47. doi: 10.1016/j.epidem.2017.02.001
Эпидемии (2017) 18:38–47. doi: 10.1016/j.epidem.2017.02.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Пуллан Р.Л., Холлидей К.Е., Освальд В.Е., Мчаро С., Бомонт Э., Кефа С. и другие. Воздействие, справедливость и стоимость стратегий лечения гельминтов, передаваемых через почву, в школах и на уровне общины в Кении: кластерное рандомизированное контролируемое исследование. Ланцет (2019) 393 (10185): 2039–50. doi: 10.1016/S0140-6736(18)32591-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Андерсон Р., Фаррелл С., Тернер Х., Уолсон Дж., Доннелли К.А., Траскотт Дж. Оценка прерывания передачи гельминтов человека только массовым введением лекарств: оптимизация дизайна кластерных рандомизированных испытаний. Parasites Vectors (2017) 10(1):93. doi: 10.1186/s13071-017-1979-x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
18. Матаморос Г., Руэда М. М., Родригес С., Габрие Х.А., Каналес М., Фонтеча Г. и др. Высокая эндемичность гельминтов, передающихся через почву, в популяции, часто подвергающейся воздействию альбендазола, но отсутствие признаков устойчивости к противопаразитарным средствам. Trop Med Infect Dis (2019) 4(2):2. doi: 10.3390/tropicalmed4020073
М., Родригес С., Габрие Х.А., Каналес М., Фонтеча Г. и др. Высокая эндемичность гельминтов, передающихся через почву, в популяции, часто подвергающейся воздействию альбендазола, но отсутствие признаков устойчивости к противопаразитарным средствам. Trop Med Infect Dis (2019) 4(2):2. doi: 10.3390/tropicalmed4020073
CrossRef Полный текст | Google Scholar
19. Moser W, Schindler C, Keizer J. Эффективность рекомендуемых препаратов против гельминтов, передающихся через почву: систематический обзор и сетевой метаанализ. BMJ (2017) 358:j4307. doi: 10.1136/bmj.j4307
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
20. Vlaminck J, Cools P, Albonico M, Ame S, Ayana M, Cringoli G, et al. Терапевтическая эффективность альбендазола в отношении почвенных гельминтозов у детей измерялась пятью методами диагностики. PloS Negl Trop Dis (2019) 13(8):e0007471. doi: 10.1371/journal.pntd.0007471
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Walker M, Cools P, Albonico M, Ame SM, Ayana M, Dana D, et al. Индивидуальные реакции на однократную пероральную дозу альбендазола указывают на снижение эффективности против гельминтов, передающихся через почву, в районах с высоким уровнем лекарственного воздействия. PloS Negl Trop Dis (2021) 15(10):e0009888. doi: 10.1371/journal.pntd.0009888
Walker M, Cools P, Albonico M, Ame SM, Ayana M, Dana D, et al. Индивидуальные реакции на однократную пероральную дозу альбендазола указывают на снижение эффективности против гельминтов, передающихся через почву, в районах с высоким уровнем лекарственного воздействия. PloS Negl Trop Dis (2021) 15(10):e0009888. doi: 10.1371/journal.pntd.0009888
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Schulz JD, Moser W, Hürlimann E, Keizer J. Профилактическая химиотерапия в борьбе с геогельминтозами: достижения и ограничения. Trends Parasitol (2018) 34(7):590–602. doi: 10.1016/j.pt.2018.04.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Мозер В., Шиндлер С., Кейзер Дж. Комбинации препаратов против передающихся через почву гельминтозов. Adv Parasitol (2019) 103:91–115. doi: 10.1016/bs.apar.2018.08.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Авраменко Р.В., Редман Э.М., Виндейер С., Гиллеард Дж.С. Оценка риска устойчивости к антигельминтным средствам в постгеномную эпоху: экспериментальное исследование, оценивающее потенциал широко распространенных устойчивых к бензимидазолу желудочно-кишечных нематод у североамериканского крупного рогатого скота и бизонов. Паразитология (2020) 147(8):897–906. дои: 10.1017/S0031182020000426
Авраменко Р.В., Редман Э.М., Виндейер С., Гиллеард Дж.С. Оценка риска устойчивости к антигельминтным средствам в постгеномную эпоху: экспериментальное исследование, оценивающее потенциал широко распространенных устойчивых к бензимидазолу желудочно-кишечных нематод у североамериканского крупного рогатого скота и бизонов. Паразитология (2020) 147(8):897–906. дои: 10.1017/S0031182020000426
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
25. Rashwan N, Bourguinat C, Keller K, Gunawardena NK, Silva N, Prichard R. Изотермические диагностические анализы для мониторинга однонуклеотидных полиморфизмов у necator americanus, связанных с лекарственной устойчивостью к бензимидазолу. PloS Negl Trop Dis (2016) 10(12):e0005113. doi: 10.1371/journal.pntd.0005113
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Roose S, Avramenko RW, Pollo SMJ, Wasmuth JD, Ame S, Ayana M, et al. Характеристика семейства генов β-тубулина у ascaris lumbricoides и ascaris suum и его значение для молекулярного обнаружения устойчивости к бензимидазолу. PloS Negl Trop Dis (2021) 15(9):e0009777. doi: 10.1371/journal.pntd.0009777
PloS Negl Trop Dis (2021) 15(9):e0009777. doi: 10.1371/journal.pntd.0009777
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
27. Diawara A, Halpenny CM, Churcher TS, Mwandaviro C, Kihara J, Kaplan RM, et al. Связь между реакцией на лечение альбендазолом и частотой генотипа β-тубулина у гельминтов, передающихся через почву. PloS Negl Trop Dis (2013) 7(5):e2247. doi: 10.1371/journal.pntd.0002247
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
28. Orr AR, Quagraine JE, Suwondo P, George S, Harrison LM, Dornas FP, et al. Генетические маркеры устойчивости к бензимидазолу среди анкилостомы человека (Necator americanus) в северном муниципалитете Кинтампо, Гана. Am J Trop Med Hyg (2019) 100(2):351–6. doi: 10.4269/ajtmh.18-0727
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
29. Хименес Кастро П.Д., Хауэлл С.Б., Шефер Дж.Дж., Авраменко Р.В., Гиллеард Дж.С. , Каплан Р.М. Множественная лекарственная устойчивость анкилостомы собачьей ancylostoma caninum: новая угроза? Parasit Vectors (2019) 12(1):576. doi: 10.1186/s13071-019-3828-6
, Каплан Р.М. Множественная лекарственная устойчивость анкилостомы собачьей ancylostoma caninum: новая угроза? Parasit Vectors (2019) 12(1):576. doi: 10.1186/s13071-019-3828-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
30. Furtado LFV, Bello ACP de P, dos Santos HA, Carvalho MRS, Rabelo ÉML. Первая идентификация SNP F200Y в гене β-тубулина связана с устойчивостью к бензимидазолу у анкилостомы собачьей. Vet Parasitol (2014) 206(3–4):313–6. doi: 10.1016/j.vetpar.2014.10.021
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
31. Диавара А., Дрейк Л.Дж., Сусвилло Р.Р., Кихара Дж., Банди Д.А.П., Скотт М.Е. и др. Анализы для выявления полиморфизма кодона 200 бета-тубулина у Trichuris trichiura и ascaris lumbricoides. PloS Negl Trop Dis (2009) 3(3):e397. doi: 10.1371/journal.pntd.0000397
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
32. Альбонико М., Райт В. , Бикл К. Молекулярный анализ гена бета-тубулина анкилостомы человека как основа возможной устойчивости к бензимидазолу на острове Пемба. Mol Biochem Parasitol (2004) 134(2):281–4. doi: 10.1016/j.molbiopara.2003.12.008
, Бикл К. Молекулярный анализ гена бета-тубулина анкилостомы человека как основа возможной устойчивости к бензимидазолу на острове Пемба. Mol Biochem Parasitol (2004) 134(2):281–4. doi: 10.1016/j.molbiopara.2003.12.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
33. Schwenkenbecher JM, Albonico M, Bickle Q, Kaplan RM. Характеристика генов бета-тубулина у анкилостомы и исследование мутаций, связанных с устойчивостью, с использованием ПЦР в реальном времени. Mol Biochem Parasitol (2007) 156(2):167–74. doi: 10.1016/j.molbiopara.2007.07.019
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
34. Диавара А., Швенкенбехер Дж.М., Каплан Р.М., Причард Р.К. Молекулярные и биологические диагностические тесты для мониторинга резистентности к бензимидазолу у гельминтов, передающихся человеку через почву. Am J Trop Med Hyg (2013) 88(6):1052–61. doi: 10.4269/ajtmh.12-0484
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
35. Zuccherato LW, Furtado LF, Medeiros C da S, Pinheiro C da S, Rabelo ÉM. ПЦР-ПДРФ-скрининг полиморфизмов, связанных с устойчивостью к бензимидазолу у necator americanus и ascaris lumbricoides из разных географических регионов Бразилии. PloS Negl Trop Dis (2018) 12(9):e0006766. doi: 10.1371/journal.pntd.0006766
Zuccherato LW, Furtado LF, Medeiros C da S, Pinheiro C da S, Rabelo ÉM. ПЦР-ПДРФ-скрининг полиморфизмов, связанных с устойчивостью к бензимидазолу у necator americanus и ascaris lumbricoides из разных географических регионов Бразилии. PloS Negl Trop Dis (2018) 12(9):e0006766. doi: 10.1371/journal.pntd.0006766
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
36. Furtado LFV, Dos Santos TR, de Oliveira VNGM, Rabelo ÉML. Генотипический профиль устойчивости к бензимидазолу, связанный с SNP F167Y в гене бета-тубулина гельминтов necator americanus, полученных из бразильских популяций. Infect Genet Evol (2020) 86:104594. doi: 10.1016/j.meegid.2020.104594
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
37. Gandasegui J, Grau-Pujol B, Cambra-Pelleja M, Escola V, Demontis MA, Cossa A, et al. Улучшение обработки образцов стула и пиросеквенирования для количественного определения аллелей устойчивости к бензимидазолу в объединенных яйцах Trichuris trichiura и necator americanus.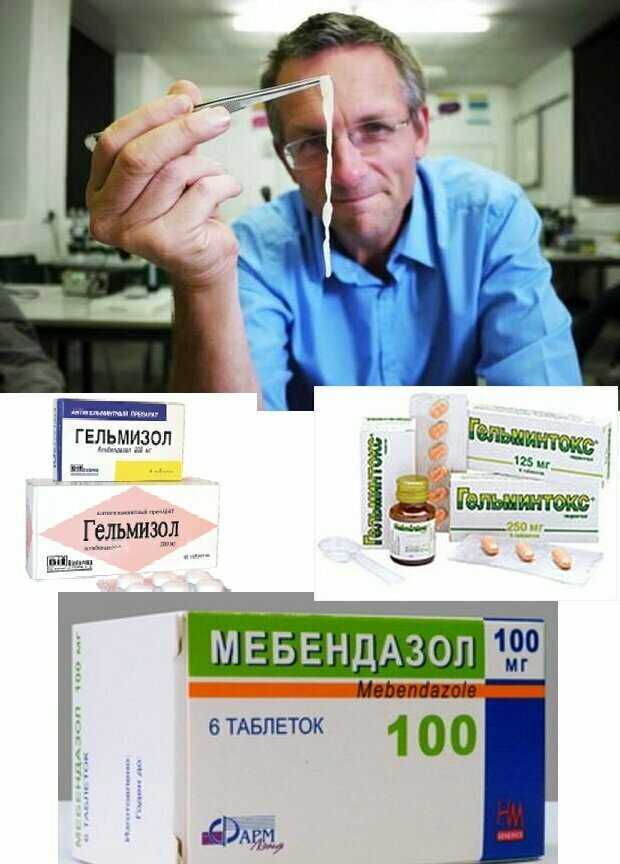 Parasit Vectors (2021) 14(1):490. doi: 10.1186/s13071-021-04941-w
Parasit Vectors (2021) 14(1):490. doi: 10.1186/s13071-021-04941-w
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
38. Hansen TVA, Thamsborg SM, Olsen A, Prichard RK, Nejsum P. Генетические вариации в гене бета-тубулина и внутренней транскрибируемой области спейсера 2 видов Trichuris от человека и бабуинов. Parasit Vectors (2013) 6:236. doi: 10.1186/1756-3305-6-236
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
39. Krücken J, Fraundorfer K, Mugisha JC, Ramünke S, Sifft KC, Geus D, et al. Снижение эффективности альбендазола против аскарид люмбрикоидов у руандийских школьников. Int J Parasitol Drugs Drug Resist (2017) 7(3):262–71. doi: 10.1016/j.ijpddr.2017.06.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
40. Furtado LFV, Medeiros C da S, Zuccherato LW, Alves WP, de Oliveira VNGM, da Silva VJ, et al. Первая идентификация SNP F200Y, связанного с устойчивостью к бензимидазолу, в гене бета-тубулина у Ascaris lumbricoides.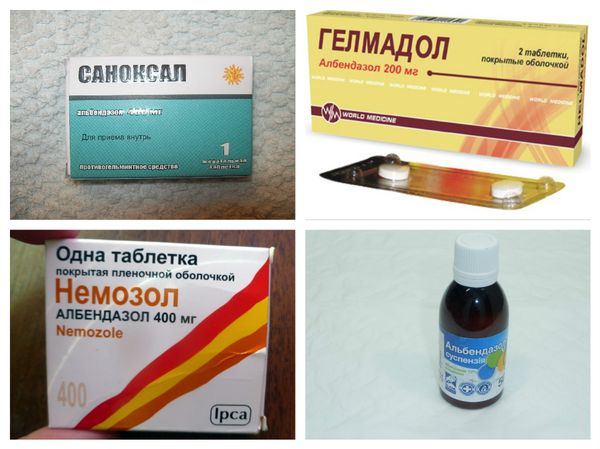 PloS One (2019) 14(10):e0224108. doi: 10.1371/journal.pone.0224108
PloS One (2019) 14(10):e0224108. doi: 10.1371/journal.pone.0224108
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
41. Альбонико М., Энгельс Д., Савиоли Л. Мониторинг эффективности лекарств и раннее выявление лекарственной устойчивости нематод, передающихся через почву человека: насущная повестка общественного здравоохранения по борьбе с гельминтами. Int J Parasitol (2004) 34(11):1205–10. doi: 10.1016/j.ijpara.2004.08.001
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
42. Geerts S, Gryseels B. Лекарственная устойчивость гельминтов человека: текущая ситуация и уроки домашнего скота. Clin Microbiol Rev (2000) 13(2):207–22. doi: 10.1128/CMR.13.2.207
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
43. Kotze AC, Gilleard JS, Doyle SR, Prichard RK. Проблемы и возможности для внедрения молекулярной диагностики устойчивости к антигельминтам. Int J Parasitol Drugs Drug Resist (2020) 14:264–73. doi: 10.1016/j.ijpddr.2020.11.005
doi: 10.1016/j.ijpddr.2020.11.005
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
44. Дойл С.Р., Коттон Дж.А. Полногеномные подходы к изучению устойчивости к глистам. Trends Parasitol (2019) 35(4):289–301. doi: 10.1016/j.pt.2019.01.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
45. Мелвилл Л.А., Редман Э., Моррисон А.А., Ребекка Чен П.С., Авраменко Р., Митчелл С. и соавт. Крупномасштабный скрининг мутаций устойчивости к бензимидазолу у nematodirus battus с использованием как пиросеквенного генотипирования, так и глубокого секвенирования ампликонов указывает на раннее появление устойчивости на овцеводческих фермах Великобритании. Int J Parasitol Drugs Drug Resist (2020) 12:68–76. doi: 10.1016/j.ijpddr.2020.03.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
46. Keizer J, Utzinger J. Лечение гельминтов, передающихся через почву, в масштабах всего сообщества эффективно с точки зрения справедливости. Ланцет (2019) 393(10185). doi: 10.1016/S0140-6736(18)32981-7
Ланцет (2019) 393(10185). doi: 10.1016/S0140-6736(18)32981-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
47. Беме К., Кармона С., Ногаро С., Малесела М. Диагностическое тестирование является ключом к устранению ДНТ. PloS Negl Trop Dis (2021) 15(8):e0009626. doi: 10.1371/journal.pntd.0009626
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
48. Истон А., Гао С., Лоутон С.П., Беннуру С., Хан А., Дальстром Э. и др. Молекулярные доказательства гибридизации аскарид свиньи и человека указывают на то, что люди заражаются комплексом межпородных видов. Элайф (2020) 9:e61562. doi: 10.7554/eLife.61562.sa2
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Препараты для лечения гельминтозов: антигельминтные средства
Токсичность авермектинов
Важно не назначать авермектины одновременно с препаратами, которые могут усилить проникновение авермектина через гематоэнцефалический барьер, такими как кетоконазол, итраконазол, циклоспорин и блокаторы кальциевых каналов . 27 Информация о токсичности селамектина подробно рассматривается ниже, в разделе, посвященном селамектину. Согласно популярному ветеринарному фармацевтическому клиническому тексту, признаками токсичности ивермектина у собак в порядке частоты являются атаксия, слепота, мидриаз, тремор и рвота. 28 Другие признаки включают обезвоживание, депрессию, диарею, гипертермию, брадикардию, синусовую аритмию, кому, судороги и смерть. 26, 29, 30 Недавнее ретроспективное исследование случаев отравления ивермектином, проведенное в токсикологическом центре, выявило клинические признаки в следующем порядке частоты: атаксия, вялость, тремор, мидриаз и слепота. 30a
27 Информация о токсичности селамектина подробно рассматривается ниже, в разделе, посвященном селамектину. Согласно популярному ветеринарному фармацевтическому клиническому тексту, признаками токсичности ивермектина у собак в порядке частоты являются атаксия, слепота, мидриаз, тремор и рвота. 28 Другие признаки включают обезвоживание, депрессию, диарею, гипертермию, брадикардию, синусовую аритмию, кому, судороги и смерть. 26, 29, 30 Недавнее ретроспективное исследование случаев отравления ивермектином, проведенное в токсикологическом центре, выявило клинические признаки в следующем порядке частоты: атаксия, вялость, тремор, мидриаз и слепота. 30a
Кажущаяся ЛД 50 для биглей составляет 80 мг/кг. 26 Первичным клинико-патологическим признаком у собак является снижение уровня сывороточного железа. 22 Общая ссылка, используемая клиническими ветеринарами, гласит, что смерть может наступить при дозах выше 40 мг/кг, тремор — при 5 мг/кг и мидриаз — при 2,5 мг/кг, и что признаки токсичности редко возникают при дозах ниже 1 мг/кг. кг. 28 Но недавнее ретроспективное исследование токсикологического центра показало, что клинические признаки могут развиваться в диапазоне от 0,2 до 2,5 мг/кг. 30a При дозах ниже 1 мг/кг были отмечены самые разнообразные признаки, включая более тяжелые признаки, такие как кома и судороги. Фактически, смерть была отмечена у собак, которые получали дозы ивермектина от 1 до 2,5 мг/кг.
кг. 28 Но недавнее ретроспективное исследование токсикологического центра показало, что клинические признаки могут развиваться в диапазоне от 0,2 до 2,5 мг/кг. 30a При дозах ниже 1 мг/кг были отмечены самые разнообразные признаки, включая более тяжелые признаки, такие как кома и судороги. Фактически, смерть была отмечена у собак, которые получали дозы ивермектина от 1 до 2,5 мг/кг.
Обычный анамнез: собака находилась в непосредственной близости от лошадей во время дегельминтизации, а позже у нее появились признаки заболевания. У собак, у которых клинические признаки развиваются в течение 4-6 часов после приема ивермектина, обычно развиваются тяжелые клинические признаки, тогда как у собак, у которых признаки развиваются через 10-12 часов после воздействия, клинические признаки, как правило, намного слабее. 29 У собак с интоксикацией ивермектином нередко возникают судороги. Когда судороги тяжелые и неконтролируемые в течение значительного периода времени, может возникнуть гемолитическая анемия и повреждение мышц. Некоторые тяжелые случаи сопровождаются судорогами и миозом, что гарантирует неблагоприятный прогноз. Возможно, что тяжелые судороги и миоз при поступлении могут быть связаны с тяжелым поражением головного мозга. 31
Некоторые тяжелые случаи сопровождаются судорогами и миозом, что гарантирует неблагоприятный прогноз. Возможно, что тяжелые судороги и миоз при поступлении могут быть связаны с тяжелым поражением головного мозга. 31
Клиническими признаками отравления ивермектином у кошек в порядке убывания частоты являются атаксия, мидриаз, тремор, гиперестезия и гипотермия. 28 Вероятность отравления ивермектином у собак примерно в 10 раз выше, чем у кошек. 28
Некоторые колли необычайно чувствительны к токсическому действию ивермектина, хотя он безопасен для всех пород в утвержденной дозе 0,006 мг/кг (6 мкг/кг). Ранние исследования показали, что у некоторых генетических линий колли развивались тяжелые побочные реакции при приеме ивермектина в дозе от 100 до 200 мкг/кг (в 16-32 раза выше рекомендуемой дозы), что вызывало мидриаз, атаксию, тремор, слюнотечение, парез, лежачее положение. возбудимость, сопор и кома. В то время также сообщалось, что австралийские овчарки, бордер-колли, шетландские овчарки и староанглийские овчарки чувствительны к ивермектину. Сообщается, что смертельная доза для некоторых колли составляет 1/2009.0382-й -й у биглей. 32
Сообщается, что смертельная доза для некоторых колли составляет 1/2009.0382-й -й у биглей. 32
После того, как было обнаружено, что колли более чувствительны к лоперамиду, 33 был идентифицирован собачий ген множественной лекарственной устойчивости (MDR1), мутировавший у чувствительных к ивермектину колли. 34 MDR1 кодирует гликопротеин, который является неотъемлемой частью гематоэнцефалического барьера. Существует много превосходных источников информации о мутации гена MDR1 и механизмах токсичности ивермектина, связанной с повышенной активностью ГАМК. 29, 30, 35 Мутантный аллель MDR1 был обнаружен у 35% из 40 протестированных в одном исследовании колли, что составляет примерно такой же процент колли, чувствительных к ивермектину. 36 Исследование ДНК 4000 чистокровных собак показало, что мутация MDR1 присутствовала у семи пород линии колли и двух пород борзых, хотя мутация не была обнаружена у всех пород, о которых известно, что они чувствительны к ивермектину. 37
37
Было обнаружено, что потенциальную чувствительность к ивермектину можно оценить с помощью генотипического тестирования или тестирования на основе полимеразной цепной реакции (ПЦР) на наличие мутации MDR1. 38 В этом исследовании мутантный аллель MDR1 был обнаружен у австралийских овчарок, миниатюрных австралийских овчарок, английских овчарок, немецких овчарок (белых), длинношерстных уиппетов, овчарок Макнаб, староанглийских овчарок, шетландских овчарок, шелковых виндхаундов и длинношерстных уиппетов. 23, 37 Чувствительность к ивермектину также отмечена у австралийских пастушьих собак, бородатых колли и бордер-колли, но мутантный аллель MDR1 у этих пород не обнаружен. 37 Совсем недавно связь с P-гликопротеином, продуктом гена ABCB1 (ранее MDR1), была тщательно изучена путем поиска аллеля ABCB1-1Δ в исследовании ДНК 5368 собак. 39 Аллель ABCB1-1Δ был обнаружен у колли, длинношерстных уиппетов, стандартных и миниатюрных австралийских овчарок, шетландских овчарок, староанглийских овчарок, бордер-колли, шелковых виндхаундов и немецких овчарок.
Дело в том, что до тех пор, пока конкретная собака не будет проверена, ее восприимчивость к токсичности ивермектина неизвестна. Университет штата Вашингтон, Колледж ветеринарной медицины, Лаборатория ветеринарной клинической фармакологии, проводит генетическое тестирование для определения наличия мутантного гена MDR1. Таблица 13-2 была адаптирована из информации, доступной на веб-сайте вышеупомянутого учреждения. 40 Врач общей практики также может использовать эту таблицу, когда ему представляют собаку, которая подвергалась известному воздействию ивермектина, для определения прогноза и соответствующего уровня лечения. Как отмечалось ранее, при сборе анамнеза в случаях воздействия ивермектина и моксидектина обычно обнаруживается, что собака присутствовала, когда владелец дегельминтизировал лошадь. Лошади нередко выплевывают небольшое количество средства от глистов, которое собака проглатывает. Если количество проглоченного животного можно определить количественно, то эта таблица может помочь ветеринару оценить прогноз и определить, насколько агрессивным будет лечение. Очевидно, что риск тяжелой токсичности у колли гораздо выше, чем у другой породы.
Очевидно, что риск тяжелой токсичности у колли гораздо выше, чем у другой породы.
Таблица 13-2 Породы, затронутые мутацией MDR-1
(Данные Вашингтонского государственного университета, Колледж ветеринарной медицины, Лаборатория ветеринарной клинической фармакологии (2010 г.). Пораженные породы Получены 26 января 2010 г. с сайта www.vetmed. wsu.edu/depts-VCPL/breeds.aspx.)
Еще одна презентация, на которую стоит обратить внимание, это собаки с привычкой есть лошадиные фекалии. Собаки, не чувствительные к ивермектину, вероятно, не подвержены риску, но чувствительная к ивермектину собака, которая ест фекалии лошади, которую лечили ивермектином в течение последних нескольких дней, может иметь серьезную, даже фатальную реакцию. Ивермектин достигает максимальной концентрации в фекалиях через 2–3 дня после лечения лошади. 41 Через 4 дня после лечения 90% препарата выводится с калом. Владельцы собак-копрофагов, чувствительных к ивермектину, должны обращаться с фекалиями лошадей, получавших ивермектин, как с токсичными отходами и утилизировать их таким образом, чтобы собака не съела их.
Что касается лечения токсичности ивермектина, хотя есть некоторые доказательства того, что внутривенное введение физостигмина может быть полезным для собак 42 , а неостигмин может помочь в лечении кошек 43 , страдающих от тяжелой интоксикации ивермектином, побочные эффекты, связанные с этим лечением, обычно перевешивают пользу, поэтому большинство ветеринаров проводят поддерживающую и симптоматическую помощь. 26 Необходимо вызвать рвоту, дать активированный уголь, обеспечить инфузионную терапию, обеспечить парентеральное питание и поддерживать респираторную поддержку и нормальную температуру тела. Эта поддерживающая терапия может потребоваться в течение длительного периода времени, поскольку период полувыведения ивермектина составляет 2 дня, а период полувыведения моксидектина — 19 дней.дней. 30
Противоядия от токсичности ивермектина и моксидектина не существует, но ветеринарам следует рассмотреть возможность восстановления липидов, многообещающую терапию, адаптированную из медицины человека. Доктор Гай Вайнберг первоначально описал использование внутривенной липидной эмульсии (Интралипид) для лечения токсичности местных анестетиков (бупивакаин) у людей. Он ввел термин «спасение липидов». Одним из исследований в поддержку использования человеком спасательных липидов был эксперимент на собаках, которые получили передозировку бупивакаина и были спасены от определенной токсичности с помощью внутривенной липидной эмульсии. 44 Д-р Вайнберг создал некоммерческий веб-сайт (www.lidrescue.com) для распространения информации и стимулирования обсуждения случаев заболевания. С тех пор восстановление липидов использовалось для лечения небупивакаиновой токсичности у других видов. Хотя поддержка, безусловно, анекдотична, в 2008 году ветеринарный онлайн-участник веб-сайта по спасению липидов описал собаку, получившую передозировку ивермектина, у которой были клинические признаки токсичности и которая хорошо выздоровела после введения активированного угля, поддерживающей терапии и внутривенной липидной эмульсии.
Доктор Гай Вайнберг первоначально описал использование внутривенной липидной эмульсии (Интралипид) для лечения токсичности местных анестетиков (бупивакаин) у людей. Он ввел термин «спасение липидов». Одним из исследований в поддержку использования человеком спасательных липидов был эксперимент на собаках, которые получили передозировку бупивакаина и были спасены от определенной токсичности с помощью внутривенной липидной эмульсии. 44 Д-р Вайнберг создал некоммерческий веб-сайт (www.lidrescue.com) для распространения информации и стимулирования обсуждения случаев заболевания. С тех пор восстановление липидов использовалось для лечения небупивакаиновой токсичности у других видов. Хотя поддержка, безусловно, анекдотична, в 2008 году ветеринарный онлайн-участник веб-сайта по спасению липидов описал собаку, получившую передозировку ивермектина, у которой были клинические признаки токсичности и которая хорошо выздоровела после введения активированного угля, поддерживающей терапии и внутривенной липидной эмульсии.