Препараты и лекарства с действующим веществом Железа [III] гидроксид полимальтозат
{{if type === ‘partner-stocks’}}
{{/if}}
{{/if}} {{each list}}${this} {{if isGorzdrav}}
Удалить
{{/if}}
{{/each}} {{/if}} Поиск по лекарствам, болезням, веществу: ДЕРМАКОСМЕТИКА, Ньюрексан, Durex, От боли, ВольтаренДействующие вещества
Железа [III] гидроксид полимальтозат
Препараты для повышения гемоглобина у пожилых людей 4
Витамины с железом 3
Ампулы 1
Капли 1
Сироп 2
Таблетки жевательные 3
Мальтофер 2
Феррум 4
мальтофер в каплях 1
Сандоз 4
Такеда Фармасьютикалс 3
Словения 4
Швейцария 3
Отпуск по рецепту 7
Назад
Доступность товаров
Доступность товаров
Категории
Категории
Форма выпуска
Форма выпуска
Производители
Производители
Страна-производитель
Страна-производитель
Отпуск по рецепту
Отпуск по рецепту
Забрать сегодня 7
Препараты для повышения гемоглобина у пожилых людей 4
Витамины с железом 3
Ампулы 1
Капли 1
Сироп 2
Таблетки жевательные 3
Мальтофер 2
Феррум 4
мальтофер в каплях 1
Сандоз 4
Такеда Фармасьютикалс 3
Швейцария 3
Отпуск по рецепту 7
Сортировать:
по популярности по названию по увеличению цены по уменьшению ценыпо популярности
+3 бонуса
Феррум Лек Таблетки жевательные 100 мг 30 шт
Производитель: Сандоз
Страна производитель: Словения
Действующее вещество (МНН): Железа [III] гидроксид полимальтозат
Цена: 326 ₽
+5 бонусов
Мальтофер Таблетки жевательные 100 мг 30 шт
Производитель: Такеда Фармасьютикалс
Страна производитель: Швейцария
Действующее вещество (МНН): Железа [III] гидроксид полимальтозат
Цена: 540 ₽
+5 бонусов
Мальтофер Капли для приема внутрь 30 мл
Производитель: Такеда Фармасьютикалс
Страна производитель: Швейцария
Действующее вещество (МНН): Железа [III] гидроксид полимальтозат
Цена: 483 ₽
+2 бонуса
Феррум Лек сироп 50мг/5мл 100мл
Производитель: Сандоз
Страна производитель: Словения
Действующее вещество (МНН): Железа [III] гидроксид полимальтозат
Цена: 161 ₽
+3 бонуса
Мальтофер Сироп 10 мг/мл 150 мл
Производитель: Такеда Фармасьютикалс
Страна производитель: Швейцария
Действующее вещество (МНН): Железа [III] гидроксид полимальтозат
Цена: 327 ₽
+5 бонусов
Феррум Лек Таблетки жевательные 100 мг 50 шт
Производитель: Сандоз
Страна производитель: Словения
Действующее вещество (МНН): Железа [III] гидроксид полимальтозат
Цена: 543 ₽
+100 бонусов
Феррум Лек Раствор для внутримышечного введения 2 мл 50 шт
Производитель: Сандоз
Страна производитель: Словения
Действующее вещество (МНН): Железа [III] гидроксид полимальтозат
Цена: 10 013 ₽
Новое поколение препаратов железа – бисглицинат (хелат) железа — Lamyra
Распространенность анемии
Значимость анемии как проблемы современного мира не вызывает сомнений. Несмотря на все достижения цивилизации, дефицит железа является основным и наиболее распространенным нарушением питания в мире. Дефицит железа, от которого страдают многие дети и женщины в развивающихся странах, является единственным видом недостаточности питательных веществ, который также в значительных масштабах распространен в экономически развитых странах. Уровни его распространенности поражают: 2 миллиарда человек, то есть более 30% населения мира, страдают от анемии.
Несмотря на все достижения цивилизации, дефицит железа является основным и наиболее распространенным нарушением питания в мире. Дефицит железа, от которого страдают многие дети и женщины в развивающихся странах, является единственным видом недостаточности питательных веществ, который также в значительных масштабах распространен в экономически развитых странах. Уровни его распространенности поражают: 2 миллиарда человек, то есть более 30% населения мира, страдают от анемии.
По данным Всемирной организации здравоохранения наиболее уязвимыми группами по развитию анемии являются беременные женщины, женщины репродуктивного возраста, дети и пожилые люди. При чем, самый высокий процент встречаемости — это среди женщин репродуктивного возраста — 30%.
Среди анемий ведущими являются железодефицитные, составляя в структуре у женщин до 90% и среди мужчин — до 80%. Важным является высокая распространенность среди населения латентного дефицита железа, которая колеблется от 19,5% до 30%, кроме того, от 50% до 86% женщин имеют факторы риска развития анемии.
Железодефицитная анемия (ЖДА) — заболевание системы крови, обусловленное дефицитом железа в организме, сопровождаетcя изменениями параметров его метаболизма, уменьшением концентрации гемоглобина в эритроцитах, количественными и качественными их изменениями и клинически выражается анемической гипоксией и сидеропенией.
Сидеропения и развивающаяся в последующем тканевая и гемическая гипоксия приводят к расстройствам сердечно-сосудистой (миокардиодистрофия и нарушение кровообращения различной степени), нервной системы (вегетативно-сосудистые, вестибулярные нарушения, астенический синдром), снижению детородной функции женщин, а также развитие осложнений во время беременности и родов, изменению интеллекта и поведенческих настроений, хронизацию различных заболеваний и как следствие снижение работоспособности и ухудшение качества жизни.4
Эволюция синтетических лекарственных средств терапии железодефицитной анемии
Фармакотерапия ЖДА базируется на введение в организм железа из состава железосодержащих лекарственных средств.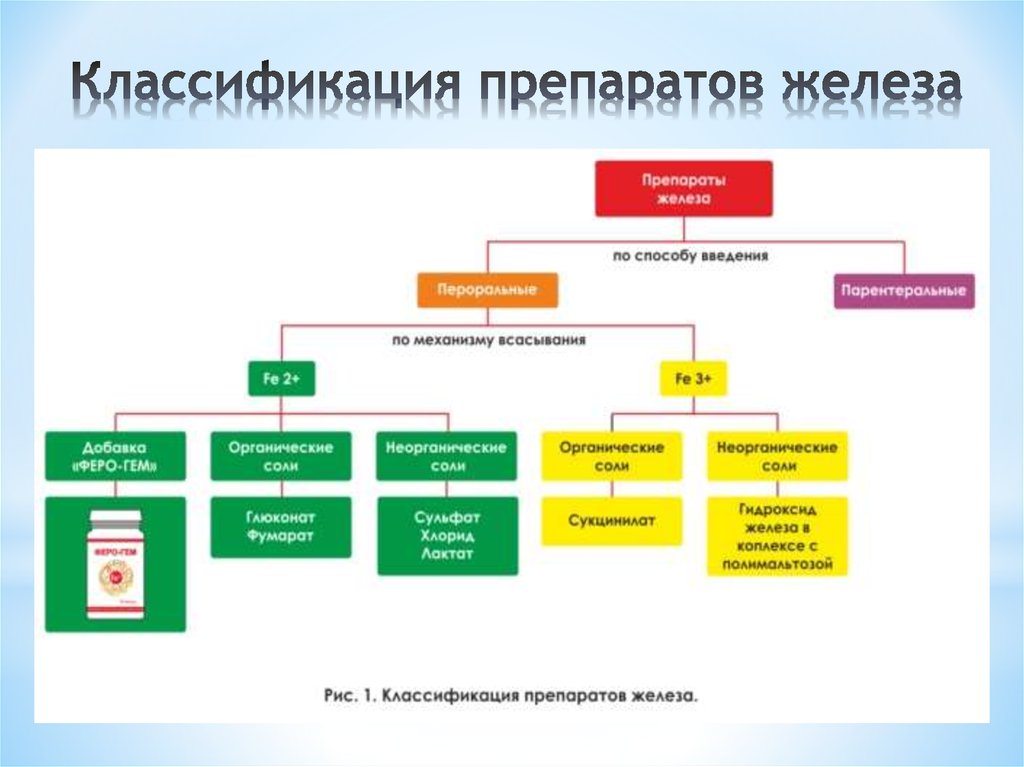 Выбору препарата для коррекции сидеропении придается особое значение, так как важна не только эффективность, но и отсутствие побочных реакций и осложнений при их применении.
Выбору препарата для коррекции сидеропении придается особое значение, так как важна не только эффективность, но и отсутствие побочных реакций и осложнений при их применении.
Существует условное деление препаратов железа на двух- и трёхвалентные. Однако, сама по себе валентность железа не представляет какой-либо ценности.
Известно, что всасывание железа в кишечнике возможно лишь тогда, когда микроэлемент находится в двухвалентной форме, которая способна проходить через клеточную мембрану слизистой оболочки кишечника. Низкое значение рН желудочного содержимого способствует растворению алиментарного железа и переходу трехвалентного железа (окисное) в двухвалентную форму (закисное).17
При поступлении желудочного содержимого в кишечник рН пищевого комка повышается и в отличие от ферро-иона (Fe2+), ферри-ион (Fe3+) образует нерастворимые соли. В этих условиях только муцин, хелатируя железо, способен поддержать ферри-ион в растворимом состоянии. 4
4
Таким образом, соединения железа в составе препаратов должны обладать хорошей растворимостью, высокой биодоступностью, достаточным содержанием элементарного железа и малой токсичностью. Рассмотрим особенности абсорбции каждой из трёх известных групп препаратов железа.
Первое поколение препаратов железа
Одной из первых групп препаратов железа стали применять ионные соли двухвалентного железа. Эта группа характеризуется довольно быстрым наступлением эффекта в плане повышения гемоглобина и улучшения гемодинамических показателей в периферической крови.
Тем не менее, лечение ионными препаратами железа, в частности сульфатом железа, вызывает побочные реакции у 44,7% пациентов. Чаще всего страдает желудочно-кишечный тракт (ЖКТ). Симптомы дисфункции его верхних отделов обычно проявляются в течение часа после приема лекарства и могут протекать как в легкой (тошнота, дискомфорт в эпигастрии), так и в тяжелой форме — с болью в животе и/ или рвотой. Кроме того, ферротерапия солевыми препаратами железа нередко сопровождается появлением металлического привкуса в течение первых дней лечения, потемнением зубной эмали и десен, возможны также диарея или запор. хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию в том числе и железа. В связи с этим, их рекомендуют назначать за 1 час до приема пищи, однако это усиливает повреждающее действие соединений Fe2+ на слизистую кишечника, вплоть до развития ее некроза.5
Кроме того, ферротерапия солевыми препаратами железа нередко сопровождается появлением металлического привкуса в течение первых дней лечения, потемнением зубной эмали и десен, возможны также диарея или запор. хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию в том числе и железа. В связи с этим, их рекомендуют назначать за 1 час до приема пищи, однако это усиливает повреждающее действие соединений Fe2+ на слизистую кишечника, вплоть до развития ее некроза.5
Причиной возникновения данных побочных явлений является гидролиз солей железа в желудке. Под действием желудочного сока ионные соли железа подвергаются гидролизу(диссоциации) в желудке, в результате чего свободные молекулы железа негативно воздействуют на слизистую оболочку ЖКТ и провоцируют возникновение побочных эффектов: тошнота, боль в животе, металлический привкус во рту, диарея/запор.
Второе поколение препаратов железа
Абсорбция железа в виде гидроксид-полимальтозного комплекса (ГПК) железа-III имеет принципиально иную схему по сравнению с его ионными соединениями и осуществляется путем активного всасывания при конкурентном обмене лигандами, уровень которых определяет скорость абсорбции железа Fe3+./70-1-1.jpg) Неионная структура, обеспечивающая стабильность комплекса и перенос железа с помощью транспортного белка, предотвращает в организме свободную диффузию ионов железа, то есть прооксидантные реакции. Однако биодоступность полимальтозного комплекса железа-III самая низкая среди всех препаратов железа, всего 10–15%.
Неионная структура, обеспечивающая стабильность комплекса и перенос железа с помощью транспортного белка, предотвращает в организме свободную диффузию ионов железа, то есть прооксидантные реакции. Однако биодоступность полимальтозного комплекса железа-III самая низкая среди всех препаратов железа, всего 10–15%.
В связи с большим размером молекулы (55 kDa), ее пассивная диффузия примерно в 40 раз медленнее, чем у ионов железа.6 Такую низкую биодоступность приходится компенсировать большими суточными дозами ГПК.
Новое поколение препаратов железа — новое решение проблемы анемии
С конца 90-х начала 2000-х годов начали активно внедрять применение хелатных комплексов железа для терапии дефицита железа и анемии у людей. Хотя данная группа препаратов появилась гораздо раньше, и использовалась изначально в качестве пищевых добавок и в ветеринарии.
В 1893 году Альфред Вернер выдвинул постулат о новой молекулярной структуре, характеризующей эти стабильные молекулы.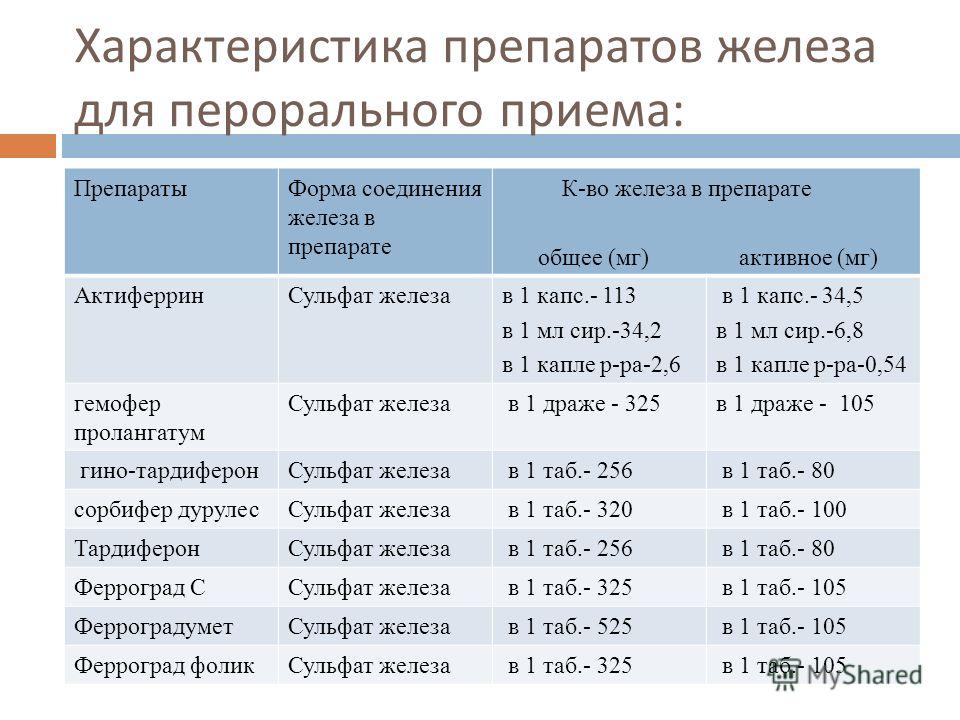 Спустя несколько лет, в 1920 году Морган и Дрю применили термин «хелат» к молекулярной структуре, постулированной Вернером. 7
Спустя несколько лет, в 1920 году Морган и Дрю применили термин «хелат» к молекулярной структуре, постулированной Вернером. 7
Небольшие белковые молекулы легче усваиваются, поэтому организм объединяет неорганические минералы с аминокислотами, чтобы воспользоваться сродством кишечника к всасыванию белка. Этот процесс связывания называется хелатированием (key-lay-shun).10
Хелаты металлов представляют собой комплексные соединения металла с аминокислотой.
В отличие от солей металлов, лиганд в хелатном комплексе отдает электроны катиону, делая тем самым молекулу ионно-нейтральной, устойчивой к разным факторам, действующим в желудочно-кишечном тракте (рН, пища), а низкая молекулярная масса способствует максимальному усвоению железа при пероральном приеме.8
Хелатные комплексы легче проникают через стенку кишечника и лучше усваиваются, не нарушая ионный и минеральный баланс клетки. 10
10
Бисглицинат железа состоит из одной молекулы железа, которая соединена с карбоксильными группами двух молекул глицина при помощи ковалентных связей.
Соотношение железа к лиганду 1:2 нейтрализует валентность железа, что обеспечивает его стойкость к разным факторам, действующим в желудочно-кишечном тракте (рН, пища). Поэтому соединение хелата не поддается гидролизации в желудке, полностью абсорбируется в тонком кишечнике и в неизмененном виде попадает внутрь энтероцитов, где и происходит высвобождение молекулы железа.8
Бисглицинат железа — это источник негемированного железа. После перорального применения соединение в неизмененном виде попадает в энтероциты, где гидролизируется на железо и глицин. Стабильность соединения бисглицината железа объясняется тем, что оно не гидролизируется при разных значениях рН, а низкая молекулярная масса (204 г/моль) способствует максимальному усвоению железа при пероральном приеме. 8
8
- Таким образом, в желудочно-кишечном тракте не образуются свободные молекулы железа.
- Отсутствие контакта неионизированного железа со слизистой̆ оболочкой̆ желудка минимизирует возможные побочные явления.
- Бисглицинат железа может связываться с двумя видами рецепторов: DMT-1 (находятся на дуоденальных ворсинках) и PEPT-1 (локализуются на протяжении всего гастроинтестинального тракта).9
- Такая особенность хелата существенно повышает уровень абсорбции железа в желудочно-кишечном тракте, которая в 3,4 раза выше, чем у сульфата железа, взаимодействующего только с DMT1-рецепторами.9
- Ионно-нейтральная молекула не вступает в реакцию с другими питательными веществами и не нарушает их всасывание.10
- Целиакия провоцирует возникновение железодефицитного состояния. Бисглицинат железа — это единственное средство, которое эффективно устраняет дефицит железа у пациентов с целиакией за счет двойного механизма абсорбции: связывание с рецепторами DMT-1 и PEPT-1.
 11
11 - Биодоступность бисглицината железа приближается к 90–100%. 9
В составе Multizan® Феррум бисглицинат железа представлен запатентованным комплексом Ferrochel® компании Albion Minerals — мировым лидером и новатором в области минерального аминокислотного хелатного питания.
Уникальная гамма хелатных минералов Albion®:
- Максимально всасываются и легко усваиваются.
- Не взаимодействует с другими питательными веществами.
- Устойчивы к кислой среде желудка (рН).
- Подходит для вегетарианцев.
- Кошерный, сертифицированный продукт.
- Без глютена и ГМО.
- Безопасность применения бисглицината железа признана EFSA (Европейским агентством по безопасности продуктов питания) и FDA (Управление по санитарному обзору за качеством пищевых продуктов и медикаментов, США).12
Даже с повышенной биодоступностью бисглицинат железа безопасен. Всасывание контролируется запасами железа в организме, при этом большие количества обычно усваиваются людьми с более низким статусом железа. Организм, страдающий железодефицитной анемией, может потреблять 90% железа, в то время как организм, не страдающий железодефицитной анемией, может потреблять всего 10%, или ровно столько, сколько необходимо организму для компенсации потерь в метаболизме. Было обнаружено, что бисглицинат железа Ferrochel®в 2,6 раза безопаснее, чем сульфат железа, и безопаснее, чем обычное неорганическое железо, содержащееся в пищевых продуктах и пищевых добавках.13
Всасывание контролируется запасами железа в организме, при этом большие количества обычно усваиваются людьми с более низким статусом железа. Организм, страдающий железодефицитной анемией, может потреблять 90% железа, в то время как организм, не страдающий железодефицитной анемией, может потреблять всего 10%, или ровно столько, сколько необходимо организму для компенсации потерь в метаболизме. Было обнаружено, что бисглицинат железа Ferrochel®в 2,6 раза безопаснее, чем сульфат железа, и безопаснее, чем обычное неорганическое железо, содержащееся в пищевых продуктах и пищевых добавках.13
Сравнительная таблица доз LD50 (cредняя доза вещества, вызывающая гибель половины членов испытуемой группы) различных препаратов железа при пероральном введении белым мышам.14, 15, 16
- Бисглицинат железа обладает наибольшим профилем безопасности
- Острая пероральная LD50 бисглицината железа Ferrochel 2800 мг / кг веса тела — самая высокая доза среди всех препаратов железа
- Уровень отсутствия наблюдаемых побочных эффектов(NOAEL) составляет не менее 500 мг на кг веса
Multizan
® Феррум — высокоэффективное и легкоусваиваемое железо с отличной переносимостьюЛитература:
- https://www.
 who. int/nutrition/topics/ida/ru/
who. int/nutrition/topics/ida/ru/ - WHO global database of anemia, 1993-2005
- WHO meeting report. Preconception care to reduce maternal and childhood mortality and morbidity, 2012
- «Лекарственные средства, применяемые для профилактики и лечения железодефицитных состояний» Круглов Д. С. Новосибирский Государственный медицинский университет. «Научное обозрение. Медицинские науки» № 4/2017
- Грибакин С. Г. Значение продуктов детского питания, обагащенных железом, в профилактике железодефицитной анемии / С. Г. Грибакин // Вопросы современной педиатрии. — 2002. — т. 1, No 5. — С. 52–56.
- https://medi. ru/info/3878/ Мальтофер
- Stephen D. Ashmead The chemistry of ferrous bis-glycinate chelate Archivos Latinoamericanos de Nutrición ALAN v.51 n.1 supl.1 Caracas mar. 2001
- DeWayne H. A. Arch. Latino Am. De Nutr., 2001, 51 (1), 7-12
- Oscar Pineda, H.
 DeWayne Ashmead Effectiveness of Treatment of Iron-Deficiency Anemia in Infants and Young Children With Ferrous Bis-glycinate Chelate Nutrition 17:381–384, 2001
DeWayne Ashmead Effectiveness of Treatment of Iron-Deficiency Anemia in Infants and Young Children With Ferrous Bis-glycinate Chelate Nutrition 17:381–384, 2001 - https://www. albionferrochel. com/index. php/iron-importance/ferrochel
- М. Бертини, О. Г. Шадрин «Коррекция дефицита железа у детей: мнение экспертов» 2018; http://health-ua.com/article/40109-korrektciya-defitcita-zheleza-u-detej-mnenie-ekspertov
- https://www.albionminerals. com/human-nutrition/products-trade/mineral-applications/dietary-supplements
- https://www.albionferrochel. com/index. php/effectiveness
- Geisser с соавторами, 1992; Forster с соавторами, 1993.
- Borzelleca, J, and Jeppsen, R., Food and Chemical Toxicology 37 (1999) 723-731 Safety evaluation of ferrous bisglycinate chelate
- Toxicology and safety of Ferrochel and other iron amino acid chelates Latinoarm.
 Nutr. 2001 Mar;51(1 Suppl 1):26-34.
Nutr. 2001 Mar;51(1 Suppl 1):26-34. - А. Г. Румянцева, И. Н. Захаровой «ДИАГНОСТИКА И ЛЕЧЕНИЕ ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ У ДЕТЕЙ И ПОДРОСТКОВ» МЗ РФ, уч. пособие, Москва, 2015
вернуться к списку новостей
Формула оксида железа (III) – структура, свойства, использование, примеры вопросов
Оксид железа (III) состоит из элементов железа и кислорода. Железо — это металл, присутствующий в группе 8 периодической таблицы. Его атомный номер равен 26 и представлен символом Fe. Он известен как наиболее используемый и дешевый металл, поскольку он является основным компонентом ядра Земли. Кислород является высокореактивным неметаллом. Он присутствует в группе халькогенов в периодической таблице. Его атомный номер равен 8 и представлен символом O. Кислород является окислителем и образует оксиды со многими элементами.
Что такое оксид железа (III)?Оксид железа (III) — неорганическое соединение и один из наиболее распространенных оксидов.
Его химическая формула Fe 2 O 3 . На латыни железо называется Ferrum .
Валентность железа равна 2 и 3. Когда оно соединяется с валентностью 2, оно называется железистым, а когда оно сочетается с валентностью 3, оно называется железным. Оксид железа (III) встречается в природе в горных породах всех возрастов. Название IUPAC оксида железа (III) — оксид железа. Его также называют гематитом или красным оксидом железа, так как он имеет красно-коричневый цвет. Это нейтральное соединение без запаха, так как значение pH равно 7,9.0003
Структура
оксида железа (III)Оксид железа (III) состоит из 3 атомов кислорода и двух атомов железа. Здесь железо — металл, а кислород — неметалл. Поэтому связи, образованные между железом и кислородом, называются ионными связями. Образование связи в оксиде железа (III) зависит от разницы в электроотрицательности между атомами железа и кислорода.
Структура оксида железа (III)
Получение оксида железа (III)
Оксид железа (III) получают путем окисления железа. В лабораториях его готовят путем электролиза раствора бикарбоната натрия вместе с инертным электролитом и железным анодом.
В лабораториях его готовят путем электролиза раствора бикарбоната натрия вместе с инертным электролитом и железным анодом.
4Fe + 3O 2 + 2H 2 O ⇢ 4FeO(OH)
Полученный гидратированный оксид железа (III) FeO(OH) дегидратируют с получением оксида железа (III) при 200°C.
2FeO(OH) ⇢ Fe 2 O 3 + H 2 O
Physical Properties of Iron (III) Oxide
- Chemical Formula- Fe 2 O 3
- Молекулярная масса – 159,69 г/моль
- Температура плавления – от 1475°C до 1565°C
- При кипячении оксид железа (III) разлагается.
- Плотность – 5,242 г/см 3
- Имеет красновато-коричневый цвет и находится в твердом состоянии при комнатной температуре.
- Оксид железа не имеет запаха.
- Не проводит электричество.

Химические свойства оксида железа (III)
- Оксид железа (III) не растворяется в воде, но растворяется в сильной кислоте.
- При растворении в воде образует слабое основание, называемое гидроксидом железа.
- Степень окисления железа в оксиде +3.
- Карботермическое восстановление: Восстановление оксида железа (III) восстановителем, таким как углерод, дает металл, присутствующий в оксиде, т. е. железо. Он применим ко всем оксидам металлов.
Fe 2 O 3 + 3CO ⇢ 2Fe + 3CO 2
- Экзотермит0006 Экзотермическая термитная реакция между оксидом железа (III) и алюминием дает оксид железа и алюминия.
2AL+ FE 2 O 3 ⇢ 2FE+ AL 2 O 3
Использование железного оксида (III)
- Оксид феррика используется в качестве канала в производстве.

- Используется для окончательной полировки металлических украшений и в качестве пигмента.
- Является важным ингредиентом лосьона с каламином. Используется в качестве пигмента.
- Используется в магнитных дисках и лентах.
- Используется в косметике.
- Также используется в стоматологических композитах.
Примеры вопросов
Вопрос 1. Является ли оксид железа (III) кислотным или основным?
Ответ:
Оксид железа (III) представляет собой атмосферный оксид железа. Все оксиды железа, алюминия и олова имеют как кислотную, так и основную природу. Итак, оксид железа (III) проявляет как кислотные, так и основные свойства.
Вопрос 2: Объясните карботермическое восстановление оксида железа?
Ответ:
Восстановление оксида железа восстановителями, такими как углерод, в диапазоне температур в несколько сотен градусов Цельсия с образованием железа.
Химическая реакция представлена формулой-
Fe 2 O 3 + 3CO ⇢ 2Fe + 3CO 2
3CO 2
9000
Ответ:
Атомный вес 1 атома железа=55,845
Атомный вес 1 атома кислорода=15,999
Молекулярный вес оксида железа (III) = 0× 2 3 O 30 90 55,845)+(3×15,999)
=159,68
Молекулярная масса оксида железа (III) равна 159,68
Вопрос 4: Каков результат экзотермической термитной реакции с алюминием?
Ответ:
В результате экзотермической термитной реакции с алюминием образуется железо и оксид алюминия. Химическая реакция дается как
2AL+ FE 2 O 3 ⇢ 2FE+ AL 2 O 3
Вопрос 5: Укажите общее использование железа (III) оксида?
Ответ:
Оксид железа (III) используется при полировке стекла, металлов, алмазов.
Он также используется в красках, чернилах, резиновых изделиях, а также в стекле в качестве агента, блокирующего УФ-излучение. В области медицины оксид железа используется в стоматологических композитах.
Оксид железа(III) – структура, свойства, применение Fe2O3
Что такое оксид железа(III)?
Fe 2 O 3 представляет собой неорганическое соединение с химическим названием оксид железа (III). Он также известен как гематит или красный оксид железа. Это соединение встречается в природе в горных породах всех возрастов. Он выглядит как красно-коричневое твердое вещество. Он без запаха. Он имеет значение pH 7,
.Содержание
- Производство оксида железа(III)
- Свойства оксида железа (III) – Fe 2 О 3
- Структура оксида железа(III) – Fe 2 O 3
- Химическая реакция
- Использование оксида железа (III) Fe 2 O 3
- Часто задаваемые вопросы
Производство оксида железа(III):
Оксид железа(III) представляет собой продукт, полученный в результате окисления железа. В лабораториях его готовят путем электролиза раствора бикарбоната натрия, инертного электролита, вместе с железным анодом.
В лабораториях его готовят путем электролиза раствора бикарбоната натрия, инертного электролита, вместе с железным анодом.
\(\begin{array}{l}4Fe+3O_{2}+2H_{2}O → 4FeO (OH)\end{массив} \)
Полученный гидратированный оксид железа (III), который здесь обозначен как Fe(O)OH, обезвоживается при температуре около 200 °C. Реакция выглядит следующим образом:
\(\begin{array}{l}2FeO (OH) → Fe_{2}O_{3}+H_{2}O\end{массив} \)
Свойства оксида железа (III) – Fe
2 O 3| Fe 2 O 3 | Оксид железа(III) |
| Молекулярная масса/ Молярная масса | 159,69 г/моль |
| Плотность | 5,242 г/см³ |
| Точка кипения | Разлагается |
| Точка плавления | 1475°С – 1565°С |
Структура оксида железа(III) – Fe
2 O 3 Изображение выше описывает структуру оксида железа (III). Fe 2 O 3 — это химическая формула оксида железа (III), который имеет три атома кислорода и два атома железа. Степень окисления Fe 2 О 3 равно +3. Образование связи между кислородом и железом зависит от разницы в электроотрицательности между этими двумя атомами. Железо (Fe) является металлом, тогда как кислород (O 2 ) является неметаллом. Поэтому такие связи называются ионной связью.
Fe 2 O 3 — это химическая формула оксида железа (III), который имеет три атома кислорода и два атома железа. Степень окисления Fe 2 О 3 равно +3. Образование связи между кислородом и железом зависит от разницы в электроотрицательности между этими двумя атомами. Железо (Fe) является металлом, тогда как кислород (O 2 ) является неметаллом. Поэтому такие связи называются ионной связью.
атома:
| 2 атома железа | 3 атома кислорода |
| Fe | О |
Химическая реакция:
- Карботермическое восстановление – Восстановление оксидов металлов восстановителем, таким как углерод, в диапазоне температур в несколько сотен градусов Цельсия. Реакция выглядит следующим образом:
\(\begin{array}{l}Fe_{2}O_{3}+3CO\rightarrow 2Fe+3CO_{2}\end{array} \)
- Экзотермическая термитная реакция с алюминием –
Реакция следующая:
\(\begin{array}{l}2Al+Fe_{2}O_{3}\rightarrow 2Fe+Al_{2}O_{3}\end{array} \)
Использование оксида железа (III) (Fe
2 O 3 )- Оксид железа(III) используется в качестве сырья для производства железа.

- Используется как пигмент. Пример: Пигмент коричневый 6 и Пигмент красный 101
- Используется в косметике.
- Используется в стоматологических композитах.
- Является важным ингредиентом лосьона с каламином.
- Используется для окончательной полировки металлических украшений.
- Используется в магнитных дисках и магнитных лентах.
Опасность для здоровья оксида железа(III) – При вдыхании железо вызывает раздражение желудочно-кишечного тракта и легких.
Часто задаваемые вопросы
Каковы виды использования оксида железа?
Оксид железа (Fe 2 O 3 ) используется в красках и покрытиях, чернилах, пластмассах, резиновых изделиях и стекле в качестве пигмента и/или агента, блокирующего УФ-излучение. Он также используется в качестве полирующего агента для стекла, алмазов и драгоценных металлов. Это соединение также находит применение в качестве компонента магнитов, в качестве стоматологического абразива и в качестве регулятора процесса или катализатора при производстве других продуктов.

 11
11 who. int/nutrition/topics/ida/ru/
who. int/nutrition/topics/ida/ru/ DeWayne Ashmead Effectiveness of Treatment of Iron-Deficiency Anemia in Infants and Young Children With Ferrous Bis-glycinate Chelate Nutrition 17:381–384, 2001
DeWayne Ashmead Effectiveness of Treatment of Iron-Deficiency Anemia in Infants and Young Children With Ferrous Bis-glycinate Chelate Nutrition 17:381–384, 2001 Nutr. 2001 Mar;51(1 Suppl 1):26-34.
Nutr. 2001 Mar;51(1 Suppl 1):26-34. Его химическая формула Fe 2 O 3 . На латыни железо называется Ferrum .
Его химическая формула Fe 2 O 3 . На латыни железо называется Ferrum .

 Химическая реакция представлена формулой-
Химическая реакция представлена формулой- Он также используется в красках, чернилах, резиновых изделиях, а также в стекле в качестве агента, блокирующего УФ-излучение. В области медицины оксид железа используется в стоматологических композитах.
Он также используется в красках, чернилах, резиновых изделиях, а также в стекле в качестве агента, блокирующего УФ-излучение. В области медицины оксид железа используется в стоматологических композитах.