Как кишечная микробиота влияет на метаболизм лекарств. Какие механизмы лежат в основе этого влияния. Какие последствия это имеет для эффективности и токсичности лекарств. Как учитывать роль микробиоты при разработке и применении лекарственных препаратов.
Микробиота кишечника и ее роль в метаболизме лекарств
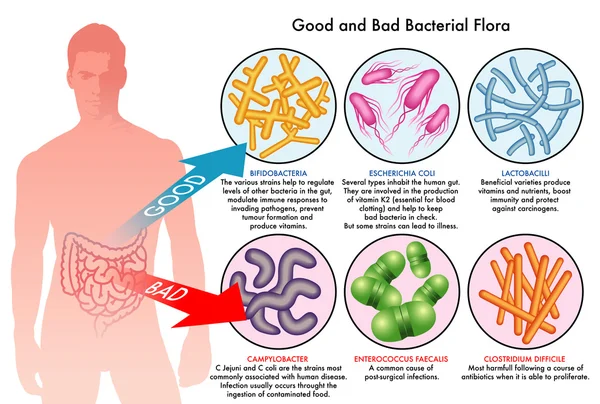
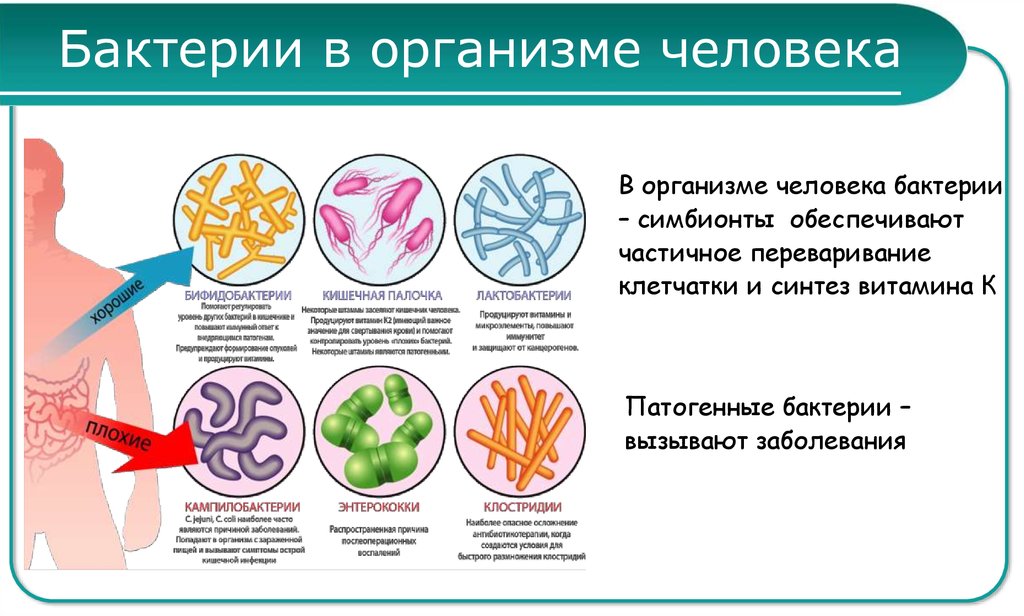
Микробиота кишечника представляет собой сложную экосистему, состоящую из триллионов микроорганизмов, населяющих желудочно-кишечный тракт человека. В последние годы ученые уделяют все больше внимания изучению влияния кишечных микробов на различные аспекты здоровья человека, включая метаболизм лекарственных препаратов.
Исследования показывают, что микроорганизмы кишечника способны модифицировать структуру и активность многих лекарств, что может существенно влиять на их фармакокинетику и фармакодинамику. Это открывает новые перспективы для понимания индивидуальных различий в реакции на лекарства и оптимизации фармакотерапии.

Основные механизмы влияния микробиоты на метаболизм лекарств
Микроорганизмы кишечника могут воздействовать на лекарственные препараты несколькими способами:
- Прямая биотрансформация лекарств с помощью микробных ферментов
- Изменение активности ферментов печени, метаболизирующих лекарства
- Влияние на всасывание и распределение лекарств в организме
- Модуляция иммунного ответа на лекарственные препараты
Рассмотрим подробнее некоторые из этих механизмов на конкретных примерах.
Примеры влияния микробиоты на метаболизм лекарств
Ацетаминофен (парацетамол)
Ацетаминофен — широко используемый анальгетик и антипиретик. Исследования показали, что кишечные бактерии способны метаболизировать этот препарат, что может влиять на его токсичность. В частности, было обнаружено, что у животных без микробиоты (гнотобионтов) снижается образование токсичных метаболитов ацетаминофена в печени.
Дигоксин
Дигоксин — сердечный гликозид, применяемый при лечении сердечной недостаточности. Некоторые виды кишечных бактерий способны инактивировать дигоксин путем восстановления его лактонного кольца. Это может приводить к снижению биодоступности препарата и ослаблению его терапевтического эффекта.
Иринотекан
Иринотекан — противоопухолевый препарат, применяемый при лечении колоректального рака. Кишечные бактерии способны реактивировать неактивный метаболит иринотекана (SN-38G) с помощью фермента β-глюкуронидазы. Это может усиливать токсическое действие препарата на слизистую кишечника, вызывая тяжелую диарею.
Влияние микробиоты на эффективность иммунотерапии рака
Недавние исследования показали, что состав микробиоты кишечника может влиять на эффективность противоопухолевой иммунотерапии. Например, было обнаружено, что наличие определенных видов бактерий в кишечнике усиливает терапевтический эффект ингибиторов контрольных точек иммунитета при меланоме.
Эти данные открывают новые возможности для повышения эффективности иммунотерапии рака путем модуляции состава кишечной микробиоты.
Роль микробиоты в индивидуальной вариабельности ответа на лекарства
Состав микробиоты кишечника может существенно различаться у разных людей. Это может быть одной из причин индивидуальных различий в метаболизме лекарств и их эффективности. Например:
- Реакция на статины (препараты для снижения уровня холестерина) коррелирует с наличием определенных бактериальных метаболитов в крови
- Эффективность метформина (препарат для лечения диабета 2 типа) зависит от состава кишечной микробиоты
Учет индивидуальных особенностей микробиоты может помочь в персонализации фармакотерапии и повышении ее эффективности.
Перспективы использования знаний о влиянии микробиоты на метаболизм лекарств
Понимание роли кишечной микробиоты в метаболизме лекарств открывает новые возможности для оптимизации фармакотерапии:
- Разработка пробиотиков для повышения эффективности лекарств
- Создание препаратов, устойчивых к бактериальному метаболизму
- Использование микробных ферментов для активации пролекарств
- Персонализация терапии с учетом индивидуального состава микробиоты
Методы изучения влияния микробиоты на метаболизм лекарств
Для исследования взаимодействий между микробиотой и лекарствами используются различные подходы:
- Исследования на животных-гнотобионтах (без микрофлоры)
- Культивирование отдельных видов бактерий in vitro
- Метагеномный анализ микробиоты
- Фармакокинетические исследования с применением антибиотиков
Комбинация этих методов позволяет получить комплексное представление о роли микробиоты в метаболизме лекарств.
Влияние антибиотиков на метаболизм лекарств
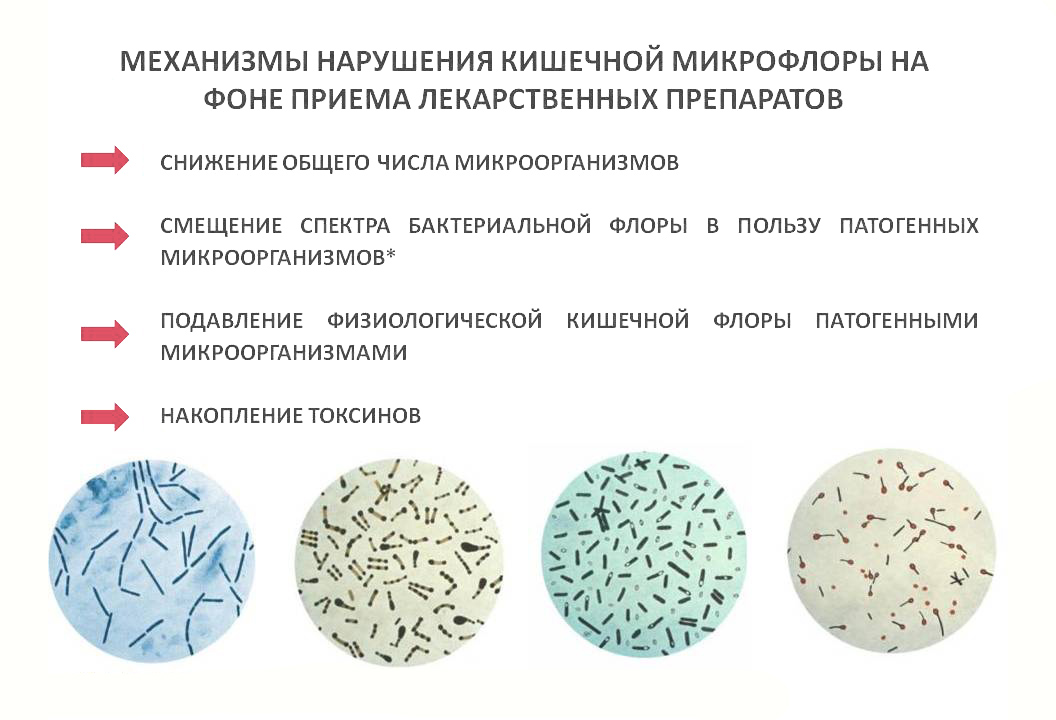
Применение антибиотиков может существенно изменять состав кишечной микробиоты, что в свою очередь влияет на метаболизм других лекарственных препаратов. Например:
- Антибиотики могут снижать инактивацию дигоксина кишечными бактериями, повышая его концентрацию в крови
- Подавление кишечной микрофлоры антибиотиками может уменьшать токсичность иринотекана
Эти взаимодействия необходимо учитывать при одновременном назначении антибиотиков с другими препаратами.
Роль микробиоты в метаболизме природных соединений
Кишечные микроорганизмы играют важную роль в метаболизме многих природных соединений, содержащихся в пище и лекарственных растениях. Например:
- Превращение изофлавонов сои в активные метаболиты
- Активация полифенолов зеленого чая
- Метаболизм лигнанов льняного семени
Понимание этих процессов важно для оценки биодоступности и эффективности фитопрепаратов и биологически активных добавок.
Микробиота и метаболизм ксенобиотиков
Помимо лекарств, кишечные микроорганизмы участвуют в метаболизме различных ксенобиотиков — чужеродных для организма веществ, поступающих из окружающей среды. К ним относятся:
- Пищевые добавки
- Пестициды
- Загрязнители окружающей среды
Микробный метаболизм может как обезвреживать эти вещества, так и усиливать их токсичность. Это необходимо учитывать при оценке рисков воздействия ксенобиотиков на организм человека.
Перспективы использования микробиоты для доставки лекарств
Исследователи изучают возможности использования кишечных микроорганизмов в качестве систем доставки лекарственных препаратов. Некоторые перспективные направления:
- Создание пробиотических штаммов, продуцирующих терапевтические вещества
- Использование бактериальных везикул для доставки лекарств
- Разработка бактериальных «наноботов» для таргетной доставки препаратов
Эти подходы могут обеспечить более эффективную и безопасную доставку лекарств в организм.
Влияние диеты на микробиоту и метаболизм лекарств
Состав пищи оказывает существенное влияние на микробиоту кишечника, что в свою очередь может отражаться на метаболизме лекарств. Например:
- Высокожировая диета может изменять активность ферментов, метаболизирующих лекарства
- Потребление пребиотиков способно модулировать состав микробиоты и влиять на фармакокинетику препаратов
Учет диетических факторов может быть важен для оптимизации фармакотерапии.

Микробиота и побочные эффекты лекарств
Кишечная микробиота может играть роль в развитии некоторых побочных эффектов лекарственных препаратов. Например:
- Антибиотик-ассоциированная диарея связана с нарушением состава микробиоты
- Гепатотоксичность некоторых препаратов может усиливаться под влиянием кишечных бактерий
Понимание этих механизмов может помочь в разработке стратегий для снижения побочных эффектов лекарств.
Заключение
Изучение влияния микробиоты кишечника на метаболизм лекарств открывает новые горизонты в фармакологии и персонализированной медицине. Учет роли кишечных микроорганизмов позволяет лучше понять индивидуальные различия в реакции на лекарства и оптимизировать фармакотерапию. Дальнейшие исследования в этой области могут привести к разработке инновационных подходов к созданию и применению лекарственных препаратов.
Пребиотики и пробиотики — список ветеринарных препаратов из 05.04.02 входит в группу клинико-фармакологических указателей (КФУ) 05
Входит в группу: 05.04 — Препараты, нормализующие микрофлору кишечника
| АЛЬФАФЛОР S Для нормализации и восстановления микрофлоры кишечника, повышения резистентности организма сельскохозяйственных животных и птицы в течение всего периода выращивания при дисбактериозах, вызванных:
| Порошок рег. №ПВИ-1-5. 0/03197
от 15.07.10 0/03197
от 15.07.10 | ALPHARMA B.V.B.A. (Бельгия) произведено: NUTRI-CONCEPT (Франция) | |
ДЖИМКЭТ ПАСТА ПРЕБИОТИК С ТГОС
| Масло для внутреннего применения рег. №РОСС DE.АГ19.Д08834 от 17.08.16 | H. von Gimborn GmbH (Германия) контакты: | |
| ФЛОРЕНТИН Для нормализации обмена веществ, восстановления нормальной микрофлоры кишечника, повышения резистентности организма кошек и собак:
| Таблетки рег. №ПВИ-2-11.8/02824 от 22.06.09 | Istituto Farmaceutico Candioli S.p.A. (Италия) контакты: | |
| ФЛОРЕНТИН Для нормализации обмена веществ, восстановления нормальной микрофлоры кишечника, повышения резистентности организма кошек, собак, декоративных кроликов и морских свинок:
| Паста рег. №ПВИ-2-11.8/02825 от 22.06.09 | Istituto Farmaceutico Candioli S.p.A. (Италия) контакты: |
Другие подгруппы из группы КФУ: Препараты, нормализующие микрофлору кишечника
- 05.04.01 — Пробиотики
Как вернуть пищеварение в норму после коронавируса? – клиника «Семейный доктор».

Большинство людей, перенесших COVID-19, отмечают снижение качества жизни. Опасная болезнь позади, но полного выздоровления нет. Повышенная тревожность, утомляемость, медлительность, забывчивость, сонливость и нарушение аппетита мешают полноценно работать или учиться. Обостряются хронические заболевания, появляются проблемы с пищеварением.
Поражение желудочно-кишечного тракта (ЖКТ) при COVID-19
Коронавирусная инфекция SARS-CoV-2 изначально может протекать с преимущественным поражением пищеварительного тракта. Если даже тошноты, жидкого стула и болей в животе во время острого периода болезни не было, ковид действует на все ткани человека и снижает иммунитет. Кроме того, лечение инфекции серьёзными препаратами нарушает естественное соотношение микрофлоры в кишечнике, негативно действует на печень.
Причины нарушения пищеварения после COVID-19
- Изменение биоценоза кишечника.
- Ухудшение работы печени.
- Снижение иммунитета.
Это приводит к диарее, болям в животе, тошноте, слабости и раздражительности, снижению аппетита.
Наладить пищеварение поможет доктор
Гастроэнтерологи нашей клиники придерживаются международных рекомендаций для диагностики и лечения патологии желудочно-кишечного тракта после перенесённого ковида.
Чтобы уточнить причину нарушения пищеварения, проводится обследование:
- общий анализ крови
- анализ кала на дисбактериоз
- копрограмма
- УЗИ органов брюшной полости
- эзофагогастродуоденоскопия
- колоноскопия.
Список диагностических процедур может быть сокращён или расширен. Обследование назначает доктор индивидуально для каждого пациента.
Восстановление пищеварения после COVID
Лечение зависит от выявленной во время обследования патологии и самочувствия человека.
В стандарт врачебных рекомендаций входят:
- нормализация режима сна и бодрствования
- контроль рациона, назначение диетического питания
- лекарственные препараты, нормализующие работу печени и пищеварительного тракта
- лечение сопутствующей патологии
- физиотерапевтическая терапия
- психотерапевтическая поддержка.
Гастроэнтерологи используют действенные схемы лечения постковидных расстройств пищеварения. Пациенты быстро идут на поправку и возвращаются к привычному образу жизни. Эффект лечения тем выше, чем раньше человек обращается в клинику.
Запишитесь на консультацию к врачу по номеру единого контакт-центра +7 (495) 775 75 66 или с помощью специальной формы онлайн-записи на сайте, не откладывайте выздоровление в долгий ящик.
Публикации наших врачей на тему «Как побороть постковидный синдром»
- Восстановление легких после коронавируса
- Восстановление обоняния после коронавируса
- Восстановление памяти после перенесённого коронавируса
- Потеря обоняния при COVID-19 — советы врача оториноларинголога
- Преодолеваем психические расстройства при постковидном синдроме
- Переживаем COVID.
 Как пандемия коронавируса влияет на психическую деятельность
Как пандемия коронавируса влияет на психическую деятельность - Постковидный скрининг — обследование после перенесенной новой коронавирусной инфекции
- Рекомендации кардиолога после перенесенного COVID-19
- Коронавирус оказался «злопамятным» — что важно знать
- Мелатонин и COVID-19 — лекарство для Трампа
- Постковидный синдром: программа диагностики и регресса постковидной симптоматики. Как справиться с долгосрочными симптомами Long COVID
Возврат к списку публикаций
Услуги
- Гастрит у детей
- Дыхательный тест на Хеликобактер пилори
- Желчнокаменная болезнь (ЖКБ)
- Лечение гастрита
- Лечение гепатоза
- Лечение диареи у детей
- Лечение дивертикулеза
- Лечение дисбактериоза
- Лечение дисбактериоза у ребенка
- Лечение дискинезии ЖВП у ребенка
- Лечение дискинезии желчевыводящих путей
- Лечение дискинезии кишечника
- Лечение панкреатита
- Лечение панкреатита у детей
- Лечение пищевода Барретта
- Лечение реактивного панкреатита
- Лечение синдрома раздраженного кишечника
- Лечение хеликобактериоза у детей
- Лечение холецистита
- Лечение хронического панкреатита
- Лечение эзофагита
- Лечение язвенной болезни и функционального расстройства желудка
- Памятка по подготовке к гастроскопии
Влияние кишечной микробиоты на метаболизм и токсичность лекарств
Особо примечательные статьи были отмечены как представляющие интерес
(•) или представляющие значительный интерес
(••) для читателей.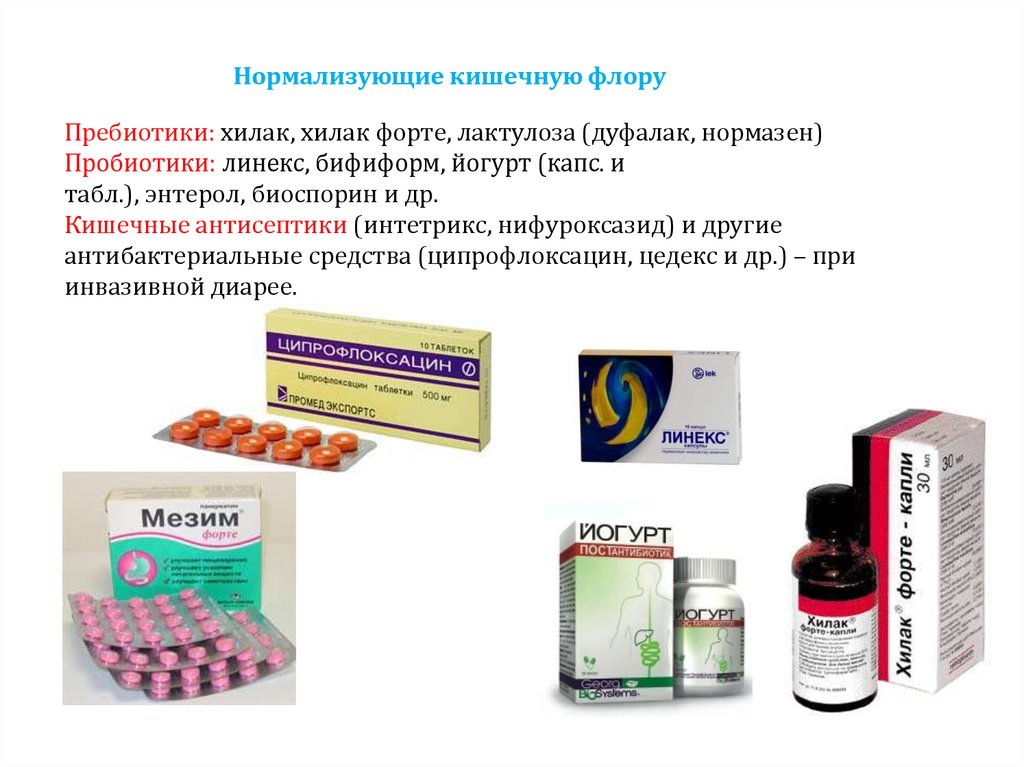
1. Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, et al. Метагеномный анализ микробиома дистального отдела кишечника человека. Наука. 2006 2 июня; 312 (5778): 1355–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, et al. Каталог микробных генов кишечника человека, созданный с помощью метагеномного секвенирования. Природа. 2010 4 марта; 464 (7285): 59–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3•. Цзя В., Ли Х., Чжао Л., Николсон Дж.К. Микробиота кишечника: потенциальная новая территория для таргетинга лекарств. Nat Rev Drug Discov. 2008 г., февраль; 7 (2): 123–9. В этом обзоре представлен обзор участия кишечной микробиоты в развитии заболеваний и выдвинута гипотеза о кишечной микробиоте в качестве потенциальной мишени для лекарств. [PubMed] [Google Scholar]
4••. Kang MJ, Kim HG, Kim JS, Oh do G, Um YJ, Seo CS и другие. Влияние микробиоты кишечника на метаболизм лекарств. Экспертное мнение о метаболизме и токсикологии лекарственных средств. 2013 Октябрь; 9(10): 1295–308. В этом обзоре систематически обобщена модуляция микробиоты кишечника многими натуральными продуктами и синтетическими лекарствами. [PubMed] [Google Scholar]
Экспертное мнение о метаболизме и токсикологии лекарственных средств. 2013 Октябрь; 9(10): 1295–308. В этом обзоре систематически обобщена модуляция микробиоты кишечника многими натуральными продуктами и синтетическими лекарствами. [PubMed] [Google Scholar]
5. Раджилич-Стоянович М., Смидт Х., де Вос В.М. Еще раз о разнообразии микробиоты желудочно-кишечного тракта человека. Окружающая среда микробиол. 9(9) сентября 2007 г.: 2125–36. [PubMed] [Google Scholar]
6•. Саад Р., Ризкалла М.Р., Азиз Р.К. Фармакомикробиомика кишечника: верхушка айсберга сложных взаимодействий между лекарствами и кишечными микробами. Гут Патог. 2012;4(1):16. В этой статье обсуждались сложные отношения между хозяином и микробами кишечника, а также был введен термин «фармакомикробиомика». [Бесплатная статья PMC] [PubMed] [Google Scholar]
7••. Хайзер Х.Дж., Тернбо П.Дж. Разработка метагеномного взгляда на метаболизм ксенобиотиков. Фармакол рез. 2013 март; 69 (1): 21–31. В этой статье авторы обобщили роль кишечной микробиоты в метаболизме ксенобиотиков с некоторыми важными примерами. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Clayton TA, Baker D, Lindon JC, Everett JR, Nicholson JK. Фармакометабономическая идентификация значительного метаболического взаимодействия хозяина и микробиома, влияющего на метаболизм лекарств человека. Труды Национальной академии наук Соединенных Штатов Америки. 2009 г.25 августа; 106 (34): 14728–33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Haiser HJ, Gootenberg DB, Chatman K, Sirasani G, Balskus EP, Turnbaugh PJ. Прогнозирование и манипулирование инактивацией сердечных препаратов кишечной бактерией Eggerthella lenta человека. Наука. 2013 г., 19 июля; 341 (6143): 295–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Westman EL, Canova MJ, Radhi IJ, Koteva K, Kireeva I, Waglechner N, et al. Бактериальная инактивация противоопухолевого препарата доксорубицина. хим. биол. 2012 26 октября; 19(10): 1255–64. [PubMed] [Google Scholar]
11. Ди Л. Роль ферментов, метаболизирующих лекарства, в клиренсе. Экспертное мнение о метаболизме и токсикологии лекарственных средств. 2014 март; 10 (3): 379–93. [PubMed] [Google Scholar]
Экспертное мнение о метаболизме и токсикологии лекарственных средств. 2014 март; 10 (3): 379–93. [PubMed] [Google Scholar]
12. Cho I, Blaser MJ. Микробиом человека: на стыке здоровья и болезни. Нат Рев Жене. 2012 апр; 13 (4): 260–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13••. Li H, Jia W. Кометаболизм микробов и хозяина: последствия для метаболизма лекарств и токсичности, вызванной лекарствами. Клин Фармакол Тер. 2013 ноябрь;94(5):574–81. В этом обзоре обсуждался сопутствующий метаболизм между хозяином и микробиотой, а также обобщались препараты, которые метаболизировались кишечной микробиотой. [PubMed] [Google Scholar]
14. Дэвидсон Д.Г., Истхэм В.Н. Острый некроз печени после передозировки парацетамола. Br Med J. 1966, 27 августа; 2 (5512): 497–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Larson AM, Polson J, Fontana RJ, Davern TJ, Lalani E, Hynan LS, et al. Ацетаминофен-индуцированная острая печеночная недостаточность: результаты многоцентрового проспективного исследования в США. Гепатология. 2005 г., декабрь; 42 (6): 1364–72. [PubMed] [Академия Google]
Гепатология. 2005 г., декабрь; 42 (6): 1364–72. [PubMed] [Академия Google]
16. Смит Э.А., Макфарлейн Г.Т. Формирование фенольных и индольных соединений анаэробными бактериями в толстой кишке человека. Микроб Экол. 1997 г., апрель; 33 (3): 180–8. [PubMed] [Google Scholar]
17. Lee SH, An JH, Lee HJ, Jung BH. Оценка фармакокинетических различий ацетаминофена у псевдомикробных крыс. Biopharm Drug Dispos. 2012 г., сен; 33 (6): 292–303. [PubMed] [Google Scholar]
18. Gamage N, Barnett A, Hempel N, Duggleby RG, Windmill KF, Martin JL, et al. Сульфотрансферазы человека и их роль в химическом обмене. Токсикол науч. 2006 март;90(1):5–22. [PubMed] [Google Scholar]
19. Possamai LA, McPhail MJ, Khamri W, Wu B, Concas D, Harrison M, et al. Роль кишечной микробиоты в мышиных моделях гепатотоксичности, вызванной ацетаминофеном. Печень инт. 2015 март; 35 (3): 764–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Jacobs WAHA. Связь между структурой и биологическим действием сердечных глюкозидов. Журнал биологической химии. 1927; 74: 787–93. [Google Scholar]
Журнал биологической химии. 1927; 74: 787–93. [Google Scholar]
21. Vick RLKJJ, Acheson GH. Влияние дигидроуабаина, дигидродигоксина и дигидродигитоксина на сердечно-легочную подготовку собаки. J Pharmacol Exp Ther. 1957;121:330–39. [PubMed] [Google Scholar]
22. Lindenbaum J, Rund DG, Butler VP, Jr, Tse-Eng D, Saha JR. Инактивация дигоксина кишечной флорой: лечение антибиотиками. Медицинский журнал Новой Англии. 1981 г., 1 октября; 305 (14): 789–94. [PubMed] [Google Scholar]
23. Saha JR, Butler VP, Jr, Neu HC, Lindenbaum J. Бактерии, инактивирующие дигоксин: идентификация во флоре кишечника человека. Наука. 1983 г., 15 апреля; 220 (4594): 325–7. [PubMed] [Google Scholar]
24. Vanhoefer U, Harstrick A, Achterrath W, Cao S, Seeber S, Rustum YM. Иринотекан в лечении колоректального рака: клинический обзор. Дж. Клин Онкол. 2001 1 марта; 19(5): 1501–18. [PubMed] [Google Scholar]
25. Стрингер А.М., Гибсон Р.Дж., Логан Р.М., Боуэн Дж.М., Йео А.С., Киф Д. М. Фекальная микрофлора и экспрессия бета-глюкуронидазы изменяются в модели диареи, вызванной иринотеканом у крыс. Рак Биол Тер. 2008 г., декабрь; 7 (12): 1919–25. [PubMed] [Google Scholar]
М. Фекальная микрофлора и экспрессия бета-глюкуронидазы изменяются в модели диареи, вызванной иринотеканом у крыс. Рак Биол Тер. 2008 г., декабрь; 7 (12): 1919–25. [PubMed] [Google Scholar]
26. Takasuna K, Hagiwara T, Hirohashi M, Kato M, Nomura M, Nagai E, et al. Участие бета-глюкуронидазы кишечной микрофлоры в кишечной токсичности противоопухолевого производного камптотецина иринотекана гидрохлорида (СРТ-11) у крыс. Рак рез. 1996 15 августа; 56 (16): 3752–7. [PubMed] [Google Scholar]
27. Wallace BD, Wang H, Lane KT, Scott JE, Orans J, Koo JS, et al. Уменьшение токсичности противораковых препаратов за счет ингибирования бактериального фермента. Наука. 2010 5 ноября; 330 (6005): 831–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Hooper LV, Littman DR, Macpherson AJ. Взаимодействие микробиоты и иммунной системы. Наука. 2012 г., 8 июня; 336 (6086): 1268–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Sistigu A, Viaud S, Chaput N, Bracci L, Proietti E, Zitvogel L. Иммуномодулирующие эффекты циклофосфамида и применение для разработки вакцин. Семин иммунопатол. 2011 июль; 33 (4): 369–83. [PubMed] [Google Scholar]
Иммуномодулирующие эффекты циклофосфамида и применение для разработки вакцин. Семин иммунопатол. 2011 июль; 33 (4): 369–83. [PubMed] [Google Scholar]
30. Schiavoni G, Sistigu A, Valentini M, Mattei F, Sestili P, Spadaro F, et al. Циклофосфамид действует синергично с интерферонами I типа посредством системной реактивации дендритных клеток и индукции иммуногенного апоптоза опухоли. Рак рез. 2011 1 февраля; 71 (3): 768–78. [PubMed] [Google Scholar]
31. Ghiringhelli F, Larmonier N, Schmitt E, Parcellier A, Cathelin D, Garrido C, et al. Регуляторные Т-клетки CD4+CD25+ подавляют опухолевый иммунитет, но чувствительны к циклофосфамиду, что позволяет излечивать иммунотерапию прижившихся опухолей. Евр Дж Иммунол. 2004 г., февраль; 34 (2): 336–44. [PubMed] [Академия Google]
32. Viaud S., Flament C., Zoubir M., Pautier P., LeCesne A., Ribrag V. и соавт. Циклофосфамид индуцирует дифференцировку клеток Th27 у больных раком. Рак рез. 2011 1 февраля; 71 (3): 661–5. [PubMed] [Google Scholar]
33•. Вио С., Саккери Ф., Миньо Г., Ямадзаки Т., Дайлер Р., Ханнани Д. и др. Кишечная микробиота модулирует противораковые иммунные эффекты циклофосфамида. Наука. 2013 22 ноября; 342 (6161): 971–6. В этой статье приводятся доказательства влияния микробов кишечника на эффективность лекарств, таких как циклофосфамид. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вио С., Саккери Ф., Миньо Г., Ямадзаки Т., Дайлер Р., Ханнани Д. и др. Кишечная микробиота модулирует противораковые иммунные эффекты циклофосфамида. Наука. 2013 22 ноября; 342 (6161): 971–6. В этой статье приводятся доказательства влияния микробов кишечника на эффективность лекарств, таких как циклофосфамид. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Иида Н., Дзуцев А., Стюарт К.А., Смит Л., Буладу Н., Вайнгартен Р.А. и соавт. Комменсальные бактерии контролируют реакцию рака на терапию, модулируя микроокружение опухоли. Наука. 2013 22 ноября; 342 (6161): 967–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Grundy SM, Cleeman JI, Merz CN, Brewer HB, Jr, Clark LT, Hunninghake DB, et al. Последствия недавних клинических испытаний для руководящих принципов группы III по лечению взрослых Национальной образовательной программы по холестерину. Тираж. 2004 г., 13 июля; 110 (2): 227–39.. [PubMed] [Google Scholar]
36. Barber MJ, Mangravite LM, Hyde CL, Chasman DI, Smith JD, McCarty CA, et al. Полногеномная ассоциация гиполипидемической реакции на статины в комбинированных исследуемых популяциях. ПЛОС Один. 2010;5(3):e9763. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Полногеномная ассоциация гиполипидемической реакции на статины в комбинированных исследуемых популяциях. ПЛОС Один. 2010;5(3):e9763. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Kaddurah-Daouk R, Baillie RA, Zhu H, Zeng ZB, Wiest MM, Nguyen UT, et al. Метаболиты кишечного микробиома коррелируют с реакцией на лечение симвастатином. ПЛОС Один. 2011;6(10):e25482. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38•. Yoo DH, Kim IS, Van Le TK, Jung IH, Yoo HH, Kim DH. Лекарственные взаимодействия между ловастатином и антибиотиками, опосредованные кишечной микробиотой. Метаболизм и расположение лекарств: биологическая судьба химических веществ. 2014 г., сен; 42 (9): 1508–13. В этой статье приводятся доказательства влияния микробов кишечника на метаболизм лекарств, таких как ловастатин. [PubMed] [Google Scholar]
39. Dapito DH, Mencin A, Gwak GY, Pradere JP, Jang MK, Mederacke I, et al. Продвижение гепатоцеллюлярной карциномы кишечной микробиотой и TLR4. Раковая клетка. 2012 17 апреля; 21 (4): 504–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2012 17 апреля; 21 (4): 504–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, et al. Метаболомический анализ показывает сильное влияние микрофлоры кишечника на метаболиты крови млекопитающих. Труды Национальной академии наук Соединенных Штатов Америки. 2009 г., 10 марта; 106 (10): 3698–703. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41•. Николсон Дж. К., Холмс Э., Кинросс Дж., Бурселин Р., Гибсон Г., Цзя В. и др. Метаболические взаимодействия микробиоты кишечника-хозяина. Наука. 2012 г., 8 июня; 336 (6086): 1262–7. В этом обзоре обсуждалась сложная взаимосвязь между микробиотой хозяина и кишечника. [PubMed] [Академия Google]
42. Голдин Б.Р., Пепперкорн М.А., Гольдман П. Вклад хозяина и кишечной микрофлоры в метаболизм L-дофа у крыс. Журнал фармакологии и экспериментальной терапии. 1973 г., июль; 186 (1): 160–6. [PubMed] [Google Scholar]
43. Koch RL, Goldman P. Анаэробный метаболизм метронидазола образует N-(2-гидроксиэтил)-оксамовую кислоту. Журнал фармакологии и экспериментальной терапии. 1979 март; 208 (3): 406–10. [PubMed] [Google Scholar]
Журнал фармакологии и экспериментальной терапии. 1979 март; 208 (3): 406–10. [PubMed] [Google Scholar]
44. Aura AM, Mattila I, Hyotylainen T, Gopalacharyulu P, Bounsaythip C, Oresic M, et al. Метаболом лекарственного средства симвастатина, образованный микробиотой кишечника человека in vitro. Молекулярные биосистемы. 2011 г., февраль; 7 (2): 437–46. [PubMed] [Академия Google]
45. Миков М., Колдуэлл Дж., Долфин К.Т., Смит Р.Л. Роль кишечной микрофлоры в образовании метаболитов метилтиоаддукта парацетамола. Исследования на мышах, предварительно обработанных неомицином, и на стерильных мышах. Биохимическая фармакология. 1988 г., 15 апреля; 37 (8): 1445–1449. [PubMed] [Google Scholar]
46. Шу Ю.З., Кингстон Д.Г., Ван Тассел Р.Л., Уилкинс Т.Д. Метаболизм левамизола, препарата против рака толстой кишки, кишечными бактериями человека. ксенобиотики; судьба чужеродных соединений в биологических системах. 1991 июня; 21 (6): 737–50. [PubMed] [Google Scholar]
47. Jin MJ, Kim U, Kim IS, Kim Y, Kim DH, Han SB и др. Влияние кишечной микрофлоры на фармакокинетику гесперидина: исследование на крысах, не получавших антибиотики, и на псевдомикробных крысах. Журнал токсикологии и гигиены окружающей среды, часть A. 2010; 73 (21–22): 1441–50. [PubMed] [Google Scholar]
Jin MJ, Kim U, Kim IS, Kim Y, Kim DH, Han SB и др. Влияние кишечной микрофлоры на фармакокинетику гесперидина: исследование на крысах, не получавших антибиотики, и на псевдомикробных крысах. Журнал токсикологии и гигиены окружающей среды, часть A. 2010; 73 (21–22): 1441–50. [PubMed] [Google Scholar]
48. Lee NK, Choi SH, Park SH, Park EK, Kim DH. Противоаллергическая активность гесперидина активируется кишечной микрофлорой. Фармакология. 2004 г., август; 71 (4): 174–80. [PubMed] [Академия Google]
49. Колдуэлл Дж., Хоксворт Г.М. Деметилирование метамфетамина кишечной микрофлорой. Журнал фармации и фармакологии. 1973 г., май; 25 (5): 422–4. [PubMed] [Google Scholar]
50. Basit AW, Newton JM, Lacey LF. Чувствительность антагонистов h3-рецепторов циметидина, фамотидина и низатидина к метаболизму микрофлорой желудочно-кишечного тракта. Международный журнал фармацевтики. 2002 г., 26 апреля; 237 (1–2): 23–33. [PubMed] [Google Scholar]
51. Ватанабэ К., Ямасита С. , Фуруно К., Кавасаки Х., Гомита Ю. Метаболизм омепразола кишечной флорой у крыс. Журнал фармацевтических наук. 1995 апреля; 84 (4): 516–7. [PubMed] [Google Scholar]
, Фуруно К., Кавасаки Х., Гомита Ю. Метаболизм омепразола кишечной флорой у крыс. Журнал фармацевтических наук. 1995 апреля; 84 (4): 516–7. [PubMed] [Google Scholar]
52. Meuldermans W, Hendrickx J, Mannens G, Lavrijsen K, Janssen C, Bracke J, et al. Метаболизм и выведение рисперидона после перорального приема у крыс и собак. Метаболизм и расположение лекарств: биологическая судьба химических веществ. 1994 г., январь-февраль; 22 (1): 129–38. [PubMed] [Google Scholar]
53. Уодворт А.Н., Фиттон А. Олсалазин. Обзор его фармакодинамических и фармакокинетических свойств, а также терапевтического потенциала при воспалительных заболеваниях кишечника. Наркотики. 1991 апреля; 41 (4): 647–64. [PubMed] [Google Scholar]
54. Strong HA, Renwick AG, George CF, Liu YF, Hill MJ. Восстановление сульфинпиразона и сулиндака кишечными бактериями. ксенобиотики; судьба чужеродных соединений в биологических системах. 1987 г., июнь; 17 (6): 685–96. [PubMed] [Google Scholar]
55. Холт Р. Бактериальная деградация хлорамфеникола. Ланцет. 1967 г., 10 июня; 1 (7502): 1259–60. [PubMed] [Google Scholar]
Холт Р. Бактериальная деградация хлорамфеникола. Ланцет. 1967 г., 10 июня; 1 (7502): 1259–60. [PubMed] [Google Scholar]
56. Tozaki H, Emi Y, Horisaka E, Fujita T, Yamamoto A, Muranishi S. Метаболизм пептидных препаратов микроорганизмами в содержимом слепой кишки крыс. Биологический и фармацевтический вестник. 1995 июня; 18 (6): 929–31. [PubMed] [Google Scholar]
57. Шим С.Б., Ким Н.Дж., Ким Д.Х. Ингибирующая активность бета-глюкуронидазы и гепатопротекторный эффект 18-бета-глицирретиновой кислоты из корневищ Glycyrrhiza uralensis. Планта медика. 2000 г., февраль; 66 (1): 40–3. [PubMed] [Google Scholar]
58. Akao T, Hayashi T, Kobashi K, Kanaoka M, Kato H, Kobayashi M, et al. Кишечный бактериальный гидролиз необходим для поглощения 18-бета-глицирретиновой кислоты после перорального введения глицирризина крысам. Журнал фармации и фармакологии. 1994 февраля; 46 (2): 135–37. [PubMed] [Google Scholar]
59. Такено С., Сакаи Т. Участие кишечной микрофлоры в тератогенности, вызванной нитразепамом у крыс, и ее связь с нитровосстановлением. Тератология. 1991 г., август; 44 (2): 209–14. [PubMed] [Google Scholar]
Тератология. 1991 г., август; 44 (2): 209–14. [PubMed] [Google Scholar]
60. Harris BE, Manning BW, Federle TW, Diasio RB. Превращение 5-фторцитозина в 5-фторурацил кишечной микрофлорой человека. Антимикробные препараты и химиотерапия. 1986 г., январь; 29 (1): 44–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Lavrijsen K, van Dyck D, van Houdt J, Hendrickx J, Monbaliu J, Woestenborghs R, et al. Восстановление оксида пролекарства лоперамида до его активного лекарственного средства лоперамида в кишечнике крыс, собак и людей. Метаболизм и расположение лекарств: биологическая судьба химических веществ. 1995 март; 23 (3): 354–62. [PubMed] [Google Scholar]
62. Тралау Т., Совада Дж., Луч А. Взгляд на микробиом человека и его ксенобиотический метаболизм: что известно о его влиянии на физиологию человека? Экспертное мнение о метаболизме и токсикологии лекарственных средств. 2015 март; 11 (3): 411–25. [PubMed] [Академия Google]
63. Nakayama H, Kinouchi T, Kataoka K, Akimoto S, Matsuda Y, Ohnishi Y. Кишечные анаэробные бактерии гидролизуют соривудин, образуя высокую концентрацию 5-(E)-(2-бромвинил)урацила в крови, что повышает уровень и токсичность 5-фторурацила. Фармакогенетика. 1997 г., февраль; 7 (1): 35–43. [PubMed] [Google Scholar]
Кишечные анаэробные бактерии гидролизуют соривудин, образуя высокую концентрацию 5-(E)-(2-бромвинил)урацила в крови, что повышает уровень и токсичность 5-фторурацила. Фармакогенетика. 1997 г., февраль; 7 (1): 35–43. [PubMed] [Google Scholar]
64. Mao B, Li D, Zhao J, Liu X, Gu Z, Chen YQ и др. Ферментация лактулозы in vitro кишечными бактериями человека. Журнал сельскохозяйственной и пищевой химии. 2014 ноя 12;62(45):10970–7. [PubMed] [Google Scholar]
65. Trinh HT, Joh EH, Kwak HY, Baek NI, Kim DH. Противозудный эффект байкалина и его метаболитов, байкалеина и ороксилина А, у мышей. Acta Pharmalogica Sinica. 2010 июнь; 31 (6): 718–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Kang MJ, Ko GS, Oh do G, Kim JS, Noh K, Kang W, et al. Роль метаболизма микробиотой кишечника в фармакокинетике перорального байкалина. Архив фармацевтических исследований. 2014 март; 37 (3): 371–378. [PubMed] [Академия Google]
67. Matties A, Clavel T, Gutschow M, Engst W, Haller D, Blaut M, et al. Преобразование даидзеина и генистеина анаэробной бактерией, недавно выделенной из кишечника мыши. Прикладная и экологическая микробиология. 2008 г., август; 74 (15): 4847–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Преобразование даидзеина и генистеина анаэробной бактерией, недавно выделенной из кишечника мыши. Прикладная и экологическая микробиология. 2008 г., август; 74 (15): 4847–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Renouf M, Hendrich S. Bacteroides uniformis — предполагаемый бактериальный вид, связанный с деградацией изофлавонового генистеина в фекалиях человека. Дж Нутр. 2011 г., июнь; 141 (6): 1120–26. [PubMed] [Академия Google]
69. Akao T, Kida H, Kanaoka M, Hattori M, Kobashi K. Для появления соединения K в плазме крови крыс после перорального введения гинзенозида Rb-1 из женьшеня Panax необходим кишечный бактериальный гидролиз. Журнал фармации и фармакологии. 1998 окт; 50 (10): 1155–60. [PubMed] [Google Scholar]
70. Matties A, Loh G, Blaut M, Braune A. Daidzein и Genistein преобразуются в эквол и 5-гидрокси-эквол под действием Slackia isoflavoniconvertens в кишечнике человека у гнотобиотических крыс. Дж Нутр. 2012 г., январь; 142 (1): 40–46. [PubMed] [Академия Google]
[PubMed] [Академия Google]
71. Schneider H, Simmering R, Hartmann L, Pforte H, Blaut M. Деградация кверцетин-3-глюкозида у гнотобиотических крыс, связанная с кишечными бактериями человека. Журнал прикладной микробиологии. 2000 г., декабрь; 89 (6): 1027–37. [PubMed] [Google Scholar]
Как лекарства влияют на микробиом кишечника: ДЖК
Если «экосистему» кишечных бактерий, так называемый микробиом, лекарствами изменить, это может иметь как хорошие, так и плохие последствия. Исследователи из нескольких европейских стран хотят выяснить, как те или иные сердечно-сосудистые заболевания и микробиом влияют друг на друга — и какую роль в этом играют назначенные лекарства.
Диета, курение или болезнь изменяют микробиом кишечника. Лекарства — антибиотики или неантибиотики — одинаково сильно влияют на молекулярные характеристики микробиома. Ученый ДЖК доктор София Форслунд из Центра молекулярной медицины Макса Дельбрюка в Ассоциации Гельмгольца (MDC) определила это вместе с международной командой ученых. Швед проводит в Берлине исследование по вопросу о том, как микробиом и сердечно-сосудистые заболевания влияют друг на друга.
Швед проводит в Берлине исследование по вопросу о том, как микробиом и сердечно-сосудистые заболевания влияют друг на друга.
В новом исследовании биоинформатик и другие ученые проанализировали данные более 2000 пациентов с кардиометаболическими заболеваниями. Кардиометаболические заболевания включают, например, ишемическую болезнь сердца и диабет 2 типа. Чтобы иметь возможность рассматривать эффекты лекарств и болезней отдельно друг от друга, исследователи иногда используют недавно разработанные статистические методы.
Новое исследование основывается на открытии, которое София Форслунд уже сделала несколькими годами ранее и которое удивило тогдашних экспертов: часто назначаемый препарат от диабета метформин изменяет микробы, живущие в кишечнике, больше, чем само заболевание.
Воздействие лекарств на микробиом может иметь как хорошие, так и плохие последствия: в случае с антибиотиками исследование подтвердило, что они разрушают разнообразие кишечной флоры, особенно если их принимать неоднократно. Уничтожение кишечных микробов в свою очередь способствует развитию кардиометаболических заболеваний и отрицательно сказывается на их течении. Это касается и других хронических заболеваний. Кроме того, потеря кишечных микробов ослабляет эффективность лечения.
Уничтожение кишечных микробов в свою очередь способствует развитию кардиометаболических заболеваний и отрицательно сказывается на их течении. Это касается и других хронических заболеваний. Кроме того, потеря кишечных микробов ослабляет эффективность лечения.
Но лекарства также могут оказывать положительное влияние на микробиом: «Мы обнаружили, что лекарства, принимаемые одновременно, могут взаимно усиливать свое воздействие на микробиом», — говорит Форслунд. Некоторые лекарства имеют очень положительный эффект. Например, ученым удалось показать, что одновременный прием бета-блокаторов и диуретиков, которые используются при повышенном артериальном давлении, связан с увеличением количества бактерий рода Roseburia в кишечнике. Эти микробы оказывают противовоспалительное действие на организм. «Такие неожиданные эффекты лекарств могут быть использованы в медицине в будущем», — говорит София Форслунд.
«Вы также должны быть осторожны при планировании исследований биомаркеров.