Какие препараты наиболее эффективны для улучшения мозговой деятельности. Как выбрать оптимальное средство для активизации работы мозга. На что обратить внимание при выборе ноотропов и нейропротекторов.
Классификация препаратов для улучшения работы мозга
Препараты для улучшения мозговой деятельности можно разделить на несколько основных групп:
- Ноотропы — улучшают память, концентрацию, обучаемость
- Нейропротекторы — защищают нервные клетки от повреждений
- Вазоактивные средства — улучшают кровоснабжение мозга
- Антиоксиданты — борются со свободными радикалами
- Витамины и минералы — обеспечивают питание мозга
Выбор конкретного препарата зависит от имеющихся проблем и целей применения. Рассмотрим наиболее эффективные средства из разных групп.
ТОП-10 препаратов для улучшения работы мозга
1. Ноопепт
Ноопепт — современный ноотропный препарат с выраженным нейропротекторным действием. Его основные эффекты:
- Улучшение памяти и обучаемости
- Повышение концентрации внимания
- Ускорение мышления
- Защита нейронов от повреждений
Ноопепт отличается быстрым началом действия и высокой эффективностью при минимуме побочных эффектов. Препарат хорошо подходит для здоровых людей с повышенными умственными нагрузками.

2. Пирацетам
Пирацетам — классический ноотропный препарат с доказанной эффективностью. Его основные свойства:
- Улучшение памяти и концентрации
- Повышение устойчивости мозга к стрессам
- Ускорение межполушарного взаимодействия
- Активизация энергетических процессов в нейронах
Пирацетам хорошо изучен и широко применяется при различных нарушениях мозгового кровообращения, последствиях травм и инсультов. Эффективен для профилактики возрастных изменений мозга.
3. Церебролизин
Церебролизин — комплексный нейропептидный препарат с мощным нейротрофическим и нейропротекторным действием. Его эффекты:
- Стимуляция роста и восстановления нейронов
- Улучшение когнитивных функций
- Защита мозга от ишемии и гипоксии
- Активизация пластичности мозга
Церебролизин особенно эффективен при тяжелых нарушениях мозгового кровообращения, травмах мозга, деменции. Препарат вводится внутривенно или внутримышечно курсами.
4. Винпоцетин (Кавинтон)
Винпоцетин — вазоактивный препарат с ноотропным действием. Его основные свойства:

- Улучшение мозгового кровообращения
- Повышение утилизации глюкозы и кислорода нейронами
- Улучшение памяти и концентрации
- Снижение вязкости крови
Винпоцетин эффективен при нарушениях мозгового кровообращения, головокружениях, шуме в ушах. Хорошо подходит для профилактики возрастных изменений мозга у пожилых людей.
5. Гинкго билоба
Гинкго билоба — растительный препарат с комплексным действием на мозг. Его основные эффекты:
- Улучшение мозгового кровообращения
- Антиоксидантное действие
- Улучшение памяти и концентрации
- Замедление возрастных изменений мозга
Препараты гинкго билоба хорошо изучены и широко применяются для профилактики возрастных нарушений памяти и мышления. Они безопасны при длительном применении.
6. Цитиколин (Цераксон)
Цитиколин — нейропротектор с выраженным ноотропным действием. Его свойства:
- Восстановление поврежденных мембран нейронов
- Улучшение синтеза ацетилхолина
- Повышение уровня дофамина в мозге
- Улучшение памяти и концентрации
Цитиколин эффективен при инсультах, травмах мозга, когнитивных нарушениях. Препарат хорошо сочетается с другими ноотропами, усиливая их действие.
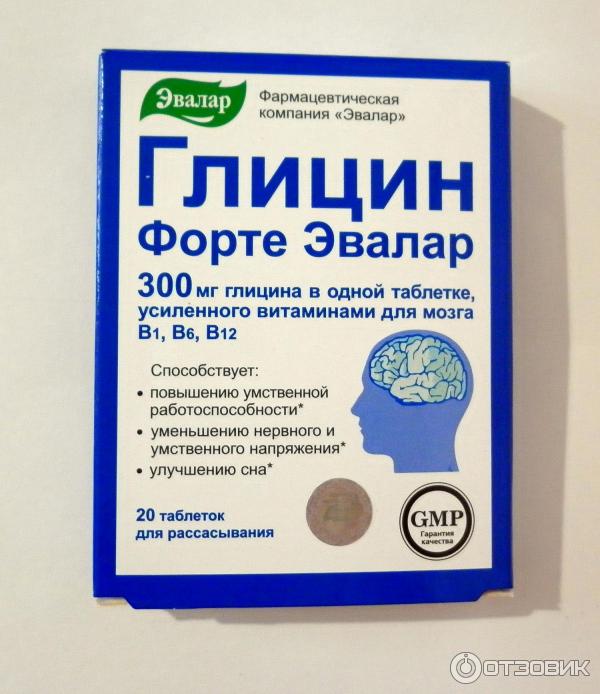
7. Глицин
Глицин — аминокислота с нейропротекторным и мягким седативным действием. Его эффекты:
- Защита нейронов от повреждений
- Улучшение метаболизма в мозге
- Снижение психоэмоционального напряжения
- Улучшение сна
Глицин хорошо подходит для снятия стресса и умственного перенапряжения. Препарат безопасен и может применяться длительно, в том числе у детей.
8. Фенотропил
Фенотропил — мощный ноотропный препарат с психостимулирующим действием. Его свойства:
- Выраженное улучшение памяти и обучаемости
- Повышение умственной работоспособности
- Ускорение мышления
- Повышение физической выносливости
Фенотропил эффективен при астении, синдроме хронической усталости, повышенных умственных нагрузках. Препарат достаточно мощный и применяется курсами под наблюдением врача.
9. Мексидол
Мексидол — антиоксидантный препарат с нейропротекторным действием. Его основные эффекты:
- Защита нейронов от окислительного стресса
- Улучшение энергетического обмена в мозге
- Улучшение микроциркуляции
- Уменьшение тревоги и эмоциональной лабильности
Мексидол эффективен при ишемии мозга, нейродегенеративных заболеваниях, последствиях черепно-мозговых травм. Препарат хорошо сочетается с другими ноотропами.

10. Омега-3 жирные кислоты
Омега-3 — незаменимые жирные кислоты с нейропротекторным действием. Их эффекты:
- Улучшение структуры мембран нейронов
- Противовоспалительное действие
- Улучшение когнитивных функций
- Замедление возрастных изменений мозга
Омега-3 жирные кислоты необходимы для нормальной работы мозга. Их дополнительный прием эффективен для профилактики возрастных нарушений памяти и мышления.
Как выбрать оптимальный препарат для улучшения работы мозга
При выборе средства для улучшения мозговой деятельности следует учитывать несколько факторов:
- Имеющиеся проблемы и симптомы
- Цели применения (профилактика или лечение)
- Возраст и состояние здоровья
- Противопоказания и побочные эффекты
- Совместимость с другими препаратами
Оптимальный выбор лучше делать после консультации с врачом. Это особенно важно при наличии хронических заболеваний или приеме других лекарств.
Заключение
Современная фармакология предлагает широкий выбор эффективных средств для улучшения работы мозга. Правильно подобранные препараты помогают улучшить память, концентрацию, повысить умственную работоспособность. При этом важно помнить, что лекарства — не панацея. Для поддержания здоровья мозга необходим комплексный подход, включающий правильное питание, физическую активность и умственные нагрузки.

Препараты для улучшения работы головного мозга
Многие, если не все, хотя бы раз в жизни замечали яркие проявления неприятных симптомов, характеризующих начало органических изменений головного мозга: беспричинные головные боли, звон и шум в ушах, проблемы с памятью, фотопсии (ложное ощущение света в глазах) и др.
Эти симптомы говорят об ишемии головного мозга, или, проще говоря — о нарушении мозгового кровообращения.
Ишемия мозга, как правило, вторична и вызывается каким-либо другим заболеванием. В 95% случаев такой патологией выступает атеросклероз. Суть заболевания состоит в образовании жирных наслоений (холестериновых комплексов) на стенках крупных сосудов, обеспечивающих кровью головной мозг, и последующем сужении их просвета.
Закупорка (окклюзия) сосудов приводит к повышению артериального давления. В результате сосуд от чрезмерной нагрузки может попросту лопнуть. Это повреждение тканей мозга носит название инсульт.
Однако не только атеросклероз, но и ряд других заболеваний и состояний приводят к нарушениям работы органа. Среди них наиболее часто встречаются вегето-сосудистая дистония (ВСД), мигрень, черепно-мозговые травмы и т.д. Суть этих процессов заключаются не в окклюзии, а в сужении (стенозе) сосудов в результате спазма.
Среди них наиболее часто встречаются вегето-сосудистая дистония (ВСД), мигрень, черепно-мозговые травмы и т.д. Суть этих процессов заключаются не в окклюзии, а в сужении (стенозе) сосудов в результате спазма.
При данных патологиях нейроны головного мозга также недополучают крови, богатой кислородом и питательными веществами. Как итог — все ярче и интенсивнее нарастают характерные симптомы и отмирают клетки-нейроны, что может привести к раннему слабоумию.
Таким образом, необходимо тщательно следить за своим здоровьем, а не отмахиваться от проблем, надеясь на «авось».
К счастью, недостаточность кровообращения можно компенсировать приёмом препаратов. Лечение недостаточности кровообращения успешно устраняется комплексом специализированных препаратов, одни из которых снимают спазм, другие качественно улучшают характеристики крови (вязкость и т.д.), благодаря чему снижается риск тромбообразования.
Содержание
- Препараты, предназначенные для расширения сосудов
- Кальциевые блокаторы (антагонисты кальция)
- Препараты на основе растительных алкалоидов
- Препараты на основе барвинка
- Препараты на основе Гинкго Билоба
- Никотиновая кислота и её производные
- Препараты, укрепляющие стенки сосудов
- Ноопепт
- Препараты для лечения мигрени
- Питание при нарушении мозгового кровообращения
Препараты, предназначенные для расширения сосудов
Кальциевые блокаторы (антагонисты кальция)
Блокаторы кальциевых каналов препятствуют проникновению ионов кальция в стенки сосудов, тем самым снижая тонус артерий. Никакого вредного воздействия на вены, при этом, препараты не оказывают.
Никакого вредного воздействия на вены, при этом, препараты не оказывают.
Антагонисты кальция производят сильнейший сосудорасширяющий эффект. В результате спазм сосудов спадает, кровоснабжение приходит в норму, и головной мозг обеспечивается необходимым количеством кислорода и питательных веществ.
В данный момент разрабатывается вот уже третье поколение препаратов этой группы.
Блокаторы первого поколения разработаны ещё в 60-е годы и включают в себя следующие наименования:
- Фенилалкиламин и его производные (верапамил, торговое название Изо- и Финоптин).
- Дигидропиридин и его производные (нифедипин, торговые названия Адалат, Кордипин, Коринфар, Фенигидин и др.).
- Бензодиазепин и его производные (дилтиазем, торговое название идентично или Диазем).
Препараты второго поколения характеризовались большей эффективностью и меньшим количеством побочных эффектов, а также большей длительностью действия:
- Амлодипин и иные лекарства, оканчивающиеся постфиксом «дипин», кроме Кордипина.
- Клентиазем.
- Анипамил и иные препараты, оканчивающиеся постфиксом «амил», кроме верапамила.
- Ломир (Исрадипин).
Группа препаратов-антагонистов кальция обладает массой побочных эффектов со стороны большинства систем организма, поэтому применяться эти лекарства должны с осторожностью, в строгом соответствии с дозировкой и обязательно только по назначению грамотного специалиста.
Все описанные выше препараты — общего действия. Это означает, что они действуют не избирательно, а влияют в одинаковой степени сразу на все сосуды.
Специально для воздействия на сосуды головного мозга существуют лекарства, действующие целенаправленно, например:Циннаризин, Нимодипин и другие.
Препараты на основе растительных алкалоидов
Препараты на основе барвинка
Существенным терапевтическим эффектом обладают препараты на основе алкалоида, содержащегося в распространённом растении — могильнике (барвинке). Действующее вещество из этого растения обладает выраженным спазмолитическим действием, расширяя стенки сосудов. Кроме того, алкалоид из барвинка улучшает свойства крови, повышает скорость циркуляции, тем самым обеспечивая клетки головного мозга оптимальным количеством питания и кислорода.
Кроме того, алкалоид из барвинка улучшает свойства крови, повышает скорость циркуляции, тем самым обеспечивая клетки головного мозга оптимальным количеством питания и кислорода.
Среди препаратов алкалоидной группы распространены:
- Кавинтон (и Кавинтон Форте, обладающий пролонгированным действием).
- Винпоцетин (или Винцетин).
- Бравинтон.
- Веро-Винпоцетин.
- Телектол.
- Винцетин.
Препараты на основе растительного алкалоида широко разрекламированы на телевидении и отлично переносятся пациентами. Они имеют минимум противопоказаний и побочных эффектов, потому в умеренных дозах допускается их самостоятельное применение.
Однако любой препарат должен назначаться врачом, и зачастую одного только Кавинтона или другого лекарства данной группы недостаточно. Поэтому самолечение может быть не только не эффективно, но ещё и опасно, поскольку пациент тратит драгоценное время на пустые хлопоты.
Алкалоидные лекарства выпускаются как в форме таблеток, так и в форме инъекций. Последние значительно эффективнее, поскольку вводятся напрямую в кровеносное русло, минуя слизистую желудка и кишечника. Оптимальный способ применения определяет врач.
Последние значительно эффективнее, поскольку вводятся напрямую в кровеносное русло, минуя слизистую желудка и кишечника. Оптимальный способ применения определяет врач.
Препараты на основе Гинкго Билоба
Также широко разрекламированы, однако в отличие от многих препаратов сомнительного качества, «хвалебные оды» об этом препарате поются вполне справедливо.
Препараты на основе данного растения обладают целым комплексом полезных свойств: они снижают тонус артерий, повышают проницаемость их стенок, обладают сосудорасширяющим действием, а кроме того, имеют выраженное антиоксидантное действие и препятствуют окислению клеточных структур (что важно для предупреждения онкологии).
Лекарства, содержащие экстракт данного растения к тому же снимают отеки и улучшают обмен веществ нервных тканей головного мозга.
Лицам, страдающим от нервных или сердечнососудистых заболеваний, скорее всего, известны наименования данных препаратов:
Медикаменты этого типа отпускаются без рецепта, потому для их приобретения и приёма нет никаких препятствий. Некоторые из них и вовсе не признаются препаратами, а считаются биологически-активными добавками (БАДами). Однако перед их приёмом лучшим решением станет консультация с врачом. Бесконтрольный приём даже безопасных с первого взгляда веществ может обернуться абсолютно неожиданным образом.
Некоторые из них и вовсе не признаются препаратами, а считаются биологически-активными добавками (БАДами). Однако перед их приёмом лучшим решением станет консультация с врачом. Бесконтрольный приём даже безопасных с первого взгляда веществ может обернуться абсолютно неожиданным образом.
Следует также знать о сочетаемости препаратов. Так, гинкго-препараты не сочетаются с аспирином, поскольку повышают текучесть крови. Из-за этого возникает риск мозгового кровоизлияния.
Никотиновая кислота и её производные
Препараты, основным действующим веществом которых является никотиновая кислота и её производные (т.е. такие вещества, которые имеют схожую с кислотой химическую основу, однако в структуре располагается 1 или более заместителей) обладают двойным действием:
- Во-первых, они эффективно устраняют излишки «плохого» холестерина в крови и очищают тем самым крупные артерии от холестериновых бляшек.
- Во-вторых, никотиновые препараты расширяют капилляры, улучшая микроциркуляцию крови в малых кровеносных сосудах.
 Вены и артерии, при этом, практически не затрагиваются, поскольку сосудорасширяющее воздействие рассчитано на мелкие сосуды, которыми богаты все отделы головного мозга.
Вены и артерии, при этом, практически не затрагиваются, поскольку сосудорасширяющее воздействие рассчитано на мелкие сосуды, которыми богаты все отделы головного мозга.
Препарат чаще всего назначается при атеросклерозе, благодаря своим свойствам. Основная форма введения в организм — инъекция.
Никотиносодержащие медикаменты обладают довольно неприятными побочными эффектами и вызывают сильное чувство жжения и жара, а также покраснение кожных покровов. Эти проявления как раз и связаны с расширением разветвлённой сети капилляров. В некоторых случаях врач может посчитать более целесообразным пероральный приём препаратов никотина. Среди лекарств этой группы можно встретить: Никошпан, Эндуратин и другие.
Все никотиновые медикаменты отпускаются только по рецепту врача, поскольку их самостоятельный приём может привести к тяжёлым повреждениям печени и выделительной системы.
Препараты, укрепляющие стенки сосудов
Многие сердечнососудистые заболевания, которые сопровождаются изменениями в головном мозге, существенно влияют на сосуды. Кровеносные магистрали становятся ломкими и теряют нормальную эластичность. Специально для повышения интенсивности обменных процессов сосудов, восстановления их эластичности и проницаемости назначаются препараты особой группы.
Кровеносные магистрали становятся ломкими и теряют нормальную эластичность. Специально для повышения интенсивности обменных процессов сосудов, восстановления их эластичности и проницаемости назначаются препараты особой группы.
Как правило, в эту группу входят витамины, а также некоторые минералы и микроэлементы:
- Рутин (P-витамин). Собирательное название целой группы активных веществ, среди которых флавоноиды, антоцианы и другие. Способствует нормальному синтезу клеточных структур, потому необходим для поддержания оптимального тонуса сосудов. Наибольшее действие вещества достигается в комплексе с витамином С, который препятствует повторному разрушению клеток под воздействием окислителей.
- Микроэлементы Калий, Селен и Кремний.Хорошим подспорьем в деле оздоровления сосудов головного мозга станут витаминные комплексы, содержащие эти микроэлементы. Кроме витаминных комплексов также рекомендуется приём некоторых БАДов, пищевых добавок, произведённых на основе растений-адаптогенов.

- Дигидроквертицин.Дигидроквертицин обладает свойством расширять сосуды и поддерживать их стабильный тонус.
В пределах указанной в аннотации к данным препаратам и витаминным комплексам дозировки, допускается самостоятельный приём. Активные вещества полезны не только для лечения, но и для профилактики нарушений функционирования головного мозга.
Ноопепт
Среди ноотропных препаратов, описанных выше (Пирацетам, Аминалон и др.) наиболее эффективен ноотропный препарат нового поколения — Ноопепт.
Ноотропные препараты направлены на стимуляцию работы мозга, улучшение памяти и защиту мозга от неблагоприятных воздействий. Фармакологическое действие этой группы медикаментов основано на улучшение циркуляции крови по капиллярам и крупным кровеносным сосудам, а также повышении интенсивности обмена веществ в сосудах.
Ноопепт стоит в группе ноотропных препаратов особняком, поскольку обладает пролонгированным действием и практически не имеет побочных действий. Он назначается лицам с ярко выраженными ишемическими проявлениями, возникшими в результате травм, атеросклеротических изменений и т.д.
Он назначается лицам с ярко выраженными ишемическими проявлениями, возникшими в результате травм, атеросклеротических изменений и т.д.
Всё же, несмотря на эффективность препарата, производители не рекомендуют его принимать лицам до 18-и лет, беременным и кормящим, а также лицам с нарушениями работы печени и выделительной системы. Препарат характеризуется минимумом побочных эффектов. Всё же бесконтрольно принимать Ноопепт не следует.
Препараты для лечения мигрени
Мигрень – сложная неврологическая патология, затрагивающая сосуды. В ходе развития она проходит ряд стадий, на каждой из которых сосуды претерпевают те или иные изменения.
- Тонус сосудов снижается.
- В области разветвления сонной артерии происходит спазм.
- Сосуды головы расширяются, но при этом остаются в спазмированном состоянии, что делает их уязвимыми к растяжению.
- Стенка сосуда и прилегающие ткани отекают, поскольку проницаемость кровеносной магистрали снижена.
- Тонус сосудов нормализуется, и магистраль возвращается в первоначальное состояние.

Поскольку сосуды в момент приступа мигрени и без того находятся в расширенном состоянии, сосудорасширяющие препараты здесь не помогут.
Эффективнее всего принимать следующий комплекс лекарственных препаратов: анальгетики, противовоспалительные средства, антагонисты серотонина (чтобы устранить излишнее расширение сосудов). Если с первыми двумя — всё ясно, антагонисты серотонина включают в себя несколько препаратов: Амердж, Зомиг и др.
Несмотря на распространённое мнение, мигрень отнюдь не так безопасна, и её лечение должно происходить строго под контролем врача. Самостоятельный приём препаратов недопустим.
Питание при нарушении мозгового кровообращения
Чтобы снизить риск развития осложнений, обусловленных нарушением работы мозга, важно скорректировать свой рацион.
Обязательно употребление следующих продуктов:
- Зерновые продукты. Отруби, свежий хлеб, каши из круп обеспечивают мозг необходимыми витаминами группы B.
- Орехи и семена.
 Необходимы для пополнения «запасов» витамина E.
Необходимы для пополнения «запасов» витамина E. - Овощи.
- Яйца.
- Ягоды (черника и черная смородина). Способствуют улучшению памяти.
- Брокколи.
- Рыба. Богата фосфором.
- Свежие фрукты (в особенности яблоки). Препятствуют окислительным процессам, повышают мозговую активность. К тому же яблоки очищают сосуды от вредных веществ.
Таким образом, панацеи от нарушений работы мозга не существует. В зависимости от патологии необходимо подбирать специфическое лечение. Часто проблема нарушений мозговой деятельности кроется не в одном, а сразу в нескольких факторах. В этом случае лечение будет комплексным. Так или иначе, без грамотной медицинской помощи справиться с проблемой невозможно.
Автор статьи: Волков Дмитрий Сергеевич | к. м. н. врач-хирург, флеболог
Образование: Московский государственный медико-стоматологический университет (1996 г.). В 2003 году получил диплом учебно-научного медицинского центра управления делами президента Российской Федерации.
Наши авторы
Механизмы нейротрофического и нейропротекторного действия препарата церебролизин при ишемии головного мозга
Высокая распространенность неврологических заболеваний (прежде всего ишемического инсульта и деменций) обусловливает необходимость рационального выбора наиболее эффективных препаратов. Если ранее считалось, что вазоактивные препараты имеют наибольшее значение для восстановления функций головного мозга, то в настоящее время происходит смещение акцента в сторону нейропротективных и нейротрофических препаратов.
Одним из таких препаратов является церебролизин (EVER Neuro Pharma, Австрия) — результат экстрагирования пептидной фракции головного мозга молодых свиней. Данный препарат отвечает требованиям международных стандартов нейропротекции в терапевтической и педиатрической практике [1]. Церебролизин производится и клинически тестируется в соответствии с существующими стандартами [2]. Многочисленные исследования указывают на несомненный положительный эффект применения препарата при инсульте, черепно-мозговой травме (ЧМТ), деменциях и перинатальной энцефалопатии.
В течение ряда лет нами исследовался состав церебролизина, включая олигопептидную и мембранную фракции [3, 10], витаминную активность [4], аминокислотный [5] и микроэлементный состав [6, 7], его воздействие на гомеостаз микроэлементов мозга [8, 9].
Исследование проводилось с использованием универсального метода для решения задач молекулярной фармакологии пептидных препаратов, состоящего из 5 основных стадий. Результаты исследования пептидного состава препарата представлены в
 Комплексный анализ состава церебролизина позволил установить наличие в нем биоактивных пептидных фрагментов нейропептидов фактора роста нервов (ФРН), энкефалинов, орексина, галанина [10-12].
Комплексный анализ состава церебролизина позволил установить наличие в нем биоактивных пептидных фрагментов нейропептидов фактора роста нервов (ФРН), энкефалинов, орексина, галанина [10-12].Фактор роста нервов необходим для развития и восстановления сетей нейронов. Связывается специфическими рецепторами TrkA (тирозинкиназа А) и LNGFR (от англ. «low affinity nerve growth factor receptor», т.е. «низкоафинный рецептор NGF»), которые и стимулируют процессы деления и дифференциации. В составе церебролизина были найдены два пептида, образовавшихся при протеолизе секретируемой молекулы ФРН: GEFSV, соответствующий остаткам 119-123 полипептида и NSYCTTT, соответствующий остаткам 186-192. Эти пептиды образуются при неспецифическом протеолизе в процессе производства препарата. Анализ взаимодействия ФРН с рецептором позволяет предположить, что пептид GEFSV (119-123) непосредственно может контактировать с молекулой рецептора, тем самым проявляя нейротрофическую активность [13]. Известны модельные пептиды, включающие GEFSV, обладающие ФРН-подобной активностью [14, 15].
Энкефалины. В составе исследованных фракций церебролизина были обнаружены несколько эндорфин/энкефалинподобных пептидов: tyr-gly-gly-phe-leu (YGGFL), gly-gly-phe-leu-arg (GGFLR) и tyr-gly-gly-phe-met (YGGFM). Leu-энкефалины и динорфины синтезируются в организме в результате протеолиза полипептида, кодируемого геном PDYN (динорфин). Энкефалины — эндогенные опиоидные пептидные нейротрансмиттеры, которые поддерживают множество физиологических и психологических функций, включая реакцию на стресс, восприятие боли, эмоции, контроль приема пищи и др.
Нейропептид VF. В составе исследованных фракций церебролизина был найден пептид PQRF, соответствующий фрагменту нейропептида VF. К настоящему времени имеется мало данных о его роли, хотя и известно, что нейропептид VF может активировать мю-опиоидные и каппа-опиоидные рецепторы и регулировать работу гипоталамуса [16].
Орексин. Пептид cys-cys-arg-gln-lys (CCRQK), найденный в образцах церебролизина, идентифицируется как фрагмент полипептида орексина (ген ORX). Пептид CCRQK локализуется в районе 39-43 полипептида орексина и, по данным интегрального биоинформационного анализа, может иметь важное значение для взаимодействия орексина-А с рецепторами. Орексины (гипокретины) играют роль в регуляции приема пищи, цикла сон-бодрствование [17] и воздействуют на разнообразные аспекты физиологии человека, включая энергетический метаболизм, баланс гормонов, регуляцию уровня жидкости в организме. Орексин-А увеличивает экспрессию нейротрофина-3 [18], который в свою очередь поддерживает выживание и дифференциацию нейронов, стимулируя нейроно- и синаптогенез.
Галанин. В составе церебролизина имеется галанинподобный пептид WWLNSAGY (в галанинах соответствующий пептид имеет последовательность WTLNSAGY). Анализ интегрированной функциональной карты галанина указывает на фрагмент 33-42, имеющий важное значение для взаимодействия галанина с рецепторами. Галанин (ген GALN) участвует в таких разнообразных процессах как регуляция приема пищи, энергетический метаболизм, регулирование секреции других нейротрансмиттеров, модуляция ноцицепции, перистальтика, восстановление нервной системы после повреждений. Галанин выступает как нейропептид, модулирующий секрецию нейротрансмиттеров ацетилхолина, серотонина и норадреналина [19, 20]. Активация рецепторов галанина оказывает антиконвульсантное, антидепрессантное действие [21]. Галанин необходим для развития нейронов [22], стимулируя спраутинг аксонов [23].
Галанин (ген GALN) участвует в таких разнообразных процессах как регуляция приема пищи, энергетический метаболизм, регулирование секреции других нейротрансмиттеров, модуляция ноцицепции, перистальтика, восстановление нервной системы после повреждений. Галанин выступает как нейропептид, модулирующий секрецию нейротрансмиттеров ацетилхолина, серотонина и норадреналина [19, 20]. Активация рецепторов галанина оказывает антиконвульсантное, антидепрессантное действие [21]. Галанин необходим для развития нейронов [22], стимулируя спраутинг аксонов [23].
Идентифицированные пептиды функционально значимы и могут проявлять специфическую биологическую активность, взаимодействуя с соответствующими рецепторами [10].
В работе проведено сопоставление результатов молекулярно-биологического исследования состава церебролизина и результатов его клинических и экспериментальных исследований.
В многочисленных исследованиях была продемонстрирована эффективность церебролизина в терапии ишемических повреждений мозга в составе комплексной терапии. Применение церебролизина при инсульте и ЧМТ достоверно снижает неврологический дефицит [24], улучшает когнитивные способности [25, 26], восстанавливает биоэлектрическую активность мозга [27], снижает объем зоны инфаркта [28]. Экспериментальные исследования подтвердили результаты клинических наблюдений и позволили уточнить физиологические механизмы действия препарата. Церебролизин оказывает нейрорегенеративное воздействие [29], ослабляя нарушения структуры нейронов [30, 31], улучшает когнитивные функции на моделях диабета, снижает уровни провоспалительного фактора ФНО-альфа, повышает уровни инсулиноподобного гормона роста IGF-1, серотонина и оказывает антиоксидантное действие [32].
Применение церебролизина при инсульте и ЧМТ достоверно снижает неврологический дефицит [24], улучшает когнитивные способности [25, 26], восстанавливает биоэлектрическую активность мозга [27], снижает объем зоны инфаркта [28]. Экспериментальные исследования подтвердили результаты клинических наблюдений и позволили уточнить физиологические механизмы действия препарата. Церебролизин оказывает нейрорегенеративное воздействие [29], ослабляя нарушения структуры нейронов [30, 31], улучшает когнитивные функции на моделях диабета, снижает уровни провоспалительного фактора ФНО-альфа, повышает уровни инсулиноподобного гормона роста IGF-1, серотонина и оказывает антиоксидантное действие [32].
Экспериментальные исследования показали, что нейропротекторные свойства церебролизина связаны с активацией сигнального каскада Shh, сигнального пути PI3K/Akt, стимулирования ангиогенеза и модуляции синтеза и секреции оксида азота.
Улучшение неврологических функций после инсульта при лечении церебролизином связывают с активацией сигнального каскада Shh. Терапия церебролизином значительно увеличивала деление клеток-предшественников нейронов и их дифференциацию в нейроны и в миелинизирующие олигодендроциты. Эти изменения сопровождались параллельным увеличением активности каскада Shh [33]. Shh осуществляет масштабную координацию клеточного роста и не обладает нейротрофическим эффектом как таковым. Активность каскада Shh имеет огромное значение для процессов развития эмбриона, осуществляя формирование общей структуры конечностей, структур головного мозга [34], спинного мозга [35], таламуса [36]. Одной из наиболее изученных ролей каскада Shh является формирование нервной трубки плода из базальной пластины и формирование вентральных типов клеток в нервной трубке [37]. Исследования ФРН указали на существование взаимодействий между сигнальным каскадом Shh, ростом нейритов и активностью ретиноидных рецепторов. Рецептор ретиноидов RARβ2 экспрессируется в нейронах с маркерами NF200, CGRP и IB4. Нейроны этого типа стимулируют рост нейритов в ответ на воздействие ретиноидов.
Терапия церебролизином значительно увеличивала деление клеток-предшественников нейронов и их дифференциацию в нейроны и в миелинизирующие олигодендроциты. Эти изменения сопровождались параллельным увеличением активности каскада Shh [33]. Shh осуществляет масштабную координацию клеточного роста и не обладает нейротрофическим эффектом как таковым. Активность каскада Shh имеет огромное значение для процессов развития эмбриона, осуществляя формирование общей структуры конечностей, структур головного мозга [34], спинного мозга [35], таламуса [36]. Одной из наиболее изученных ролей каскада Shh является формирование нервной трубки плода из базальной пластины и формирование вентральных типов клеток в нервной трубке [37]. Исследования ФРН указали на существование взаимодействий между сигнальным каскадом Shh, ростом нейритов и активностью ретиноидных рецепторов. Рецептор ретиноидов RARβ2 экспрессируется в нейронах с маркерами NF200, CGRP и IB4. Нейроны этого типа стимулируют рост нейритов в ответ на воздействие ретиноидов. Сигналы от их рецепторов регулируют рост аксонов и ФРН-зависимый рост аксонов тормозится при делеции генов рецепторов ретиноидов. Каскад Shh является всего лишь одной из мишеней воздействия сигнального пути рецепторов ретиноидов и при делеции гена рецептора RARβ2 не активируется. Shh не может вызвать сам по себе рост аксонов, но может усиливать сигнал от ретиноидных рецепторов [38], повышая выживание клеток [39]. Дотации витамина А индуцируют синтез ФРН и нейротрофического фактора мозга [40].
Сигналы от их рецепторов регулируют рост аксонов и ФРН-зависимый рост аксонов тормозится при делеции генов рецепторов ретиноидов. Каскад Shh является всего лишь одной из мишеней воздействия сигнального пути рецепторов ретиноидов и при делеции гена рецептора RARβ2 не активируется. Shh не может вызвать сам по себе рост аксонов, но может усиливать сигнал от ретиноидных рецепторов [38], повышая выживание клеток [39]. Дотации витамина А индуцируют синтез ФРН и нейротрофического фактора мозга [40].
Учитывая данные о функционировании ФРН и наличие активных пептидных фрагментов ФРН в составе церебролизина, причина повышения активности каскада Shh под воздействием препарата становится очевидной [33]. ФРН инициирует рост нейритов и потенциирует активность рецепторов ретиноидов (RARβ2 и др.). Активированный ретиноидами рецептор RARβ2 дополнительно стимулирует рост нейритов и активирует каскад Shh. Активация каскада Shh способствует росту нейритов посредством усиления сигнала от ретиноидных рецепторов, что и является нейротрофическим эффектом.
Церебролизин (2,5 мл/кг) стимулирует рост клеток-предшественников нейронов за счет активации сигнального пути PI3K/Akt и повышает результат оценки неврологического тестирования [41]. Сигнальный путь PI3K/Akt активируется ФРН и орексином, которые были найдены в составе церебролизина. ФРН стимулирует цикл клеточного деления с участием циклинов и циклинзависимых киназ [42], а орексин стимулирует поглощение нервной тканью глюкозы за счет транслокации транспортера глюкозы GLUT4 из цитоплазмы нейронов на внешнюю поверхность мембраны [43].
ФРН и орексин стимулируют синтез/секрецию нейротрофического фактора мозга (BDNF), который также активирует сигнальный путь PI3K/Akt [44] под действием церебролизина. ФРН активирует циклинзависимую киназу 5 (cdk5) с участием цАМФ, что активирует процессы клеточного роста [45], нейропротекцию [46] и регулирует экспрессию BDNF [47] через сигнальный каскад внеклеточной регулируемой киназы 1/2 (ERK1/2) [48]. Орексин подавляет толерантность к глюкозе и предупреждает повреждение нейронов посредством повышения активности BDNF [49, 50].
Церебролизин улучшает восстановление когнитивных способностей после ЧМТ, в частности за счет стимулирования ангиогенеза [25]. Улучшение неврологических показателей связано с повышением уровня фактора роста эндотелия (VEGF), стимулирующего восстановление сосудистого русла и повышающего кровоток в зоне ишемии [51]. Данный эффект также объясняется наличием в церебролизине ФРН. Известно, что ФРН стимулирует повышение экспрессии VEGF и ангиогенез при репаративной регенерации нейрональной ткани [52].
Церебролизин также модулирует активность синтеза/секреции оксида азота. В эксперименте хроническая алкогольная интоксикация в течение 30 дней приводила к увеличению уровня оксида азота с одновременным снижением уровней L-аргинина, каталазы и супероксиддисмутазы. Применение церебролизина в течение последующих 14 дней привело к нормализации функции системы оксида азота [53]. Данный эффект основан на том, что в состав церебролизина входят энкефалины и ФРН, которые оказывают влияние на метаболизм оксида азота. Цитопротекция энкефалином опосредована активацией синтазы окиси азота (СОА) и функции аденозинтрифосфат-регулируемых калиевых каналов [54]. В частности, мет-энкефалин модулирует синтез/секрецию оксида азота [55]. ФРН стимулирует экспрессию индуцируемой формы СОА и вещества Р [56]. Сигнальный путь Akt — оксид азота — цГМФ способствует воздействию ФРН на рост нейритов в модели деменции [57].
Цитопротекция энкефалином опосредована активацией синтазы окиси азота (СОА) и функции аденозинтрифосфат-регулируемых калиевых каналов [54]. В частности, мет-энкефалин модулирует синтез/секрецию оксида азота [55]. ФРН стимулирует экспрессию индуцируемой формы СОА и вещества Р [56]. Сигнальный путь Akt — оксид азота — цГМФ способствует воздействию ФРН на рост нейритов в модели деменции [57].
Успешное применение церебролизина для поддержания состояния пациентов при нейродегенеративных заболеваниях было многократно продемонстрировано. Метаанализ 6 рандомизированных исследований по применению церебролизина для терапии сосудистой деменции (597 участников) подтвердил наличие его положительного эффект в отношении когнитивных функций пациентов по шкалам MMSE (на 1,10 балла в среднем, 95% ДИ 0,37-1,82) и ADAS-cog+ (в среднем на 4,01 балла, 95% ДИ 2,66-5,36) и по шкале CGI (ОШ 2,71; 95% ДИ 1,83-4,00) [58, 59]. Лечение церебролизином снижает уровень атрофии таламуса у молодых пациентов (20±0,5 года) с активным рассеянным склерозом [60] и способствует профилактике атрофии зрительного нерва у детей [61].
Вызываемое церебролизином уменьшение дефицита памяти и других проявлений нейродегенеративного процесса сохраняется по крайней мере в течение 3 мес после окончания лечения. Посредством иммуногистохимического анализа было показано, что снижение амилоидных бляшек в новой коре и гиппокампе также сохраняется в течение 3 мес [62]. Эффект церебролизина при деменции связывают с преодолением холинергического дефицита, воздействием на отложение амилоидного тау-белка, модуляцией активности киназы 3 гликогенсинтазы (GSK3), ингибированием каскада калпаина.
Показано, что церебролизин увеличивает число холинергических нейронов [63] и общую длину дендритных пирамидальных нейронов [64]. Известно, что ФРН-рецептор TrkA повышает экспрессию генов, вовлеченных в холинергическую передачу сигнала [65]. Входящий в состав церебролизина активный фрагмент ФРН активирует TrkA, восполняя дефицит ацетилхолина. На амилоидной модели деменции церебролизин уменьшал уровни бета-амилоида и фосфорилирование ассоциированного с микротрубочками тау-белка путем регулирования киназы 3 гликогенсинтазы и циклинзависимой киназы 5, увеличивая плотность синапсов и восстанавливая цитоархитектонику нейрональной ткани [66, 67]. Этот эффект может быть связан с воздействием активного фрагмента пептидов галанина и ФРН. Показано, что галанин тормозит ухудшение пространственной памяти и уменьшает уровень бета-амилоида в модели болезни Альцгеймера [68], способствует дифференцировке нейронов в культуре клеток субвентрикулярной зоны [69].
Этот эффект может быть связан с воздействием активного фрагмента пептидов галанина и ФРН. Показано, что галанин тормозит ухудшение пространственной памяти и уменьшает уровень бета-амилоида в модели болезни Альцгеймера [68], способствует дифференцировке нейронов в культуре клеток субвентрикулярной зоны [69].
Антиамилоидное действие церебролизина может быть связано с наличием в его составе активных пептидов ФРН. Интраназальное введение ФРН снижает отложения амилоида [70] и его токсическое воздействие на нейроны [71]. ФРН воздействует на активность киназы 3 гликогенсинтазы (GSK3) посредством активации сигнального пути Akt [72], что приводит к подавлению ее активности [73]. ФРН активирует циклинзависимую киназу 5 (cdk5) с участием сигнальной молекулы цАМФ, что активирует процессы клеточного роста и дифференциации [45], причем взаимодействие между cdk5 и GSK3 опосредовано белком нейрегулином [46].
Церебролизин стабилизирует целостность нейронов и уменьшает число апоптотических клеток после ишемического поражения путем ингибирования каскада калпаина за счет активности ФРН и галанина. Активация рецептора ФРН тормозит активность бета- и гамма-секретаз, что предотвращает стимулируемое GSK3 фосфорилирование тау-белка и активацию каспаз и калпаина, которые приводят к распаду цитоскелета и ухудшению аксонального транспорта [74]. Делеция гена галанина приводит к увеличению экспрессии калпаина, увеличивая гибель нейронов, в том числе холинергических [75].
Активация рецептора ФРН тормозит активность бета- и гамма-секретаз, что предотвращает стимулируемое GSK3 фосфорилирование тау-белка и активацию каспаз и калпаина, которые приводят к распаду цитоскелета и ухудшению аксонального транспорта [74]. Делеция гена галанина приводит к увеличению экспрессии калпаина, увеличивая гибель нейронов, в том числе холинергических [75].
Терапевтический эффект церебролизина при атрофии зрительного нерва у 646 детей отмечался при внутримышечном (0,1 мл/кг массы тела) и ретробульбарном (0,3-0,5 мл) введении [61]. Этот эффект связан с наличием ФРН в составе препарата. Этим наблюдениям соответствуют экспериментальные данные о снижении экспрессии генов ФРН и рецептора TrkA в зрительном нерве крыс с глаукомой [76]. При дегенерации ганглиозных клеток сетчатки установлено влияние ФРН на регенерацию сетчатки [77]. ФРН и его рецепторы TrkA и p75 экспрессируются в переднем и заднем сегментах глаза человека; при нанесении на склеру ФРН достигает сетчатки и зрительного нерва [78].
Церебролизин улучшает состояние нейронных структур на моделях синдрома Ретта — врожденной прогрессирующей аномалией развития ЦНС, которая характеризуется умственной отсталостью, стереотипиями и апраксией. Исследования пациентов с синдромом Ретта показали снижение ветвления дендритов нейронов и аномальное формирование нейронных структур. Делеция гена метил-CpG-связывающего белка (MECP2) приводит к экспериментальной модели синдрома Ретта. Применение церебролизина на моделях синдрома Ретта улучшало рост нейронов и структурирование нервной ткани [79]. Положительное воздействие церебролизина на структуру нервной ткани при синдроме Ретта объясняется входящим в состав препарата активных пептидов ФРН. При синдроме Ретта отмечаются снижение уровня ФРН, продолжающееся с возрастом, в то время как в контрольной группе здоровых лиц уровень ФРН возрастает [80].
Церебролизин уменьшает апоптоз лимфоцитов человека [81, 82]. Этот эффект может осуществляться за счет ФРН и энкефалиновых пептидов в его составе. ФРН имеет выраженный антиапоптотический эффект на лимфоциты, защищая их от апоптоза путем активации белка PKCzeta [83]. В В-лимфоцитах памяти ФРН ингибирует апоптоз с помощью инактивации белка р38МАРК и предотвращения фосфорилирования регулирующего апоптоз белка Bcl-2 [84]. Энкефалины также защищают лимфоциты от апоптоза [85]. Антиапоптотическое действие метионинэнкефалина связано с эффектами каспазы-3 [86].
ФРН имеет выраженный антиапоптотический эффект на лимфоциты, защищая их от апоптоза путем активации белка PKCzeta [83]. В В-лимфоцитах памяти ФРН ингибирует апоптоз с помощью инактивации белка р38МАРК и предотвращения фосфорилирования регулирующего апоптоз белка Bcl-2 [84]. Энкефалины также защищают лимфоциты от апоптоза [85]. Антиапоптотическое действие метионинэнкефалина связано с эффектами каспазы-3 [86].
Церебролизин снижает уровень перинатальных расстройств ЦНС посредством иммуномодуляции, антиоксидантной защиты и нейротрофического эффекта. Изучалось влияние церебролизина на аутоиммунные параметры (FasL, Fas и металлотионеин-1) у новорожденных с перинатальными ишемическими повреждениями ЦНС и в группе 20 здоровых новорожденных. Лечение церебролизином (0,1 мл/кг, 10 инъекций через день) привело к нормализации апоптоза Т-лимфоцитов (увеличение Fas и снижение FasL) и активация антиоксидантной защиты путем увеличения экспрессии белка-антиоксиданта металлотионеина-1. Нормализация аутоиммунных реакций приводила к уменьшению отека мозга и улучшению кровотока в участках мозга пострадавших от ишемии [87].
Структура рецептора ФРН р75 сходна со структурой Fas-рецептора, связывающего лиганд FasL, который играет важную роль в регуляции клеточного апоптоза [83]. Нельзя исключить, что ФРН может непосредственно взаимодействовать с Fas-рецептором, проявляя иммуномодуляторные эффекты. Модуляции системы Fas-рецептор/FasL могут осуществляться метионинэнкефалином [88].
Церебролизин стимулирует секрецию гамма-интерферона лимфоцитами [89]. Показано, что метионинэнкефалин стимулирует субпопуляции лимфоцитов в периферической крови [90], а энкефалин-подобные агонисты дельта-опиоидных рецепторов существенно улучшают выживаемость в моделях сепсиса [91]. Мет-энкефалин и его пептидный фрагмент YGG оказывают непосредственное влияние на синтез гамма-интерферона: стимулируя синтез при низких дозах и тормозя синтез при высоких. Пептидный фрагмент YG является минимальным молекулярным фрагментом энкефалина, оказывающим иммуномодулирующее воздействие [92]. Известно, что процессы дифференцировки нейронов сопровождаются вызываемым рецептором ФРН повышением уровня гамма-интерферона [93].
Основополагающая роль энкефалинов и ФРН в осуществляемой церебролизином иммуномодуляции подтверждается профилем иммунологических изменений при внутримышечном применении препарата у детей с синдромом дефицита внимания и гиперактивностью. В этих случаях была отмечена нормализация как неврологических, так и иммунных показателей. Церебролизин повышал экспрессию маркеров активации (HLA-DR, CD25) и нормализацию количества клеток лимфоцитов типа CD45+, CD14-, CD4+, CD19+, CD16+, CD11b+ и CD56+, а также уровней IgG и IgA в сыворотке, активность NK-клеток и активацию Т-хелперов [94, 95]. Данный эффект также реализуется через действие энкефалинов и ФРН. Метионинэнкефалин воздействует на лимфоциты человека, нормализуя количество и активность Т-клеток CD4+, CD8+, регуляторных Т-клеток, дендритных клеток, NK-клеток и маркер активации CD25 [90]. Бета-эндорфин и мет-энкефалин оказывают иммуномодулирующее действие, влияя на экспрессию маркеров CD11b+, CD18+ и CD16+ [96]. ФРН влияет на экспрессию маркера активации Т-клеток HLA-DR [97], а рецептор ФРН (NGFR) присутствует на поверхности лимфоцитов человека и модулирует деление В-клеток и секрецию иммуноглобулинов [98].
Заключение
Несмотря на существование доказательной базы по использованию церебролизина в клинической медицине, точные механизмы фармакологического действия препарата изучены недостаточно. В настоящей работе представлен анализ связи состава церебролизина и результатов исследований препарата in vitro, in vivo. Показано что установленные ранее специфические особенности воздействия церебролизина в рамках нейротрофического, нейропротективного, иммуномодулирующего эффектов, могут быть объяснены через специфическую активность пептидных компонентов препарата (активные фрагменты ФРН, энкефалинов, орексина, галанина).
Проведенный анализ позволил сделать ряд выводов, важных для повышения эффективности использования церебролизина в клинической практике. Наиболее интересным, на наш взгляд, является возможный синергизм церебролизина с витамином А (ретиноидами). Результаты фундаментальных исследований показали, что установленное в эксперименте повышение активности сигнального каскада Shh под воздействием церебролизина связано скорее всего с наличие активных пептидных фрагментов ФРН в составе препарата. ФРН потенцирует активность рецепторов ретиноидов, которые стимулируют долговременный рост нейритов и параллельно активируют каскад Shh. Активация каскада Shh дополнительно способствует росту нейритов посредством усиления сигнала от ретиноидных рецепторов. Результаты позволяют сделать вывод о том, что долговременное воздействие церебролизина может существенно зависеть от обеспеченности организма витамином А. Поэтому у пациентов с дефицитом витамина А (и/или с неблагоприятными вариантами полиморфизмов генов метаболизма витамина А) можно ожидать более низкую нейротрофическую активность церебролизина. И наоборот, у пациентов, обеспеченных витамином А, церебролизин будет проявлять большую нейтротрофическую активность.
ФРН потенцирует активность рецепторов ретиноидов, которые стимулируют долговременный рост нейритов и параллельно активируют каскад Shh. Активация каскада Shh дополнительно способствует росту нейритов посредством усиления сигнала от ретиноидных рецепторов. Результаты позволяют сделать вывод о том, что долговременное воздействие церебролизина может существенно зависеть от обеспеченности организма витамином А. Поэтому у пациентов с дефицитом витамина А (и/или с неблагоприятными вариантами полиморфизмов генов метаболизма витамина А) можно ожидать более низкую нейротрофическую активность церебролизина. И наоборот, у пациентов, обеспеченных витамином А, церебролизин будет проявлять большую нейтротрофическую активность.
Представляется весьма перспективным исследование возможного синергичного эффекта церебролизина и ряда других микронутриентов. Первым этапом такого исследования является системно-биологический и биоинформационный анализ возможных молекулярно-фармакологических механизмов такого рода синергизма. Данный анализ позволит отобрать микронутриенты, восполнение дефицита который максимизирует эффективность церебролизина в экспериментальных и клинических исследованиях.
Данный анализ позволит отобрать микронутриенты, восполнение дефицита который максимизирует эффективность церебролизина в экспериментальных и клинических исследованиях.
Наркотики, мозг и поведение: наука о зависимости: наркотики и мозг
Знакомство с человеческим мозгом
Изображение
Человеческий мозг — самый сложный орган в организме. Эта трехфунтовая масса серого и белого вещества находится в центре всей человеческой деятельности — она нужна вам, чтобы водить машину, наслаждаться едой, дышать, создавать художественные шедевры и получать удовольствие от повседневных дел. Мозг регулирует основные функции вашего тела, позволяет вам интерпретировать и реагировать на все, что вы испытываете, и формирует ваше поведение. короче ваш мозг — это вы — все, что вы думаете и чувствуете, и кто вы есть.
Как работает мозг?
Мозг часто сравнивают с невероятно сложным компьютером. Вместо электрических цепей на кремниевых чипах, управляющих нашими электронными устройствами, мозг состоит из миллиардов клеток, называемых нейронами, из которых организованы в цепи и сети. Каждый нейрон действует как переключатель, контролирующий поток информации. Если нейрон получает достаточно сигналов от других нейронов, к которым он подключен, он срабатывает, посылая свой собственный сигнал другим нейронам в цепи.
Каждый нейрон действует как переключатель, контролирующий поток информации. Если нейрон получает достаточно сигналов от других нейронов, к которым он подключен, он срабатывает, посылая свой собственный сигнал другим нейронам в цепи.
Мозг состоит из множества частей со взаимосвязанными цепями, которые работают вместе как одна команда. Различные цепи мозга отвечают за координацию и выполнение определенных функций. Сети нейронов посылают сигналы туда и обратно друг другу и между различными частями головного и спинного мозга и нервами в остальной части тела (периферическая нервная система).
Чтобы отправить сообщение, нейрон выпускает нейромедиатор в щель (или синапс) между ней и следующей ячейкой. Нейротрансмиттер проходит через синапс и прикрепляется к рецепторам принимающего нейрона, как ключ к замку. Это вызывает изменения в принимающей клетке. Другие молекулы, называемые транспортерами , рециркулируют нейротрансмиттеры (то есть возвращают их обратно в нейрон, который их высвободил), тем самым ограничивая или отключая сигнал между нейронами.
Как наркотики действуют на мозг?
Image
Наркотики мешают нейронам посылать, получать и обрабатывать сигналы через нейротрансмиттеры. Некоторые наркотики, такие как марихуана и героин, могут активировать нейроны, потому что их химическая структура имитирует структуру естественного нейротрансмиттера в организме. Это позволяет лекарствам прикрепляться к нейронам и активировать их. Хотя эти препараты имитируют собственные химические вещества мозга, они не активируют нейроны так же, как естественные нейротрансмиттеры, и приводят к отправке аномальных сообщений по сети.
Другие наркотики, такие как амфетамин или кокаин, могут заставлять нейроны высвобождать аномально большое количество естественных нейротрансмиттеров или препятствовать нормальной переработке этих химических веществ в мозге, мешая транспортерам. Это также усиливает или нарушает нормальную связь между нейронами.
На какие части мозга влияет употребление наркотиков?
Наркотики могут изменять важные области мозга, которые необходимы для поддержания жизнедеятельности, и могут вызывать навязчивое употребление наркотиков, характеризующееся зависимостью. Области мозга, на которые влияет употребление наркотиков, включают:
Области мозга, на которые влияет употребление наркотиков, включают:
Image
- Базальные ганглии, , которые играют важную роль в положительных формах мотивации, включая приятные эффекты здоровой деятельности, такой как прием пищи, общение и секс, а также участвуют в формировании привычек и распорядка дня. Эти области образуют ключевой узел того, что иногда называют «контуром вознаграждения» мозга. Наркотики чрезмерно активируют эту цепь, вызывая кайф от наркотика. Но при многократном воздействии схема адаптируется к присутствию наркотика, уменьшая ее чувствительность и затрудняя получение удовольствия от чего-либо, кроме наркотика.
- Расширенная миндалина играет роль в стрессовых ощущениях, таких как тревога, раздражительность и беспокойство, которые характеризуют абстиненцию после того, как кайф от наркотика исчезает, и, таким образом, мотивирует человека снова искать наркотик. Эта схема становится все более чувствительной при увеличении употребления наркотиков.
 Со временем человек с расстройством, связанным с употреблением психоактивных веществ, употребляет наркотики, чтобы получить временное облегчение от этого дискомфорта, а не для того, чтобы получить кайф.
Со временем человек с расстройством, связанным с употреблением психоактивных веществ, употребляет наркотики, чтобы получить временное облегчение от этого дискомфорта, а не для того, чтобы получить кайф. - Префронтальная кора обеспечивает способность думать, планировать, решать проблемы, принимать решения и проявлять самоконтроль над импульсами. Это также последняя часть мозга, которая созревает, что делает подростков наиболее уязвимыми. Смещение баланса между этой цепью и цепями базальных ганглиев и расширенной миндалины заставляет человека с расстройством, связанным с употреблением психоактивных веществ, навязчиво искать наркотик со сниженным импульсным контролем.
Некоторые наркотики, такие как опиоиды, также нарушают работу других частей мозга, таких как ствол мозга, который контролирует основные жизненно важные функции, включая частоту сердечных сокращений, дыхание и сон. Это вмешательство объясняет, почему передозировка может вызвать угнетение дыхания и смерть.
Как наркотики доставляют удовольствие?
Изображение
Простые действия в повседневной жизни могут вызывать небольшие всплески нейротрансмиттеров в мозгу, вызывая приятные ощущения. Наркотики могут захватить этот процесс.Удовольствие или эйфория — кайф от наркотиков — до сих пор плохо изучены, но, вероятно, связаны с выбросами химических сигнальных соединений, включая естественные опиоиды организма (эндорфины) и другие нейротрансмиттеры в частях базальных ганглиев (система вознаграждения). Когда принимаются некоторые наркотики, они могут вызывать всплески этих нейротрансмиттеров, намного большие, чем меньшие всплески, которые естественным образом возникают в связи со здоровыми наградами, такими как еда, слушание или игра на музыке, творческие занятия или социальное взаимодействие.
Когда-то считалось, что выбросы нейротрансмиттера допамина , вырабатываемого наркотиками, напрямую вызывают эйфорию, но теперь ученые считают, что дофамин больше связан с повторением приятных действий (подкрепление), чем с непосредственным получением удовольствия.
Как дофамин усиливает употребление наркотиков?
Чувство удовольствия — это то, как здоровый мозг идентифицирует и усиливает полезное поведение, такое как прием пищи, общение и секс. Наш мозг устроен таким образом, чтобы увеличить вероятность того, что мы будем повторять приятные действия. Центральное место в этом занимает нейротрансмиттер дофамин. Всякий раз, когда схема вознаграждения активируется здоровым,
приятный опыт, всплеск дофамина сигнализирует о том, что происходит что-то важное, о чем нужно помнить. Этот сигнал дофамина вызывает изменения в нейронных связях, которые облегчают повторение действия снова и снова, не задумываясь об этом, что приводит к формированию привычек.
Точно так же, как наркотики вызывают интенсивную эйфорию, они также вызывают гораздо более сильные выбросы дофамина, мощно усиливая связь между употреблением наркотика, полученным удовольствием и всеми внешними сигналами, связанными с опытом. Большие всплески дофамина «учат» мозг искать наркотики в ущерб другим, более здоровым целям и занятиям.
Сигналы в распорядке дня или окружающей среде человека, которые стали связаны с употреблением наркотиков из-за изменений в цепи вознаграждения, могут вызвать неконтролируемую тягу всякий раз, когда человек подвергается воздействию этих сигналов, даже если сам наркотик недоступен. Этот выученный «рефлекс» может длиться долго, даже у людей, которые не употребляли наркотики много лет. Например, люди, которые не употребляли наркотики в течение десяти лет, могут испытывать тягу, когда возвращаются в старый район или дом, где они употребляли наркотики. Как езда на велосипеде, мозг помнит.
Почему наркотики вызывают большее привыкание, чем естественные награды?
Для мозга разницу между нормальным вознаграждением и вознаграждением от наркотиков можно сравнить с разницей между тем, кто шепчет вам на ухо, и кем-то, кто кричит в микрофон. Точно так же, как мы уменьшаем громкость на слишком громком радио, мозг человека, злоупотребляющего наркотиками, приспосабливается, производя меньше нейротрансмиттеров в цепи вознаграждения или уменьшая количество рецепторов, которые могут принимать сигналы. В результате способность человека испытывать удовольствие от естественно вознаграждающей (т. е. подкрепляющей) деятельности также снижается.
В результате способность человека испытывать удовольствие от естественно вознаграждающей (т. е. подкрепляющей) деятельности также снижается.
Вот почему человек, злоупотребляющий наркотиками, в конечном итоге чувствует себя опустошенным, лишенным мотивации, безжизненным и/или подавленным и неспособным получать удовольствие от того, что раньше доставляло удовольствие. Теперь человеку нужно продолжать принимать наркотики, чтобы испытать хотя бы нормальный уровень вознаграждения, что только усугубляет проблему, подобно порочному кругу. Кроме того, человеку часто приходится принимать большее количество наркотика, чтобы вызвать знакомый кайф — эффект, известный как толерантность .
Image
Длительное употребление наркотиков ухудшает работу мозга.
Злоупотребление наркотиками и наркомания | Национальный институт по борьбе со злоупотреблением наркотиками (NIDA)
Что такое наркомания?
Наркомания определяется как хроническое рецидивирующее расстройство, характеризующееся компульсивным поиском и употреблением наркотиков, несмотря на неблагоприятные последствия. † Это считается расстройством головного мозга, поскольку оно включает функциональные изменения в цепях мозга, связанных с вознаграждением, стрессом и самоконтролем. Эти изменения могут длиться долгое время после того, как человек перестал принимать наркотики. 11
† Это считается расстройством головного мозга, поскольку оно включает функциональные изменения в цепях мозга, связанных с вознаграждением, стрессом и самоконтролем. Эти изменения могут длиться долгое время после того, как человек перестал принимать наркотики. 11
Наркомания очень похожа на другие заболевания, например болезни сердца. Оба нарушают нормальное, здоровое функционирование органа в организме, оба имеют серьезные вредные последствия, и оба во многих случаях поддаются профилактике и лечению. Если их не лечить, они могут длиться всю жизнь и могут привести к смерти.
Image
Лицом к лицу с наркоманией в Америке: доклад главного хирурга об алкоголе, наркотиках и здоровье.
Изменено с разрешения Volkow et al. 1993. Примечание. Эти ПЭТ-сканы сравнивают мозг человека с историей расстройства, связанного с употреблением кокаина (в центре и справа), с мозгом человека, не употреблявшего кокаин в анамнезе (слева). У человека, у которого было расстройство, связанное с употреблением кокаина, более низкий уровень дофаминового рецептора D2 (обозначен красным) в полосатом теле через месяц (в центре) и через четыре месяца (справа) после прекращения употребления кокаина по сравнению с тем, кто не употреблял. Уровень дофаминовых рецепторов в мозге человека, употребляющего кокаин, выше на 4-месячной отметке (справа), но не вернулся к уровням, наблюдаемым у не употребляющего кокаин (слева).
Уровень дофаминовых рецепторов в мозге человека, употребляющего кокаин, выше на 4-месячной отметке (справа), но не вернулся к уровням, наблюдаемым у не употребляющего кокаин (слева).
Почему люди принимают наркотики?
Обычно люди принимают наркотики по нескольким причинам:
- Чтобы чувствовать себя хорошо. Наркотики могут вызывать сильное чувство удовольствия. За этой первоначальной эйфорией следуют другие эффекты, которые различаются в зависимости от типа используемого наркотика. Например, при приеме таких стимуляторов, как кокаин, за кайфом следует чувство силы, уверенности в себе и увеличение энергии. Напротив, эйфория, вызванная опиоидами, такими как героин, сопровождается чувством расслабления и удовлетворения.
- Чтобы чувствовать себя лучше. Некоторые люди, страдающие социальной тревожностью, стрессом и депрессией, начинают принимать наркотики, чтобы уменьшить беспокойство. Стресс может играть важную роль в начале и продолжении употребления наркотиков, а также в рецидиве (возвращении к употреблению наркотиков) у пациентов, выздоравливающих от зависимости.

- Сделать лучше. Некоторые люди чувствуют необходимость улучшить свою концентрацию в школе или на работе или свои способности в спорте. Это может сыграть роль в попытке или продолжении употребления наркотиков, таких как отпускаемые по рецепту стимуляторы или кокаин.
- Любопытство и социальное давление. В этом отношении подростки особенно подвержены риску, поскольку давление сверстников может быть очень сильным. Подростковый возраст — это период развития, в течение которого наличие факторов риска, таких как сверстники, употребляющие наркотики, может привести к употреблению психоактивных веществ.
Если употребление наркотиков заставляет людей чувствовать себя лучше или лучше, в чем проблема?
Image
При первом употреблении наркотика люди могут ощущать положительные эффекты. Они также могут полагать, что могут контролировать их использование. Но наркотики могут быстро завладеть жизнью человека. Со временем, если употребление наркотиков продолжается, другие приятные занятия становятся менее приятными, и человеку приходится принимать наркотик только для того, чтобы чувствовать себя «нормально». Им трудно контролировать свою потребность в наркотиках, хотя это создает много проблем для них самих и их близких. Некоторые люди могут начать ощущать необходимость принимать больше наркотиков или чаще, даже на ранних стадиях употребления наркотиков. Это признаки зависимости.
Им трудно контролировать свою потребность в наркотиках, хотя это создает много проблем для них самих и их близких. Некоторые люди могут начать ощущать необходимость принимать больше наркотиков или чаще, даже на ранних стадиях употребления наркотиков. Это признаки зависимости.
Даже относительно умеренное употребление наркотиков представляет опасность. Подумайте, как пьяница может напиться, сесть за руль автомобиля и быстро превратить приятное занятие в трагедию, затрагивающую многие жизни. Случайное употребление наркотиков, например злоупотребление опиоидами для получения кайфа, может иметь такие же катастрофические последствия, включая нарушение вождения и передозировку.
Люди продолжают употреблять наркотики?
Первоначальное решение принимать наркотики обычно является добровольным. Но при продолжительном использовании способность человека к самоконтролю может серьезно ухудшиться. Это нарушение самоконтроля является отличительной чертой зависимости.
Исследования мозга людей, страдающих зависимостью, показывают физические изменения в областях мозга, которые имеют решающее значение для суждений, принятия решений, обучения, памяти и контроля поведения. 12 Эти изменения помогают объяснить компульсивную природу зависимости.
12 Эти изменения помогают объяснить компульсивную природу зависимости.
Ни один фактор не определяет, станет ли человек зависимым от наркотиков.
Почему одни люди становятся зависимыми от наркотиков, а другие нет?
Как и в случае с другими заболеваниями и расстройствами, вероятность развития зависимости у разных людей разная, и ни один фактор не определяет, станет ли человек зависимым от наркотиков. В общем, чем больше факторов риска человек имеет, тем больше вероятность того, что прием наркотиков приведет к употреблению наркотиков и наркомании. Защитные факторы, с другой стороны, снижают риск человека. Факторы риска и защиты могут быть как экологическими, так и биологическими.
| Факторы риска | Защитные факторы |
|---|---|
| Агрессивное поведение в детстве 13,14 | Самоэффективность (вера в самоконтроль) 15 |
| Отсутствие родительского надзора 14,16 | Родительский контроль и поддержка 16-18 |
| Низкие навыки отказа от сверстников 13,17,18 | Положительные отношения 17,19 |
| Эксперименты с наркотиками 14,20,21 | Хорошие оценки 17,22 |
| Наличие лекарств в школе 21,23 | Политика школы по борьбе с наркотиками 17 |
| Общинная бедность 24,25 | Районные ресурсы 26 |
Image
Какие биологические факторы повышают риск зависимости?
Биологические факторы, которые могут повлиять на риск зависимости человека, включают его гены, стадию развития и даже пол или этническую принадлежность. Ученые подсчитали, что гены, в том числе влияние факторов окружающей среды на экспрессию генов человека, называемое эпигенетикой, составляют от 40 до 60 процентов риска зависимости человека. 27 Кроме того, подростки и люди с психическими расстройствами подвергаются большему риску употребления наркотиков и зависимости, чем другие. 28
Ученые подсчитали, что гены, в том числе влияние факторов окружающей среды на экспрессию генов человека, называемое эпигенетикой, составляют от 40 до 60 процентов риска зависимости человека. 27 Кроме того, подростки и люди с психическими расстройствами подвергаются большему риску употребления наркотиков и зависимости, чем другие. 28
Первые взаимодействия детей в семье имеют решающее значение для их здорового развития и риска употребления наркотиков.
Какие факторы окружающей среды повышают риск зависимости?
Факторы окружающей среды связаны с семьей, школой и районом. Факторы, которые могут увеличить риск для человека, включают следующее:
- Дом и семья. Домашняя обстановка, особенно в детстве, является очень важным фактором. Родители или старшие члены семьи, употребляющие наркотики или злоупотребляющие алкоголем или нарушающие закон, могут увеличить риск возникновения у детей проблем с наркотиками в будущем.
 29
29 - Сверстники и школа. Друзья и другие сверстники могут оказывать все более сильное влияние в подростковом возрасте. Подростки, употребляющие наркотики, могут склонить даже тех, у кого нет факторов риска, попробовать наркотики впервые. Проблемы в школе или плохие социальные навыки могут подвергнуть ребенка еще большему риску употребления наркотиков или зависимости от них. 30
Какие другие факторы повышают риск зависимости?
- Раннее использование. Хотя употребление наркотиков в любом возрасте может привести к зависимости, исследования показывают, что чем раньше люди начинают употреблять наркотики, тем выше вероятность того, что у них разовьются серьезные проблемы. 31 Это может быть связано с вредным воздействием лекарств на развивающийся мозг. 32 Это также может быть результатом сочетания ранних социальных и биологических факторов риска, включая отсутствие стабильного дома или семьи, подверженность физическому или сексуальному насилию, генетические или психические заболевания.
 Тем не менее, факт остается фактом: раннее употребление является сильным индикатором будущих проблем, включая зависимость.
Тем не менее, факт остается фактом: раннее употребление является сильным индикатором будущих проблем, включая зависимость. - Как принимать препарат. Курение наркотика или введение его в вену увеличивает вероятность привыкания. 33,34 Как выкуренные, так и инъекционные наркотики попадают в мозг в течение нескольких секунд, вызывая мощный прилив удовольствия. Однако этот интенсивный эффект может исчезнуть в течение нескольких минут. Ученые считают, что этот мощный контраст заставляет некоторых людей постоянно принимать наркотики, чтобы вернуть мимолетное состояние удовольствия.
Изображения развития мозга у здоровых детей и подростков (в возрасте 5–20 лет)
Изображение
По мере взросления мозга опыт сокращает лишние нейронные связи и укрепляет те, которые используются чаще. Многие ученые считают, что этот процесс способствует неуклонному уменьшению объема серого вещества, наблюдаемому в подростковом возрасте (обозначен переходом от желтого к синему на рисунке). По мере того как силы окружающей среды помогают определить, какие связи будут увядать, а какие будут процветать, возникающие мозговые цепи становятся более эффективными. Однако это процесс, который может обойти обе стороны, потому что не все модели поведения желательны или здоровы. Окружающая среда подобна художнику, который создает скульптуру, откалывая лишний мрамор; и точно так же, как плохие художники могут создать плохое искусство, среда с негативными факторами (такими как наркотики, недоедание, издевательства или лишение сна) может привести к эффективным, но потенциально опасным схемам, которые заговорят против благополучия человека.
По мере того как силы окружающей среды помогают определить, какие связи будут увядать, а какие будут процветать, возникающие мозговые цепи становятся более эффективными. Однако это процесс, который может обойти обе стороны, потому что не все модели поведения желательны или здоровы. Окружающая среда подобна художнику, который создает скульптуру, откалывая лишний мрамор; и точно так же, как плохие художники могут создать плохое искусство, среда с негативными факторами (такими как наркотики, недоедание, издевательства или лишение сна) может привести к эффективным, но потенциально опасным схемам, которые заговорят против благополучия человека.Мозг продолжает развиваться во взрослом возрасте и претерпевает значительные изменения в подростковом возрасте.
Одной из областей мозга, которая все еще созревает в подростковом возрасте, является префронтальная кора — часть мозга, которая позволяет людям оценивать ситуации, принимать обоснованные решения и контролировать эмоции и желания.
