Что такое дисбактериоз кишечника. Какие симптомы указывают на нарушение микрофлоры. Какие препараты помогают восстановить баланс кишечных бактерий. Как правильно питаться при дисбактериозе. Какие народные средства эффективны при лечении.
Что такое дисбактериоз кишечника
Дисбактериоз кишечника — это нарушение количественного и качественного состава нормальной микрофлоры кишечника. При этом состоянии происходит:
- Уменьшение количества полезных бактерий (бифидо- и лактобактерий)
- Увеличение числа условно-патогенных микроорганизмов
- Нарушение баланса между различными видами бактерий
В норме микрофлора кишечника на 90% состоит из полезных бактерий и лишь на 10% из условно-патогенных. При дисбактериозе это соотношение нарушается.
Основные причины развития дисбактериоза
Факторы, способствующие нарушению микрофлоры кишечника:
- Нерациональное применение антибиотиков
- Неправильное питание
- Стрессы
- Инфекционные заболевания ЖКТ
- Снижение иммунитета
- Заболевания эндокринной системы
- Хронические заболевания органов пищеварения
Симптомы дисбактериоза кишечника
Основные проявления нарушения микрофлоры кишечника:

- Нарушения стула (диарея, запоры)
- Вздутие живота, метеоризм
- Боли и урчание в животе
- Тошнота, отрыжка
- Снижение аппетита
- Общая слабость, утомляемость
- Кожные высыпания, зуд
При появлении этих симптомов следует обратиться к врачу для диагностики и назначения лечения.
Диагностика дисбактериоза
Для подтверждения диагноза проводят следующие исследования:
- Копрограмма
- Бактериологический посев кала
- Анализ кала на дисбактериоз
- Водородный дыхательный тест
Эти анализы позволяют оценить состав микрофлоры кишечника и выявить нарушения.
Препараты для лечения дисбактериоза
Пробиотики
Пробиотики — это живые микроорганизмы, восстанавливающие нормальную микрофлору кишечника. Наиболее эффективные пробиотики:
- Бифидобактерин
- Лактобактерин
- Линекс
- Бактисубтил
- Энтерол
Пребиотики
Пребиотики — вещества, стимулирующие рост полезных бактерий. К ним относятся:
- Хилак форте
- Лактулоза
- Дюфалак
Энтеросорбенты
Энтеросорбенты связывают и выводят токсины из кишечника:
- Полифепан
- Энтеросгель
- Смекта
Ферментные препараты
Ферменты улучшают пищеварение и помогают нормализовать стул:

- Панкреатин
- Мезим
- Фестал
Правильное питание при дисбактериозе
Диета играет важную роль в лечении дисбактериоза. Основные правила питания:
- Исключить жирную, острую, копченую пищу
- Ограничить употребление сахара и сладостей
- Включить в рацион кисломолочные продукты
- Употреблять больше овощей и фруктов
- Пить достаточное количество воды
Народные средства лечения дисбактериоза
В качестве дополнительной терапии можно использовать народные методы:
- Отвар ромашки
- Настой шиповника
- Льняное семя
- Прополис
- Травяные сборы
Однако применять народные средства следует только после консультации с врачом.
Профилактика дисбактериоза
Для предупреждения нарушений микрофлоры кишечника рекомендуется:
- Придерживаться правильного питания
- Вести здоровый образ жизни
- Избегать стрессов
- Не злоупотреблять антибиотиками
- Укреплять иммунитет
Когда необходимо обратиться к врачу
Следует незамедлительно обратиться к гастроэнтерологу при следующих симптомах:
- Длительная диарея
- Сильные боли в животе
- Повышение температуры тела
- Кровь в стуле
- Резкое снижение веса
Эти признаки могут указывать на серьезные заболевания, требующие немедленного лечения.

Прогноз и возможные осложнения
При своевременном и правильном лечении прогноз при дисбактериозе благоприятный. Микрофлора кишечника обычно восстанавливается за 1-2 месяца. Однако без лечения возможны осложнения:
- Хронические воспалительные заболевания кишечника
- Авитаминозы
- Снижение иммунитета
- Аллергические реакции
- Нарушения обмена веществ
Поэтому важно не игнорировать симптомы дисбактериоза и своевременно обращаться к врачу.
Современные методы лечения дисбактериоза
Помимо традиционных препаратов, сегодня применяются новые методы коррекции микрофлоры:
- Трансплантация фекальной микробиоты
- Персонализированный подбор пробиотиков
- Использование синбиотиков (комбинации про- и пребиотиков)
- Применение бактериофагов
- Коррекция питания с учетом состава микробиоты
Эти методы позволяют более эффективно восстанавливать нормальный баланс кишечных бактерий.
Влияние дисбактериоза на иммунитет
Нарушение микрофлоры кишечника негативно сказывается на иммунной системе:
- Снижается выработка иммуноглобулинов
- Нарушается барьерная функция кишечника
- Повышается риск аллергических реакций
- Ухудшается противовирусная и противоопухолевая защита
Поэтому восстановление нормальной микрофлоры важно для укрепления иммунитета.

Дисбактериоз у детей
У детей дисбактериоз развивается чаще, чем у взрослых. Особенности течения у детей:
- Более выраженные симптомы
- Быстрое развитие осложнений
- Нарушение роста и развития
- Частые аллергические реакции
Лечение дисбактериоза у детей должно проводиться под наблюдением педиатра.
Роль пробиотиков в лечении заболеваний ЖКТ
Пробиотики эффективны не только при дисбактериозе, но и при других заболеваниях ЖКТ:
- Синдром раздраженного кишечника
- Язвенный колит
- Болезнь Крона
- Антибиотик-ассоциированная диарея
- Инфекционные диареи
Включение пробиотиков в комплексную терапию этих заболеваний улучшает результаты лечения.
Связь дисбактериоза с другими заболеваниями
Нарушение микрофлоры кишечника может быть связано с развитием различных патологий:
- Ожирение
- Сахарный диабет 2 типа
- Атеросклероз
- Депрессия
- Аутоиммунные заболевания
Поэтому коррекция дисбактериоза важна для профилактики многих хронических заболеваний.
ВОССТАНАВЛИВАЕМ НАРУШЕННОЕ ПИЩЕВАРЕНИЕ
Сообщество микроорганизмов, заселяющих кишечник человека и участвующих в пищеварении и в некоторых других физиологических процессах, называют «микробиота» или «микробиом». Нормальная микрофлора кишечника состоит из разных микроорганизмов, но ее основой являются лакто- и бифидо-бактерии, обеспечивающие синтез необходимых для пищеварения витаминов и способствующие правильной работе кишечника и регуляции его перистальтики. Кроме того, при участии нормальной микрофлоры в кишечнике поддерживается иммунитет против чужеродных патогенных бактерий
Нарушения микрофлоры. Пищеварительная система человека представляет собой своеобразный биологический конвейер, в верхних отделах которого (ротовая полость, желудок, двенадцатиперстная кишка, поджелудочная железа, печень и желчный пузырь) пища измельчается и переваривается с помощью ферментов желудочного сока, секрета поджелудочной железы и желчи. А в нижних отделах ЖКТ, в тонком и толстом кишечнике, происходит усвоение необходимых организму и выведение наружу ненужных ему продуктов процесса пищеварения.
Причинами дисбиоза чаще всего являются неправильное питание и бесконтрольное применение антибиотиков – кроме осознанного приема с лечебной целью, большинство людей получает их ежедневно с пищей, т.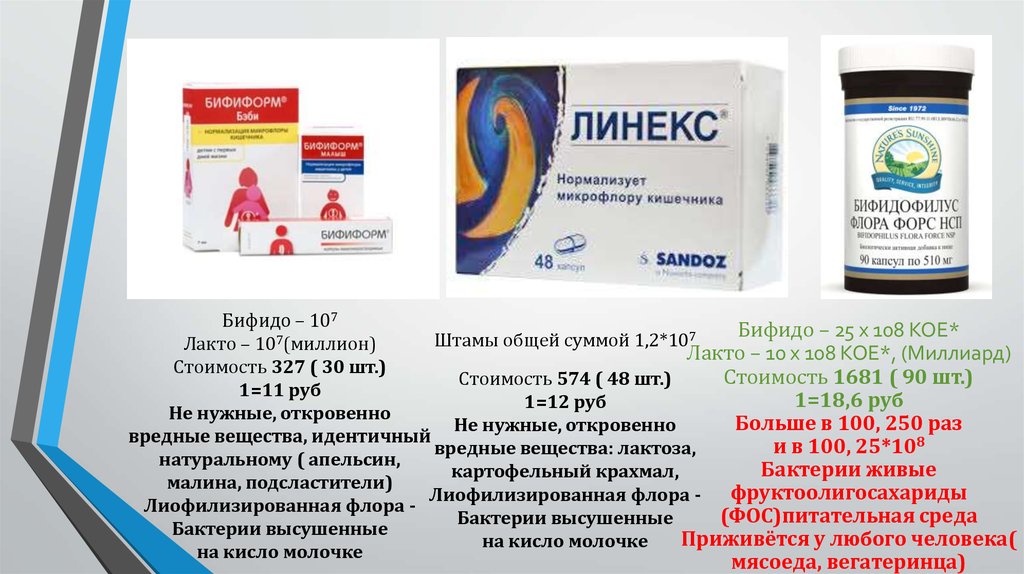
Симптомы дисбактериоза разнообразны и зависят от характера хронических заболеваний, индивидуальных особенностей организма и от возраста пациентов – дети и пожилые люди страдают больше. Сначала могут беспокоить отрыжка, тошнота, изжога, неприятный привкус и запах изо рта, периодически субфебрильная температура, чувство дискомфорта и/или боли в животе, метеоризм (повышенное газообразование). Позже появляются неустойчивый стул, поносы, запоры, изменения аппетита. Если не лечиться, симптомы усугубляются – возникают длительные запоры с тенезмами (ложные позывы на дефекацию), боли становятся схваткообразными и упорными, периодически появляется рвота, кожа и слизистые становятся сухими и гиперчувствительными, возникают аллергические реакции на «безобидные» продукты. Кроме того, дисбактериоз всегда приводит к усугублению течения хронических заболеваний пищеварительного тракта. Прежде всего, в таких ситуациях необходима консультация врача для назначения исследований крови или кала на дисбиоз, которые показывают, сколько и каких микроорганизмов наличествует в кишечнике. Состав микрофлоры является индивидуальным у каждого человека и зависит от возраста пациента, его питания и даже от времени года – врач все это учтет при установке диагноза и назначении лечения.
Кроме того, дисбактериоз всегда приводит к усугублению течения хронических заболеваний пищеварительного тракта. Прежде всего, в таких ситуациях необходима консультация врача для назначения исследований крови или кала на дисбиоз, которые показывают, сколько и каких микроорганизмов наличествует в кишечнике. Состав микрофлоры является индивидуальным у каждого человека и зависит от возраста пациента, его питания и даже от времени года – врач все это учтет при установке диагноза и назначении лечения.
Питание при дисбактериозе. Пищу надо принимать дробно, хорошо пережевывая, не запивая холодными напитками – еда и питье должны быть теплыми и свежеприготовленными. Необходимо свести к минимуму наличие в рационе жареных, копченых, соленых и жирных блюд. Полностью исключаются шоколад и конфеты, крепкие чай, кофе и какао, алкоголь, консервированные продукты, чипсы, готовые полуфабрикаты и продукты с обилием консервантов. В рационе питания должны быть крупяные блюда, слизистые супы, фрукты, овощи и ягоды, кисломолочные продукты, мясо и рыба без жира, хлеб с отрубями, растительное масло. Кроме того, необходимо включать в диету продукты, способные снижать активность патогенной микрофлоры. Такими свойствами обладают корень имбиря, корица, тмин и укроп, хрен, лук и чеснок, яблоки и абрикосы, смородина и рябина, шиповник, клюква, земляника и брусника.
Кроме того, необходимо включать в диету продукты, способные снижать активность патогенной микрофлоры. Такими свойствами обладают корень имбиря, корица, тмин и укроп, хрен, лук и чеснок, яблоки и абрикосы, смородина и рябина, шиповник, клюква, земляника и брусника.
Коррекция дисбиоза. Основная цель терапии – восстановление баланса полезной и условнопатогенной микрофлоры и заселение кишечника полезными бактериями. Как правило, для этого назначают пробиотики (живые бактерии, выращенные в лабораторных условиях) и пребиотики (Дюфалак и т.п. препараты), ферменты (Панзинорм, Панкреатин, Фестал), противоаллергические лекарственные средства и при наличии патогенной микрофлоры – специфические бактериофаги. Рекомендуются также продукты пчеловодства, проявляющие бактерицидные и адаптогенные свойства: перга, прополис, маточное молочко, пыльца, мед. Противомикробными свойствами обладают и некоторые растения – ромашка, календула, пижма, зверобой, тысячелистник, хвощ полевой, корень лопуха. Эти фитосредства способствуют нормализации состояния кишечника, поскольку способны инактивировать «плохие» микроорганизмы, снимать воспаление и подавлять процессы брожения. А вот препаратами листа сенны, которые часто употребляются при упорном запоре, не стоит долго увлекаться, чтобы кишечник не стал «ленивым».
Эти фитосредства способствуют нормализации состояния кишечника, поскольку способны инактивировать «плохие» микроорганизмы, снимать воспаление и подавлять процессы брожения. А вот препаратами листа сенны, которые часто употребляются при упорном запоре, не стоит долго увлекаться, чтобы кишечник не стал «ленивым».
Гомеопатическое лечение.
Существует немало гомеопатических лекарственных препаратов растительного, животного и минерального происхождения, способных помочь справиться с дисбактериозом, причем в последнее время врачи-специалисты все чаще назначают комплексное лечение по рецептурам, хорошо зарекомендовавшим себя в борьбе с дисбактериозом. Такие лекарственные средства содержат в своем составе моно-компоненты, наиболее часто назначаемые в гомеопатии при расстройствах функций ЖКТ. Алоэ помогает при метеоризме, тяжести и боли в желудке и в кишечнике, Хамомилла (ромашка) обладает бактерицидными свойствами и помогает снять практически все симптомы при дисбактериозе. Ирис особенно эффективен, когда дисбиоз проявляется рвотой, чередованием запора с диареей, тошнотой и спастическими болями в животе. Бриония (переступень белый, чертов виноград) эффективно борется с дисбактериозом, сопровождающимся повышенной жаждой, горьким привкусом и сухостью во рту, тошнотой и рвотой, нестабильным стулом. Бриония и Ирис, наряду с другими компонентами, содержатся в препарате
ГАСТРОПАН ЭДАС-954 гранулы, который эффективно используется в комплексном лечении дисбиоза наряду с другими лекарственными средствами. Данный лекарственный препарат способствует регуляции работы кишечника и обеспечивает гармоничное взаимодействие всех органов пищеварительной системы. При лечении запоров, достаточно частых при дисбиозе, поможет ДЕФЕКОЛ ЭДАС-124 капли (ДЕФЕКОЛ ЭДАС-124 гранулы) Длительные запоры часто приводят к геморрою – в этих случаях врачи назначают ВЕНОМИЛ ЭДАС-120 капли (ЭДАС-920 гранулы).
Ирис особенно эффективен, когда дисбиоз проявляется рвотой, чередованием запора с диареей, тошнотой и спастическими болями в животе. Бриония (переступень белый, чертов виноград) эффективно борется с дисбактериозом, сопровождающимся повышенной жаждой, горьким привкусом и сухостью во рту, тошнотой и рвотой, нестабильным стулом. Бриония и Ирис, наряду с другими компонентами, содержатся в препарате
ГАСТРОПАН ЭДАС-954 гранулы, который эффективно используется в комплексном лечении дисбиоза наряду с другими лекарственными средствами. Данный лекарственный препарат способствует регуляции работы кишечника и обеспечивает гармоничное взаимодействие всех органов пищеварительной системы. При лечении запоров, достаточно частых при дисбиозе, поможет ДЕФЕКОЛ ЭДАС-124 капли (ДЕФЕКОЛ ЭДАС-124 гранулы) Длительные запоры часто приводят к геморрою – в этих случаях врачи назначают ВЕНОМИЛ ЭДАС-120 капли (ЭДАС-920 гранулы).
«Московский ветеран»
16 августа 2021 г.
Обзор лекарственных средств при дисбактериозе кишечника
Нормальная микрофлора человека формируется сразу после рождения (до рождения плод в норме «стерилен») и видоизменяется с возрастом.
Однако в целом микрофлора человека обычна весьма стабильна. Представители нормальной микрофлоры играют значимую роль в организме, и не вызывают никаких заболеваний. Возможно, на коже, в кишечнике или иных местах временное появление откровенно неблагоприятных микробов, без появлений признаков заболевания называется колонизацией.
Важно, помнить, что, наличие бактерий нормальной микрофлоры в одном месте (например, в толстом кишечнике) — это норма, в другом-могут вызывать инфекцию (например, мочевой пузырь). Инфекция-это уже заболевание. Наглядно это видно на примере Кишечной палочки (Escherichia coli), которая является обязательным компонентом нормальной микрофлоры толстого кишечника, но при попадании в значительном количестве в мочеиспускательный канал и/ или в мочевой пузырь, может привести к уретриту и циститу. Таким образом, наличие Escherichia coli в толстом кишечнике считается нормой (нормальной флорой), в мочеиспускательном канале-колонизацией, без симптомов, а при наличии симптомов-инфекцией.
Таким образом, наличие Escherichia coli в толстом кишечнике считается нормой (нормальной флорой), в мочеиспускательном канале-колонизацией, без симптомов, а при наличии симптомов-инфекцией.
Далее переходим непосредственно к самим лекарственным средствам, применяемых при дисбактериозе:
1. Пребиотики. Это пищевые волокна, которые не перевариваются и не усваиваются в верхних отделах желудочно-кишечного тракта, но ферментируются микрофлорой толстого кишечника человека, стимулируя рост и жизнедеятельность нормальной микрофлоры.
2. Пробиотики. Это только полезные бактерии, которые возможно использовать в качестве добавки к пище, БАДа или лекарства, а не вообще все представители нормальной микрофлоры человека.
3. Метабиотики. Это активные метаболиты (продукты жизнедеятельности) пробиотических культур. В отличие от пробиотиков и пребиотиков, метабиотики начинают свое действие сразу. В отличии от лиофилизированных (высушенных) пробиотиков, которым необходимо время, среда, питание и отсутствие антибиотиков, чтобы начать вырабатывать метаболиты.
4. Сорбенты. Данные препараты связывают токсические вещества и блокируют распространение гнилостных бактерий в кишечнике. Используются на первом этапе лечения дисбактериоза.
5. БС из живых штаммов. Применяются на первой и второй стадии дисбактериоза, изготавливаются на основе микроорганизмов, формирующих нормальную флору кишечника.
6. Ферменты. Данные лекарственные средства способствуют нормализации пищеварительных процессов: перевариванию пищи и всасыванию витаминов в кишечнике.
7. Иммуномодуляторы. Они способствуют нормализации местного иммунитета желудочно-кишечного тракта. Их применение обосновано на заключительных этапах лечения для закрепления положительных результатов.
8. Спазмолитики миотропного действия. Данные препараты восстанавливают нормальную моторику кишечника, инактивируют такие симптомы как диарея, вздутия, метеоризм.
Действительно, большое разнообразие лекарственных средств, применяемых при дисбактериозе, особенно многие из них отпускаются без рецепта врача, способствует самолечению. Важно, что, для оценки эффективности конкретного лекарственного средства и/или комплекса средств у конкретного пациента, необходима диагностика и полный анамнез, что под силу только врачу!
Важно, что, для оценки эффективности конкретного лекарственного средства и/или комплекса средств у конкретного пациента, необходима диагностика и полный анамнез, что под силу только врачу!
Часть 2: Лечение хронических желудочно-кишечных заболеваний и дисбактериоза кишечника
1. Мечников Е. В кн.: Продление жизни: оптимистические исследования. Митчелл ПК, переводчик. Нью-Йорк, штат Нью-Йорк: Сыновья ГП Патнэма; 1908. [Google Scholar]
2. Продовольственная и сельскохозяйственная организация Объединенных Наций; Всемирная организация здравоохранения. Полезные и питательные свойства пробиотиков в пищевых продуктах, включая сухое молоко с живыми молочнокислыми бактериями. Кордова, Аргентина: Продовольственная и сельскохозяйственная организация Объединенных Наций, Всемирная организация здравоохранения; 2001. [Google Академия]
3. Продовольственная и сельскохозяйственная организация Объединенных Наций; Всемирная организация здравоохранения. Руководство по оценке пробиотиков в пищевых продуктах. Лондон, Онтарио: Продовольственная и сельскохозяйственная организация Объединенных Наций, Всемирная организация здравоохранения; 2002. [Google Scholar]
Лондон, Онтарио: Продовольственная и сельскохозяйственная организация Объединенных Наций, Всемирная организация здравоохранения; 2002. [Google Scholar]
4. Сандерс М.Е., Марко М.Л. Пищевые форматы для эффективной доставки пробиотиков. Annu Rev Food Sci Technol. 2010;1:65–85. [PubMed] [Google Scholar]
5. Сандерс М.Э. Пробиотики: определение, источники, выбор и применение. Клин Инфекция Дис. 2008; 46 (дополнение 2): S58–S61. [PubMed] [Академия Google]
6. Мечников Е. Молочная кислота как ингибитор кишечного гниения. В: Митчелл ПК, переводчик. Продление жизни: оптимистические исследования. Нью-Йорк, штат Нью-Йорк: Сыновья ГП Патнэма; 1907. С. 161–183. [Google Scholar]
7. Lilly DM, Stillwell RH. Пробиотики: стимулирующие рост факторы, вырабатываемые микроорганизмами. Наука. 1965; 147 (3659): 747–748. [PubMed] [Google Scholar]
8. Паркер Р.Б. Пробиотики, вторая половина истории с антибиотиками. Аним Нутр Здоровье. 1974; 29: 4–8. [Академия Google]
9. Фуллер Р. Пробиотики у человека и животных. J Приложение Bacteriol. 1989;66(5):365–378. [PubMed] [Google Scholar]
Фуллер Р. Пробиотики у человека и животных. J Приложение Bacteriol. 1989;66(5):365–378. [PubMed] [Google Scholar]
10. Havenaar R, Huis in’t Veld JH. Пробиотики: общий вид. В: Вуд Б.Дж., редактор. Молочнокислые бактерии. Том. 1. Нью-Йорк, штат Нью-Йорк: Springer US; 1992. С. 151–170. [Google Scholar]
11. Шаафсма Г. Современное состояние пробиотических штаммов в молочных продуктах. Int Dairy Food Nutr News Lett. 1996; 5: 23–24. [Google Scholar]
12. Ringel Y, Quigley EM, Lin HC. Применение пробиотиков при желудочно-кишечных расстройствах. Am J Gastroenterol Suppl. 2012;1(1):34–40. [Академия Google]
13. Ян Ф., Полк Д.Б. Пробиотики как функциональное питание при лечении диареи. Curr Opin Clin Nutr Metab Care. 2006;9(6):717–721. [PubMed] [Google Scholar]
14. Mack DR, Ahrne S, Hyde L, Wei S, Hollingsworth MA. Внеклеточная секреция муцина MUC3 следует за прикреплением штаммов Lactobacillus к эпителиальным клеткам кишечника in vitro. Кишка. 2003;52(6):827–833. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Джонсон-Генри К.С., Хаген К.Е., Гордонпур М., Томпкинс Т.А., Шерман П.М. Экстракты белков поверхностного слоя Lactobacillus helveticus ингибируют энтерогеморрагическую адгезию Escherichia coli O157:H7 к эпителиальным клеткам. Клеточная микробиология. 2007;9(2): 356–367. [PubMed] [Google Scholar]
16. Tejero-Sariñena S, Barlow J, Costabile A, Gibson GR, Rowland I. In vitro оценка антимикробной активности ряда пробиотиков против патогенов: доказательства действия органических кислот . Анаэроб. 2012;18(5):530–538. [PubMed] [Google Scholar]
17. Пеннер Р., Федорак Р.Н., Мэдсен К.Л. Пробиотики и нутрицевтики: немедикаментозное лечение желудочно-кишечных заболеваний. Курр Опин Фармакол. 2005;5(6):596–603. [PubMed] [Академия Google]
18. Лебер С., Вандерлейден Дж., Де Кеерсмакер С.К. Взаимодействие молекул поверхности пробиотических бактерий с хозяином: сравнение с комменсалами и патогенами. Nat Rev Microbiol. 2010;8(3):171–184. [PubMed] [Google Scholar]
2010;8(3):171–184. [PubMed] [Google Scholar]
19. Медельин-Пенья М.Дж., Ван Х., Джонсон Р., Ананд С., Гриффитс М.В. Пробиотики влияют на экспрессию генов, связанных с вирулентностью, в Escherichia coli O157:H7. Appl Environ Microbiol. 2007;73(13):4259–4267. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Кендалл М.М., Сперандио В. Ощущение кворума кишечными патогенами. Курр Опин Гастроэнтерол. 2007;23(1):10–15. [PubMed] [Академия Google]
21. Дрейкс М., Бланшар Т., Чинн С. Бактериальная пробиотическая модуляция дендритных клеток. Заразить иммун. 2004;72(6):3299–3309. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Kim SO, Sheikh HI, Ha SD, Martins A, Reid G. Опосредованное G-CSF ингибирование JNK является ключевым механизмом индуцированного Lactobacillus rhamnosus подавления Продукция TNF в макрофагах. Клеточная микробиология. 2006;8(12):1958–1971. [PubMed] [Google Scholar]
23. Owens RC, Jr, Donskey CJ, Gaynes RP, Loo VG, Muto CA. Антимикробные факторы риска инфекции Clostridium difficile. Клин Инфекция Дис. 2008;46(дополнение 1):S19–S31. [PubMed] [Google Scholar]
Клин Инфекция Дис. 2008;46(дополнение 1):S19–S31. [PubMed] [Google Scholar]
24. Johnston BC, Goldenberg JZ, Vandvik PO, Sun X, Guyatt GH. Пробиотики для профилактики антибиотикоассоциированной диареи у детей. Cochrane Database Syst Rev. 2011;(11):CD004827. [PubMed] [Google Scholar]
25. McFarland LV. Антибиотикоассоциированная диарея: эпидемиология, тенденции и лечение. Будущая микробиология. 2008;3(5):563–578. [PubMed] [Google Scholar]
26. McFarland LV. Метаанализ пробиотиков для профилактики антибиотикоассоциированной диареи и лечения болезни Clostridium difficile. Am J Гастроэнтерол. 2006;101(4):812–822. [PubMed] [Академия Google]
27. Сазавал С., Хиремат Г., Дингра У., Малик П., Деб С., Блэк Р.Э. Эффективность пробиотиков в профилактике острой диареи: метаанализ замаскированных рандомизированных плацебо-контролируемых исследований. Ланцет Infect Dis. 2006;6(6):374–382. [PubMed] [Google Scholar]
28. Hempel S, Newberry SJ, Maher AR, et al. Пробиотики для профилактики и лечения антибиотикоассоциированной диареи: систематический обзор и метаанализ. ДЖАМА. 2012;307(18):1959–1969. [PubMed] [Академия Google]
ДЖАМА. 2012;307(18):1959–1969. [PubMed] [Академия Google]
29. Пламмер С., Уивер М.А., Харрис Дж.К., Ди П., Хантер Дж. Пилотное исследование Clostridium difficile: влияние пробиотических добавок на заболеваемость диареей C. difficile. Интер микробиол. 2004;7(1):59–62. [PubMed] [Google Scholar]
30. Оман Л., Симрен М. Кишечная микробиота и ее роль в развитии синдрома раздраженного кишечника (СРК) Curr Gastroenterol Rep. 2013;15(5):323. [PubMed] [Google Scholar]
31. Moayyedi P, Ford AC, Talley NJ, et al. Эффективность пробиотиков при лечении синдрома раздраженного кишечника: систематический обзор. Кишка. 2010;59(3): 325–332. [PubMed] [Google Scholar]
32. Уилан К., Куигли Э.М. Пробиотики в лечении синдрома раздраженного кишечника и воспалительных заболеваний кишечника. Курр Опин Гастроэнтерол. 2013;29(2):184–189. [PubMed] [Google Scholar]
33. Леоне В., Чанг Э.Б., Девкота С. Диета, микробы и генетика хозяина: идеальный шторм при воспалительных заболеваниях кишечника. J Гастроэнтерол. 2013;48(3):315–321. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Гастроэнтерол. 2013;48(3):315–321. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Шейл Б., Шанахан Ф., О’Махони Л. Влияние пробиотиков на воспалительное заболевание кишечника. Дж Нутр. 2007;137(3) доп. 2:819С-824С. [PubMed] [Google Scholar]
35. O’Mahony L, McCarthy J, Kelly P, et al. Лактобациллы и бифидобактерии при синдроме раздраженного кишечника: реакция на симптомы и связь с профилями цитокинов. Гастроэнтерология. 2005;128(3):541–551. [PubMed] [Google Scholar]
36. Мэдсен К.Л., Дойл Дж.С., Джуэлл Л.Д., Тавернини М.М., Федорак Р.Н. Виды Lactobacillus предотвращают колит у мышей с дефицитом гена интерлейкина 10. Гастроэнтерология. 1999;116(5):1107–1114. [PubMed] [Академия Google]
37. О’Махони Л., Фини М., О’Халлоран С. и др. Влияние пробиотиков на микробную флору, воспаление и развитие опухолей у мышей с нокаутом IL-10. Алимент Фармакол Тер. 2001;15(8):1219–1225. [PubMed] [Google Scholar]
38. Schultz M, Munro K, Tannock GW, et al. Влияние скармливания пробиотического препарата (ППП), содержащего инулин, на тяжесть колита и состав кишечной микрофлоры у трансгенных по HLA-B27 крыс. Клин Диагн Лаб Иммунол. 2004;11(3):581–587. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Влияние скармливания пробиотического препарата (ППП), содержащего инулин, на тяжесть колита и состав кишечной микрофлоры у трансгенных по HLA-B27 крыс. Клин Диагн Лаб Иммунол. 2004;11(3):581–587. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Schultz M, Veltkamp C, Dieleman LA, et al. Lactobacillus plantarum 299V в лечении и профилактике спонтанного колита у мышей с дефицитом интерлейкина-10. Воспаление кишечника Dis. 2002;8(2):71–80. [PubMed] [Google Scholar]
40. Рахими Р., Никфар С., Рахими Ф. и соавт. Метаанализ эффективности пробиотиков для поддержания ремиссии и предотвращения клинических и эндоскопических рецидивов при болезни Крона. Dig Dis Sci. 2008;53(9):2524–2531. [PubMed] [Академия Google]
41. Мэллон П., Маккей Д., Кирк С., Гардинер К. Пробиотики для индукции ремиссии язвенного колита. Cochrane Database Syst Rev. 2007;(4):CD005573. [PubMed] [Google Scholar]
42. Prantera C, Scribano ML. Антибиотики и пробиотики при воспалительных заболеваниях кишечника: зачем, когда и как. Курр Опин Гастроэнтерол. 2009;25(4):329–333. [PubMed] [Google Scholar]
Курр Опин Гастроэнтерол. 2009;25(4):329–333. [PubMed] [Google Scholar]
43. Prantera C. Пробиотики при болезни Крона: чему мы научились? Кишка. 2006;55(6):757–759. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Окада Х., Кун С., Фейе Х., Бах Дж. Ф. «Гигиеническая гипотеза» аутоиммунных и аллергических заболеваний: обновление. Клин Эксп Иммунол. 2010;160(1):1–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Абрахамссон Т.Р., Якобссон Х.Е., Андерссон А.Ф., Бьоркстен Б., Энгстранд Л., Дженмальм М.К. Низкое разнообразие микробиоты кишечника у детей раннего возраста с атопической экземой. J Аллергия Клин Иммунол. 2012;129(2):434–440. [PubMed] [Google Scholar]
46. Williams HC, Grindlay DJ. Что нового в атопической экземе? Анализ систематических обзоров, опубликованных в 2007 и 2008 гг. I: определения, причины и последствия экземы. Клин Эксп Дерматол. 2010;35(1):12–15. [PubMed] [Академия Google]
47. Элазаб Н., Менди А., Гасана Дж., Виейра Э. Р., Кисон А., Форно Э. Применение пробиотиков в раннем возрасте, при атопии и астме: метаанализ клинических испытаний. Педиатрия. 2013;132(3):e666–e676. [PubMed] [Google Scholar]
Р., Кисон А., Форно Э. Применение пробиотиков в раннем возрасте, при атопии и астме: метаанализ клинических испытаний. Педиатрия. 2013;132(3):e666–e676. [PubMed] [Google Scholar]
48. Kalliomäki M, Salminen S, Arvilommi H, Kero P, Koskinen P, Isolauri E. Пробиотики в первичной профилактике атопических заболеваний: рандомизированное плацебо-контролируемое исследование. Ланцет. 2001;357(9262):1076–1079. [PubMed] [Google Scholar]
49. Majamaa H, Isolauri E. Пробиотики: новый подход к лечению пищевой аллергии. J Аллергия Клин Иммунол. 1997;99(2):179–185. [PubMed] [Google Scholar]
50. Foolad N, Brezinski EA, Chase EP, Armstrong AW. Влияние пищевых добавок на атопический дерматит у детей: систематический обзор пробиотиков, пребиотиков, детских смесей и жирных кислот. ДЖАМА Дерматол. 2013;149(3):350–355. [PubMed] [Google Scholar]
51. Illi S, von Mutius E, Lau S, et al. Постоянная сенсибилизация аллергенами в раннем возрасте и хроническая астма у детей: когортное исследование рождения. Ланцет. 2006;368(9537):763–770. [PubMed] [Академия Google]
Ланцет. 2006;368(9537):763–770. [PubMed] [Академия Google]
52. Updegrove K. Некротизирующий энтероколит: доказательства использования грудного молока для профилактики и лечения. Дж. Гум Лакт. 2004;20(3):335–339. [PubMed] [Google Scholar]
53. Schnabl KL, Van Aerde JE, Thomson AB, Clandinin MT. Некротизирующий энтероколит: многофакторное заболевание, неизлечимое. Мир J Гастроэнтерол. 2008;14(14):2142–2161. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Embleton N, Berrington JE. Пробиотики снижают риск развития некротизирующего энтероколита (НЭК) у недоношенных детей. Медицина на основе Evid. 2013;18(6):219–220. [PubMed] [Google Scholar]
55. Дешпанде Г., Рао С., Патоле С., Булсара М. Обновленный метаанализ пробиотиков для профилактики некротизирующего энтероколита у недоношенных новорожденных. Педиатрия. 2010;125(5):921–930. [PubMed] [Google Scholar]
56. Дешпанде Г., Рао С., Патоле С. Пробиотики для профилактики некротизирующего энтероколита у недоношенных новорожденных с очень низкой массой тела при рождении: систематический обзор рандомизированных контролируемых исследований. Ланцет. 2007;369(9573):1614–1620. [PubMed] [Академия Google]
Ланцет. 2007;369(9573):1614–1620. [PubMed] [Академия Google]
57. Вагнер С.Л., Тейлор С.Н., Джонсон Д. Факторы хозяина в амниотической жидкости и грудном молоке, которые способствуют созреванию кишечника. Клин Рев Аллергия Иммунол. 2008;34(2):191–204. [PubMed] [Google Scholar]
58. Requena T, Cotter P, Shahar DR, et al. Взаимодействие между кишечной микробиотой, пищей и тучным хозяином. Тенденции Food Sci Technol. 2013;34(1):44–53. [Google Scholar]
59. Aronsson L, Huang Y, Parini P, et al. Уменьшение накопления жира Lactobacillus paracasei связано с повышенным уровнем ангиопоэтиноподобного белка 4 (ANGPTL4) PLoS One. 2010;5(9):e13087. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Lee HY, Park JH, Seok SH, et al. Бактерии человеческого происхождения, Lactobacillus rhamnosus PL60, продуцируют конъюгированную линолевую кислоту и проявляют эффекты против ожирения у мышей с ожирением, вызванным диетой. Биохим Биофиз Акта. 2006;1761(7):736–744. [PubMed] [Google Scholar]
61. Андреасен А.С., Ларсен Н., Педерсен-Сковсгаард Т. и соавт. Влияние Lactobacillus acidophilus NCFM на чувствительность к инсулину и системную воспалительную реакцию у людей. Бр Дж Нутр. 2010;104(12):1831–1838. [PubMed] [Академия Google]
Андреасен А.С., Ларсен Н., Педерсен-Сковсгаард Т. и соавт. Влияние Lactobacillus acidophilus NCFM на чувствительность к инсулину и системную воспалительную реакцию у людей. Бр Дж Нутр. 2010;104(12):1831–1838. [PubMed] [Академия Google]
62. Naito E, Yoshida Y, Makino K, et al. Положительный эффект перорального введения штамма Shirota Lactobacillus casei на резистентность к инсулину у мышей с ожирением, вызванным диетой. J Appl Microbiol. 2011;110(3):650–657. [PubMed] [Google Scholar]
63. Chen JJ, Wang R, Li XF, Wang RL. Добавка Bifidobacterium longum улучшила метаболический синдром, вызванный употреблением пищи с высоким содержанием жиров, и способствовала экспрессии гена Reg I в кишечнике. Exp Biol Med (Maywood) 2011;236(7):823–831. [PubMed] [Академия Google]
64. Kadooka Y, Sato M, Imaizumi K, et al. Регулирование абдоминального ожирения пробиотиками (Lactobacillus gasseri SBT2055) у взрослых с тенденцией к ожирению в рандомизированном контролируемом исследовании. Eur J Clin Nutr. 2010;64(6):636–643. [PubMed] [Google Scholar]
Eur J Clin Nutr. 2010;64(6):636–643. [PubMed] [Google Scholar]
65. Gøbel RJ, Larsen N, Jakobsen M, Mølgaard C, Michaelsen KF. Пробиотики для подростков с ожирением: влияние на воспаление и метаболический синдром. J Pediatr Gastroenterol Nutr. 2012;55(6):673–678. [PubMed] [Академия Google]
66. Larsen N, Vogensen FK, Gøbel RJ, et al. Влияние Lactobacillus salivarius Ls-33 на фекальную микробиоту у подростков с ожирением. Клин Нутр. 2013;32(6):935–940. [PubMed] [Google Scholar]
67. Gill PJ, Goldacre MJ, Mant D, et al. Увеличение числа неотложных госпитализаций детей в возрасте до 15 лет в Англии, 1999–2010 гг.: анализ национальной базы данных. Арч Дис Чайлд. 2013;98(5):328–334. [PubMed] [Google Scholar]
68. Leyer GJ, Li S, Mubasher ME, Reifer C, Ouwehand AC. Влияние пробиотиков на частоту возникновения и продолжительность простудных и гриппоподобных симптомов у детей. Педиатрия. 2009 г.;124(2):e172–e179. [PubMed] [Google Scholar]
69. Bajaj JS, Saeian K, Christensen KM, et al. Пробиотический йогурт для лечения минимальной печеночной энцефалопатии. Am J Гастроэнтерол. 2008;103(7):1707–1715. [PubMed] [Google Scholar]
Пробиотический йогурт для лечения минимальной печеночной энцефалопатии. Am J Гастроэнтерол. 2008;103(7):1707–1715. [PubMed] [Google Scholar]
70. Вьяс У., Ранганатан Н. Пробиотики, пребиотики и синбиотики: кишечник и не только. Гастроэнтерол Рез Практ. 2012;2012:872716. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Harrison SA, Day CP. Преимущества модификации образа жизни при НАЖБП. Кишка. 2007; 56 (12): 1760–1769.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Nascimbeni F, Pais R, Bellentani S, et al. От НАЖБП в клинической практике к ответам из руководств. J Гепатол. 2013;59(4):859–871. [PubMed] [Google Scholar]
73. Wong VW, Won GL, Chim AM, et al. Лечение неалкогольного стеатогепатита пробиотиками: исследование, подтверждающее концепцию. Энн Хепатол. 2013;12(2):256–262. [PubMed] [Google Scholar]
74. Eutamene H, Bueno L. Роль пробиотиков в коррекции нарушений кишечной флоры, вызванных стрессом. Кишка. 2007;56(11):1495–1497. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Bested AC, Logan AC, Selhub EM. Кишечная микробиота, пробиотики и психическое здоровье: от Мечникова до современных достижений, I: новый взгляд на аутоинтоксикацию. Гут Патог. 2013;5(1):5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Bested AC, Logan AC, Selhub EM. Кишечная микробиота, пробиотики и психическое здоровье: от Мечникова до современных достижений, II: современные контекстуальные исследования. Гут Патог. 2013;5(1):3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Бестед AC, Логан AC, Selhub EM. Кишечная микробиота, пробиотики и психическое здоровье: от Мечникова до современных достижений, III: переход к клиническим испытаниям. Гут Патог. 2013;5(1):4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Messaoudi M, Lalonde R, Violle N, et al. Оценка психотропных свойств пробиотической композиции (Lactobacillus helveticus R0052 и Bifidobacterium longum R0175) у крыс и людей. Бр Дж Нутр. 2011;105(5):755–764. [PubMed] [Академия Google]
Бр Дж Нутр. 2011;105(5):755–764. [PubMed] [Академия Google]
79. Roberfroid M. Пребиотики: новый взгляд на концепцию. Дж Нутр. 2007;137(3) приложение 2:830S–837S. [PubMed] [Google Scholar]
80. Macfarlane S, Macfarlane GT, Cummings JH. Обзорная статья: пребиотики в желудочно-кишечном тракте. Алимент Фармакол Тер. 2006;24(5):701–714. [PubMed] [Google Scholar]
81. Нинесс К.Р. Инулин и олигофруктоза: что это? Дж Нутр. 1999; 129(7) приложение: 1402S–1406S. [PubMed] [Google Scholar]
82. Tako E, Glahn RP, Welch RM, Lei X, Yasuda K, Miller DD. Пищевой инулин влияет на экспрессию транспортеров железа кишечных энтероцитов, рецепторов и запасного белка, а также изменяет микробиоту в кишечнике свиней. Бр Дж Нутр. 2008;99(3):472–480. [PubMed] [Google Scholar]
83. Roberfroid MB, Van Loo JA, Gibson GR. Бифидогенная природа инулина цикория и продуктов его гидролиза. Дж Нутр. 1998;128(1):11–19. [PubMed] [Google Scholar]
84. Cherbut C. Инулин и олигофруктоза в концепции пищевых волокон. Бр Дж Нутр. 2002; 87 (дополнение 2): S159–S162. [PubMed] [Google Scholar]
Бр Дж Нутр. 2002; 87 (дополнение 2): S159–S162. [PubMed] [Google Scholar]
85. Roberfroid M, Gibson GR, Hoyles L, et al. Эффекты пребиотиков: польза для обмена веществ и здоровья. Бр Дж Нутр. 2010; 104 (прил. 2): S1–S63. [PubMed] [Академия Google]
86. Kootte RS, Vrieze A, Holleman F, et al. Терапевтический потенциал воздействия на микробиоту кишечника при ожирении и сахарном диабете 2 типа. Сахарный диабет Ожирение Metab. 2012;14(2):112–120. [PubMed] [Google Scholar]
87. Schwiertz A, Taras D, Schäfer K, et al. Микробиота и SCFAs у здоровых людей с худощавым телом и избыточным весом. Ожирение (Серебряная весна) 2010;18(1):190–195. [PubMed] [Google Scholar]
88. Wu X, Ma C, Nawaz M, et al. Молекулярная характеристика фекальной микробиоты у больных сахарным диабетом II типа. Карр микробиол. 2010;61(1):69–78. [PubMed] [Google Scholar]
89. Cani PD, Neyrinck AM, Fava F, et al. Селективное увеличение количества бифидобактерий в микрофлоре кишечника улучшает диабет, вызванный диетой с высоким содержанием жиров, у мышей посредством механизма, связанного с эндотоксемией. Диабетология. 2007;50(11):2374–2383. [PubMed] [Google Scholar]
Диабетология. 2007;50(11):2374–2383. [PubMed] [Google Scholar]
90. Cani PD, Possemiers S, Van de Wiele T, et al. Изменения в микробиоте кишечника контролируют воспаление у мышей с ожирением с помощью механизма, включающего улучшение проницаемости кишечника под действием GLP-2. Кишка. 2009 г.;58(8):1091–1103. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Crittenden RG, Playne MJ. Производство, свойства и применение пищевых олигосахаридов. Тенденции Food Sci Technol. 1996;7(11):353–361. [Google Scholar]
92. Mussatto SI, Mancilha IM. Неперевариваемые олигосахариды: обзор. Карбогидр Полим. 2007;68(3):587–597. [Google Scholar]
93. Bouhnik Y, Florurié B, D’Agay-Abensour L, et al. Введение трансгалактоолигосахаридов увеличивает фекальные бифидобактерии и изменяет метаболизм ферментации в толстой кишке у здоровых людей. Дж Нутр. 1997;127(3):444–448. [PubMed] [Google Scholar]
94. Ito M, Kimura M, Deguchi Y, Miyamori-Watabe A, Yajima T, Kan T. Влияние трансгалактозилированных дисахаридов на микрофлору кишечника человека и их метаболизм. J Nutr Sci Vitaminol (Токио) 1993;39(3):279–288. [PubMed] [Google Scholar]
Влияние трансгалактозилированных дисахаридов на микрофлору кишечника человека и их метаболизм. J Nutr Sci Vitaminol (Токио) 1993;39(3):279–288. [PubMed] [Google Scholar]
95. Мугамби М.Н., Мусекива А., Ломбард М., Янг Т., Блаау Р. Пробиотики, использование пребиотических детских смесей у недоношенных детей или детей с низкой массой тела при рождении: систематический обзор. Нутр Дж. 2012 авг; 11:58. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Растал Р.А., Майтин В. Пребиотики и синбиотики: навстречу новому поколению. Курр Опин Биотехнолог. 2002;13(5):490–496. [PubMed] [Google Scholar]
97. Kotzampassi K, Giamarellos-Bourboulis EJ, Vouduris A, Kazamias P, Eleftheriadis E. Преимущества синбиотической формулы (Synbiotic 2000Forte) у пациентов с травмами в критическом состоянии: первые результаты рандомизированного контролируемого исследования . Мир J Surg. 2006; 30 (10): 1848–1855. [PubMed] [Google Scholar]
98. Koo HL, DuPont HL. Рифаксимин: уникальный желудочно-кишечный селективный антибиотик при кишечных заболеваниях. Курр Опин Гастроэнтерол. 2010;26(1):17–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Курр Опин Гастроэнтерол. 2010;26(1):17–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Jiang ZD, Ke S, Palazzini E, Riopel L, Dupont H. Активность in vitro и концентрация рифаксимина в кале после перорального введения. Противомикробные агенты Chemother. 2000;44(8):2205–2206. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Пиментел М., Парк С., Мироча Дж., Кейн С.В., Конг Ю. Влияние неабсорбированного перорального антибиотика (рифаксимина) на симптомы синдрома раздраженного кишечника: рандомизированное исследование. Энн Интерн Мед. 2006;145(8):557–563. [PubMed] [Академия Google]
101. Sharara AI, Aoun E, Abdul-Baki H, Mounzer R, Sidani S, Elhajj I. Рандомизированное двойное слепое плацебо-контролируемое исследование рифаксимина у пациентов со вздутием живота и метеоризмом. Am J Гастроэнтерол. 2006;101(2):326–333. [PubMed] [Google Scholar]
102. Гусланди М., Петроне М.С., Тестони П.А. Рифаксимин при активном язвенном колите. Воспаление кишечника Dis. 2006;12(4):335. [PubMed] [Google Scholar]
2006;12(4):335. [PubMed] [Google Scholar]
103. Шафран И., Джонсон Л.К. Открытая оценка рифаксимина при лечении активной болезни Крона. Curr Med Res Opin. 2005; 21(8):1165–1169.. [PubMed] [Google Scholar]
104. Бороди Т.Дж., Хоруц А. Трансплантация фекальной микробиоты и новые приложения. Нат Рев Гастроэнтерол Гепатол. 2011;9(2):88–96. [PubMed] [Google Scholar]
105. van Nood E, Speelman P, Nieuwdorp M, Keller J. Трансплантация фекальной микробиоты: факты и противоречия. Курр Опин Гастроэнтерол. 2014;30(1):34–39. [PubMed] [Google Scholar]
106. Bakken JS. Фекальная бактериотерапия рецидивирующей инфекции Clostridium difficile. Анаэроб. 2009 г.;15(6):285–289. [PubMed] [Google Scholar]
107. Хоруц А., Диксвед Дж., Янссон Дж. К., Садовски М. Дж. Изменения состава фекального микробиома человека после бактериотерапии рецидивирующей Clostridium difficile-ассоциированной диареи. Дж. Клин Гастроэнтерол. 2010;44(5):354–360. [PubMed] [Google Scholar]
Кишечные микробы и заболевания пищеварительной системы у собак
Микробиом представляет собой сложную экосистему кишечных бактерий, оказывающую огромное влияние на здоровье хозяина. Вот обзор бактерий в кишечнике собак и роль дисбактериоза в этиологии заболеваний ЖКТ.
Вот обзор бактерий в кишечнике собак и роль дисбактериоза в этиологии заболеваний ЖКТ.
4 августа 2017 г. |
Доктор Суходольский — профессор медицины мелких животных, заместитель директора по исследованиям и руководитель отдела микробиома в желудочно-кишечной лаборатории Техасского университета A&M. Он получил степень доктора ветеринарной медицины в Венском университете, Австрия, и докторскую степень в области ветеринарной микробиологии в Техасском университете A&M. Он сертифицирован в области иммунологии Американским колледжем ветеринарных микробиологов. Его исследования сосредоточены на разработке биомаркеров желудочно-кишечных заболеваний и терапевтических подходов к модуляции кишечной микробиоты.
Читать статьи Автор Ян Суходольский
Кишечная микробиота состоит из вирусов, бактерий, грибков и простейших. В прошлом слово микрофлора использовалось для описания этой сложной экосистемы, но микробиота (от – биос , «живые организмы») является более подходящим термином. Микробиом — это коллективный геном всех этих микробов. Большинство исследований на сегодняшний день были сосредоточены на бактериальной микробиоте, которая, по оценкам, составляет подавляющее большинство кишечной микробиоты.
Микробиом — это коллективный геном всех этих микробов. Большинство исследований на сегодняшний день были сосредоточены на бактериальной микробиоте, которая, по оценкам, составляет подавляющее большинство кишечной микробиоты.
Приблизительно 100 триллионов микробных клеток находятся в кишечнике, что в 10 раз превышает количество клеток млекопитающих во всем организме. В совокупности количество микробных генов превышает количество генов хозяина примерно в 10 раз.
Эта сложная экосистема кишечных бактерий оказывает огромное влияние на здоровье хозяина. Взаимодействия между бактериями и хозяином опосредованы прямым контактом микробов с иммунной системой и различными метаболитами микробиоты. Физиологический микробиом модулирует иммунную систему, защищает от энтеропатогенов и обеспечивает питательные преимущества для хозяина.
И наоборот, изменения в сложных отношениях между кишечными бактериями и клетками хозяина влияют на иммунные реакции хозяина и метаболический статус и могут привести к заболеванию ( Рисунок 1 ). В недавних исследованиях описан дисбактериоз кишечника (т.е. изменения состава и/или разнообразия кишечной микробиоты) при различных острых и хронических желудочно-кишечных (ЖКТ) заболеваниях. 1 Кроме того, первоначальные данные на моделях человека и животных связывают хронический дисбактериоз, например, вызванный воздействием антибиотиков, с внекишечными расстройствами, такими как диабет и ожирение. 2,3 Эти результаты подчеркивают важность кишечной микробиоты и дисбактериоза в регуляции метаболизма хозяина, последствия которых выходят далеко за пределы желудочно-кишечного тракта.
В недавних исследованиях описан дисбактериоз кишечника (т.е. изменения состава и/или разнообразия кишечной микробиоты) при различных острых и хронических желудочно-кишечных (ЖКТ) заболеваниях. 1 Кроме того, первоначальные данные на моделях человека и животных связывают хронический дисбактериоз, например, вызванный воздействием антибиотиков, с внекишечными расстройствами, такими как диабет и ожирение. 2,3 Эти результаты подчеркивают важность кишечной микробиоты и дисбактериоза в регуляции метаболизма хозяина, последствия которых выходят далеко за пределы желудочно-кишечного тракта.
Характер дисбиоза и метаболические признаки, наблюдаемые при острых и хронических заболеваниях ЖКТ и метаболическом синдроме, только начинают описываться. Признаки дисбиоза и метаболические изменения оцениваются на предмет их диагностического и терапевтического потенциала. В данной статье представлен обзор бактерий в кишечнике собак и роль дисбиоза в этиологии заболеваний ЖКТ.
Рисунок 1. Взаимодействие между микробиотой кишечника, иммунной системой и метаболизмом хозяина. (A) В здоровом кишечнике существует надлежащее пространственное расположение между очень многочисленной микробиотой просвета, эпителием и иммунными клетками (дендритными клетками, лимфоцитами, макрофагами, нейтрофилами), которые присутствуют в небольшом количестве. Микробиота обеспечивает иммуномодулирующие стимулы для иммунной системы, метаболизирует и ферментирует сложные углеводы в полезные короткоцепочечные жирные кислоты (КЖК). Эти SCFAs обеспечивают энергию для эндотелиальных клеток, обладают противовоспалительным действием и регулируют перистальтику кишечника. Нормальная микробиота также превращает первичные желчные кислоты во вторичные желчные кислоты, которые также обладают противовоспалительным действием, индуцируют глюкагоноподобный пептид 1 (который, в свою очередь, повышает уровень инсулина) и уменьшают, например, спорообразование Clostridium difficile. (B) В болезненном состоянии, независимо от первопричины, снижение продукции антимикробных пептидов и слизи приводит к повышению проницаемости кишечника и транслокации бактерий. Рецепторы врожденного иммунитета, такие как Toll-подобные рецепторы на макрофагах и других иммунных клетках, распознают специфические молекулярные паттерны, связанные с патогеном, вследствие дисбактериоза (например, липополисахариды в бактериальных клеточных стенках) и запускают воспалительные реакции. Макрофаги фагоцитируют микробы, вызывая также иммунные реакции, которые могут привести к окислительному стрессу. Окислительный стресс, в свою очередь, может вызвать дисбактериоз кишечника.
Рецепторы врожденного иммунитета, такие как Toll-подобные рецепторы на макрофагах и других иммунных клетках, распознают специфические молекулярные паттерны, связанные с патогеном, вследствие дисбактериоза (например, липополисахариды в бактериальных клеточных стенках) и запускают воспалительные реакции. Макрофаги фагоцитируют микробы, вызывая также иммунные реакции, которые могут привести к окислительному стрессу. Окислительный стресс, в свою очередь, может вызвать дисбактериоз кишечника.
Редкая порода
Каждая собака является пристанищем для уникального микробного сообщества с отчетливыми различиями в пропорциях этих бактериальных групп. Тем не менее, содержание бактериального гена сохраняется у разных людей, что позволяет предположить, что функциональные аспекты микробиома одинаковы у всех животных. Индивидуальные различия в микробных видах могут вызывать индивидуальную реакцию на различные диеты, источники клетчатки и пробиотики.
Кишечная микробиота в здоровой среде
Идентификация и компоненты
До недавнего времени идентификация кишечных бактерий осуществлялась почти исключительно с использованием традиционной бактериальной культуры. Культура фекалий все еще может быть полезна для обнаружения специфических энтеропатогенов, таких как Salmonella или Campylobacter jejuni , поскольку этот подход позволяет проводить тестирование чувствительности клинических образцов к антибиотикам, но подавляющее большинство кишечных бактерий являются строгими анаэробами и не поддаются обнаружению с помощью стандартные методы выращивания. Таким образом, рутинная бактериальная культура не позволяет подробно охарактеризовать сложные кишечные бактериальные сообщества (9).0239 Рисунок 2 ). В настоящее время для характеристики микробиоты кишечника используется ряд молекулярных методов. 4
Культура фекалий все еще может быть полезна для обнаружения специфических энтеропатогенов, таких как Salmonella или Campylobacter jejuni , поскольку этот подход позволяет проводить тестирование чувствительности клинических образцов к антибиотикам, но подавляющее большинство кишечных бактерий являются строгими анаэробами и не поддаются обнаружению с помощью стандартные методы выращивания. Таким образом, рутинная бактериальная культура не позволяет подробно охарактеризовать сложные кишечные бактериальные сообщества (9).0239 Рисунок 2 ). В настоящее время для характеристики микробиоты кишечника используется ряд молекулярных методов. 4
Традиционные бактериальные культуры, а также молекулярные подходы выявили различия в типе и количестве бактерий в желудочно-кишечном тракте. Бактериальная численность в двенадцатиперстной кишке здоровых собак колеблется от 10 2 до 10 9 колониеобразующих единиц (КОЕ)/г. 5 В толстой кишке их гораздо больше, до 10 11 КОЕ/г. 6
6
Молекулярные инструменты позволили идентифицировать ранее не культивируемые и, следовательно, неизвестные бактерии. В то время как двенадцатиперстная кишка содержит смесь аэробных и факультативно-анаэробных бактерий, толстая кишка колонизирована почти исключительно строгими анаэробами. 7 В толстом кишечнике преобладают бактерии групп Clostridiaceae, Bacteroidaceae, Prevotellaceae и Fusobacteriaceae ( Рисунок 2 ). Следует отметить, что у каждой собаки есть уникальное микробное сообщество с отчетливыми различиями в пропорциях этих бактериальных групп. Тем не менее, содержание бактериального гена сохраняется у разных людей, что позволяет предположить, что функциональные аспекты микробиомов одинаковы у всех животных. 8 Тем не менее, индивидуальные различия в видах микробов могут вызывать индивидуальную реакцию на различные диеты, источники клетчатки и пробиотики.
Желудочно-кишечный тракт также является домом для разнообразной популяции вирусов и грибков. В одном исследовании описано до 40 видов грибков в образцах фекалий собак; большинство из них были различными Candida spp. 9 На основании этих результатов ожидается, что грибковые организмы будут обнаружены в обычных мазках кала. Их точный вклад в здоровье и болезни остается неясным, так как не было зарегистрировано существенных различий в типах грибков при сравнении здоровых собак с собаками с острой диареей.
В одном исследовании описано до 40 видов грибков в образцах фекалий собак; большинство из них были различными Candida spp. 9 На основании этих результатов ожидается, что грибковые организмы будут обнаружены в обычных мазках кала. Их точный вклад в здоровье и болезни остается неясным, так как не было зарегистрировано существенных различий в типах грибков при сравнении здоровых собак с собаками с острой диареей.
Рисунок 2. Преобладающие таксоны бактерий в образцах фекалий здоровых собак. Каждая полоса представляет одну здоровую собаку. Обратите внимание, что присутствующие бактериальные семейства сильно различаются, преобладают анаэробные бактерии, и соотношение этих бактериальных групп различается у каждой здоровой собаки. Обычная бактериальная культура пропускает эти анаэробные бактерии. Мазки фекалий, которые оценивают соотношение грамположительных и грамотрицательных бактерий, также бесполезны для оценки дисбактериоза, поскольку каждая собака имеет уникальное соотношение этих групп.
Роли
Сбалансированный микробиом имеет решающее значение для поддержания здоровья хозяина. Нормальная микробиота выполняет следующие функции:
- Модулирует иммунную систему
- Контролирует проникновение энтеропатогенов
- Обеспечивает хозяина питательными веществами путем метаболизма и ферментации различных пищевых компонентов
Кишечные бактерии также способствуют развитию физиологии кишечника. Это было продемонстрировано в исследованиях с выращенными мышами без микробов, которые демонстрируют измененную эпителиальную архитектуру (например, уменьшенное количество лимфоидных фолликулов) по сравнению с мышами, подвергшимися воздействию бактерий при рождении.
Постоянные перекрестные помехи между кишечной микробиотой и иммунными клетками хозяина опосредованы комбинацией метаболитов микробного происхождения (например, короткоцепочечных жирных кислот [SCFA], индола, вторичных желчных кислот), а также молекул на поверхности бактерий, которые активируют рецепторы врожденной иммунной системы хозяина (например, Toll-подобные рецепторы дендритных клеток).
Комменсальные бактерии, которые предотвращают инвазию транзиторных патогенов в слизистую за счет конкуренции за питательные вещества и участки эпителиальной адгезии, являются важной частью кишечного барьера. Кроме того, они создают физиологически ограничительную среду для нерезидентных видов бактерий за счет секреции противомикробных соединений и модуляции рН просвета.
Основные группы бактерий в кишечнике являются строгими или факультативными анаэробами. Преобладающие семейства бактерий в толстой кишке ( Рисунок 2 ) ферментируют пищевые углеводы (например, крахмал, целлюлозу, пектин, инулин), что приводит к образованию короткоцепочечных жирных кислот (например, ацетата, пропионата, бутирата) и других метаболитов. SCFAs являются важным источником энергии и факторов роста эпителиальных клеток кишечника и оказывают модулирующее действие на перистальтику кишечника. Кроме того, SCFAs обладают иммуномодулирующим действием. Например, бутират индуцирует иммунорегуляторные Т-клетки, а ацетат благотворно влияет на проницаемость кишечника.
Новая область исследований направлена на то, чтобы лучше охарактеризовать биологические функции дополнительных метаболитов бактериального происхождения, которые недавно были признаны регуляторами здоровья хозяина, таких как индол и вторичные желчные кислоты. Например, пищевой триптофан метаболизируется бактериями в индол, который, как было показано, снижает экспрессию интерлейкина-8, укрепляет барьерную функцию кишечника и облегчает энтеропатию, вызванную нестероидными противовоспалительными препаратами, у мышей. 10 Некоторые виды бактерий в толстой кишке превращают первичные желчные кислоты во вторичные желчные кислоты (например, литохолевую и дезоксихолевую кислоты). Следовательно, вторичные желчные кислоты присутствуют в толстой кишке в гораздо более высоких концентрациях, чем первичные желчные кислоты. Эта высокая концентрация вторичных желчных кислот в толстой кишке полезна, поскольку эти кислоты являются важным регулятором гомеостаза хозяина посредством активации различных рецепторов по всему телу. Например, специфичный для желчных кислот мембранный рецептор TGR5 экспрессируется в желчном пузыре, в эпителии желчных протоков, на моноцитах и макрофагах, а также в клетках мышц, почек, поджелудочной железы и кишечника. Активация этих рецепторов, к которым вторичные желчные кислоты имеют наибольшее сродство, снижает экспрессию провоспалительных цитокинов и модулирует метаболизм инсулина и глюкозы посредством активации глюкагоноподобного пептида 1. 11
Например, специфичный для желчных кислот мембранный рецептор TGR5 экспрессируется в желчном пузыре, в эпителии желчных протоков, на моноцитах и макрофагах, а также в клетках мышц, почек, поджелудочной железы и кишечника. Активация этих рецепторов, к которым вторичные желчные кислоты имеют наибольшее сродство, снижает экспрессию провоспалительных цитокинов и модулирует метаболизм инсулина и глюкозы посредством активации глюкагоноподобного пептида 1. 11
Вторичные желчные кислоты также подавляют прорастание спор Clostridium difficile , тогда как увеличение первичных желчных кислот (вследствие дисбактериоза) способствует прорастанию бактериальных спор. Кишечный дисбиоз приводит к уменьшению числа видов бактерий, преобразующих желчные кислоты, и, следовательно, связан с дисметаболизмом желчных кислот (уменьшение вторичных и увеличение первичных желчных кислот) и потенциально системными эффектами на метаболизм хозяина. 12,13 Кроме того, аномальное увеличение первичных желчных кислот может вызвать секреторную диарею.
Дисбиоз
Дисбактериоз кишечника определяется как различие в соотношении групп бактерий по сравнению с таковым у здоровых собак и часто сопровождается снижением видового разнообразия. Сообщалось о дисбактериозе кишечника при различных острых и хронических желудочно-кишечных заболеваниях, но он также может быть вызван применением антибиотиков широкого спектра действия. 1
Значение кишечной микробиоты в иммунной регуляции и метаболизме хозяина ( Рисунок 1 ) означает, что дисбиотический микробиом может иметь негативные последствия для хозяина. Однако выраженность клинических признаков у разных людей разная. Например, введение метронидазола здоровым собакам вызывало серьезные изменения в микробиоте кишечника с уменьшением количества комменсальных анаэробных бактерий и одновременным увеличением Escherichia coli ; эти изменения сопровождались обширными изменениями метаболических путей в просвете кишечника (например, усиление окислительного стресса, снижение уровня вторичных желчных кислот). 14 У девяти из 16 собак во время приема антибиотиков развился жидкий стул, но у остальных собак не было никаких клинических признаков, несмотря на схожие микробные и биохимические изменения. Это говорит о том, что клинические признаки зависят от взаимодействия множества микробных факторов и факторов хозяина, некоторые из которых (например, лежащая в основе генетическая предрасположенность хозяина, диетические и экологические триггеры) еще предстоит выяснить. Тем не менее дисбактериоз, вызванный антибиотиками, является примером того, как изменения микробного состава и метаболизма могут влиять на здоровье хозяина, поскольку дисбиоз, вызванный антибиотиками в раннем детстве, или повторная пульс-терапия признаны фактором риска развития аллергии, ожирения и воспалительных заболеваний. заболевания кишечника у человека. 3,15
14 У девяти из 16 собак во время приема антибиотиков развился жидкий стул, но у остальных собак не было никаких клинических признаков, несмотря на схожие микробные и биохимические изменения. Это говорит о том, что клинические признаки зависят от взаимодействия множества микробных факторов и факторов хозяина, некоторые из которых (например, лежащая в основе генетическая предрасположенность хозяина, диетические и экологические триггеры) еще предстоит выяснить. Тем не менее дисбактериоз, вызванный антибиотиками, является примером того, как изменения микробного состава и метаболизма могут влиять на здоровье хозяина, поскольку дисбиоз, вызванный антибиотиками в раннем детстве, или повторная пульс-терапия признаны фактором риска развития аллергии, ожирения и воспалительных заболеваний. заболевания кишечника у человека. 3,15
Появляющиеся эпидемиологические данные о людях и наше развивающееся понимание иммуномодулирующих и метаболических свойств микробиоты кишечника позволяют предположить, что правильная диагностика и коррекция дисбиоза будут важными целями при различных заболеваниях. Дисбиотический микробиом может причинять вред с помощью нескольких механизмов ( Box 1 ), которые, вероятно, будут действовать одновременно. Диарея может быть вызвана бактериальными энтеротоксинами, которые стимулируют секрецию слизистой жидкости. Другим недавно признанным механизмом диареи у людей является мальабсорбция желчных кислот из-за неспособности дисбиотической микробиоты преобразовывать первичные желчные кислоты во вторичные. 13 Первоначальные исследования предполагают, что такой механизм может встречаться и у собак, и требуют дальнейшего изучения. 12,16
Дисбиотический микробиом может причинять вред с помощью нескольких механизмов ( Box 1 ), которые, вероятно, будут действовать одновременно. Диарея может быть вызвана бактериальными энтеротоксинами, которые стимулируют секрецию слизистой жидкости. Другим недавно признанным механизмом диареи у людей является мальабсорбция желчных кислот из-за неспособности дисбиотической микробиоты преобразовывать первичные желчные кислоты во вторичные. 13 Первоначальные исследования предполагают, что такой механизм может встречаться и у собак, и требуют дальнейшего изучения. 12,16
ВСТАВКА 1 Последствия дисбактериоза
- Перепроизводство и транслокация бактериальных токсинов
- Воспалительная стимуляция иммунной системы
- Снижение противовоспалительных метаболитов (например, SCFA, индолов, вторичных желчных кислот)
- Изменения ферментов щеточной каемки
- Повреждение рецепторов слизистой оболочки
- Конкуренция за питательные вещества (например, витамин B12)
- Повышенная кишечная проницаемость
Оценка дисбактериоза
Из-за важности комменсальной микробиоты для гомеостаза хозяина важно диагностировать дисбактериоз. Как уже отмечалось, фекальная бактериальная культура не может охарактеризовать множество анаэробов в желудочно-кишечном тракте. Подсчитано, что только очень небольшой процент кишечных бактерий можно культивировать с помощью стандартных лабораторных методов. Лучший способ полностью охарактеризовать микробиоту — использовать высокопроизводительные платформы для секвенирования, которые могут предоставить обзор пропорций всех бактериальных групп в образце; однако стоимость и длительное время выполнения работ ограничивают использование этого метода научными исследованиями. Использование полимеразной цепной реакции (ПЦР) для определения специфических бактериальных таксонов, которые последовательно изменены у собак с хроническими энтеропатиями (ХЭ), может дать более быстрые результаты. 1
Как уже отмечалось, фекальная бактериальная культура не может охарактеризовать множество анаэробов в желудочно-кишечном тракте. Подсчитано, что только очень небольшой процент кишечных бактерий можно культивировать с помощью стандартных лабораторных методов. Лучший способ полностью охарактеризовать микробиоту — использовать высокопроизводительные платформы для секвенирования, которые могут предоставить обзор пропорций всех бактериальных групп в образце; однако стоимость и длительное время выполнения работ ограничивают использование этого метода научными исследованиями. Использование полимеразной цепной реакции (ПЦР) для определения специфических бактериальных таксонов, которые последовательно изменены у собак с хроническими энтеропатиями (ХЭ), может дать более быстрые результаты. 1
Результаты этих множественных ПЦР могут быть объединены и выражены в виде математического соотношения, индекса дисбактериоза (DI; Рисунок 3 ). Отрицательный DI (<0) указывает на нормальную микробиоту, тогда как положительный DI (>0) указывает на дисбактериоз, связанный с CE. 17 Затем DI можно использовать для мониторинга реакции микробиоты на терапию ХЭ. Первоначальные долгосрочные последующие исследования у собак с ХЭ предполагают, что для нормализации микробиома требуется несколько месяцев, даже если собаки реагируют в течение нескольких недель снижением показателей клинической активности. 18
17 Затем DI можно использовать для мониторинга реакции микробиоты на терапию ХЭ. Первоначальные долгосрочные последующие исследования у собак с ХЭ предполагают, что для нормализации микробиома требуется несколько месяцев, даже если собаки реагируют в течение нескольких недель снижением показателей клинической активности. 18
Недавнее небольшое исследование, в котором оценивали 3 собак с ХЭ, использовало DI для мониторинга микробных изменений в кале в ответ на фекальную микробную трансплантацию. 19 У всех 3 собак первоначально наблюдалось немедленное снижение ИД, но через 3 недели дисбактериоз вернулся у 1 собаки (увеличение ИД выше 2), что не показало улучшения клинических признаков. У оставшихся 2 собак наблюдалось частичное улучшение клинических признаков, и их ИД оставался ниже 0 в течение большей части 8-недельного периода наблюдения. Этот первоначальный небольшой набор данных предполагает потенциал для мониторинга микробиоты с течением времени у пациентов с ХЭ и после фекальной микробной трансплантации, но необходимы дополнительные исследования для определения точности и клинической полезности анализа микробиоты.
Анализ образцов фекалий дает информацию только об изменениях люминальной микробиоты. Использование флуоресцентной гибридизации in situ (FISH) образцов биопсии кишечника позволяет визуализировать, переместились ли бактерии в эпителий слизистой оболочки, как это наблюдается у собак с гранулематозным колитом. 20 Положительный результат указывает на необходимость антимикробной терапии для удаления транслоцированных бактерий. FISH требует специального анализа и доступен только в нескольких референс-лабораториях.
Хотя оценка фекальной микробиоты полезна для выявления дисбактериоза в толстой кишке, образцы кала, вероятно, не точно отражают ситуацию в тонкой кишке. Хотя образцы фекалий многих собак с заболеванием тонкой кишки показывают дисбактериоз, у части собак может быть дисбактериоз исключительно тонкой кишки. Измерения концентрации кобаламина и фолиевой кислоты в сыворотке крови остаются наиболее полезными маркерами дисбактериоза тонкой кишки. У собак с дисбактериозом тонкого кишечника может быть снижен уровень кобаламина в сыворотке крови и повышена концентрация фолиевой кислоты в сыворотке; изменение обоих параметров очень наводит на мысль о состоянии.
Недавние исследования оценили связь между дисбактериозом и изменениями различных биохимических путей (например, аномальный метаболизм желчных кислот, аминокислот и триптофана), которые влияют на иммунную систему и обмен веществ хозяина. 18,21 Многие новые метаболические биомаркеры, такие как концентрации фекальных желчных кислот, исследуются для лучшей оценки этиологии и лечения желудочно-кишечных заболеваний, и вскоре они могут стать полезными для повседневной практики.
Рисунок 3. Индекс дисбактериоза (ИД) повышен у собак с хроническими энтеропатиями (ХЭ). DI представляет собой математическое соотношение, которое суммирует численность различных групп бактерий (например, E coli, Faecalibacterium, Blautia, Fusobacterium) в одно число. DI ниже 0 указывает на нормальную микробиоту, а DI выше 0 указывает на дисбактериоз в толстой кишке. Анализ DI коммерчески доступен в Гастроинтестинальной лаборатории Техасского университета A&M.
Терапевтические рекомендации по коррекции дисбактериоза
Микробиота играет важную роль в метаболизме хозяина. Недавние метаболомические исследования ясно связали дисбактериоз с различными заболеваниями внутри и вне желудочно-кишечного тракта. Однако требуется дополнительная работа, чтобы определить, как модулировать микробиом для достижения наилучшего терапевтического успеха и прогнозировать ответ на конкретную терапию.
Недавние метаболомические исследования ясно связали дисбактериоз с различными заболеваниями внутри и вне желудочно-кишечного тракта. Однако требуется дополнительная работа, чтобы определить, как модулировать микробиом для достижения наилучшего терапевтического успеха и прогнозировать ответ на конкретную терапию.
Диета и антимикробная терапия
Дисбактериоз присутствует у многих собак с ХЭ и может быть причиной диареи у некоторых пациентов, но дисбактериоз также может быть следствием воспаления ЖКТ у других пациентов. Вероятен градиент различных моделей заболевания у пациентов, при этом иммунная система хозяина и микробиом вносят свой вклад в различной степени. Таким образом, наличие дисбактериоза не означает неотложной необходимости в антимикробной терапии, поскольку у собак с ХЭ, поддающимся лечению диетой, также может быть дисбактериоз. Некоторые животные с диареей положительно реагируют на противомикробные препараты, но у других антибиотики могут вызывать диарею. Длительное введение антибиотиков может вызвать дисбактериоз, который может создать фактор риска для различных метаболических заболеваний, например, из-за индукции дисметаболизма желчных кислот. 3 В настоящее время лучшим терапевтическим подходом к хроническим заболеваниям ЖКТ остается эмпирический, с последовательным протоколом испытаний пищевых продуктов, противовоспалительных препаратов и/или противомикробных препаратов.
Длительное введение антибиотиков может вызвать дисбактериоз, который может создать фактор риска для различных метаболических заболеваний, например, из-за индукции дисметаболизма желчных кислот. 3 В настоящее время лучшим терапевтическим подходом к хроническим заболеваниям ЖКТ остается эмпирический, с последовательным протоколом испытаний пищевых продуктов, противовоспалительных препаратов и/или противомикробных препаратов.
Пробиотики и пребиотики
Поскольку микробиота участвует в патофизиологии хронических заболеваний ЖКТ, может быть целесообразным добавление пробиотиков и пребиотиков. Пробиотики — это живые микроорганизмы, которые при введении в достаточных количествах приносят пользу здоровью хозяина. В нескольких исследованиях оценивались преимущества пробиотиков при острых и хронических заболеваниях ЖКТ. Данные свидетельствуют о том, что пробиотики оказывают лишь незначительное влияние на кишечную микробиоту, но их положительный эффект у собак с воспалительным заболеванием кишечника может быть частично обусловлен иммунной стимуляцией и/или усилением барьерной функции кишечника. 22 Также представляется, что введение более высоких доз и нескольких штаммов приводит к более высокой вероятности того, что пробиотические бактерии смогут колонизировать кишечник.
22 Также представляется, что введение более высоких доз и нескольких штаммов приводит к более высокой вероятности того, что пробиотические бактерии смогут колонизировать кишечник.
Пребиотики представляют собой ферментируемые и неферментируемые волокна, которые после достижения толстой кишки метаболизируются кишечными бактериями с образованием короткоцепочечных жирных кислот и других метаболитов, которые могут оказывать иммуномодулирующее действие. Большинство коммерческих кишечных диет содержат пребиотики.
Трансплантация фекальных микробов
Трансплантация фекальных микробов вызвала большой интерес. Хотя это очень успешный терапевтический подход у людей с рецидивирующим C difficile , его использование при CE у собак требует дальнейшего изучения, поскольку патофизиология этих заболеваний различается. Неподтвержденные данные и небольшие исследования позволяют предположить, что фекальная микробная трансплантация может быть многообещающей у подмножества собак с CE, 19 , но в настоящее время правильный отбор пациентов является чисто эмпирическим, и требуются дополнительные исследования.
Ссылки
- Хоннеффер Дж.Б., Минамото Ю., Суходольский Дж.С. Изменения микробиоты при остром и хроническом воспалении желудочно-кишечного тракта у кошек и собак. World J Gastroenterol 2014;20:16489-16497.
- Саари А., Вирта Л.Дж., Санкилампи У. и др. Воздействие антибиотиков в младенчестве и риск избыточного веса в первые 24 месяца жизни. Педиатрия 2015;135:617-626.
- Vrieze A, Out C, Fuentes S и др. Влияние перорального ванкомицина на микробиоту кишечника, метаболизм желчных кислот и чувствительность к инсулину. J Гепатол 2014;60:824-831.
- Суходольский Ю.С. Диагностика и интерпретация дисбактериоза кишечника у собак и кошек. Вет J 2016; doi: 10.1016/j.tvjl.2016.04.011
- German AJ, Day MJ, Ruaux CG и др. Сравнение прямых и непрямых тестов на избыточный бактериальный рост в тонком кишечнике и диарею, реагирующую на прием антибиотиков, у собак. J Vet Intern Med 2003;17:33-43.

- Mentula S, Harmoinen J, Heikkilä M, et al. Сравнение культивируемой микробиоты тонкого кишечника и фекальной микробиоты у собак породы бигль. Appl Environ Microbiol 2005; 71:4169-4175.
- Суходольский Дж.С., Камачо Дж., Штайнер Дж.М. Анализ бактериального разнообразия в двенадцатиперстной, тощей, подвздошной и толстой кишке собак с помощью сравнительного анализа гена 16S рРНК. FEMS Microbiology Ecology 2008;66:567-578.
- Гвардия БЦ, Суходольский Ю.С. Симпозиум по видам лошадей — кишечная микробиология и метагеномика собак: от филогении к функциям. J Anim Sci 2016;94:2247-2261.
- Foster ML, Dowd SE, Stephenson C, et al. Характеристика грибкового микробиома (микобиома) в образцах фекалий собак. Vet Med Int 2013;2013:658373.
- Whitfield-Cargile CM, Cohen ND, Chapkin RS, et al. Метаболит микробиоты индол уменьшает воспаление и повреждение слизистой оболочки в мышиной модели НПВП-энтеропатии. Микробы кишечника 2016;7:246-261.

- Павлидис П., Пауэлл Н., Винсент Р.П. и др. Систематический обзор: желчные кислоты и воспаление кишечника – агрессоры просвета или регуляторы защиты слизистой оболочки? Aliment Pharmacol Ther 2015; 42:802-817.
- Хоннеффер Дж., Гард Б., Штайнер Дж.М. и др. Mo1805 Нецелевой метаболомический анализ выявляет нарушение путей метаболизма желчных кислот, холестерина и триптофана у собак с идиопатическим воспалительным заболеванием кишечника. Гастроэнтерология 2015;148:S-715 (аннотация).
- Дубок Х., Райца С., Рейнто Д. и др. Связь дисбактериоза, дисметаболизма желчных кислот и воспаления кишечника при воспалительных заболеваниях кишечника. Гут 2013; 62: 531-539.
- Суходольский Дж.С., Олсон Э., Хоннеффер Дж. и соавт. Влияние диеты с гидролизованным белком и метронидазола на фекальный микробиом и метаболом у здоровых собак. J Vet Intern Med 2016;30:1455 (аннотация).
- Кокс Л.М., Блазер М.Дж. Антибиотики в раннем возрасте и ожирение.
 Nat Rev Endocrinol 2015; 11:182-190.
Nat Rev Endocrinol 2015; 11:182-190. - Кент А.С., Кросс Г., Тейлор Д.Р. и др. Измерение 7альфа-гидрокси-4-холестен-3-она в сыворотке как маркера мальабсорбции желчных кислот у собак с хронической диареей: экспериментальное исследование. Vet Rec Open 2016;3:e000163.
- Alshawaqfeh M, Guard M, Minamoto Y и др. Индекс дисбактериоза для оценки микробных изменений в образцах фекалий собак с хронической энтеропатией. J Vet Intern Med 2016;30:1536 (аннотация).
- Минамото Ю., Отони К.С., Стилман С.М. и др. Изменение профилей фекальной микробиоты и метаболитов сыворотки у собак с идиопатическим воспалительным заболеванием кишечника. Микробы кишечника 2015;6:33-47.
- Гербек З. Оценка терапевтического потенциала восстановления гомеостаза желудочно-кишечного тракта с помощью трансплантации фекальной микробиоты у собак. Магистерская работа: Университет Любляны, Словения, 2016.
- Симпсон К.В., Доган Б., Ришнив М.